一种碘普罗胺中间体的制备方法与流程
1.本发明属于有机化学合成技术领域,具体涉及一种碘普罗胺中间体的制备方法。
背景技术:
2.碘普罗胺(iopromide)是一种非离子型低渗造影剂,主要用于血管造影、尿路造影、ct增强扫描以及各种体腔造影。
[0003][0004]
目前,全球碘普罗胺市场仍由原研主导,国内尚无仿制药物,德国先灵公司率先报道了碘普罗胺的制备方法,随后不断有其他新合成方法被开发出来。综合文献,主要有以下几种合成路线:
[0005]
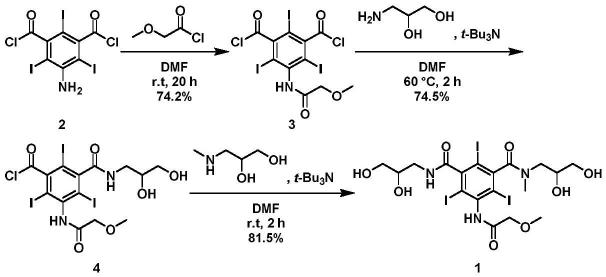
方法一:
[0006][0007]
speck等(us4364921a)以化合物2为原料,与甲氧基乙酰氯反应合成化合物3,3再与3-氨基-1,2-丙二醇反应制得化合物4,4最后与3-甲胺基-1,2-丙二醇反应得到碘普罗胺。该路线步骤少、经济性好,是目前最为理想的工艺路线。但在合成化合物4的过程中,过量3-氨基-1,2-丙二醇的使用,会产生双对称副产物,从而导致多次纯化操作,大大降低了产物收率,增加了生产成本。
[0008]
方法二:
[0009][0010]
us4364921a公开了合成碘普罗胺的单酯合成法,以化合物5为起始物料,与3-甲胺基-1,2-丙二醇反应合成化合物6,6甲酯化后与3-氨基-1,2-丙二醇反应得到化合物8,8再经羟基保护、还原、碘代生成化合物10,最后经氨基酰化后碱性水解得碘普罗胺。该路线看似规避了对称副产的生成,实质上在化合物7合成化合物8时,有酰胺氨解反应的发生,导致对称性杂质再次带入产品。另外,条件剧烈的碘代反应易使得乙酰基脱去,从而造成产物杂乱,结晶提纯困难。
[0011]
方法三:
[0012][0013]
us4364921a报道的路线与路线二相似,同样以化合物5为原料,与3-甲胺基-1,2-丙二醇反应制得化合物6。6乙酰化后再经还原、碘代、氯代反应得到酰氯13,13与甲氧基乙酰氯反应合成化合物14,随后与3-氨基-1,2-丙二醇反应再经碱性水解得碘普罗胺。虽然该路线避免了对称性副产物的产生,但路线冗长,中间体纯化困难。在剧烈的碘代反应过程中,部分羟基发生水解反应,导致产物复杂,使得该路线总收率不高。
[0014]
方法四:
[0015][0016]
陈炜粱在us4364921a的基础上开发了一条碘普罗胺的合成路线(硕士论文:《非离子造影剂碘普罗胺的合成工艺优化》)。以化合物5为起始原料,经氯化后与3-氨基-1,2-丙二醇反应合成化合物7,7与3-甲氨基-1,2-丙二醇反应制得化合物8,8再经还原、碘化、乙酰化反应生成化合物10,最后与甲氧基乙酰氯反应经碱性水解得碘普罗胺。在重复该路线时,发现化合物5到化合物7的这一步反应体系复杂,难以纯化,为后续反应增加了难度。其次,该路线较长,不适合产业化。
[0017]
方法五:
[0018][0019]
韩国专利wo2009134030a1利用中间体16与3-甲氨基-1,2-丙二醇反应经碱性水解得到碘普罗胺。而16则是化合物2的后续产物。该路线对中间体16进行简单的结晶操作,即可除去制备过程中产生的对称副产。但与us4364921a相比,新中间体及合成步骤的增加,大大降低了其工业应用价值。
[0020]
方法六:
[0021][0022]
沈阳中海生物技术公司在专利cn105001114a报道了一条制备碘普罗胺的新路线。以化合物2为起始原料,先后与烯丙基胺、甲氧基乙酰氯以及n-甲基烯丙基胺反应制得化合物19,最后经氧化得碘普罗胺。该路线可通过对化合物17进行简单的结晶,以除去双对称副产物,且不引入保护基。oso4不仅价格昂贵且有剧毒,限制了其在工业化生产的应用。
[0023]
综合以上文献,碘普罗胺合成过程中,都不能有效解决不对称酰胺和二酰化杂质问题,导致生产成本居高不下。为此,急需开发一种创新的,更具产业化价值的碘普罗胺及其关键中间体的合成方法。
技术实现要素:
[0024]
为了解决上述的技术问题,本发明提供了一种生产成本低、收率高、操作简便的方法制备碘普罗胺关键中间体n,n
’‑
双(2,3-二羟基丙基)-n-甲基-5-硝基间苯二甲酰胺的制备方法。
[0025]
本发明通过下述的技术方案来实现的:
[0026]
本发明的碘普罗胺关键中间体n,n
’‑
双(2,3-二羟基丙基)-n-甲基-5-硝基间苯二甲酰胺是以3-硝基苯甲酸(式ⅱ化合物)为原料,在一定条件下经七步反应,从而制得式ⅰ所示化合物。
[0027]
一种碘普罗胺中间体的制备方法,包括如下步骤:
[0028][0029]
1)以式(ⅱ)所示的3-硝基苯甲酸为原料,经溴化制得式(ⅲ)所示的3-溴-5-硝基苯甲酸;
[0030]
2)式(ⅲ)所示的3-溴-5-硝基苯甲酸经酯化制得式(ⅳ)所示的3-溴-5-硝基苯甲酸甲酯;
[0031]
3)式(ⅳ)所示的3-溴-5-硝基苯甲酸甲酯与甲胺反应制得式(
ⅴ
)所示的n-甲基-3-溴-5-硝基苯甲酰胺;
[0032]
4)式(
ⅴ
)所示的n-甲基-3-溴-5-硝基苯甲酰胺与烯丙基溴反应制得式(ⅵ)所示的n-甲基-n-烯丙基-3-溴-5-硝基苯甲酰胺;
[0033]
5)式(ⅵ)所示的n-甲基-n-烯丙基-3-溴-5-硝基苯甲酰胺在氰化亚铜作用下制得式(ⅶ)所示的n-甲基-n-烯丙基-5-硝基间苯二甲酰胺;
[0034]
6)式(ⅶ)所示的n-甲基-n-烯丙基-5-硝基间苯二甲酰胺与烯丙基溴反应制得式(
ⅷ
)所示的n,n
’‑
双烯丙基-n-甲基-5-硝基间苯二甲酰胺;
[0035]
7)式(
ⅷ
)所示的n,n
’‑
双烯丙基-n-甲基-5-硝基间苯二甲酰胺经氧化制得式(ⅰ)所示的n,n
’‑
双(2,3-二羟基丙基)-n-甲基-5-硝基间苯二甲酰胺。
[0036]
所述步骤1)中,式(ⅱ)所示的化合物与n-溴代丁二酰亚胺在硫酸中加热反应制得式(ⅲ)所示化合物,n-溴代丁二酰亚胺与的式(ⅱ)所示的化合物的摩尔比为1.1-1.5:1,反应温度为50-90℃。
[0037]
所述步骤2)中,式(ⅲ)所示化合物与二氯亚砜在甲醇中加热反应制得式(ⅳ)所示的化合物,二氯亚砜与式(ⅲ)所示化合物的摩尔比为1.1-1.5:1,反应温度为50-80℃。
[0038]
所述步骤3)中,式(ⅳ)所示化合物与甲胺溶液在极性非质子溶剂中经碱催化下反应制得式(
ⅴ
)所示化合物,极性非质子溶剂选自四氢呋喃、二甲基亚砜或n,n-二甲基甲酰胺,碱催化剂为有机碱,选自三乙胺、dipea(n,n-二异丙基乙胺)或dbu(1,8-二氮杂双环[5.4.0]十一碳-7-烯),甲胺与式(ⅳ)所示化合物的摩尔比为10.0~20.0:1,碱催化剂与式(ⅳ)所示化合物的摩尔比为0.1~0.4:1。
[0039]
所述在于步骤4)中,式(
ⅴ
)所示化合物与烯丙基溴在极性非质子溶剂中经碱催化下反应制得式(ⅵ)化合物,极性非质子溶剂选自二甲基亚砜、n,n-二甲基甲酰胺或n-甲基吡咯烷酮,碱催化剂为无机碱,无机碱选自氢氧化钾、碳酸铯、磷酸钾或甲醇钠,烯丙基溴与式(
ⅴ
)所示化合物摩尔比为1.1~1.5:1,碱催化剂与式
ⅴ
化合物摩尔比为2.0~3.0:1。
[0040]
所述步骤5)中,式(ⅵ)所示化合物与氰化亚铜在极性非质子溶剂中加热反应制得式(ⅶ)所示化合物,极性非质子溶剂选自二甲基亚砜、1,3-二甲基-2-咪唑啉酮或n-甲基吡咯烷酮,氰化亚铜与式(ⅵ)所示化合物的摩尔比为1.1~2.0:1,所述反应的反应温度为140~190℃。
[0041]
所述步骤6)中,式(ⅶ)所示化合物与烯丙基溴在极性非质子溶剂中经碱催化下反应制得式(
ⅷ
)所示化合物,极性非质子溶剂选自丙酮、乙腈或1,4-二氧六环,碱催化剂为无机碱,无机碱选自氢氧化钾、碳酸钾、甲醇钠或叔丁醇钾,烯丙基溴与式(
ⅴ
)所示化合物摩尔比为1.1~1.5:1,所述反应的反应温度为40~80℃,碱催化剂与式
ⅴ
化合物摩尔比为2.0~3.0:1。
[0042]
所述步骤7)中,式(
ⅷ
)所示化合物与氧化剂在极性非质子溶剂中反应制得式(ⅰ)所示化合物,极性非质子溶剂选自四氢呋喃、丙酮、乙腈或1,4-二氧六环;氧化剂选自高锰酸钾、锇酸钾或过氧硫酸氢钾复合盐,氧化剂与式(
ⅷ
)所示化合物的摩尔比为2.0~4.0:1,所述反应的反应温度为-15~10℃。
[0043]
本发明的有益效果在于:高选择性地构建不对称的酰胺结构,有效地避免二酰化副产物的生成,较现有方法更高效合成碘普罗胺,更适用于工业化生产。
附图说明
[0044]
图1为实施例4制备得到的n-甲基-n-烯丙基-3-溴-5-硝基苯甲酰胺的氢谱图;
[0045]
图2为实施例4制备得到的n-甲基-n-烯丙基-3-溴-5-硝基苯甲酰胺的碳谱图;
[0046]
图3为实施例5制备得到的n-甲基-n-烯丙基-5-硝基间苯二甲酰胺的氢谱图;
[0047]
图4为实施例5制备得到的n-甲基-n-烯丙基-5-硝基间苯二甲酰胺的碳谱图;
[0048]
图5为实施例6制备得到的n,n
’‑
双烯丙基-n-甲基-5-硝基间苯二甲酰胺的氢谱图;
[0049]
图6为实施例6制备得到的n,n
’‑
双烯丙基-n-甲基-5-硝基间苯二甲酰胺的碳谱图;
[0050]
图7为实施例7制备得到的n,n
’‑
双(2,3-二羟基丙基)-n-甲基-5-硝基间苯二甲酰胺的氢谱图;
[0051]
图8为实施例7制备得到的n,n
’‑
双(2,3-二羟基丙基)-n-甲基-5-硝基间苯二甲酰胺的碳谱图。
具体实施方式
[0052]
下文将结合具体实施例对本发明的制备方法做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。
[0053]
下述实施例中所使用的实验方法如无特殊说明,均为常规方法;下述实施例中所用的试剂、材料等,如无特殊说明,均可从商业途径得到。
[0054]
实施例中纯度的检测方法是:色谱柱:diamonsil c
18
(250
×
4.6mm,5μm);流动相:乙腈/水=15/85(v/v);流速:1.0ml/min;检测波长:254nm;柱温:30℃;进样量:5.0μl。
[0055]
实施例1
[0056]
(s1)3-溴-5硝基苯甲酸(式ⅲ)的制备
[0057]
将3-硝基苯甲酸(式ⅱ)20g加入到250ml三口烧瓶中,加入浓硫酸80ml,60℃油浴加热溶清,分3批加入n-溴代丁二酰亚胺25.6g,每批间隔20~30分钟;加毕,保温反应12小时,反应结束后,反应液边搅拌边倾倒至1000ml冰水中,搅拌30分钟,抽滤,滤饼干燥;滤饼用乙酸乙酯/石油醚重结晶得类白色固体,3-溴-5硝基苯甲酸25g,纯度98.3%,收率85.0%。
[0058]
熔点:158.0~159.8℃.;1h nmr(400mhz,dmso-d6):δ13.99(bs,1h),8.61(t,j=2.0hz,1h),8.54(dd,j=2.2,1.4hz,1h),8.40(t,j=1.6hz,1h);
13
c nmr(100mhz,dmso-d6):δ164.2,148.5,137.5,134.1,129.8,122.7,122.3。
[0059]
按上述操作步骤,改变不同的n-溴代丁二酰亚胺用量、温度,所得到的实验结果如下表1:
[0060]
表1溴化工艺优化
[0061]
序号n-溴代丁二酰亚胺(当量)温度(℃)产物收率(%)
11.16081.421.36083.931.46084.141.56084.251.25080.861.27084.271.28084.081.29084.8
[0062]
实施例2
[0063]
(s2)3-溴-5-硝基苯甲酸甲酯(式ⅳ)的制备
[0064]
将3-溴-5硝基苯甲酸(式ⅲ)25g加入到500ml三口烧瓶中,加入甲醇300ml,冰浴下搅拌溶清,缓慢滴加二氯亚砜9.6ml;滴毕,恢复至室温,放置在70℃油浴加热反应6小时;反应结束后,反应液浓缩,加入饱和碳酸氢钠水溶液100ml打浆,抽滤,滤饼干燥,得白色固体化合物3-溴-5-硝基苯甲酸甲酯24.5g,纯度98.4%,收率92.8%。
[0065]
熔点:69.4~71.5℃;1h nmr(400mhz,cdcl3):δ8.78(dd,j=2.2,1.4hz,1h),8.55(t,j=2.0hz,1h),8.48(t,j=1.6hz,1h),4.00(s,3h);
13
c nmr(100mhz,cdcl3):δ163.8,148.9,138.3,133.4,130.5,123.3,123.2,53.2。
[0066]
按上述操作步骤,采用不同的二氯亚砜用量、温度,所得到的实验结果如下表2:
[0067]
表2酯化工艺优化
[0068]
组别二氯亚砜(当量)温度(℃)产物收率(%)11.17081.421.27089.331.47091.441.57091.651.35088.761.36090.471.38092.1
[0069]
实施例3
[0070]
(s3)n-甲基-3-溴-5-硝基苯甲酰胺(式
ⅴ
)的制备
[0071]
将3-溴-5-硝基苯甲酸甲酯(式ⅳ)26g加入到250ml三口烧瓶中,加入四氢呋喃60ml,1,8-二氮杂双环[5.4.0]十一碳-7-烯3ml,室温搅拌溶解;缓慢滴加12mol/l的甲胺甲醇溶液60ml;滴毕,室温搅拌过夜,反应结束后,反应液浓缩,加入1mol/l盐酸水溶液100ml打浆,抽滤,滤饼干燥,得淡黄色固体化合物n-甲基-3-溴-5-硝基苯甲酰胺24.5g,纯度99.2%,收率94.6%。
[0072]
熔点:172.0~173.8℃;1h nmr(400mhz,dmso-d6):δ8.90(q,j=4.8hz,1h),8.62(dd,j=1.5,0.5hz,1h),8.52(t,j=1.9hz,1h),8.43(t,j=1.6hz,1h),2.82(d,j=4.6hz,3h);
13
c nmr(100mhz,dmso-d6):δ167.8,150.2,137.3,135.6,130.1,124.1,122.3,26.7。
[0073]
按上述操作步骤,采用不同的碱及其用量、溶剂,所得到的实验结果如下表3:
[0074]
表3甲胺化工艺优化
[0075]
组别碱(当量)溶剂产物收率(%)1dbu(0.2)四氢呋喃87.92dbu(0.2)四氢呋喃94.03dbu(0.2)二甲基亚砜93.44dbu(0.2)n,n-二甲基甲酰胺92.55三乙胺(0.2)四氢呋喃78.96dipea(0.2)四氢呋喃85.47dbu(0.1)四氢呋喃90.28dbu(0.3)四氢呋喃94.59dbu(0.4)四氢呋喃93.9
[0076]
实施例4
[0077]
(s4)n-甲基-n-烯丙基-3-溴-5-硝基苯甲酰胺(式ⅵ)的制备
[0078]
将n-甲基-3-溴-5-硝基苯甲酰胺(式
ⅴ
)25.9g,碳酸铯78.2g加入到250ml三口烧瓶中,加入n,n-二甲基甲酰胺50ml,室温搅拌30分钟,缓慢滴加烯丙基溴10.4ml,滴毕,室温搅拌过夜;反应结束后,加入乙酸乙酯80ml稀释,然后用1mol/l盐酸水溶液40ml洗涤两次,合并水相,水相用乙酸乙酯80ml反萃二次,合并有机相,饱和食盐水溶液40ml洗涤两次,无水硫酸钠干燥,抽滤,滤液浓缩得红棕色油状化合物n-甲基-3-溴-5-硝基苯甲酰胺27.1g,纯度98.9%,收率90.5%,检测得到如图1的氢谱图。
[0079]1h nmr(400mhz,dmso-d6):(mixture of rotamers)δ8.45(t,j=2.0hz,1h),8.22
–
8.05(m,2h),5.90
–
5.79(m,1h),5.31
–
5.18(m,2h),4.08(d,j=5.6hz,1h),3.81(d,j=5.1hz,1h),2.96
–
2.85(m,3h);
13
c nmr(100mhz,dmso-d6):(mixture of rotamers)δ167.0,166.3,148.5,148.4,139.6,139.4,135.7,135.4,133.4,132.7,126.9,126.9,122.2,121.0,120.5,117.6,117.2,53.2,49.3,36.5,32.9;hrms(esi)m/z:c
11h12
brn2o3[m+h]
+
,理论值:299.0026,实际值:299.0029。
[0080]
从图2的碳谱中可以看出,由于叔酰胺存在旋转异构的现象,所以某些碳峰存在裂分的情况。
[0081]
按上述操作步骤,采用不同的烯丙基溴用量、碱及其用量、溶剂,所得到的实验结果如下表4:
[0082]
表4n-烯丙基化工艺优化
[0083][0084][0085]
实施例5
[0086]
(s5)n-甲基-n-烯丙基-5-硝基间苯二甲酰胺(式ⅶ)的制备
[0087]
将n-甲基-n-烯丙基-3-溴-5-硝基苯甲酰胺(式ⅵ)29.9g,氰化亚铜15.2g加入到250ml三口烧瓶中,加入n-甲基吡咯烷酮80ml,氮气保护;在160℃油浴加热反应36小时。反应结束后,冷却至室温,加入乙酸乙酯80ml稀释,然后用1.5mol/l氨水溶液40ml洗涤两次,合并水相,水相用乙酸乙酯80ml反萃三次,合并有机相,饱和食盐水溶液40ml洗涤两次,无水硫酸钠干燥,抽滤,滤液浓缩得橙黄色半油半固化合物,再经柱层析得黄色固体化合物n-甲基-n-烯丙基-5-硝基间苯二甲酰胺19.9g,纯度99.0%,收率75.8%,检测得到如图3所示的氢谱图。
[0088]
熔点:122.5~124.0℃;1h nmr(400mhz,dmso-d6):(mixture of rotamers)δ8.74(t,j=2.0hz,1h),8.41
–
8.32(m,3h),7.78(s,1h),5.91
–
5.79(m,1h),5.31
–
5.17(m,2h),4.11(d,j=4.4hz,1h),3.83(d,j=3.2hz,1h),2.99
–
2.87(m,3h);
13
c nmr(100mhz,dmso-d6):(mixture of rotamers)δ168.1,167.3,165.0,147.9,147.7,138.1,137.9,136.0,
133.4,132.8,131.7,131.6,124.3,123.7,123.1,117.5,117.3,53.2,49.3,36.7,32.9;hrms(esi)(m/z):c
12h14
n3o4[m+h]
+
,理论值:264.0979,实际值:264.0984。
[0089]
从图4的碳谱中可以看出,由于叔酰胺存在旋转异构的现象,所以某些碳峰存在裂分的情况。
[0090]
按上述操作步骤,采用不同的氰化亚铜用量、温度、溶剂,所得到的实验结果如下表5:
[0091]
表5一锅法制备酰胺工艺优化
[0092][0093][0094]
实施例6
[0095]
(s6)n,n
’‑
双烯丙基-n-甲基-5-硝基间苯二甲酰胺(式
ⅷ
)的制备
[0096]
将n-甲基-n-烯丙基-5-硝基间苯二甲酰胺(式ⅶ)13.2g,氢氧化钾7g加入到250ml三口烧瓶中,加入1,4-二氧六环80ml,40℃搅拌30分钟,缓慢滴加烯丙基溴5.2ml,滴毕,保温反应16小时;反应结束后,加入乙酸乙酯80ml稀释,然后用1mol/l盐酸水溶液40ml洗涤两次,合并水相,水相用乙酸乙酯80ml反萃一次,合并有机相,饱和食盐水溶液40ml洗涤两次,无水硫酸钠干燥,抽滤,滤液浓缩得棕黄色油状化合物,再经柱层析得黄色油状化合物n,n
’‑
双烯丙基-n-甲基-5-硝基间苯二甲酰胺10.4g,纯度98.9%,收率68.5%,检测得到如图5所示的氢谱图。
[0097]1h nmr(400mhz,dmso-d6):(mixture of rotamers)δ9.14(dd,j=10.8,4.8hz,1h),8.75(t,j=2.0hz,1h),8.38
–
8.22(m,2h),5.95
–
5.79(m,2h),5.26
–
5.18(m,3h),5.11(dq,j=10.3,1.6hz,1h),4.10(d,j=5.2hz,1h),3.94(t,j=6.0hz,2h),3.84(d,j=4.8hz,1h),2.99
–
2.87(m,3h);
13
c nmr(100mhz,dmso-d6):(mixture of rotamers)δ168.0,167.3,163.2,147.9,147.7,138.2,138.0,135.9,134.9,134.9,133.4,132.8,131.5,131.5,124.2,123.6,122.9,117.6,117.2,115.7,115.7,53.2,49.3,41.9,36.7,33.0;hrms(esi)m/z:c
15h18
n3o4[m+h]
+
,理论值:304.1292,实际值:304.1283。
[0098]
从图6的碳谱中可以看出,由于叔酰胺存在旋转异构的现象,所以某些碳峰存在裂
分的情况。
[0099]
按上述操作步骤,采用不同的烯丙基溴用量、碱及其用量、溶剂、温度,所得到的实验结果如下表6:
[0100]
表6n-单烯丙基化工艺优化
[0101][0102][0103]
实施例7
[0104]
(s7)n,n
’‑
双(2,3-二羟基丙基)-n-甲基-5-硝基间苯二甲酰胺(式ⅰ)的制备
[0105]
将10.1gn,n
’‑
双烯丙基-n
’‑
甲基-5-硝基间苯二甲酰胺(式
ⅷ
)加入到250ml三口烧瓶中,加入50ml四氢呋喃,于-5℃下搅拌溶清,缓慢滴加44ml3mol/l的高锰酸钾水溶液,滴毕,在-5℃下保温反应10小时,tlc监测,反应完全后,加入60ml 3mol/l硫代硫酸钠水溶液淬灭,反应液浓缩,加入60ml甲醇打浆,抽滤,滤液浓缩,得淡黄色油状物,最后经柱层析得无色油状化合物5.8g,收率46.8%。
[0106]1h nmr(600mhz,dmso-d6):(mixture of diastereomers)δ8.91(t,j=6.0hz,0.45h),8.85(t,j=5.4hz,0.55h),8.73(t,j=6.0hz,0.45h),8.70(t,j=5.4hz,0.55h),8.39(s,1h),8.31(d,j=9.6hz,1h),5.02(d,j=4.8hz,0.55h),4.97(d,j=5.4hz,0.45h),4.85(q,j=2.4hz,1h),4.64(t,j=6.0hz,0.45h),4.59(t,j=6.0hz,1h),4.54(t,j=6.0hz,0.55h),3.67(q,j=6.0hz,1.55h),3.61(dd,j=13.8,3.0hz,0.45h),3.46
–
3.36(m,5h),3.25
–
3.10(m,3h),3.04
–
2.97(m,3h);
13
c nmr(100mhz,cd3od,cf3cood):(mixture of diastereomers)δ173.8,173.3,170.2,170.0,150.7,150.6,139.8,138.6,138.5,134.6,134.1,127.8,127.4,126.3,126.1,74.6,72.9,72.0,71.1,66.1,66.0,65.7;hrms(esi)m/z:c
15h22
n3o8[m+h]
+
,理论值:372.1401,实际值:372.1398。
[0107]
从图7、8的氢谱和碳谱中可以看出,由于已知碘普罗胺具有多个构型,导致四羟基中间体也存在着多个构型,所以某些碳峰存在裂分的情况。
[0108]
按上述操作步骤,采用不同的高锰酸钾用量、溶剂、温度,所得到的实验结果如下表7:
[0109]
表7氧化工艺优化
[0110]
组别氧化剂(当量)温度(℃)溶剂产物收率(%)1高锰酸钾(2.0)-5四氢呋喃62.92高锰酸钾(3.0)-5四氢呋喃68.23高锰酸钾(4.0)-5四氢呋喃45.24锇酸钾(3.5)-5四氢呋喃46.55oxone(3.5)-5四氢呋喃38.26高锰酸钾(3.5)-15四氢呋喃45.97高锰酸钾(3.5)-10四氢呋喃46.08高锰酸钾(3.5)0四氢呋喃38.59高锰酸钾(3.5)5四氢呋喃33.810高锰酸钾(3.5)10四氢呋喃28.911高锰酸钾(3.5)-5丙酮40.112高锰酸钾(3.5)-5乙腈37.213高锰酸钾(3.5)-51,4-二氧六环35.7
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1