一种喹唑啉类化合物、其制备方法及其应用与流程
6元杂芳基和所述的被1、2或3个r
2-1-2
取代的5-6元杂芳基里,所述的5-6元杂芳基的杂原子数量为1、2或3个,所述的5-6元杂芳基的杂原子选自氧、硫和氮中的一种或多种;所述3-7元杂环烷基和被1、2或3个r
2-1-1
取代的3-7元杂环烷基里,所述3-7元杂环烷基的杂原子数量为1、2或3个,所述3-7元杂环烷基的杂原子选自氧、硫和氮中的一种或多种;
14.r
2-1-1
独立地为c
1-4
烷基;
15.r
2-1-2
独立地为c
1-4
烷基或c
1-4
烷氧基;
16.r
2-1-3
独立地为卤素、氰基、c
1-4
烷氧基、被1、2或3个卤素取代的c
1-4
烷基、被1、2或3个卤素取代的c
1-4
烷氧基、c
6-12
芳基、5-6元杂芳基、或所述的5-6元杂芳基的杂原子数量为1、2或3个,所述的5-6元杂芳基的杂原子选自氧、硫和氮中的一种或多种;
17.r
2-1-3-1
独立地为c
1-4
烷基;
18.r
2-1-3-2
独立地为c
1-4
烷基;
19.或者,r1、r2及它们之间的n原子一起形成环a,所述的环a为4-12元杂环烷基或被1、2或3个r
2-2
取代的4-12元杂环烷基;所述的环a为4-12元杂环烷基或被1、2或3个r
2-2
取代的4-12元杂环烷基里,所述的4-12元杂环烷基的杂原子数量为1、2或3个,所述的4-12元杂环烷基的杂原子选自氧、硫和氮中的一种或多种;
20.r
2-2
独立地为氧代、c
1-4
烷基或卤素。
21.在某一方案中,所述的如式i所示的喹唑啉类化合物满足下列条件中的1个、2个或3个:
22.i:r1为
23.ii:r2为被1、2或3个r
2-1
取代的c
1-4
烷基,r
2-1
为3-7元杂环烷基、5-6元杂芳基、被1、2或3个r
2-1-1
取代的3-7元杂环烷基或被1、2或3个r
2-1-2
取代的5-6元的杂芳基;
24.iii:r1、r2及它们之间的n原子一起形成环a,所述的环a为螺环或桥环;或者r1、r2及它们之间的n原子一起形成环a,所述的环a为单环,环a为被2或3个r
2-2
取代的4-12元杂环烷基,r
2-2
独立地为氧代、c
1-4
烷基或卤素,且当所述的4-12元杂环烷基的取代基包含氧代时,所述氧代的个数为2个或3个。
25.在某一方案中,x为卤素;
26.y为ch或n;
27.l为-(ch2)
m-或被1、2或3个c
1-4
烷基取代的-(ch2)
m-;m为4或5;
28.r1为h或
29.r2为被1、2或3个r
2-1
取代的c
1-4
烷基;
30.r
2-1
为3-7元杂环烷基、5-6元杂芳基、c
6-12
芳基、被1、2或3个r
2-1-1
取代的3-7元杂环烷基、被1、2或3个r
2-1-2
取代的5-6元的杂芳基或被1、2或3个r
2-1-3
取代的c
6-12
芳基;所述的5-6元杂芳基和所述的被1、2或3个r
2-1-2
取代的5-6元杂芳基里,所述的5-6元杂芳基的杂原子数量为1、2或3个,所述的5-6元杂芳基的杂原子选自氧、硫和氮中的一种或多种;所述3-7元杂环烷基和被1、2或3个r
2-1-1
取代的3-7元杂环烷基里,所述3-7元杂环烷基的杂原子数量为1、2或3个,所述3-7元杂环烷基的杂原子选自氧、硫和氮中的一种或多种;
31.r
2-1-1
独立地为c
1-4
烷基;
32.r
2-1-2
独立地为c
1-4
烷基或c
1-4
烷氧基;
33.r
2-1-3
独立地为卤素、氰基、c
1-4
烷氧基、被1、2或3个卤素取代的c
1-4
烷基、被1、2或3个卤素取代的c
1-4
烷氧基、5-6元杂芳基、所述的5-6元杂芳基的杂原子数量为1、2或3个,所述的5-6元杂芳基的杂原子选自氧、硫和氮中的一种或多种;
34.r
2-1-3-1
独立地为c
1-4
烷基;
35.r
2-1-3-2
独立地为c
1-4
烷基;
36.或者,r1、r2及它们之间的n原子一起形成环a,所述的环a为5-12元杂环烷基a1,所述的杂环烷基a1为桥环;或被2或3个r
2-2-1
取代的5-10元杂环烷基a2,所述杂环烷基a2为单环;或被1、2或3个r
2-2-2
取代8-12元杂环烷基a3,所述杂环烷基a3为螺环;所述的杂环烷基里,杂原子数量为1、2或3个,杂原子的个数选自氧、硫和氮的一种或多种;
37.r
2-2-1
独立地为氧代、c
1-4
烷基或卤素;
38.r
2-2-2
独立地为氧代、c
1-4
烷基或卤素;
39.且其满足下列条件中的1个、2个或3个:
40.i:r1为
41.ii:r2为被1、2或3个r
2-1
取代的c
1-4
烷基,r
2-1
为3-7元杂环烷基、5-6元杂芳基、被1、2或3个r
2-1-1
取代的3-7元杂环烷基或被1、2或3个r
2-1-2
取代的5-6元的杂芳基;
42.iii:r1、r2及它们之间的n原子一起形成环a,所述的环a为5-12元杂环烷基a1,所述的杂环烷基a1为桥环;或被1、2或3个r
2-2-2
取代8-12元杂环烷基a3,所述杂环烷基a3为螺环;或者r1、r2及它们之间的n原子一起形成环a,所述的环a为被2或3个r
2-2-1
取代的5-10元杂环烷基a2,所述杂环烷基a2为单环;r
2-2-1
独立地为氧代、c
1-4
烷基或卤素,且当所述的5-10元杂环烷基的取代基包含氧代时,所述氧代的个数为2个或3个。
43.在某一方案中,如式i所示的喹唑啉类化合物、其药学上可接受的盐、其溶剂合物或其药学上可接受的盐的溶剂合物里,某些基团的定义可如下所述,其他基团的定义可如其他任一方案所述(以下简称“在某一方案中”):l为-(ch2)
m-;被1个甲基取代的-(ch2)
m-;m为4或5;例如为为4或5;例如为
44.在某一方案中,l为在某一方案中,l为其中,标*的一侧表示与母核结构中nh上的n相连。
45.在某一方案中,x为f或cl。
46.在某一方案中,r2为被1、2或3个r
2-1
取代的c
1-4
烷基。
47.在某一方案中,r
2-1-3
独立地为卤素、氰基、c
1-4
烷氧基、被1、2或3个卤素取代的c
1-4
烷基、被1、2或3个卤素取代的c
1-4
烷氧基、5-6元杂芳基、所述的5-6元杂芳基的杂原子数量为1、2或3个,所述的5-6元杂芳基的杂原子选自氧、硫和氮中的一种或多种。
48.在某一方案中,r1、r2及它们之间的n原子一起形成环a,所述的环a为5-12元杂环烷基a1,所述的杂环烷基a1为桥环;或被2或3个r
2-2-1
取代的5-10元杂环烷基a2,所述杂环烷基a2为单环;或被1、2或3个r
2-2-2
取代8-12元杂环烷基a3,所述杂环烷基a3为螺环。
49.r
2-2-1
独立地为氧代、c
1-4
烷基或卤素;
50.r
2-2-2
独立地为氧代、c
1-4
烷基或卤素。
51.在某一方案中,r1、r2及它们之间的n原子一起形成环a,所述的环a为5-12元杂环烷基a1,所述的杂环烷基a1为桥环;或被2或3个r
2-2-1
取代的5-10元杂环烷基a2,所述杂环烷基a2为单环;或被1、2或3个r
2-2-2
取代8-12元杂环烷基a3,所述杂环烷基a3为螺环;
52.r
2-2-1
独立地为氧代、c
1-4
烷基或卤素;
53.r
2-2-2
独立地为氧代、c
1-4
烷基或卤素;
54.a2中,当所述的5-10元杂环烷基的取代基包含氧代时,所述氧代的个数为2个或3个。
55.在某一方案中,r1、r2及它们之间的n原子一起形成环a,所述的环a可为
56.其中,z为ch或n;
57.ra、rb和rc各自独立地为h或c
1-4
烷基;或者rb、rc和与其相连的原子共同形成c
3-6
脂碳环或3~6元脂杂环;所述的3~6元脂杂环的杂原子数量为1个或2个,所述的3~6元脂杂环的杂原子选自氧、硫和氮中的一种或多种;
58.结构片段表示被2个或3个rd取代的3~6元含氮杂环烷基;所述的杂环烷基的杂原子数量为1个、2个或3个,所述的杂环烷基的中除含氮外,其余杂原子选自氧、硫和氮中的一种或多种;
59.所述的rd为h、氧代或卤素;或相邻的两个rd与其相连的原子共同形成c
3-6
脂碳环、3~6元脂杂环、被1个、2个或3个r
d-1
取代的c
3-6
脂碳环或被1个、2个或3个r
d-1
取代的3~6元脂杂环;或者同一原子上的两个rd与其相连的原子共同形成c
3-6
脂碳环、3~6元脂杂环、被1个、2个或3个r
d-1
取代的c
3-6
脂碳环或被1个、2个或3个r
d-1
取代的3~6元脂杂环;所述的脂杂环的杂原子数量为1个、2个或3个,所述的脂杂环中杂原子选自氧、硫和氮中的一种或多种;
60.r
d-1
独立地为c
1-4
烷基。
61.在某一方案中,ra为h,rb和rc各自独立地为c
1-4
烷基。
62.在某一方案中,r2为被1或2个r
2-1
取代的甲基或乙基。
63.在某一方案中,环a为在某一方案中,环a为
64.在某一方案中,r2为为
65.在某一方案中,r2中,所述的c
1-4
烷基和被1、2或3个r
2-1
取代的c
1-4
烷基里,所述的c
1-4
烷基可独立地为甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基或仲丁基,例如为甲基或乙基。
66.在某一方案中,r
2-1
中,所述的3-7元杂环烷基和被1、2或3个r
2-1-1
取代的3-7元杂环烷基里,所述的3-7元杂环烷基中,杂原子的数量可独立地为1个,杂原子的种类可独立地为n或o。
67.在某一方案中,r
2-1
中,所述的3-7元杂环烷基和被1、2或3个r
2-1-1
取代的3-7元杂环烷基里,所述的3-7元杂环烷基可独立地为4-5元杂环烷基,例如四氢吡咯基或氧杂环丁烷基,更例如为
68.在某一方案中,r
2-1
中,所述的5-6元杂芳基和被1、2或3个r
2-1-2
取代的5-6元的杂芳基里,所述的5-6元杂芳基中,杂原子的种类可选自n和o的一种或两种。
69.在某一方案中,r
2-1
中,所述的5-6元杂芳基和被1、2或3个r
2-1-2
取代的5-6元的杂芳基里,所述的5-6元杂芳基可独立地为噁唑基、三唑基、吡啶基或吡嗪基,例如
70.在某一方案中,r
2-1
中,所述的c
6-12
芳基和被1、2或3个r
2-1-3
取代的c
6-12
芳基里,所述的c
6-12
芳基可独立地为苯基或萘基,例如为芳基可独立地为苯基或萘基,例如为
71.在某一方案中,r
2-1-1
中,所述c
1-4
烷基独立地为甲基、乙基、正丙基、异丙基、正丁
基、叔丁基、异丁基或仲丁基,例如为甲基。
72.在某一方案中,r
2-1-2
中,所述c
1-4
烷基独立地为甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基或仲丁基,例如为甲基。
73.在某一方案中,r
2-1-2
中,所述c
1-4
烷氧基独立地为甲氧基、乙氧基或丙氧基,例如为乙氧基。
74.在某一方案中,r
2-1-3
中,所述卤素独立地为f、cl、br或i,例如为f或cl。
75.在某一方案中,r
2-1-3
中,所述c
1-4
烷氧基独立地为甲氧基、乙氧基或丙氧基,例如为甲氧基。
76.在某一方案中,r
2-1-3
中,所述被1、2或3个卤素取代的c
1-4
烷基独立地为三氟甲基、三氟乙基或三氟丙基,例如为三氟甲基。
77.在某一方案中,r
2-1-3
中,所述被1、2或3个卤素取代的c
1-4
烷氧基独立地为三氟甲氧基、三氟乙氧基或三氟丙氧基,例如为三氟甲氧基。
78.在某一方案中,r
2-1-3
中,所述c
6-12
芳基为苯基或萘基。
79.在某一方案中,r
2-1-3
中,所述5-6元杂芳基可为吡唑基、吡嗪基、哒嗪基、吡啶基、嘧啶基或吡咯基,例如为吡唑基,再例如为
80.在某一方案中,r
2-1-3-1
和r
2-1-3-2
中,所述的c
1-4
烷基可独立地为甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基或仲丁基,例如为甲基。
81.在某一方案中,r
2-2
中,所述的c
1-4
烷基可独立地为甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基或仲丁基,例如为甲基或乙基。
82.在某一方案中,r
2-2
中,所述卤素可独立地为f、cl、br或i,例如为f。
83.在某一方案中,ra、rb和rc中,所述的c
1-4
烷基可独立地为甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基或仲丁基,例如为甲基。
84.在某一方案中,rb、rc和与其相连的原子共同形成c
3-6
脂碳环,所述的c
3-6
脂碳环可为环丙烷、环丁烷、环戊烷或环己烷,例如环丙烷、环丁烷或环戊烷。
85.在某一方案中,rb、rc和与其相连的原子共同形成3~6元脂杂环,所述的3~6元脂杂环中,杂原子的数量可为1个,杂原子的种类可为n。
86.在某一方案中,rb、rc和与其相连的原子共同形成3~6元脂杂环,所述的3~6元脂杂环可为6元脂杂环,例如哌啶环,更例如
87.在某一方案中,的定义中,所述的3~6元含氮杂环烷基中,杂原子的数量可独立地为1个或2个,杂原子的种类可独立地为n、n和s。
88.在某一方案中,的定义中,所述的3~6元含氮杂环烷基可独立地为硫代吗啉基、四氢吡咯基或n杂环丁烷基,例如
89.在某一方案中,的定义中,所述的c
3-6
脂碳环可独立地为环丙烷、环丁烷、环戊烷或环己烷,例如环戊烷。
90.在某一方案中,的定义中,所述的3~6元脂杂环中,杂原子的数目可独立地为1个,杂原子的种类可独立地为n或o。
91.在某一方案中,的定义中,所述的3~6元脂杂环可独立地为氧杂环丁烷、四氢吡咯环或四氢吡喃环,例如同一原子上的两个rd与其相连的原子共同形成3~6元脂杂环或被1个、2个或3个r
d-1
取代的3~6元脂杂环时,所述的3~6元脂杂环可为
92.在某一方案中,r
d-1
中,所述的c
1-4
烷基可为甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基或仲丁基,例如为甲基。
93.在某一方案中,x为卤素;y为ch或n;r1为r2为被1、2或3个r
2-1
取代的c
1-4
烷基;r
2-1
为或被1、2或3个r
2-1-3
取代的c
6-12
芳基;l较佳地为
94.在某一方案中,x为卤素;y为n;r1为r2为l为-(ch2)
m-,m为4或5。
95.在某一方案中,x为cl;y为ch;l为当被1个甲基取代的-(ch2)
m-,r1、r2及它们之间的n原子一起形成环a,所述的环a为其中ra为c
1-4
烷基,rb和rc均为h。
96.在某一方案中,x为cl;y为n;l为当被1个甲基取代的-(ch2)
m-,m为4或5;r1、r2及它们之间的n原子一起形成环a,所述的环a为们之间的n原子一起形成环a,所述的环a为
97.在某一方案中,x为cl;y为ch;l为被1个甲基取代的-(ch2)
m-,m为4或5;r1、r2及它们之间的n原子一起形成环a,所述的环a为所述的rd为氧代或卤素;或相邻的两个rd与其相连的原子共同形成c
3-6
脂碳环,或者同一原子上的两个rd与其相连的原子共同形成3~6元脂杂环或被1个、2个或3个r
d-1
取代的3~6元脂杂环;所述的脂杂环的杂原子数量为1个、2个或3个,所述的脂杂环中杂原子选自氧、硫和氮中的一种或多种。
98.在某一方案中,x为cl;y为ch;l为被1个甲基取代的-(ch2)
m-,m为4或5;r1为h;r2为被1、2或3个r
2-1
取代的c
1-4
烷基,r
2-1
为被1、2或3个r
2-1-1
取代的3-7元杂环烷基。
99.在某一方案中,r1为
100.在某一方案中,r2为被1、2或3个r
2-1
取代的c
1-4
烷基,r
2-1
为3-7元杂环烷基、5-6元杂芳基、被1、2或3个r
2-1-1
取代的3-7元杂环烷基或被1、2或3个r
2-1-2
取代的5-6元的杂芳基。
101.在某一方案中,r1、r2及它们之间的n原子一起形成环a,所述的环a为5-12元杂环烷基a1,所述的杂环烷基a1为桥环;或被1、2或3个r
2-2-2
取代8-12元杂环烷基a3,所述杂环烷基a3为螺环,所述的杂环烷基里,杂原子数量为1、2或3个,杂原子的个数选自氧、硫和氮的一种或多种。
102.在某一方案中,当r1、r2及它们之间的n原子一起形成环a时,所述的环a为被2或3个r
2-2-1
取代的5-10元杂环烷基a2,所述杂环烷基a2为单环;r
2-2-1
独立地为氧代、c
1-4
烷基或卤素,且当所述的5-10元杂环烷基的取代基包含氧代时,所述氧代的个数为2个或3个,所述的杂环烷基里,杂原子数量为1、2或3个,杂原子的个数选自氧、硫和氮的一种或多种。
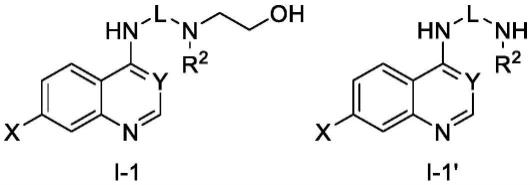
103.在某一方案中,所述如式i所示的喹唑啉类化合物可为如式i-1或i-1’所述的化合物:
[0104][0105]
其中各取代基的定义均如前所述。
[0106]
在某一方案中,所述如式i所述的喹唑啉类化合物可为如式i-2所述的化合物:
[0107][0108]
其中各取代基的定义均如前所述。
[0109]
在某一方案中,所述如式i所述的喹唑啉类化合物可为如式i-2所述的化合物:
[0110][0111]
其中各取代基的定义均如前所述。
[0112]
在某一方案中,所述如式i所示的喹唑啉类化合物为以下任一化合物:
[0113][0114]
[0115]
[0116]
[0117][0118]
本发明还提供一种上述如式i所示的喹唑啉类化合物的制备方法,其为以下方法中的任一种:
[0119]
方法1,其包含以下步骤:在溶剂中,在碱和碘盐的作用下,如式ii-1所示的化合物与如式ii-2所示的化合物进行反应,即可;
[0120][0121]
其中,x1为卤素,例如f、cl、br或i,优选为cl;y为ch;上述各式中其余各取代基的定义均如前所述;
[0122]
所述的溶剂可为本领域此类反应常用溶剂,例如腈类溶剂,优选为乙腈;
[0123]
所述的碱可为本领域此类反应常用碱,例如碱金属的碳酸盐,优选为碳酸钾;
[0124]
所述的碘盐可为本领域此类反应常用碘盐,例如ki;
[0125]
方法2:在溶剂中,在碱和季铵盐的作用下,如式ii-1所示的化合物与如式ii-2所示的化合物进行反应,即可;
[0126][0127]
其中,x1为卤素,例如f、cl、br或i,优选为cl;y为n;上述各式中其余各取代基的定义均如前所述;
[0128]
所述的溶剂可为本领域此类反应常用溶剂,例如腈类溶剂,优选为乙腈;
[0129]
所述的碱可为本领域此类反应常用碱,例如碱金属的碳酸盐,优选为碳酸钾;
[0130]
所述的季铵盐可为本领域此类反应常用季铵盐,例如n-bu4nbr;
[0131]
方法3,其包含以下步骤:在溶剂中,在碱的作用下,如式ii-3所示的化合物和如式ii-4所示的化合物进行反应,即可;
[0132][0133]
其中,式ii-4中,x2为卤素,例如f、cl、br或i,优选为cl;式i中,r1为上述各式中其余各取代基的定义均如前所述;
[0134]
所述的溶剂可为本领域此类反应常用溶剂,例如腈类溶剂,优选为乙腈;
[0135]
所述的碱可为本领域此类反应常用碱,例如碱金属的碳酸盐,优选为碳酸钾。
[0136]
本发明还提供一种药物组合物,其包括物质x和药用辅料;所述的物质x为上述的如式i所示的喹唑啉类化合物、其药学上可接受的盐、其溶剂合物或其药学上可接受的盐的溶剂合物。
[0137]
本发明还提供一种物质y在制备药物中的应用;所述的物质y为如上所述的如式i所示的喹唑啉类化合物、其药学上可接受的盐、其溶剂合物、其药学上可接受的盐的溶剂合物或如上所述的药物组合物,所述的药物为对细胞因子tnf-α、il-6、il-1β中的1、2或3种有抑制作用的药物。
[0138]
本发明还提供一种物质y在制备抑制剂中的应用;所述的物质y为如上所述的如式i所示的喹唑啉类化合物、其药学上可接受的盐、其溶剂合物、其药学上可接受的盐的溶剂合物或如上所述的药物组合物,所述的抑制剂为细胞因子tnf-α抑制剂、il-6抑制剂和il-1β抑制剂中的1、2或3种。
[0139]
某一方案中,所述的抑制剂为在体外对tnf-α、il-6和il-1β中的1、2或3种有抑制作用的抑制剂。
[0140]
本发明还提供一种物质y在制备药物中的应用;所述的物质y为如上所述的如式i所示的喹唑啉类化合物、其药学上可接受的盐、其溶剂合物、其药学上可接受的盐的溶剂合物或如上所述的药物组合物;所述药物为用于预防和/或治疗与tnf-α、il-6和il-1β中的1、2或3种相关的疾病的药物。
[0141]
本发明还提供一种物质y在制备药物中的应用;所述的物质y为如上所述的如式i所示的喹唑啉类化合物、其药学上可接受的盐、其溶剂合物、其药学上可接受的盐的溶剂合物或如上所述的药物组合物;所述药物为用于预防和/或治疗自身免疫性疾病(例如类风湿性关节炎、系统性红斑狼疮、皮肤性红斑狼疮、糖尿病、干燥综合征、多发性硬化等),疟疾,感染性疾病(例如艾滋病、病毒性肝炎、冠状病毒等),过敏性疾病(例如哮喘等),心血管系统疾病,器官移植后的抗排异反应,慢性阻塞性肺疾病、肿瘤等与机体免疫系统的功能及反应状态异常有关的疾病的药物。
[0142]
术语“卤素”是指氟、氯、溴或碘。
[0143]
术语“烷基”是指具有指定的碳原子数(例如c1~c4)的直链或支链烷基。烷基包括但不限于甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基或仲丁基等。
[0144]
术语“烷氧基”是指基团r
x-o-,其中,r
x
为上文所定义的烷基。
[0145]
术语“氧代”是指基团
[0146]
术语“脂碳环”是指具有指定碳原子数(例如c
3-6
)的、环状的、饱和的单环,脂碳环的例子包括但不限于环丙烷、环丁烷、环戊烷、环己烷。
[0147]
术语“杂环烷基”是指具有指定环原子数(例如5~10元)的、指定杂原子数(例如1、2或3个)的、指定杂原子种类(n、o和s中的一种或多种)的环状基团,其为单环、桥环或螺环,且每一个环均为饱和的。杂环烷基包括但不限于氮杂环丁烷基、四氢吡咯基、四氢呋喃基、吗啉基、哌啶基等。
[0148]
术语“脂杂环”是指具有指定环原子数(例如3~6元)的、指定杂原子数(例如1、2或3个)的、指定杂原子种类(n、o和s中的一种或多种)的环,其为单环,脂杂环的例子包括但不限于氧杂环丁烷、四氢吡咯环、四氢吡喃环。
[0149]
术语“芳基”是指具有指定的碳原子数(例如c6~c
10
)的、仅由碳原子组成的环状基团,其为单环或多环,且至少一个环具有芳香性(符合休克尔规则)。芳基通过具有芳香性的环或不具有芳香性的环与分子中的其他片段连接。芳基包括但不限于苯基、萘基等。
[0150]
术语“杂芳基”是指具有指定环原子数(例如5~10元)的、指定杂原子数(例如1、2或3个)的、指定杂原子种类(n、o和s中的一种或多种)的环状基团,其为单环或多环,且至少一个环具有芳香性(符合休克尔规则)。杂芳基通过具有芳香性的环或不具有芳香性的环与分子中的其他片段连接。杂芳基包括但不限于呋喃基、吡咯基、噻吩基、吡唑基、咪唑基、噁唑基、噻唑基、吡啶基、嘧啶基、吲哚基等。在某一方案中,所述的杂芳基为单环。
[0151]
基团末端的
“‑”
是指该基团通过该位点与分子中的其他片段连接。例如,ch
3-c(=o)-是指乙酰基。
[0152]
结构片段中的是指该结构片段通过该位点与分子中的其他片段连接。例如,是指环己基。
[0153]
当任意变量(例如基团r
1-1
)在化合物的定义中多次出现时,它们的定义互相独立、互不影响。例如,被3个r
1-1
取代的c6~c
10
芳基是指c6~c
10
芳基会被3个r
1-1
取代,3个r
1-1
的定义互相独立的、互不影响。
[0154]
术语“药学上可接受的盐”是指化合物与药学上可接受的(相对无毒、安全、适合于患者使用)酸或碱反应得到的盐。当化合物中含有相对酸性的官能团时,可以通过在合适的惰性溶剂中用足量的药学上可接受的碱与化合物的游离形式接触的方式获得碱加成盐。药学上可接受的碱加成盐包括但不限于钠盐、钾盐、钙盐、铝盐、镁盐、铋盐、铵盐等。当化合物中含有相对碱性的官能团时,可以通过在合适的惰性溶剂中用足量的药学上可接受的酸与化合物的游离形式接触的方式获得酸加成盐。药学上可接受的酸加成盐包括但不限于盐酸盐、硫酸盐、甲磺酸盐等。具体参见handbook of pharmaceutical salts:properties,selection,and use(p.heinrich stahl,2002)。
[0155]
术语“溶剂合物”是指化合物与溶剂(包括但不限于:水、甲醇、乙醇等)结晶后形成的物质。溶剂合物分为化学计量类溶剂合物和非化学计量类溶剂合物。
[0156]
术语“药学上可接受的盐的溶剂合物”是指化合物与药学上可接受的(相对无毒、安全、适合于患者使用)酸或碱、溶剂(包括但不限于:水、甲醇、乙醇等)结合形成的物质,其中,药学上可接受的盐与上文术语“药学上可接受的盐”的含义相同,溶剂为化学计量的或非化学计量的。药学上可接受的盐的溶剂合物包括但不限于盐酸盐一水合物。
[0157]
术语“治疗有效量”是指给予患者的、足以有效治疗疾病的化合物的量。治疗有效量将根据化合物、疾病种类、疾病的严重度、患者的年龄等变化,但可由本领域技术人员视情况调整。
[0158]
术语“药用辅料”是指生产药品和调配处方时使用的赋形剂和附加剂,是除活性成分以外,包含在药物制剂中的所有物质。具体参见中华人民共和国药典(2020年版)或handbook of pharmaceutical excipients(raymond c rowe,2009)。
[0159]
术语“治疗”是指下述任一情形:(1)缓解疾病的一种或多种生物学表现;(2)干扰引发疾病的生物级联中的一个或多个点;(3)减缓疾病的一种或多种生物学表现发展。
[0160]
术语“预防”是指降低发生疾病的风险。
[0161]
术语“患者”是指已经或即将接受治疗的任何动物,优选哺乳动物,最优选人类。哺乳动物包括但不限于牛、马、羊、猪、猫、狗、小鼠、大鼠、家兔、豚鼠、猴、人类等。
[0162]
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0163]
本发明所用试剂和原料均市售可得。
[0164]
本发明的积极进步效果在于:本发明的喹唑啉类化合物结构新颖,对细胞因子tnf-α,il-6,il-1β具有良好的抑制效果。
具体实施方式
[0165]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0166]
实施例1:4-(4-((7-氯喹啉-4-基)氨基)戊基)硫代吗啉-1,1-二氧化物(化合物1)
[0167][0168]
步骤1制备4-氨基-1-戊醇(化合物1-2)
[0169]
在室温并有氢气保护下,将5-羟基-2-戊酮(5.0g,48.96mmol)和甲酸铵(10.0g,158.58mmol)加入到含钯/炭(1g)的甲醇(200ml)的溶液中,室温搅拌48小时。将反应混合物减压浓缩,剩余液体加入乙酸乙酯(200ml)打浆。过滤,减压浓缩至干,得到粗品4-氨基-1-戊醇(4g,收率79.22%)。lc-ms:m/z 104.1[m+h]
+
.
[0170]
步骤2制备5-((叔丁基二苯基甲硅烷基)氧基)戊-2-胺(化合物1-3)
[0171]
在室温并有氩气保护的情况下,将4-氨基-1-戊醇(4.0g,38.83mmol)、咪唑(5.28g,77.67mmol)和叔丁基二苯基氯硅烷(16.02g,58.25mmol)加入到二氯甲烷(200ml)的溶液中,室温搅拌18小时。反应完全,浓缩后加入水和乙酸乙酯,乙酸乙酯萃取三次,有机相经干燥、过滤,浓缩,再经柱层析分离得到产物5-((叔丁基二苯基甲硅烷基)氧基)戊-2-胺(5.4g,收率40.79%)。lc-ms:m/z 342.2[m+h]
+
.
[0172]
步骤3制备n-(5-((叔丁基二苯基甲硅烷基)氧基)戊基-2-基)-7-氯喹啉-4-胺(化合物1-4)
[0173]
将原料5-((叔丁基二苯基甲硅烷基)氧基)戊-2-胺(3.8g,11.14mmol)溶于40ml 1,4-二氧六环中,分别加入pd2(dba)3(50mg)、binap(40mg)、cs2co3(7.25g,22.25mmol)和4,7-二氯喹啉(2.0g,10.1mmol),该反应混合物在氩气保护下加热至110℃,反应18小时。反应完全,浓缩,剩余物经柱层析分离得到产品4g,收率78.72%。lc-ms:m/z 503.2[m+h]
+
.
[0174]
步骤4制备4-((7-氯喹啉-4-基)氨基)戊-1-醇(化合物1-5)
[0175]
将原料n-(5-((叔丁基二苯基甲硅烷基)氧基)戊基-2-基)-7-氯喹啉-4-胺(4.0g,7.95mmol)溶于40ml甲醇中,加入氟化铵(2.0g,54.05mmol),该反应混合物在氩气保护下加
热回流,反应2小时。反应完全,浓缩,剩余物经液相制备分离得到产品1.6g,收率76.19%。lc-ms:m/z 265.1[m+h]
+
.
[0176]
步骤5制备7-氯-n-(5-氯戊烷-2-基)喹啉-4-胺(化合物1-6)
[0177]
将原料4-((7-氯喹啉-4-基)氨基)戊-1-醇(2.0g,7.58mmol)溶于40ml二氯甲烷中,加入氯化亚砜(2.0g,16.81mmol)和催化量的n,n-二甲基甲酰胺(0.1ml),该反应混合物在氩气保护下室温反应2小时。反应完全,浓缩,剩余物经碳酸氢钠溶液淬灭,经乙酸乙酯萃取。有机相干燥、过滤、浓缩得到初产品2.1g,收率97.95%,直接用于下一步反应。lc-ms:m/z 283.1[m+h]
+
.
[0178]
步骤6制备4-(4-((7-氯喹啉-4-基)氨基)戊基)硫代吗啉-1,1-二氧化物(化合物1)
[0179]
将原料7-氯-n-(5-氯戊烷-2-基)喹啉-4-胺(80mg,0.28mmol)溶于20ml乙腈中,分别加入ki(10mg)、k2co3(100mg,0.73mmol)和硫吗啉-1,1-二氧化物(150mg,1.11mmol),该反应混合物在氩气保护下加热至60-70℃,反应48小时。反应完全,浓缩,剩余物经柱层析分离得到产品15mg,收率13.89%。1h nmr(400mhz,cdcl3)δ8.47(d,j=5.6hz,1h),7.98(d,j=1.8hz,1h),7.87(d,j=9.0hz,1h),7.35(dd,j=8.9,2.0hz,1h),6.45(d,j=5.7hz,1h),5.57(s,1h),3.78(dd,j=13.4,6.8hz,1h),3.05(d,j=6.1hz,4h),2.99(d,j=5.9hz,4h),2.56(t,j=6.9hz,2h),1.86
–
1.76(m,1h),1.76
–
1.56(m,4h),1.39(d,j=6.3hz,3h).lc-ms:m/z 382.1[m+h]
+
.
[0180]
实施例2-12
[0181]
按照实施例1的相同方法,制备实施例2-12的化合物,具体实验数据见表1。
[0182]
表1化合物1-12的实验数据表
[0183]
[0184]
[0185]
[0186]
[0187][0188]
[0189]
实施例13:3-(4-((7-氯喹唑啉-4-基)氨基)戊基)咪唑烷-2,4-二酮(化合物13)
[0190][0191]
步骤1制备n-(5-((叔丁基二苯基甲硅烷基)氧基)戊烷-2-基)-7-氯喹唑啉-4-胺(化合物2-2)
[0192]
将原料5-((叔丁基二苯基甲硅烷基)氧基)戊-2-胺(2.8g,8.20mmol)溶于40ml异丙醇中,分别加入dipea(3.5g,27.08mmol)和4,7-二氯喹唑啉(2.0g,10.05mmol),该反应混合物在氩气保护下加热至90℃,反应18小时。反应完全,浓缩,剩余物经制备分离得到产品3.1g,收率75.01%。lc-ms:m/z 504.2[m+h]
+
.
[0193]
步骤2制备4-((7-氯喹唑啉-4-基)氨基)戊-1-醇(化合物2-3)
[0194]
将原料n-(5-((叔丁基二苯基甲硅烷基)氧基)戊基-2-基)-7-氯喹唑啉-4-胺(3.1g,6.15mmol)溶于40ml甲醇中,加入氟化铵(2.0g,54.05mmol),该反应混合物在氩气保护下加热回流,反应2小时。反应完全,浓缩,剩余物经液相制备分离得到产品1.3g,收率79.75%。lc-ms:m/z 266.1[m+h]
+
.
[0195]
步骤3制备7-氯-n-(5-氯戊烷-2-基)喹唑啉-4-胺(化合物2-4)
[0196]
将原料4-((7-氯喹啉-4-基)氨基)戊-1-醇(1.0g,3.76mmol)溶于20ml二氯甲烷中,加入氯化亚砜(1.0g,8.40mmol)和催化量的n,n-二甲基甲酰胺(0.1ml),该反应混合物在氩气保护下室温反应2小时。反应完全,浓缩,剩余物经碳酸氢钠溶液淬灭,经乙酸乙酯萃取。有机相干燥、过滤、浓缩得到初产品1.0g,收率93.66%,直接用于下一步反应。lc-ms:m/z 284.1[m+h]
+
.
[0197]
步骤4制备3-(4-((7-氯喹唑啉-4-基)氨基)戊基)咪唑烷-2,4-二酮(化合物13)
[0198]
将原料7-氯-n-(5-氯戊烷-2-基)喹唑啉-4-胺(100mg,0.35mmol)溶于20ml乙腈中,分别加入n-bu4nbr(10mg)、k2co3(100mg,0.73mmol)和咪唑烷-2,4-二酮(100mg,1.00mmol),该反应混合物在氩气保护下加热至60-70℃,反应48小时。反应完全,浓缩,剩余物经柱层析分离得到产品54mg,收率44.12%。1h nmr(400mhz,cdcl3)δ8.62(s,1h),7.81(t,j=5.5hz,2h),7.41(dd,j=8.8,2.1hz,1h),6.13(d,j=8.0hz,1h),5.74(s,1h),4.66
–
4.52(m,1h),4.01(d,j=0.9hz,2h),3.68
–
3.56(m,2h),1.90
–
1.80(m,2h),1.72
–
1.60(m,2h),1.32(d,j=6.5hz,3h).lc-ms:m/z 348.1[m+h]
+
.
[0199]
实施例14
[0200]
按照实施例13的相同方法,制备实施例14的化合物,具体实验数据见表2。
[0201]
表2化合物13、14的实验数据表
[0202][0203]
实施例15:1-(4-((7-氯喹唑啉-4-基)氨基)戊基)吡咯烷-2,5-二酮(化合物15)
[0204][0205]
步骤1制备1-(4-((7-氯喹唑啉-4-基)氨基)戊基)吡咯烷-2,5-二酮(化合物15)
[0206]
将原料4-((7-氯喹唑啉-4-基)氨基)戊-1-醇(50mg,0.19mmol)溶于20ml无水四氢呋喃中,分别加入pph3(280mg,1.07mmol)、diad(240mg,1.19mmol)和吡咯烷-2,5-二酮(100mg,1.01mmol),该反应混合物在氩气保护下室温反应48小时。反应完全,浓缩,剩余物经柱层析分离得到产品57mg,收率87.10%。1h nmr(400mhz,cdcl3)δ8.63(s,1h),7.82(d,j=2.0hz,1h),7.78(d,j=8.8hz,1h),7.42(dd,j=8.8,2.1hz,1h),5.97(d,j=7.9hz,1h),4.63
–
4.51(m,1h),3.67
–
3.52(m,2h),2.74(s,4h),1.76
–
1.60(m,4h),1.32(d,j=6.5hz,3h).lc-ms:m/z 348[m+h]
+
.
[0207]
表3化合物15的实验数据表
[0208][0209]
实施例16:2-((4-((7-氯喹唑啉-4-基)氨基)戊基)(噁唑-2-基甲基)氨基)乙-1-醇(化合物16)
[0210][0211]
步骤1制备5-(苄基(2-羟乙基)氨基)戊-2-酮(化合物4-3)
[0212]
室温下将原料2-(苄基氨基)乙醇(17.5g,116mmol),5-氯戊-2-酮(28g,232mmol),碳酸钾(24g,174mmol)和碘化钾(1.9g,12mmol)加于n,n-二甲基甲酰胺(300ml)中,氩气保护下120℃反应过夜。蒸干n,n-二甲基甲酰胺后,加水并用二氯甲烷萃取三次,有机相用饱和食盐水洗涤,无水硫酸钠干燥,过滤后旋蒸至干。残留物用柱层析纯化得到黄色油状物5-(苄基(2-羟乙基)氨基)戊-2-酮(23g,98mmol,收率84.5%)。lc-ms:m/z 236[m+h]
+
.
[0213]
步骤2制备2-[4-氨基戊基(苄基)氨基]乙醇(化合物4-4)
[0214]
原料5-(苄基(2-羟乙基)氨基)戊-2-酮(9g,38mmol)溶于甲醇((200ml)中,室温下加入醋酸铵(17.7g,230mmol)搅拌30分钟。然后加入氰基硼氢化钠(5g,80mmol),室温搅拌
过夜。蒸干甲醇后,加入40%氢氧化钠水溶液(200ml),二氯甲烷萃取三次,有机相用饱和食盐水洗涤,无水硫酸钠干燥,过滤后旋蒸至干。残留物用柱层析纯化得到黄色油状物2-[4-氨基戊基(苄基)氨基]乙醇(2.45g,10.4mmol,收率27.1%)。lc-ms:m/z 237[m+h]
+
.
[0215]
步骤3制备2-(苄基(4-((7-氯喹唑啉-4-基)氨基)戊基)氨基)乙醇(化合物4-5)
[0216]
原料2-[4-氨基戊基(苄基)氨基]乙醇(2.4g,10mmol)和4,7-二氯喹唑啉(2.26g,11.4mmol)加入到n,n-二异丙基乙胺(7.5g)中,90℃搅拌过夜。蒸干n,n-二异丙基乙胺,加水并用二氯甲烷萃取三次,有机相用饱和食盐水洗涤,无水硫酸钠干燥,过滤后旋蒸至干。残留物用柱层析纯化得到黄色油状物2-(苄基(4-((7-氯喹唑啉-4-基)氨基)戊基)氨基)乙醇(2.2g,5.5mmol,收率54%)。lc-ms:m/z 399[m+h]
+
.
[0217]
步骤4制备n
1-苄基-n
1-(2-((叔丁基二甲基硅基)氧)乙基)-n
4-(7-氯喹唑啉-4-基)戊烷-1,4-二胺(化合物4-6)
[0218]
原料2-(苄基(4-((7-氯喹唑啉-4-基)氨基)戊基)氨基)乙醇(2.2g,5.5mmol)和咪唑(0.752g,11.0mmol)溶于无水二氯甲烷(30ml)中,冰浴下滴入叔丁基二甲基氯硅烷(1g,6.6mmol),反应液室温搅拌过夜。反应液水洗三次,无水硫酸钠干燥,过滤后旋蒸至干。残留物用柱层析纯化得到白色固体n1-苄基-n1-(2-((叔丁基二甲基硅基)氧)乙基)-n4-(7-氯喹唑啉-4-基)戊烷-1,4-二胺(1.4g,2.7mmol,收率50%)。lc-ms:m/z 513[m+h]
+
.
[0219]
步骤5制备2-((4-((7-氯喹唑啉-4-基)氨基)戊基)氨基)乙醇(化合物4-7)
[0220]
原料n1-苄基-n1-(2-((叔丁基二甲基硅基)氧)乙基)-n4-(7-氯喹唑啉-4-基)戊烷-1,4-二胺(1.4g,2.7mmol)溶于无水二氯甲烷(30ml)中,冰浴下滴入1-氯乙基氯甲酸酯(0.51g,3.6mmol),反应液室温下搅拌2小时。蒸去二氯甲烷,加入甲醇回流2小时。蒸去甲醇,残留物用柱层析纯化得到黄色油状物2-((4-((7-氯喹唑啉-4-基)氨基)戊基)氨基)乙醇(0.388g,1.26mmol,收率46%)。lc-ms:m/z 309[m+h]
+
.
[0221]
步骤6制备2-((4-((7-氯喹唑啉-4-基)氨基)戊基)(噁唑-2-基甲基)氨基)乙-1-醇(化合物16)
[0222]
原料2-((4-((7-氯喹唑啉-4-基)氨基)戊基)氨基)乙醇(65mg,0.21mmol),2-(氯甲基)噁唑(30mg,0.26mmol)和碳酸钾(44mg,0.32mmol)加入乙腈(5ml)中,反应液80℃搅拌过夜。蒸干溶剂后,加水并用二氯甲烷萃取三次,有机相用饱和食盐水洗涤,无水硫酸钠干燥,过滤后旋蒸至干。残留物用硅胶制备板纯化得到黄色油状物2-((4-((7-氯喹唑啉-4-基)氨基)戊基)(噁唑-2-基甲基)氨基)乙-1-醇(39mg,0.10mmol,收率47.52%)。1h nmr(400mhz,cdcl3)δ8.62(s,1h),7.85(d,j=2.0hz,1h),7.82(d,j=8.9hz,1h),7.63(s,1h),7.42(dd,j=8.8,2.0hz,1h),7.08(s,1h),6.00(d,j=6.4hz,1h),4.58
–
4.47(m,1h),3.90(s,2h),3.65(t,j=5.1hz,2h),2.79(t,j=4.4hz,2h),2.73-2.64(m,2h),1.85-1.80(m,2h),1.71
–
1.62(m,3h),1.34(d,j=6.5hz,3h)。lc-ms:m/z 390[m+h]
+
.
[0223]
实施例17-43
[0224]
按照实施例16的相同方法,制备实施例17-43的化合物,具体实验数据见表4
[0225]
表4化合物16-43的实验数据表
[0226]
[0227]
[0228]
[0229]
[0230]
[0231]
[0232]
[0233]
[0234]
[0235]
[0236]
[0237]
[0238][0239]
实施例44:甲基4-(((5-((7-氯喹唑啉-4-基)氨基)戊基)(2-羟乙基)氨基)甲基)苯甲酸酯(化合物44)
[0240][0241]
步骤1制备2-(5-(苄基(2-羟乙基)氨基)戊基)异吲哚-1,3-二酮(化合物5-3)
[0242]
在室温下,将碳酸钾(2.07g,15mmol)、2-(5-溴戊基)异吲哚-1,3-二酮(2.96g,10mmol)加入到2-(苄氨基)乙-1-醇(1.51g,10mmol)在乙腈(30ml)的溶液中。升温至80℃并搅拌16小时。然后冷却至室温,过滤,滤液浓缩干得到淡黄色液体2-(5-(苄基(2-羟乙基)氨基)戊基)异吲哚-1,3-二酮(3.66g,10mmol,收率100%)。lc-ms:m/z 367.2[m+h]
+
.
[0243]
步骤2制备2-(5-((2-羟乙基)氨基)戊基)异吲哚-1,3-二酮(化合物5-4)
[0244]
将2-(5-(苄基(2-羟乙基)氨基)戊基)异吲哚-1,3-二酮(3.66g,10mmol)溶于甲醇(40ml),然后加入10%pd/c(0.9g)。1atom h2压力,30℃反应48小时。lcms显示反应完全,过滤去除pd/c,母液浓缩干得到淡黄色液体2-(5-((2-羟乙基)氨基)戊基)异吲哚-1,3-二酮(2.76g,10mmol,收率99%),直接用于下一步反应。lc-ms:m/z 277.2[m+h]
+
.
[0245]
步骤3制备叔丁基(5-(1,3-二氧异吲哚-2-基)戊基)(2-羟乙基)碳酸酯(化合物5-5)
[0246]
将2-(5-((2-羟乙基)氨基)戊基)异吲哚-1,3-二酮(2.76g,10mmol)溶于二氯甲烷(30ml)中,然后加入二碳酸二叔丁酯(2.62g,12mmol),三乙胺(1.5g,15mmol)。在室温下搅拌16小时后,lcms显示反应完成。将反应混合物通过旋转蒸发仪浓缩并将残余物通过biotage制备色谱柱纯化(25g硅胶,meoh/dcm=0~5%,v/v),得叔丁基(5-(1,3-二氧异吲哚-2-基)戊基)(2-羟乙基)碳酸酯(3.0g,7.958mmol,收率79.58%),为黄色油状物。lc-ms:m/z 377.2[m+h]
+
.
[0247]
步骤4制备叔丁基(5-氨基戊基)(2-羟乙基)碳酸酯(化合物5-6)
[0248]
将叔丁基(5-(1,3-二氧异吲哚-2-基)戊基)(2-羟乙基)碳酸酯(3.0g,7.958mmol)溶于甲醇(20ml)中,然后加入水合肼(10ml,50%)。在30℃下搅拌6小时后,lcms显示反应完成。将反应混合物通过旋转蒸发仪浓缩并于残余物中加入1m naoh溶液,用二氯甲烷(20mlx3)萃取,合并有机相,无水na2so4干燥,浓缩干得到叔丁基(5-氨基戊基)(2-羟乙基)碳酸酯(1.1g,4.453mmol,收率55.96%),为黄色油状物。lc-ms:m/z 247.3[m+h]
+
.
[0249]
步骤5制备叔丁基(5-((7-氯喹唑啉-4-基)氨基)戊基)(2-羟乙基)碳酸酯(化合物
5-7)
[0250]
在室温下,向4,7-二氯喹唑啉(0.88g,4.453mmol)在异丙醇(10ml)的溶液中加入得到叔丁基(5-氨基戊基)(2-羟乙基)碳酸酯(1.1g,4.453mmol),dipea(1.29g,10.00mmol)。80℃下搅拌搅拌16小时后,将反应浓缩干。加入饱和碳酸氢钠水溶液(100ml),用二氯甲烷(100ml
×
2)萃取。合并有机相,无水硫酸钠干燥,浓缩干过硅胶柱纯化(洗脱剂:石油醚:乙酸乙酯=10:1)得到产物叔丁基(5-((7-氯喹唑啉-4-基)氨基)戊基)(2-羟乙基)碳酸酯(1.2g,2.934mmol,收率65.89%),为黄色油状物。lc-ms:m/z 409.2[m+h]
+
.
[0251]
步骤6制备2-((5-((7-氯喹唑啉-4-基)氨基)戊基)氨基)乙-1-醇(化合物5-8)
[0252]
在室温下,向叔丁基(5-((7-氯喹唑啉-4-基)氨基)戊基)(2-羟乙基)碳酸酯(1.2g,2.94mmol)在甲醇(5ml)的溶液中加入氯化氢/1,4-二氧六环溶液(10ml)。室温搅拌1.5小时后,将反应浓缩干得到2-((5-((7-氯喹唑啉-4-基)氨基)戊基)氨基)乙-1-醇(0.905g,2.94mmol,收率100%),为黄色固体。lc-ms:m/z 309.2[m+h]
+
.
[0253]
步骤7制备甲基4-(((5-((7-氯喹唑啉-4-基)氨基)戊基)(2-羟乙基)氨基)甲基)苯甲酸酯(化合物44)
[0254]
将2-((5-((7-氯喹唑啉-4-基)氨基)戊基)氨基)乙-1-醇(0.08g,0.2591mmol,)和甲基4-(溴甲基)苯甲酸酯(0.060g,0.2619mmol)溶于乙腈(3ml)中,加碳酸钾(0.04g,0.2899mmol)。混合物在80℃下搅拌16小时。将反应混合物冷却至室温,浓缩干,薄层制备硅胶板纯化(展开剂:二氯甲烷:甲烷=10:
[0255]
1)得到黄色油状产物甲基4-(((5-((7-氯喹唑啉-4-基)氨基)戊基)(2-羟乙基)氨基)甲基)苯甲酸酯(23mg,0.05033mmol,收率19.43%)。1h nmr(400mhz,d-dmso)δ8.45(s,1h),8.32-8.39(t,j=6.0hz,1h),8.27(d,j=8.9hz,1h),7.85(d,j=8.2hz,2h),7.70(d,j=2.2hz,1h),7.55(dd,j=8.8,2.2hz,1h),7.43(d,j=8.1hz,2h),4.33(t,j=5.2hz,1h),3.84(s,3h),3.63(s,2h),3.51(q,j=6.8hz,2h),3.45(q,j=6.4hz,2h),2.44(m,4h),1.67
–
1.54(m,2h),1.53
–
1.40(m,2h),1.38
–
1.28(m,2h).lc-ms:m/z 457.2[m+h]
+
.
[0256]
实施例45-49
[0257]
按照实施例44的相同方法,制备实施例45-49的化合物,具体实验数据见表5
[0258]
表5化合物44-49的实验数据表
[0259]
[0260]
[0261][0262]
实施例50:3-(5-((7-氟喹唑啉-4-基)氨基)戊基)咪唑烷-2,4-二酮(化合物50)
[0263][0264]
步骤1制备5-((7-氟喹唑啉-4-基)氨基)戊-1-醇(化合物6-3)
[0265]
将原料4-氯-7-氟喹唑啉(0.9g,5mmol)和5-氨基戊-1-醇(0.5g,5mmol)溶于10ml异丙醇中,加入n,n-二异丙基乙胺(0.7g,5mmol),该反应混合物在氩气保护下加热至90℃,反应6小时。反应完全,浓缩,剩余物经柱层析分离得到产品622mg,收率50%。lc-ms:m/z 250.1[m+h]
+
.
[0266]
步骤2制备n-(5-氯戊基)-7-氟喹唑啉-4-胺(化合物6-4)
[0267]
将原料5-((7-氟喹唑啉-4-基)氨基)戊-1-醇(0.6g,2.4mmol)溶于20ml无水二氯甲烷中,加入氯化亚砜(1.2g,10mmol)和催化量的n,n-二甲基甲酰胺(0.3ml),该反应混合物在氩气保护下室温反应4小时。反应完全,浓缩,剩余物经碳酸氢钠水溶液调ph至8,二氯甲烷萃取。有机相干燥、过滤、浓缩,剩余物经柱层析分离得到产品493mg,收率76.5%。lc-ms:m/z268.0[m+h]
+
.
[0268]
步骤3制备3-(5-((7-氟喹唑啉-4-基)氨基)戊基)咪唑烷-2,4-二酮(化合物50)
[0269]
将原料n-(5-氯戊基)-7-氟喹唑啉-4-胺(80mg,0.3mmol)溶于5ml干燥四氢呋喃中,分别加入咪唑烷-2,4-二酮(60mg,0.6mmol),碳酸钾(130mg,0.9mmol)和四丁基硫酸氢铵(20mg,0.06 mmol),该反应混合物在氩气保护下加热至60℃,反应过夜。反应完全,浓缩,剩余物经硅胶制备板分离得到产品42mg,收率42.4%。1h nmr(400mhz,meod)δ8.45(s,1h),8.23(dd,j=9.9,5.8hz,1h),7.37-7.32(m,2h),3.93(s,2h),3.64(t,j=7.1hz,2h),3.52(t,j=7.1hz,2h),1.83-1.75(m,2h),1.74-1.66(m,2h),1.50
–
1.41(m,2h).lc-ms:m/z 332.0[m+h]
+
.
[0270]
实施例51-77
[0271]
按照实施例50的相同方法,制备实施例51-77的化合物,具体实验数据见表6
[0272]
表6化合物50-77的实验数据表
[0273]
[0274]
[0275]
[0276]
[0277]
[0278]
[0279]
[0280]
[0281][0282]
效果实施例1:化合物对细胞因子抑制作用的ic
50
值测定
[0283]
实验方法与步骤
[0284]
(1)细胞培养与接种:用无血清培养基rp1640将1mg/ml的pma母液配制成100ng/ml的pma溶液。取正常培养的thp-1细胞离心,用完全培养基(含有10%fbs的rp1640培养基)重悬计数,调整细胞密度为2
×
106cells/ml,然后加入等体积100ng/ml的pma溶液,此时细胞密度为1
×
106cells/ml,pma终浓度为50ng/ml。每孔100μl接种于96孔细胞培养板中,每孔细胞个数为1
×
105个。将96孔细胞培养板放置于37摄氏度,5%co2的条件下培养24小时。
[0285]
(2)加药处理细胞:第二天在完全培养基中加入lps并调整lps终浓度为100ng/ml,并用该含有lps的培养基配制化合物。化合物按照配制好的浓度梯度药物分别加入相应的细胞孔中。阳性对照组(lps+)为不含药物但含有终浓度为100ng/ml的lps和0.1%dmso的培养基溶液,阴性对照组(lps-)为不加lps含0.1%dmso的培养基溶液。每孔体积为100μl。
[0286]
(3)检测样品收集:1000转离心5分钟,分别收集细胞上清液和细胞沉淀。细胞上清液用于检测tnf-α和il-6;收集细胞沉淀用于检测il-1β。细胞上清液收集完成后,吸弃孔内剩余液体,每孔加入100μl细胞裂解液(20mm tris 8.0;2mm edta;0.5%triton x-100),充分裂解。
[0287]
(4)样品检测:酶联免疫吸附测定法(elisa)检测各个细胞因子的含量:具体步骤在对应试剂盒说明书的指导下操作。试剂盒货号如下:
[0288]
human tnf-alpha quantikine elisa kit货号catalog#sta00d
[0289]
human il-1beta/il-1f2 quantikine elisa kit货号catalog#slb50
[0290]
human il-6quantikine elisa kit货号catalog#s6050。
[0291]
(5)数据分析:按下列公式对化合物的体外抑制活性进行计算:
[0292]
抑制率(%)=[1-(od450
加药
-od450
lps-)/(od450
lps+
-od450
lps-)]
×
100%。
[0293]
在该测定中,本发明的化合物具有低于2000μm的ic
50
。某些化合物具有低于10μm的ic
50
。表7和表8提供本发明的化合物在该测定中测试的具体ic
50
值。
[0294]
表7本发明的化合物在该测定中测试的具体ic
50
值
[0295]
[0296]
[0297][0298]
表8本发明的化合物在该测定中测试的具体ic
50
值
[0299]
[0300]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1