烃或其衍生物的氧化反应产物的制造方法、烯烃的氧化反应产物的制造方法
烃或其衍生物的氧化反应产物的制造方法、烯烃的氧化反应产物的制造方法
1.本技术是基于申请号:201680074063.9、申请日:2016年12月16日、发明名称“烃或其衍生物的氧化反应产物的制造方法、烯烃的氧化反应产物的制造方法”的中国发明专利申请的分案申请。
技术领域
2.本发明涉及烃或其衍生物的氧化反应产物的制造方法、烯烃的氧化反应产物的制造方法。
背景技术:
3.[第一发明的背景技术]醇、羧酸等因其工业利用价值很高,因此通过各种方法进行工业化制造。例如作为甲醇的制造方法,一般使用如下方法,即,使通过烃的部分燃烧得到的一氧化碳和氢气在高温高压下反应。作为原料的一氧化碳及氢气例如可以通过甲烷(天然气)的部分燃烧、蒸汽重整法等制造。另外,通常也通过发酵等生化方法制造醇、羧酸等。而且,近年来,为了有效利用页岩气等天然气,也提出了将天然气中所含的烃氧化而制造醇等氧化反应产物的方法。作为利用气相反应的制造方法,例如有如下方法:在铁催化剂的存在下,利用一氧化氮氧化乙烷从而制造乙醇(非专利文献1)等。另外,作为利用液相反应的制造方法,如下方法:在铁催化剂的存在下,于乙腈溶剂中,利用氢过氧化物氧化甲烷而制造甲醇(非专利文献2)等。
[0004]
[第二发明的背景技术]醇、羧酸等因其工业利用价值很高,因此通过各种方法进行工业化制造。例如作为甲醇的制造方法,一般使用如下方法,即,使通过烃的部分燃烧得到的一氧化碳和氢气在高温高压下反应。作为原料的一氧化碳及氢气例如可以通过甲烷(天然气)的部分燃烧、蒸汽重整法等制造。
[0005]
近年来,为了有效利用页岩气等天然气,也提出了将天然气中所含的甲烷氧化而制造甲醇等氧化反应产物的方法。从甲烷向甲醇的氧化在自然界中由嗜甲烷菌所含的甲烷单加氧酶来进行(非专利文献3、4)。另一方面,作为人工由甲烷制造甲醇的方法,目前已知的制造方法有如下方法:在铁催化剂的存在下,于乙腈溶剂中,利用氢过氧化物氧化甲烷而制造甲醇(非专利文献2)等。
[0006]
[第三发明的背景技术]醇、羧酸等因其工业利用价值很高,因此通过各种方法进行工业化制造。例如通常也通过发酵等生化方法制造醇、羧酸等。特别是作为乙烷衍生物的乙醇及乙酸通常通过发酵等生化方法制造。
[0007]
而且,近年来,为了有效利用页岩气等天然气,也提出了将天然气中所含的烃氧化而制造醇等氧化反应产物的方法。作为利用气相反应的制造方法,例如有如下方法:在铁催
化剂的存在下,利用一氧化氮氧化乙烷从而制造乙醇(非专利文献1)等。另外,作为利用液相反应制造醇之类的氧化反应产物的方法,有如下方法:在铁催化剂的存在下,于乙腈溶剂中,利用氢过氧化物氧化甲烷而制造甲醇(非专利文献2)等。
[0008]
[第四发明的背景技术]作为环己烷的氧化产物的环己酮及环己酮(ka-油)通过各种方法进行工业化制造。例如已知有使用n-羟基邻苯二甲酰亚胺,在锰(ii)和钴(ii)催化下,于100度进行合成的方法(非专利文献5)。
[0009]
还已知有通过光反应对环己烷进行空气氧化的方法。例如将9-均三甲苯基-10-甲基吖啶鎓离子用作光催化剂,在盐酸存在下进行光照,由此得到环己酮及环己酮(非专利文献6)。
[0010]
[第五发明的背景技术]烯烃氧化制备1,2-二醇是重要的工业过程,用于在精细化工或特种化工中制造树脂、药品、染料、杀虫剂及香料组合物等各种化学物质的前体。目前已报道了使用无机金属氧络合物及重原子的金属氧化物将烯烃氧化转化为对应环氧化物及醇的数种方法。高原子价的os
viii
o4是用于将烯烃转化为1,2-二醇的转化的氧化的有效且具有选择性的试剂(非专利文献7~14)。但是,锇化合物的毒性及升华性和其废弃物会造成严重的问题。
[0011]
另一方面,自由基是因富有反应性而被广泛利用的重要的化学物种。例如亚氯酸钠(naclo2)为无毒且廉价的氧化试剂,一直被用作自由基二氧化氯(clo2·
)的前体(非专利文献15~18)。现有技术文献非专利文献
[0012]
非专利文献1:jeffrey r.long and co-workers nature chem.2014,6,590非专利文献2:georg suss-fink and co-workers adv.synth.catal.2004,346,317非专利文献3:i.bertini,h.b.gray,s.j.lippard,j.s.valentine,"bioinorganic chemistry,"university science books,california(1994)非专利文献4:s.j.lippard,j.m.berg,"principles of bioinorganic chemistry,"university science books,california(1994).非专利文献5:ishii,y.and co-workers j.org.chem.2001,66,7889.非专利文献6:ohkubo,k.and co-workers,chem.commun.2011,47,8515非专利文献7:m.schroeder,chem.rev.,1980,80,187-213.非专利文献8:(a)e.n.jacobsen,i.marko,w.s.mungall,g.schroeder and k.b.sharpless,j.am.chem.soc.,1988,110,1968-1970;(b)s.g.hentges and k.b.sharpless,j.am.chem.soc.,1980,102,4263-4265.非专利文献9:w.yu,y.mei,y.kang,z.hua and z.jin,org.lett.,2004,6,3217-3219.非专利文献10:(a)a.j.delmonte,j.haller,k.n.houk,k.b.sharpless,d.a.singleton,t.strassner,and a.a.thomas,j.am.chem.soc.,1997,119,9907-9908.(b)j.s.m.wai,i.marko,j.s.svendsen,m.g.finn,e.n.jacobsen and k.b.sharpless,
j.am.chem.soc.,1989,111,1123-1125.非专利文献11:(a)s.kobayashi,m.endo and s.nagayama,j.am.chem.soc.,1999,121,11229-11230;(b)s.kobayashi,t.ishida and r.akiyama,org.lett.,2001,3,2649-2652.非专利文献12:h.c.kolb,p.g.andersson and k.b.sharpless,j.am.chem.soc.,1994,116,1278-1291.非专利文献13:e.j.corey and m.c.noe,j.am.chem.soc.,1996,118,11038-11053.非专利文献14:s.y.jonsson,k.faernegrdh and j.-e.baeckvall,j.am.chem.soc.,2001,123,1365-1371.非专利文献15:h.dodgen and h.taube,j.am.chem.soc.,1949,71,2501-2504.非专利文献16:j.k.leigh,j.rajput,and d.e.richardson,inorg.chem.,2014,53,6715-6727.非专利文献17:c.l.latshaw,tappi,1994,163-166.非专利文献18:(a)j.j.leddy,in riegel’s handbook of industrial chemistry,8th edn.ed.,j.a.kent,van nostrand reinhold co.inc,new york,1983,pp.212-235;(b)i.fabian,coord.chem.rev.,2001,216-217,449-472.
技术实现要素:
发明要解决的课题
[0013]
[第一发明要解决的课题]但是,通过烃的部分燃烧制造一氧化碳的过程中存在排出大量二氧化碳(温室效应气体)的问题。另外,通过发酵等生化方法进行制造时,例如存在作为原料的农作物(例如玉米)培育过程中的施肥、撒药、收获、运输等需要大量能量的问题。而且,这些方法不能以烃为原料来制造醇、羧酸等,因此天然气等中所含的烃未得到有效利用。
[0014]
另一方面,以烃为原料制造氧化反应产物的方法存在如下课题。首先,在利用气相反应的制造方法中,由于反应系统中的分子撞击频率低,因此反应效率差。另一方面,主要研究了使用氧化剂或催化剂的固相及气相反应,但是烃对固体的吸附特性低,未见效率较高的报告。因此,在利用气相反应的制造方法中,需要高温高压等剧烈的反应条件,存在制造效率、成本、安全管理等问题。另一方面,在利用液相反应的制造方法中,由烃(原料)产生的自由基(中间体)的反应难以控制,容易产生副反应。由于这些问题,以烃为原料制造氧化反应产物的方法均不能高效地制造所述氧化反应产物,目前未实现工业实用化。
[0015]
因此,本发明中的第一发明的目的在于,提供一种可以以烃或其衍生物为原料高效地制造所述烃或其衍生物的氧化反应产物的方法。
[0016]
[第二发明要解决的课题]在通过甲烷部分燃烧制造一氧化碳的过程中,存在排出大量二氧化碳(温室效应气体)的问题。为了解决该问题,需要不进行燃烧而使甲烷分子活化。但是,甲烷是最为惰性的烃,作为其主要的化学性质,可以举出牢固的碳-氢键(104kcal/mol)和因较高的对称性而造成的偶极矩缺失,因此难以不进行燃烧而使其活化。另外,氢气制造的价格也是一个问
题。
[0017]
作为不进行燃烧而使甲烷的碳-氢键断裂的方法,已知有氯自由基。氯自由基通常通过对氯气进行光照而得到。但是,在该方法中,每一分子的氯生成两分子的氯自由基,因此,即使一个氯自由基使甲烷的碳-氢键断裂而制成甲基自由基,也会与另一个氯自由基产生加成反应而生成氯代甲烷。即,在该方法中,仅得到利用价值很低的氯代甲烷,而不能得到甲醇、甲酸等利用价值高的氧化反应产物。
[0018]
另外,关于前述利用嗜甲烷菌所含的甲烷单加氧酶制造甲醇等(非专利文献3、4)的情况,分离纯化出甲烷单加氧酶,并研究了其的性质。但是,仍然存在很多不明确的方面,试管内的氧化反应已经非常困难,实际使用仍然任重道远。
[0019]
另一方面,以气体状的烃为原料制造氧化反应产物的方法存在如下课题。首先,在利用气相反应的制造方法中,由于反应系统中的分子的撞击频率较低,因此反应效率差。另一方面,主要研究了使用氧化剂或催化剂的固相及气相反应,但烃对固体的吸附特性低,未见效率较高的报告。因此,在利用气相反应的制造方法中,需要高温高压等剧烈的反应条件,存在制造效率、成本、安全管理等问题。另一方面,在利用液相反应的制造方法(例如非专利文献3等)中,由烃(原料)产生的自由基(中间体)的反应难以控制,容易产生副反应,因此收率及选择性上存在问题。由于这些问题,以烃为原料的氧化反应产物的制造方法均不能高效地制造所述氧化反应产物,目前未实现工业实用化。
[0020]
因此,本发明中的第二发明的目的在于,提供一种可以以甲烷为原料高效地制造甲烷的氧化反应产物的方法。
[0021]
[第三发明要解决的课题]但是,通过发酵等生化方法进行制造时,例如存在作为原料的农作物(例如玉米)培育过程中的施肥、撒药、收获、运输等需要大量能量的问题。而且,这些方法不能以烃为原料来制造醇、羧酸等,因此天然气等中所含的烃未得到有效利用。
[0022]
另一方面,以烃为原料制造氧化反应产物的方法存在如下课题。首先,在利用气相反应的制造方法中,由于反应系统中的分子的撞击频率低,因此反应效率差。另一方面,主要研究了使用氧化剂或催化剂的固相及气相反应,但是烃对固体的吸附特性低,未见效率较高的报告。因此,在利用气相反应的制造方法中,需要高温高压等剧烈的反应条件,存在制造效率、成本、安全管理等问题。另一方面,在利用液相反应的制造方法中,由烃(原料)产生的自由基(中间体)的反应难以控制,容易产生副反应。由于这些问题,以烃为原料制造氧化反应产物的方法均不能高效地制造所述氧化反应产物,目前未实现工业实用化。
[0023]
因此,本发明中的第三发明的目的在于,提供一种可以以乙烷为原料高效地制造乙烷的氧化反应产物的方法。
[0024]
[第四发明要解决的课题]但是,需要重金属催化剂和高温的工艺存在环境负担大的问题。
[0025]
另一方面,以9-均三甲苯基-10-甲基吖啶鎓离子为光催化剂的方法,存在产物收率低、反应时间长的问题。
[0026]
因此,本发明中的第四发明的目的在于,提供一种可以以环己烷为原料高效地制造环己烷的氧化反应产物的方法。
[0027]
[第五发明要解决的课题]
但是,通常为了产生自由基需要较大能量。因此,需要通过加热等实现高温,存在成本及反应控制方面的问题。因此,本发明中的第五发明的目的在于,提供一种可以在温和条件下进行反应的烯烃的氧化反应产物的制造方法。用于解决课题的手段
[0028]
[第一发明的用于解决课题的手段]为了实现所述目的,本发明中的第一发明的所述烃或其衍生物的氧化反应产物的制造方法(下面,有时简称为“本发明中的第一发明的制造方法”、“第一发明的制造方法”或“第一发明”。)的特征在于,包含反应工序,所述反应工序在原料及二氧化氯自由基存在下对反应系统进行光照;所述原料为烃或其衍生物,所述反应系统为包含有机相的反应系统,所述有机相包含所述原料及所述二氧化氯自由基,在所述反应工序中,通过所述光照,所述原料被氧化,从而生成所述原料的氧化反应产物。
[0029]
[第二发明的用于解决课题的手段]为了实现所述目的,本发明中的第二发明的甲烷的氧化反应产物的制造方法(下面,有时简称为“本发明中的第二发明的制造方法”、“第二发明的制造方法”或“第二发明”。)的特征在于,包含:反应工序,所述反应工序在甲烷及二氧化氯自由基存在下对反应系统进行光照;所述反应系统为包含有机相的反应系统,所述有机相包含所述甲烷及所述二氧化氯自由基,在所述反应工序中,通过所述光照,所述甲烷被氧化,从而生成所述甲烷的氧化反应产物。
[0030]
[第三发明的用于解决课题的手段]为了实现所述目的,本发明中的第三发明的乙烷的氧化反应产物的制造方法(下面,有时简称为“本发明中的第三发明的制造方法”、“第三发明的制造方法”或“第三发明”。)的特征在于,包含反应工序,所述反应工序在乙烷及二氧化氯自由基的存在下对反应系统进行光照;所述反应系统为包含有机相的反应系统,所述有机相包含所述乙烷及所述二氧化氯自由基,在所述反应工序中,通过所述光照,所述乙烷被氧化,从而生成所述乙烷的氧化反应产物。
[0031]
[第四发明的用于解决课题的手段]为了实现所述目的,本发明中的第四发明的环己烷的氧化反应产物的制造方法(下面,有时简称为“本发明中的第四发明的制造方法”、“第四发明的制造方法”或“第四发明”。)的特征在于,包含反应工序,所述反应工序在环己烷及二氧化氯自由基存在下对反应系统进行光照;所述反应系统为包含有机相的反应系统,所述有机相包含所述环己烷及所述二氧化氯自由基,在所述反应工序中,通过所述光照,所述环己烷被氧化,从而生成所述环己烷的氧化反应产物。
[0032]
[第五发明的用于解决课题的手段]为了实现所述目的,本发明中的第五发明的烯烃的氧化反应产物的制造方法(下面,有时简称为“本发明中的第五发明的制造方法”、“第五发明的制造方法”或“第五发明”。)的特征在于,包含:自由基产生工序,所述自由基产生工序使路易斯酸及布郎斯台德酸中的至少一者与自由基产生源作用,从而产生自由基;和氧化反应工序,所述氧化反应工序将所述自由基作为氧化剂对烯烃进行氧化。发明效果
[0033]
[第一发明的效果]根据本发明中的第一发明的制造方法,可以以烃或其衍生物为原料,高效地制造所述烃或其衍生物的氧化反应产物。
[0034]
[第二发明的效果]根据本发明中的第二发明的制造方法,可以以甲烷为原料,高效率制造甲烷的氧化反应产物。
[0035]
[第三发明的效果]根据本发明中的第三发明的制造方法,可以以乙烷为原料,高效地制造乙烷的氧化反应产物。
[0036]
[第四发明的效果]根据本发明中的第四发明的制造方法,可以以环己烷为原料,高效地制造环己烷的氧化反应产物。
[0037]
[第五发明的效果]本发明中的第五发明的烯烃的氧化反应产物的制造方法可以在温和的条件下进行反应,因此成本低,反应容易控制。
附图说明
[0038]
图1为利用ucam-b3lyp/6-311+g(d,p)def2tzv计算结果对向二氧化氯自由基(clo2·
)进行光照的情况进行预测的一例。图2为示意性表示第一发明的制造方法中的反应工序的一例的图。图3为示意性表示第二发明的制造方法中的反应工序的一例的图。图4为示意性表示第三发明的制造方法中的反应工序的一例的图。图5为示意性表示第四发明的制造方法中的反应工序的一例的图。图6为在298k的水溶液中与sc(otf)3(10mm)混合之后,在0、4及16小时所采集的naclo2(5.0mm)的紫外线+可见光吸收光谱。图7中,(a)为sc(otf)3(10mm)和naclo2(5.0mm)在298k的水溶液(0.20m乙酸缓冲液ph2.9)中反应形成sc
3+
(clo2·
)时,358nm处的uv-vis吸收的时间分布。(b)为二次作图。图8中,(a)为在298k的mecn/h2o(1:1v/v)溶液中,在苯乙烯(30~90mm)存在下,sc
3+
(clo2·
)的消耗在358nm处的uv-vis吸收的时间分布。(b)为准一阶速率常数相对于苯乙烯浓度的图表。图9为mecn溶液在298k时测得的epr谱图。(a)为含有naclo2(0.10mm)的mecn溶液在353k下回流1小时之后的谱图。(b)为含有naclo2(0.10mm)及cf3cooh(10mm)的mecn溶液的谱图。(c)为含有naclo2(0.10mm)及sc(otf)3(10mm)的mecn溶液的谱图。图10为通过cam-b3lyp/6-311+g(d,p)水平的理论计算得到的dft优化结构的键长(a)为clo2·
,(b)为h
+
clo2·
,(c)为sc
3+
clo2·
。图11为表示室温(25℃)下水性mecn溶液(mecn/h2o 1:1v/v)中的、naclo2(20mm)所引起的苯乙烯(2.0mm)的反应的1hnmr追踪结果的光谱图。图12表示苯乙烯(66mm)及包含naclo2(200mm)的cd3cn/d2o(4:1v/v)混合后,在60℃(333k)下放置0小时及25小时之后的1hnmr谱图。*标记为来自苯乙烯氧化物的峰。
图13表示苯乙烯(2.0mm)、包含naclo2(20mm)及sc(otf)3(30mm)的cd3cn/d2o(1:1v/v)混合后,在25℃下放置0.6小时后及17小时后之后的1hnmr谱图。*标记及标记分别为来自1-苯乙烷-1,2-二醇及2-氯-1-苯基乙醇的峰。图14表示苯乙烯(2.0mm)、包含naclo2(20mm)及cf3cood(30mm)的cd3cn/d2o(1:1v/v)混合后,放置0.5小时及17小时之后的1hnmr谱图。*标记及标记分别为来自1-苯乙烷-1,2-二醇及2-氯-1-苯基乙醇的峰。图15为表示(a)h
+
clo2·
及(b)sc
3+
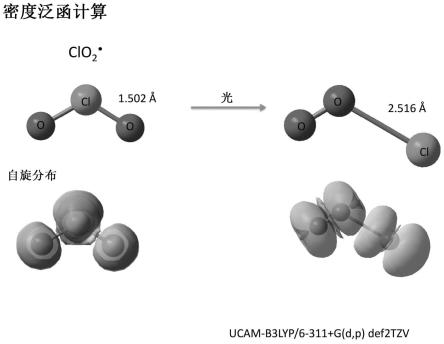
clo2·
通过cam-b3lyp/6-311+g(d,p)水平的理论计算获得的自旋分布的图。图16为在298k的水溶液中与sc(otf)3(40mm)混合后采集的naclo2(20mm)的紫外线+可见光吸收光谱。图17的(a)为追踪使用naclo2及三氟甲基磺酸钪的三苯基膦的氧化反应的紫外可见光吸收光谱。图17的(b)为表示图17的(a)的反应中的ph3p的初期浓度和所生成的ph3p=o的浓度之间的关系的图形。图18表示苯乙烯(2.0mm)、包含naclo2(6.0mm)及sc(otf)3(5.6mm)的cd3cn/d2o(1:1v/v)混合后在ar气氛中于25℃下放置0小时及45小时之后的1hnmr谱图。图19的(a)的紫外可见光吸收光谱表示三苯基膦随时间的变化而转化为三苯基氧化膦的情况。图19的(b)的图形表示sc(otf)3(sc
3+
)存在下及不存在下三苯基膦(ph3p)浓度随时间的变化。附图标记说明1 有机层(有机相)2 水层(水相)
具体实施方式
[0039]
下面,举例对本发明进行更具体的说明。但是,本发明不受以下说明限定。
[0040]
[第一~第四发明的实施方式]在本发明的第一发明中,例如所述原料可以为甲烷。本发明的第二发明为本发明的第一发明中的所述原料为甲烷的情况。
[0041]
在本发明的第一发明中,例如所述原料可以为乙烷。本发明的第三发明为本发明的第一发明中的所述原料为乙烷的情况。
[0042]
在本发明的第一发明中,例如所述原料可以为环己烷。本发明的第四发明为本发明的第一发明中的所述原料为环己烷的情况。
[0043]
本发明的第一~第四发明的制造方法可以在所述反应工序中至少对所述有机相进行光照。
[0044]
本发明的第一~第四发明的制造方法可以进一步包含生成所述二氧化氯自由基的二氧化氯自由基生成工序。
[0045]
作为本发明的第一~第四发明的制造方法,所述反应系统可以为进一步包含水相的二相反应系统。在该情况下,本发明的制造方法可以进一步包含生成所述二氧化氯自由基的二氧化氯自由基生成工序,在所述二氧化氯自由基生成工序中,所述水相可以包含所述二氧化氯自由基的产生源,由所述二氧化氯自由基的产生源生成所述二氧化氯自由基。
另外,在所述二氧化氯自由基生成工序中,例如所述二氧化氯自由基的产生源可以为亚氯酸根离子(clo
2-),使所述亚氯酸根离子与路易斯酸及布郎斯台德酸中的至少一者作用而生成所述二氧化氯自由基。
[0046]
作为本发明的第一~第四发明的制造方法,所述反应工序后,可以进一步包含所述氧化反应产物的回收工序,所述回收工序为从所述反应系统中回收包含所述氧化反应产物的所述水相的工序。
[0047]
本发明的第一~第四发明的制造方法可以在例如温度为负100~200℃,压力为0.1~10mpa的气氛下进行。或,本发明的制造方法也可以在例如温度为0~40℃、压力为0.1~0.5mpa的气氛下进行。
[0048]
作为本发明的第一~第四发明的制造方法,例如在所述反应工序中,可以在所述水相溶解有氧(o2)的状态下进行光照。
[0049]
在本发明的第一~第四发明的制造方法中,所述有机相例如包含有机溶剂。所述有机溶剂可以为例如烃溶剂、卤化溶剂或氟溶剂。另外,例如在本发明的第一发明的制造方法中,在所述原料为环己烷的情况下(即,本发明的第四发明的制造方法),所述环己烷可以兼做所述氧化反应产物的原料和所述有机溶剂。
[0050]
在本发明的第一发明的制造方法中,例如所述原料中的所述烃可以为饱和烃。如上所述,所述饱和烃可以为例如甲烷、乙烷或环己烷。
[0051]
在本发明的第一发明的制造方法中,例如所述原料中的所述烃可以为非芳香族不饱和烃。
[0052]
在本发明的第一发明的制造方法中,例如所述原料中的所述烃可以为芳香族烃。所述芳香族烃例如可以为苯。
[0053]
在本发明的第一发明的制造方法中,在所述原料中的所述烃为饱和烃或非芳香族不饱和烃的情况下,例如所述氧化反应产物可以为选自由醇、羧酸、醛、酮、过氧化羧酸及氢过氧化物构成的组中的至少一种。
[0054]
在本发明的第一发明的制造方法中,在所述原料中的所述烃为甲烷的情况下(即,本发明的第二发明的制造方法),例如所述氧化反应产物可以包含甲醇、甲酸、甲醛及甲基过氧化氢中的至少一种。
[0055]
在本发明的第一发明的制造方法中,在所述原料中的所述烃为乙烷的情况下(即,本发明的第三发明的制造方法),例如所述氧化反应产物可以包含乙醇、乙酸、乙醛及乙基过氧化氢中的至少一种。
[0056]
在本发明的第一发明的制造方法中,在所述原料中的所述烃为环己烷的情况下(即,本发明的第四发明的制造方法),例如所述氧化反应产物可以包含环己醇、环己酮、环己烷过氧化氢及开环氧化物(例如己二酸等)中的至少一种。
[0057]
本发明的第一发明的制造方法中,在所述原料中的所述烃为芳香族烃的情况下,例如所述氧化反应产物可以包含苯酚及醌中的至少一者。需要说明的是,“苯酚”包括表示羟基苯的情况和表示芳香族(例如芳香族烃或杂芳香族)核的氢原子被羟基(氢氧基)取代而成的全部芳香族羟基化合物(包含羟基苯)的情况,在本发明中,除非另有说明,否则表示后者。另外,“醌”包括表示对苯醌的情况和表示芳香族(例如芳香族烃或杂芳香族)中的芳香环(例如苯环)的两个氢原子被两个氧原子取代而成的结构的全部二羰基化合物(包含对
苯醌及邻苯醌)的情况,在本发明,除非另有说明,否则表示后者。
[0058]
在本发明的第一发明的制造方法中,在所述原料中的所述烃为苯的情况下,例如所述氧化反应产物可以包含羟基苯、对苯醌、邻苯醌,氢醌及儿茶酚中的至少一种。
[0059]
更具体而言,例如本发明的第一~第四发明的制造方法可以如下进行。
[0060]
[1.烃或其衍生物]首先,准备原料(基质)即烃或其衍生物。所述原料可以为烃本身,也可以为其衍生物。
[0061]
所述烃没有特别限定,例如可以为非芳香族也可以为芳香族,可以为饱和也可以为不饱和。更具体而言,所述烃可以为例如直链状或支链状的饱和或不饱和烃(例如直链状或支链状的烷烃、直链状或支链状的烯烃、直链状或支链状的炔烃等)。另外,所述烃可以为例如包含非芳香族的环状结构的饱和或不饱和烃(例如环烷烃、环烯烃等)。另外,所述烃可以为芳香族烃。另外,所述烃可以在其结构中分别具有一个或多个芳香族或非芳香族环,也可以不具有,可以分别具有一个或多个直链状或支链状的饱和或不饱和烃的烃基,也可以不具有。作为所述烃的具体例,例如可以举出:甲烷、乙烷、丙烷、正丁烷、2-甲基丙烷、正戊烷、正己烷、乙烯、丙烯、1,3-丁二烯、乙炔、环戊烷、环己烷、环庚烷、环辛烷、甲基环己烷、环己烯、苯、甲苯、邻二甲苯、间二甲苯、对二甲苯、均三甲苯、杜烯、联苯、萘、1-甲基萘、2-甲基萘、蒽、菲、芘、苯乙烯等。
[0062]
另外,在本发明中,烃的“衍生物”为包含杂元素(碳及氢以外的元素)的有机化合物。作为所述杂元素,没有特别限定,例如可以举出:氧(o)、氮(n)、硫(s)、卤素等。作为所述卤素,例如可以举出:氟(f)、氯(cl)、溴(br)、碘(i)等。所述衍生物可以为例如烃基和任意的取代基或原子团键合而成的结构的有机化合物。另外,例如可以为多个烃基被任意原子团键合而成的结构的化合物,而且,所述烃基可以被任意一个或多个取代基取代,也可以不取代。并且,可以在所述反应工序中通过氧化反应使所述烃基部分氧化,从而制造所述烃的衍生物的氧化反应产物。所述烃基没有特别限定,例如可以举出由所述烃衍生的1价或2价以上的基团。作为所述烃基,例如其一个或两个以上碳原子可以被杂原子取代。具体而言,例如可以通过苯基的一个碳原子(及与其键合的氢原子)被氮原子取代,从而形成吡啶基。另外,作为所述取代基或原子团,没有特别限定,例如可以举出:羟基、卤素基(氟基、氯基、溴基、碘基等)、烷氧基、芳氧基(例如苯氧基等)、羧基、烷氧基羰基、芳氧基羰基(例如苯氧基羰基等)、巯基、烷硫基、芳基硫基(例如苯基硫基等)、具有或不具有取代基的氨基(例如氨基、烷基氨基、二烷基氨基等)、醚键(-o-)、酯键(-co-o-)、硫醚键(-s-)等。
[0063]
需要说明的是,在本发明中,除非另有说明,否则链状化合物(例如烷烃、不饱和脂肪族烃等)或由链状化合物衍生的链状取代基(例如烷基、不饱和脂肪族烃基等烃基)可以为直链状也可以为支链状,其碳原子数没有特别限定,例如可以为1~40、1~32、1~24、1~18、1~12、1~6或1~2(在不饱和烃基的情况为2以上)。另外,在本发明中,环状化合物(例如环状饱和烃、非芳香族环状不饱和烃、芳香族烃、杂芳香族化合物等)或由环状化合物衍生的环状基团(例如环状饱和烃基,非芳香族环状不饱和烃基,芳基,杂芳基等)的环元数(构成环的原子数)没有特别限定,例如可以为5~32、5~24、6~18、6~12或6~10。另外,在取代基等存在异构体的情况下,除非另有说明,否则可以为任意异构体,例如在简单称为“萘基”的情况下,可以为1-萘基也可以为2-萘基。
[0064]
另外,在本发明中,在化合物(例如所述电子供体
·
受体连结分子等)存在互变异构体或立体异构体(例:几何异构体、构象异构体及光学异构体)等异构体的情况下,除非另有说明,否则任意异构体均可以用于本发明。另外,在化合物(例如所述电子供体
·
受体连结分子等)可以形成盐的情况下,除非另有说明,否则所述盐也可以用于本发明。所述盐可以为酸加成盐,也可以为碱加成盐。而且,形成所述酸加成盐的酸可以为无机酸也可以为有机酸,形成所述碱加成盐的碱可以为无机碱也可以为有机碱。作为所述无机酸,没有特别限定,例如可以举出:硫酸、磷酸、氢氟酸、盐酸、氢溴酸、氢碘酸、次氟酸、次氯酸、次溴酸、次碘酸、亚氟酸、亚氯酸、亚溴酸、亚碘酸、氟酸、氯酸、溴酸、碘酸、高氟酸、高氯酸、高溴酸及高碘酸等。所述有机酸也没有特别限定,例如可以举出:对甲苯磺酸、甲磺酸、草酸、对溴苯磺酸、碳酸、琥珀酸、柠檬酸、苯甲酸及乙酸等。作为所述无机碱,没有特别限定,例如可以举出:氢氧化铵、碱金属氢氧化物、碱土金属氢氧化物、碳酸盐及碳酸氢盐等,更具体而言,例如可以举出:氢氧化钠、氢氧化钾、碳酸钾、碳酸钠、碳酸氢钠、碳酸氢钾、氢氧化钙及碳酸钙等。所述有机碱也没有特别限定,例如可以举出:乙醇胺、三乙胺及三(羟基甲基)氨基甲烷等。这些盐的制造方法也没有特别限定,例如可以通过利用公知方法向所述化合物适当加成如上所述的酸或碱等方法制造。
[0065]
需要说明的是,如上所述,作为所述原料(基质)基质,在本发明的第二发明中为甲烷,在第三发明中为乙烷,在第四发明中为环己烷。
[0066]
[2.反应系统]接着,准备所述反应系统。如上所述,所述反应系统包含有机相。所述反应系统例如可以为仅包含有机相的单相反应系统,也可以为包含有机相和水相的二相反应系统。
[0067]
(1)有机相首先,对所述有机相进行说明。
[0068]
如上所述,所述有机相包含所述原料(烃或其衍生物)。所述有机相为例如所述原料溶解在有机溶剂中而成的有机相。
[0069]
所述有机溶剂没有特别限定。在所述反应系统为包含水相和有机相的二相反应系统的情况下,所述有机溶剂优选可以形成所述二相系统的溶剂。另外,所述有机剂可以仅使用一种也可以并用多种。作为所述有机溶剂,例如如上所述,可以举出:烃溶剂、卤化溶剂、氟溶剂等。需要说明的是,“氟溶剂”为卤化溶剂的一种,例如它是指烃的全部或大部分氢原子被氟原子取代而成的溶剂。所述氟溶剂例如可以为烃的50%以上、60%以上、70%以上、80%以上或90%以上的氢原子数被氟原子取代的溶剂。
[0070]
作为所述烃溶剂,没有特别限定,例如可以举出:正己烷、环己烷、苯、甲苯、邻二甲苯、间二甲苯、对二甲苯等。另外,例如所述烃溶剂可以兼做作为原料的所述烃。
[0071]
作为所述卤化溶剂,没有特别限定,例如可以举出:二氯甲烷、氯仿、四氯化碳、四溴化碳及后述氟溶剂等。
[0072]
作为所述氟溶剂的例子,例如可以举出下述化学式(f1)~(f6)所表示的溶剂等,其中,例如优选cf3(cf2)4cf3等。通过使用氟溶剂,例如由于溶剂自身的反应性低,因此具有可以抑制或防止副反应的优点。作为所述副反应,例如可以举出:溶剂的氧化反应、氯自由基引起的溶剂的夺氢反应或氯化反应及来自所述原料(基质)的自由基与溶剂的反应(例如在所述原料为甲烷的情况下,则为甲基自由基和溶剂的反应)等。另外,由于氟溶剂不易与
水混和,因此可以将反应系统(氟相)和产物回收系统(水相)分离,因此具有抑制产物进一步氧化反应的作用。
[0073]
[化学式f1]
[0074]
[化学式f2]
[0075]
[化学式f3]
[0076]
[化学式f4]
[0077]
[化学式f5]
[0078]
[化学式f6]
[0079]
需要说明的是,所述有机溶剂的沸点没有特别限定,可以适当选择。在所述反应工序中,在需要使温度为高温的情况下,优选选择高沸点溶剂。但是,如下所述,本发明的制造方法也可以不进行加热(例如常温常压下)而进行。在该情况下,无需为高沸点溶剂,从容易操作的观点考虑,反而优选沸点不太高的溶剂。
[0080]
另外,在本发明中,“溶剂”(例如所述有机相中的有机溶剂或所述水相中的水)可以溶解原料(所述烃或其衍生物)、路易斯酸、布郎斯台德酸、自由基产生源等,也可以不溶解。例如可以在所述原料、路易斯酸、布郎斯台德酸、自由基产生源等分散或沉淀在所述溶剂中的状态下进行本发明的制造方法。
[0081]
对所述有机相中的原料(基质)即所述烃或其衍生物的浓度没有特别限定,例如可以为0.0001mol/l以上,也可以为60mol/l以下。
[0082]
另外,所述有机相可以包含除所述原料(烃或其衍生物)及所述有机溶剂以外的其它成分,也可以不包含。作为所述其它成分,没有特别限定,例如可以举出:布郎斯台德酸、路易斯酸及氧(o2)等。
[0083]
如上所述,所述有机相包含所述二氧化氯自由基。在所述反应系统为仅所述有机相的单相系统的情况下,例如在构成所述反应系统的所述有机相以外另外生成所述二氧化氯自由基,利用所述有机相提取所生成的所述自由基。并且,可以将包含该提取的所述二氧化自由基的所述有机相作为所述反应系统,提供给所述反应工序。例如如下所述,所述二氧化自由基可以在另外准备的水相中进行生成(二氧化氯自由基生成工序)。另一方面,在所述反应系统为包含所述有机相和水相的二相系统的情况下,例如在所述反应系统中,可以在所述水相中生成所述二氧化氯自由基,将所生成的二氧化氯自由基从所述水相中提取到所述有机相中。并且,可以将包含所述水相和含有所述二氧化氯自由基的有机相的二相反应系统提供给所述反应工序。
[0084]
(2)水相
接着,对所述水相进行说明。如上所述,所述反应系统可以为除所述有机相以外还包含水相的二相反应系统。另外,在所述反应系统为仅所述有机相的单相系统的情况下,如上所述,为了生成所述二氧化氯自由基,也可以另外使用所述水相。
[0085]
例如所述水相可以包含二氧化氯自由基的产生源。作为所述二氧化氯自由基的产生源,例如如下所述,可以举出亚氯酸钠(naclo2)等。另外,所述水相例如可以进一步包含路易斯酸及布郎斯台德酸中的至少一者。所述水相包含例如亚氯酸根离子(clo
2-)和布郎斯台德酸。所述水相为例如所述亚氯酸钠(naclo2)和布郎斯台德酸(例如盐酸)溶解在水中而成的水相。例如可以在所述亚氯酸钠和布郎斯台德酸溶解在所述水相中的状态下,开始后述光照(反应工序)。或,在水相中包含所述二氧化氯自由基的产生源的状态下,使所述有机相和所述水相接触,并对所述水相进行光照,从而产生所述二氧化氯自由基。并且,可以直接继续进行光照,从而进行所述反应工序。
[0086]
例如所述水相可以通过将所述二氧化氯自由基的产生源与水混合来制造。另外,可以进一步适当混合除所述二氧化氯自由基的产生源及水以外的其它成分,也可以不混合。作为所述其它成分,没有特别限定,例如可以举出:所述路易斯酸、所述布郎斯台德酸及所述氧(o2)。
[0087]
所述二氧化氯自由基的产生源没有特别限定,例如其为亚氯酸(hclo2)或其盐。作为亚氯酸的盐,没有特别限定,例如可以为金属盐。所述金属盐可以为例如碱金属盐、碱土金属盐、稀土类盐等,更具体而言,例如可以举出:亚氯酸钠(naclo2)、亚氯酸锂(liclo2)、亚氯酸钾(kclo2)、亚氯酸镁(mg(clo2)2)、亚氯酸钙(ca(clo2)2)等。这些亚氯酸及其盐可以仅使用一种,或并用多种。其中,从成本、操作难度等观点考虑,优选亚氯酸钠(naclo2)。
[0088]
在所述水相中,所述亚氯酸或其盐的浓度没有特别限定,换算为亚氯酸根离子(clo
2-)浓度计,例如可以为0.0001mol/l以上,也可以为1mol/l以下。另外,所述亚氯酸根离子(clo
2-)的摩尔数例如可以为所述原料(烃或其衍生物)的摩尔数的1/100000倍以上,也可以为1000倍以下。
[0089]
所述路易斯酸及布郎斯台德酸可以仅使用一种,也可以并用多种。另外,可以仅使用路易斯酸及布郎斯台德酸中的一者也可以并用两者,也可以是一种物质兼做路易斯酸及布郎斯台德酸。需要说明的是,在本发明中,“路易斯酸”是指例如相对于所述二氧化氯自由基产生源作为路易斯酸起作用的物质。
[0090]
所述路易斯酸及布郎斯台德酸中的至少一者在所述水相中的浓度没有特别限定,例如可以根据原料(基质)及目标产物(氧化反应产物)的种类等适当设置,例如可以为0.0001mol/l以上,可以为1mol/l以下。
[0091]
所述路易斯酸例如可以为有机物质也可以为无机物质。作为所述有机物质,例如可以为铵离子、有机酸(例如羧酸)等。所述无机物质可以包含金属离子及非金属离子中的一者或两者。所述金属离子可以包含典型金属离子及过渡金属离子中的一者或两者。所述无机物质可以为例如选自由碱土金属离子(例如ca
2+
等)、稀土类离子、mg
2+
、sc
3+
、li
+
、fe
2+
、fe
3+
、al
3+
、硅酸根离子及硼酸根离子构成的组中的至少一种。作为所述碱土金属离子,例如可以举出:钙、锶、钡或镭的离子,更具体而言,例如可以举出:ca
2+
、sr
2+
、ba
2+
及ra
2+
。另外,“稀土类”为钪
21
sc、钇
39
y这两种元素和从镧
57
la至镥
71
lu这15种元素(镧系元素)共17种元素的总称。作为稀土类离子,例如可以举出与所述17种元素各自相对应的三价阳离子。另外,
作为所述路易斯酸的反离子,例如可以举出:三氟甲磺酸根离子(也记作cf3so
3-或otf-)、三氟乙酸根离子(cf3coo-)、乙酸根离子、氟离子、氯离子、溴离子、碘离子、硫酸根离子、硫酸氢根离子、亚硫酸根离子、硝酸根离子、亚硝酸根离子、磷酸根离子、亚磷酸根离子等。例如所述路易斯酸可以为三氟甲基磺酸钪(sc(otf)3)等。
[0092]
另外,所述路易斯酸(也包含反离子)可以为例如选自由alcl3、almecl2、alme2cl、bf3、bph3、bme3、ticl4、sif4及sicl4构成的组中的至少一种。其中,“ph”表示苯基,“me”表示甲基。
[0093]
所述路易斯酸的路易斯酸度为例如0.4ev以上,但不限定于此。所述路易斯酸度的上限值没有特别限定,例如为20ev以下。需要说明的是,所述路易斯酸度可以通过例如ohkubo,k.;fukuzumi,s.chem.eur.j.,2000,6,4532,j.am.chem.soc.2002,124,10270-10271或j.org.chem.2003,68,4720-4726中记载的方法来测定,具体而言,可以通过下述方法测定。
[0094]
(路易斯酸度的测定方法)对于包含下述化学反应式(1a)中的四苯基卟啉钴、饱和o2及路易斯酸度的测定目标物(例如金属等的阳离子,在下述化学反应式(1a)中,由m
n+
所表示)的乙腈(mecn),在室温下,测定紫外可见光吸收光谱的变化。可以由得到的反应速率常数(k
cat
)计算作为路易斯酸度的指标的δe值(ev)。k
cat
值越大,表示路易斯酸度越强。另外,有机化合物的路易斯酸度也可以由通过量子化学计算算出的最低空轨道(lumo)的能级进行推测。正侧值越大,表示路易斯酸度越强。
[0095]
[数学式1a]
[0096]
作为所述布郎斯台德酸,没有特别限定,例如可以为无机酸也可以为有机酸,例如可以举出:三氟甲磺酸、三氟乙酸、乙酸、氢氟酸、氢氯酸、氢溴酸、氢碘酸、硫酸、亚硫酸、硝酸、亚硝酸、磷酸、亚磷酸等。所述布郎斯台德酸的酸解离常数pka为例如10以下。所述pka的下限值没有特别限定,例如为-10以上。
[0097]
关于所述氧(o2),例如可以在添加所述二氧化氯自由基产生源、所述路易斯酸、所述布郎斯台德酸、反应基质(原料)等之前或之后的水中及有机相中的至少一者中吹入空气或氧气,从而使氧溶解。此时,例如可以使氧(o2)在所述水中饱和。通过所述水相及有机相中的至少一者包含所述氧(o2),例如可以进一步促进原料(基质)即所述烃或其衍生物的氧化反应。
[0098]
需要说明的是,在本发明中,如上所述,所述水相中的水可以溶解路易斯酸、布郎斯台德酸、自由基产生源等,也可以不溶解。例如可以在路易斯酸、布郎斯台德酸、自由基产生源等分散或沉淀在水中的状态下进行本发明的制造方法。
[0099]
[3.二氧化氯自由基生成工序]接着,本发明的制造方法中,如上所述,可以进行生成所述二氧化氯自由基的二氧化氯自由基生成工序。
[0100]
所述二氧化氯自由基生成工序没有特别限定,例如可以使所述二氧化氯自由基产生源(例如亚氯酸或其盐)溶解在水中并静置,由亚氯酸根离子自然产生二氧化氯自由基。此时,例如通过所述水中存在所述路易斯酸及布郎斯台德酸中的至少一者,进一步促进二氧化氯自由基的产生。另外,例如如上所述,可以通过对所述水相进行光照来产生所述二氧化氯自由基。但是,如上所述,不进行光照而仅简单静置,也可以产生二氧化氯自由基。
[0101]
关于在水中由亚氯酸根离子产生二氧化氯自由基的机制(机理),例如推测如下述方案1所示。但是,下述方案1为推测机制的一例,丝毫不限定本发明。下述方案1的第一(上部)反应式为亚氯酸根离子(clo
2-)的歧化反应,一般认为,通过水中存在路易斯酸及布郎斯台德酸中的至少一者,平衡容易向右侧移动。下述方案1中的第二(中部)反应式为二聚化反应,第一反应式所生成的次氯酸根离子(clo-)和亚氯酸根离子反应,生成二氧化二氯(cl2o2)。一般认为,水中的质子h
+
越多,即,越呈酸性,该反应越容易进行。下述方案1中的第三(下部)反应式生成自由基。在该反应中,第二反应式所生成的二氧化二氯与亚氯酸根离子反应,生成二氧化氯自由基。
[0102]
[化学式s1]
[0103]
在下一工序即反应工序中,在使用包含所述有机相和所述水相的二相反应系统的情况下,例如在所述二相反应系统中产生所述二氧化氯自由基之后,直接将所述反应系统提供给反应工序即可。另外,在下一工序即反应工序中,在使用仅包含所述有机相的单相反应系统的情况下,例如在所述水相中产生所述二氧化氯自由基,并将所产生的所述二氧化氯自由基提取至所述有机相中之后,除去所述水相,将包含二氧化氯自由基的所述有机相作为所述单相反应系统,提供给反应工序即可。
[0104]
[4.反应工序]接着,进行所述反应工序。下面,作为所述反应工序中使用的所述反应系统,以包含所述有机相和所述水相的二相反应系统为例进行说明。
[0105]
首先,在进行所述反应工序之前,使所述水相和所述有机相这二相接触。此时,可
以将所述水相和所述有机相混合制成乳液等状态。但是,除此之外,也可以简单地使水层(所述水相)和有机层(所述有机相)这二层分离,在彼此仅在界面处接触的状态下,进行所述反应工序。
[0106]
接着,在所述反应工序中,例如如上所述,对所述有机相进行光照。在对所述有机相中的二氧化氯自由基(clo2·
)进行光照的情况下,例如预测将如图1所示。图1为利用ucam-b3lyp/6-311+g(d,p)def2tzv获得的计算结果。图1左侧表示光照前的二氧化氯自由基(clo2·
)分子的状态,右侧表示光照后的状态。如图所示,光照前,氯原子cl上分别键合有两个氧原子o,cl-o的键长为与此相对,光照后,仅一个氧原子o与氯原子cl键合,cl-o的键长变为另一个氧原子变为与所述一个氧原子键合的状态。一般认为,由此,cl-o键断裂,产生氯自由基(cl
·
)及氧分子(o2)。但是,图1为根据计算结果的一种预测,丝毫不限定本发明。
[0107]
图2示意性表示所述反应工序的一例。如图所示,在反应容器中,该反应系统的水层(所述水相)和有机层(所述有机相)这二层分离,彼此仅在界面处接触。上层为水层(所述水相)2,下层为有机层(所述有机相)1。需要说明的是,图2为剖面图,为了容易观看,省略了水层及有机层的界面(hatch)。如图所示,水层(水相)中的亚氯酸根离子(clo
2-)与酸反应,产生二氧化氯自由基(clo2·
)。由于二氧化氯自由基(clo2·
)难溶于水,因此溶解在有机层中。接着,对包含二氧化氯自由基(clo2·
)的有机层进行光照,提供光能hν(h为普朗克常数,ν为光的频率),由此,有机层中的二氧化氯自由基(clo2·
)分解,产生氯自由基(cl
·
)及氧分子(o2)。由此,有机层(有机相)中的基质(原料,图中由符号rh表示)被氧化,生成作为氧化反应产物的醇(图中,由符号r-oh表示)。醇为水溶性,因此溶解在水层中。但是,图2为例示,丝毫不限定本发明。例如图2表示氧化反应产物为水溶性醇的例子,但如上所述,氧化反应产物不限定于水溶性醇,可以为任意物质。另外,图2中,有机层(有机相)中的有机溶剂可以为例如氟溶剂,但如上所述,所述有机溶剂不限定于氟溶剂,可以为任意溶剂。另外,图2中,水层为上层,有机层为下层,例如在有机层的密度(比重)较低的情况下,有机层变为上层。而且,本发明的制造方法不限定于在图2所示的层分离状态下进行,例如如上所述,可以在乳液等状态进行,也可以一边进行搅拌等一边进行制造。
[0108]
图3中示意性示出了所述反应工序的另外一例。图3中,基质(原料)为甲烷(ch4),氧化反应产物为甲醇(ch
3-oh),除此之外,与图2相同。甲醇为水溶性,因此溶解在水层中。另外,虽然图3示出了氧化反应产物为甲醇的例子,但如上所述,基质(原料)为甲烷时的氧化反应产物不限定于甲醇,可以为任意物质。
[0109]
图4中示意性示出了所述反应工序的另外一例。图4中,基质(原料)为乙烷(ch3ch3),氧化反应产物为乙醇(ch3ch
2-oh),除此之外,与图2相同。乙醇为水溶性,因此溶解在水层中。另外,虽然图3示出了氧化反应产物为乙醇的例子,但如上所述,基质(原料)为乙烷时的氧化反应产物不限定于乙醇,可以为任意。
[0110]
图5中示意性示出了所述反应工序的另外一例。图5中,基质(原料)为环己烷,氧化反应产物为环己醇,除此之外,与图2相同。环己醇为水溶性,因此溶解在水层中。另外,虽然图5示出了氧化反应产物为环己醇的例子,但如上所述,基质(原料)为环己烷时的氧化反应产物不限定于环己醇,可以为任意物质。
[0111]
在所述反应工序中,照射光的波长没有特别限定,例如可以为200nm以上,也可以
为800nm以下。光照时间也没有特别限定,例如可以为1min以上,也可以为1000h以下。反应温度也没有特别限定,例如可以为0℃以上,也可以为100℃以下。反应时的气氛压力也没有特别限定,例如可以为0.1mpa以上,也可以为100mpa以下。根据本发明,例如如后述实施例所示,也可以完全不进行加热、加压、减压等,在常温(室温)及常压(气压)下进行所述反应工序或包含其在内的全部工序。需要说明的是,“室温”没有特别限定,例如为5~35℃。另外,根据本发明,例如如后述实施例所示,也可以不进行惰性气体置换等,而在大气中进行所述反应工序或包含其在内的全部工序。
[0112]
所述光照时,光源没有特别限定,例如利用阳光等自然光所含的可见光即可简单激发。另外,例如可以适当使用氙气灯、卤素灯、荧光灯、汞灯等光源代替所述自然光,或将氙气灯、卤素灯、荧光灯、汞灯等光源与所述自然光并用,也可以不使用。而且,可以适当使用对所需波长以外的波长进行拦截的滤光片,但也可以不使用。
[0113]
作为通过乙烷的氧化反应生成乙醇的机制(机理),例如推测如下述方案2所示。但是,下述方案2为所推测机制的一例,丝毫不限定本发明。对下述方案2进行具体说明,首先,如图1所示,二氧化氯自由基因光照而分解,产生氯自由基(cl
·
)和氧分子(o2)。所述氯自由基相对于乙烷作为夺氢剂起作用,产生乙基自由基(ch3ch2·
)。并且,所述氧分子如下述方案2所示那样将所述乙基自由基氧化,生成乙醇。
[0114]
[化学式s2]
[0115]
另外,使用亚氯酸钠通过甲烷的氧化反应生成甲醇及甲酸时的反应式例如如下述方案3所示。但是,下述方案3也为一例,使用本发明对甲烷进行氧化的反应不限定于此。
[0116]
[化学式s3]naclo2+2ch4→
2ch3oh+nacl3naclo2+2ch4→
2hcooh+3nacl+h2o方案3
[0117]
作为通过甲烷的氧化反应生成甲醇的机制(机理),例如推测如下述方案4所示。但
是,下述方案4为所推测机制的一例,丝毫不限定本发明。对下述方案4进行具体说明,与由乙烷生成乙醇的情况(方案2)同样地,首先,二氧化氯自由基因光照分解,产生氯自由基(cl
·
)和氧分子(o2)。所述氯自由基相对于甲烷作为夺氢剂起作用,产生甲基自由基(ch3·
)。并且,所述氧分子如下述方案4所示那样将所述甲基自由基氧化,生成甲醇。
[0118]
[化学式s4][化学式s4]
[0119]
作为通过环己烷的氧化反应生成环己醇的机制(机理),例如推测如下述方案5所示。但是,下述方案5为所推测机制的一例,丝毫不限定本发明。对下述方案5进行具体说明,首先,如图1所示,二氧化氯自由基因光照分解,产生氯自由基(cl
·
)和氧分子(o2)。所述氯自由基相对于环己烷作为夺氢剂起作用,产生环己基自由基。并且,所述氧分子如下述方案5所示那样将所述环己基自由基氧化,生成环己醇。
[0120]
[化学式s5]
[0121]
另外,在本发明中的第一发明中,所述原料(基质)不仅限定于乙烷、甲烷或环己烷,如上所述,可以为任意的烃或其衍生物。作为原料(基质)的所述烃或其衍生物的例子例如如上所述。
[0122]
在本发明中的第一发明中,例如如下述方案a所示,所述原料由下述化学式(a1)表示,其氧化反应产物可以为下述化学式(a2)所表示的醇和下述化学式(a3)所表示的羧酸中的至少一者。在下述方案a中,r为任意原子或原子团,例如氢原子、烃基或其衍生物。所述烃基是任意的,例如可以为直链状也可以为支链状,可以为饱和也可以为不饱和,可以包含环状结构也可以不包含环状结构,所述环状结构可以为芳香环也可以为非芳香环。另外,例如在下述方案a中,氧化反应产物可以包含醛来代替醇及羧酸中的至少一者或与它们同时存在。
[0123]
[化学式sa]
[0124]
在所述方案a中,在原料(基质)(a1)为甲烷的情况下,例如如下述方案a1所示,氧化反应产物可以包含甲醇及甲酸中的至少一者。另外,在原料(基质)(a1)为乙烷的情况下,例如如下述方案a2所示,氧化反应产物可以包含乙醇及乙酸中的至少一者。但是,下述方案a1及a2也为例示,在本发明的制造方法中,甲烷或乙烷的氧化反应不限定于此。
[0125]
[化学式sa1]
[0126]
[化学式sa2]
[0127]
另外,例如如下述方案b所示,所述原料由下述化学式(b1)表示,其氧化反应产物可以为下述化学式(b2)所表示的醇和下述化学式(b3)所表示的羰基化合物(例如酮)中的至少一者。在下述方案b中,r为任意原子或原子团,例如烃基或其衍生物。所述烃基是任意的,例如可以为直链状也可以为支链状,可以为饱和也可以为不饱和,可以包含环状结构也可以不包含环状结构,所述环状结构可以为芳香环也可以为非芳香环。各r彼此可以相同也可以不同。另外,例如在下述化学式(b1)、(b2)及(b3)中,两个r可以形成一体并与它们所键合的碳原子共同形成环状结构。
[0128]
[化学式sb]
[0129]
在所述方案b中,在原料(基质)(b1)为环己烷的情况下,例如如下述方案b1所示,氧化反应产物可以包含环己醇及环己酮中的至少一者。但是,下述方案b1也为例示,在本发明的制造方法中,环己烷的氧化反应不限定于此。
[0130]
[化学式sb1]
[0131]
在本发明中,例如如下述方案c所示,所述原料为下述化学式(c1)所表示的芳香族化合物,该氧化反应产物可以为下述化学式(c2)所表示的苯酚和下述化学式(c3)所表示的醌中的至少一者。在下述方案c中,各r为任意原子或原子团,例如氢原子、烃基或其衍生物。所述烃基是任意的,例如可以为直链状也可以为支链状,可以为饱和也可以为不饱和,可以包含环状结构也可以不包含环状结构,所述环状结构可以为芳香环也可以为非芳香环。各r彼此可以相同也可以不同。另外,例如在下述化学式(c1)、(c2)及(c3)中,两个以上的r可以形成一体并与它们所键合的苯环共同形成环状结构。但是,下述方案c为例示,不限定本发明。即,如上所述,本发明的制造方法中,作为原料(基质)的芳香族化合物不限定于下述化学式(c1),所述芳香族化合物的氧化反应产物也不限定于下述(c2)及(c3)。
[0132]
[化学式sc]
[0133]
在所述方案c中,在原料(基质)(c1)为苯的情况下,例如如下述方案c1所示,氧化反应产物可以包含羟基苯及对苯醌中的至少一者。但是,下述方案c1也为例示,本发明的制造方法中,苯的氧化反应不限定于此。
[0134]
[化学式sc1]
[0135]
需要说明的是,在所述原料(基质)为芳香族化合物的情况下,若所述芳香族化合物的芳香环上键合有供电子基团,例如所述原料芳香族化合物的氧化反应(包含氧化性取代反应)容易进行,故优选。所述供电子基团可以为一个也可以为多个,优选供电子性强的基团。更具体而言,所述原料芳香族化合物更优选芳香环上共价键合有选自由-or
100
、-nr
2002
及ar
100
构成的组中的至少一种取代基。所述r
100
为氢原子或任意的取代基,在r
100
为多个的情况下,各r
100
可以相同也可以不同。所述r
200
为氢原子或任意的取代基,各r
200
可以相同也可以不同。所述ar
100
为芳基,在ar
100
为多个的情况下,各ar
100
可以相同也可以不同。
[0136]
所述ar
100
为由苯环、萘环、蒽环、菲环、吡啶环、噻吩环、芘环等任意芳香环衍生的
基团。所述芳香环可以在环上进一步具有一个或多个取代基,在所述取代基为多个的情况,它们可以相同也可以不同。作为所述ar
100
,例如可以举出苯基等。
[0137]
另外,所述r
100
优选为选自由氢原子、烷基、芳基及酰基构成的组中的至少一种。所述烷基优选碳原子数1~6的直链或支链烷基,特别优选甲基。所述酰基优选碳原子数1~6的直链或支链酰基。例如与所述ar
100
同样地,所述芳基为例如苯基。
[0138]
另外,所述r
200
优选为选自由氢原子、烷基、芳基及酰基构成的组中的至少一种。所述烷基优选碳原子数1~6的直链或支链烷基,特别优选甲基。所述酰基优选碳原子数1~6的直链或支链酰基。例如与所述ar
100
同样地,所述芳基为例如苯基。作为所述-nr
2002
,二甲基氨基、二苯基氨基等被供电子性取代基取代的氨基的供电子性特别高,故优选。
[0139]
另外,作为原料(基质)的所述芳香族化合物例如在芳香环上共价键合有烷基等取代基,可以通过所述反应工序将所述取代基氧化。例如所述氧化剂包含氧原子,所述芳香族化合物包含共价键合在芳香环上的亚甲基(-ch
2-),在所述反应工序中,可以将所述亚甲基(-ch
2-)氧化并转化为羰基(-co-)。在该情况下,键合在所述亚甲基及羰基上的原子或原子团没有特别限制,可以举出:氢原子、烷基、芳基等。所述烷基优选碳原子数1~6的直链或支链烷基。所述烷基、芳基可以进一步被一个或多个取代基取代,在所述取代基为多个的情况下,它们可以相同也可以不同。例如若所述亚甲基上键合有氢,则变为甲基(-ch3),氧化后,形成甲酰基(-cho)。若所述亚甲基上键合有甲基,则变为乙基(-ch2ch3),氧化后,形成乙酰基(-coch3)。若所述亚甲基上键合有苯基,则变为苄基(-ch2ph),氧化后,形成苯甲酰基(-coph)。另外,例如可以是:共价键合在芳香环上的所述取代基(氧化前)为甲酰基(-cho),氧化后形成羧基(-cooh)。
[0140]
另外,例如所述原料(基质)可以为烯烃,所述烯烃可以为例如芳香族烯烃,也可以为脂肪族烯烃。所述烯烃可以为例如下述方案d中的化学式(d1)所表示的烯烃。另外,所述烯烃的氧化反应产物没有特别限定,例如如下述方案d所示,可以包含环氧化物及二醇中的至少一者。在下述化学式(d1)、(d2)及(d3)中,r分别为氢原子或任意的取代基,各r彼此可以相同也可以不同。所述任意的取代基为例如烷基、不饱和脂肪族烃基、芳基、杂芳基、卤素、羟基(-oh)、巯基(-sh)或烷硫基(-sr、r为烷基),可以进一步被取代基取代,也可以不被取代。所述烷基更优选为碳原子数1~6的直链或支链烷基。另外,作为被氧化物的所述烯烃可以为仅包含一个烯烃键(碳-碳双键)的烯烃,但也可以为包含多个(两个以上)烯烃键的烯烃。
[0141]
[化学式sd]
[0142]
所述烯烃可以为例如芳香族烯烃。即,例如在所述化学式(d1)中,r的至少一个可以为芳香环(芳基或杂芳基)。在本发明中,所述芳香族烯烃没有特别限制,若所述芳香族烯烃的芳香环上键合有供电子基团,例如则所述芳香族烯烃的氧化反应(包含氧化性取代反
应)容易进行,故优选。所述供电子基团可以为一个也可以为多个,优选供电子性强的基团。更具体而言,所述芳香族烯烃更优选在芳香环上共价键合有选自由所述-or
100
、-nr
2002
及ar
100
构成的组中的至少一个取代基。
[0143]
在本发明中的第一发明的氧化反应产物的制造方法中,所述烯烃可以为选自由乙烯、丙烯、苯乙烯及丁二烯构成的组中的至少一种。另外,例如如上所述,所述氧化反应产物可以为环氧化物及二醇中的至少一者。在下述方案d1~d3中示出了其的例子。但是,下述方案d1~d3为例示,在本发明中,乙烯、丙烯及苯乙烯的氧化反应不限定于此。
[0144]
[化学式sd1-3]3]
[0145]
需要说明的是,在本发明中的第一~第四发明的制造方法中,得到的氧化反应产物的比率(例如第一发明中,醇和羧酸的比率、苯酚和醌的比率等;第二发明中,甲醇和甲酸的比率等;第三发明中,乙醇和乙酸的比率等;第四发明中,环己醇和环己酮的比率等)可以通过适当设置反应条件来调整。
[0146]
另外,在本发明中的第一发明的制造方法中,所述原料(基质)的氧化反应产物不限定于所述醇、羧酸、醛、酮、苯酚、醌等,例如也可以包含所述原料(基质)的氯化物(氯化物)等来代替它们或者与之共存。需要说明的是,例如在烃的气相反应中,氯原子自由基cl
·
双分子参与的情况下(例如使用氯气cl2的气相反应),预测即使在氧分子o2存在下,也会优先产生氯化。在本发明的制造方法中,二氧化氯自由基分解而产生氯原子自由基cl
·
及氧分子o2,但推测由于在液相中进行反应,因此,基质的氯化被抑制,优先生成所述醇、羧酸、醛、酮、苯酚、醌等。但是,这些推测也为例示,丝毫不限定本发明。另外,根据本发明,通过在水相和有机相的二相系统中进行反应,即使是以往难以进行液相反应的烃气体(例如甲烷、乙烷等),也可以在液相中高效地进行氧化反应。因此,可以由所述烃气体高效地制造工业利用价值极高的所述烃气体的氧化反应产物(例如甲醇、甲酸、乙醇、乙酸等)。
[0147]
在本发明中的第二发明的制造方法中,作为所述原料(基质)的甲烷的氧化反应产
物,不限定于所述甲醇、甲酸、甲醛、甲基过氧化氢等,例如可以包含作为所述原料(基质)的甲烷的氯化物(氯化物)等来代替它们或与之共存。需要说明的是,例如在烃的气相反应中,氯原子自由基cl
·
双分子参与的情况下(例如使用氯气cl2的气相反应),推测即使在氧分子o2存在下,也优选产生氯化。在本发明的制造方法中,二氧化氯自由基分解,由此产生氯原子自由基cl
·
及氧分子o2,但推测由于在液相进行反应,因此,基质的氯化被抑制,优先生成所述甲醇、甲酸、甲醛、甲基过氧化氢等。但是,这些推测也为例示,丝毫不限定本发明。另外,根据本发明,通过在水相和有机相的二相系统中进行反应,即使是以往难以进行液相反应的烃气体甲烷,也可以在液相中高效地进行氧化反应。因此,可以由所述甲烷高效地制造工业利用价值极高的所述烃气体的氧化反应产物(例如甲醇、甲酸等)。
[0148]
在本发明中的第三发明的制造方法中,所述原料(基质)的氧化反应产物不限定于所述乙醇、乙酸、乙醛、乙基过氧化氢等,例如可以包含所述原料(基质)的氯化物(氯化物)等来代替它们或与之共存。需要说明的是,例如在烃的气相反应中,氯原子自由基cl
·
双分子参与的情况下(例如使用氯气cl2的气相反应),推测即使在氧分子o2存在下,也优先产生氯化。在本发明的制造方法中,二氧化氯自由基分解,由此产生氯原子自由基cl
·
及氧分子o2,但推测由于在液相中进行反应,因此,基质的氯化被抑制,优先生成所述乙醇、乙酸、乙醛、乙基过氧化氢等。但是,这些推测也为例示,丝毫不限定本发明。另外,根据本发明,通过在水相和有机相的二相系统中进行反应,即使是以往难以进行液相反应的烃气体乙烷,也可以在液相中高效地进行氧化反应。因此,可以由所述烃气体高效地制造工业利用价值极高的乙烷的氧化反应产物(例如乙醇、乙酸等)。
[0149]
在本发明中的第四发明的制造方法中,所述原料(基质)的氧化反应产物不限定于所述环己醇、环己酮、环己烷过氧化氢、开环氧化物(例如己二酸等)等,例如可以包含作为所述原料(基质)的环己烷的氯化物(氯化物)等来代替它们或与之共存。需要说明的是,例如在烃的气相反应中,氯原子自由基cl
·
双分子参与的情况下(例如使用氯气cl2的气相反应),推测即使在氧分子o2存在下,也优先产生氯化。在本发明的制造方法中,二氧化氯自由基分解,由此产生氯原子自由基cl
·
及氧分子o2,但推测由于在液相中进行反应,因此,基质的氯化被抑制,优先生成所述环己醇、环己酮、环己烷过氧化氢、开环氧化物(例如己二酸等)等。但是,这些推测也为例示,丝毫不限定本发明。另外,根据本发明,通过在水相和有机相的二相系统中进行反应,即使环己烷,也可以在液相中高效地进行氧化反应。因此,可以由环己烷高效地制造工业利用价值极高的环己烷的氧化反应产物(例如环己醇、环己烷等)。
[0150]
而且,所述反应工序后,根据需要,进行所述氧化反应产物的回收工序。如上所述,所述回收工序可以为例如从所述反应系统中回收包含所述氧化反应产物的所述水相的工序。这是因为,作为低级醇、低级羧酸等的所述氧化反应产物(例如甲醇、乙醇、甲酸、羧酸等)容易溶解在所述水相中。另外,在所述氧化反应产物难溶于所述水相而易溶于所述有机相中的情况下(例如所述氧化反应产物为苯醌,所述有机相的溶剂为苯的情况等),可以从所述反应系统回收包含所述氧化反应产物的所述有机相。另外,例如在所述氧化反应产物既难溶于所述水相也难溶于所述有机相的情况下,例如可以通过过滤等回收所述氧化反应产物。而且,根据需要,对所回收的氧化反应产物进行分离纯化。分离纯化方法没有特别限定,可以根据一般的有机合成反应,适当使用蒸馏、过滤等方法来进行。
[0151]
需要说明的是,如上所述,本发明中的第一~第四发明的制造方法中的所述反应工序也可以仅在有机相中进行。例如另外准备如上所述的包含二氧化氯自由基的产生源的水相,在所述水相中生成二氧化氯自由基(二氧化氯自由基生成工序)。然后,通过分液法等将所述二氧化氯自由基从所述水相提取至有机相中。所述原料(基质)可以在提取所述二氧化氯自由基之前添加到所述有机相中,也可以与提取所述二氧化氯自由基同时地或在提取后添加到所述有机相中。然后,在所述水相和所述有机相分离(所述有机相单独的)且所述有机相包含所述原料(基质)及所述二氧化氯自由基的状态下,如上所述那样进行光照,从而进行所述反应工序。但是,本发明的制造方法中的所述反应工序优选在不使所述水相和所述有机相分离而是接触状态下(在二相反应系统中)进行。这样一来,例如如上所述,具有可以从所述水相中简单回收水溶性的氧化反应产物等优点。另外,例如若在水相包含二氧化氯自由基的产生源的二相反应系统中,同时进行所述二氧化氯自由基生成工序和所述反应工序(生成原料的氧化反应产物的工序),则具有反应效率高的优点。
[0152]
根据本发明,例如可以通过仅仅对二氧化氯自由基水溶液进行光照这样极其简单的方法,产生氯原子自由基cl
·
及氧分子o2,从而进行氧化反应。并且,通过这样简单的方法,例如即使在常温及常压等极其温和的条件下,也可以将烃或其衍生物高效地转化为氧化反应产物。
[0153]
而且,根据本发明中的第一~第四发明,例如也可以不使用有毒的重金属催化剂等,而得到所述原料(烃或其衍生物)的氧化反应产物。这样一来,如上所述,可以在常温及常压等极其温和的条件下进行反应,而且,也可以通过环境负担极小的方法高效地得到所述氧化反应产物。
[0154]
[第五发明的实施方式]下面,举例对本发明中的第五发明进行具体的说明。但是,本发明不受以下说明限定。
[0155]
[1.自由基产生工序等]本发明中的第五发明的烯烃的氧化反应产物的制造方法包含例如使路易斯酸及布郎斯台德酸中的至少一者和自由基产生源混合的混合工序。在所述混合工序中,可以进一步混合除路易斯酸及布郎斯台德酸中的至少一者和自由基产生源以外的任意物质,也可以不混合。即,通过所述混合工序得到的混合物可以进一步包含除路易斯酸及布郎斯台德酸中的至少一者和自由基产生源以外的任意物质,也可以不包含。例如从反应性等观点考虑,在所述混合工序中优选进一步混合溶剂。需要说明的是,在本发明中,“溶剂”可以溶解路易斯酸、布郎斯台德酸、自由基产生源等,但也可以不溶解。例如在所述混合工序后中,所述路易斯酸及布郎斯台德酸中的至少一者和自由基产生源分别可以为溶解在所述溶剂中的状态,也可以为分散或沉淀在所述溶剂中的状态。另外,在本发明中,“路易斯酸”是指例如相对于所述自由基产生源作为路易斯酸起作用的物质。
[0156]
如上所述,本发明中的第五发明的烯烃的氧化反应产物的制造方法包含自由基产生工序,所述自由基产生工序使所述路易斯酸及布郎斯台德酸中的至少一者和所述自由基产生源作用,从而产生自由基。所述自由基产生工序例如在所述混合工序后,通过得到的混合物中的反应产生(制造)自由基。如上所述,所述混合物可以为例如溶液状态,也可以为悬浮液状态、胶体状态等。从反应性观点考虑,所述混合物优选为例如溶液状态或胶体状态。
在所述自由基制造工序中,例如可以仅将所述混合物在室温下静置,也可以根据需要对所述混合物进行加热、光照等。所述自由基制造工序中的反应温度及反应时间没有特别限定,例如在可以根据反应物(原料)及目标产物的种类等适当设置的光照的情况下,照射光的波长没有特别限定,例如可以根据反应物(原料)的吸收带等适当设置。需要说明的是,关于反应时间及反应温度,例如也可以通过所述混合物中的路易斯酸及布郎斯台德酸中的至少一者和自由基产生源的浓度进行调整。例如可以通过提高所述浓度来缩短反应时间,本发明不受该说明限定。
[0157]
所述路易斯酸及布郎斯台德酸中的至少一者的浓度没有特别限定,例如可以根据反应物(原料)及目标产物的种类等适当设置。另外,所述溶剂没有特别限定,例如可以为水也可以为有机溶剂,可以根据溶质的种类等适当选择。作为有机溶剂,例如可以举出:二氯甲烷、氯仿、四氯化碳等卤化溶剂、丙酮等酮、乙腈等腈溶剂、甲醇、乙醇等醇溶剂、乙酸溶剂、硫酸溶剂等,这些溶剂可以单独使用也可以并用二种以上。所述乙酸溶剂及硫酸溶剂例如可以为乙酸或硫酸溶解在水中而成,它们例如在作为溶剂的同时,也作为路易斯酸或布郎斯台德酸起作用。所述溶剂的种类可以根据例如溶质(例如所述路易斯酸及布郎斯台德酸中的至少一者、所述自由基产生源等)的溶解性等区分使用。
[0158]
在本发明中的第五发明的烯烃的氧化反应产物的制造方法中,如上所述,可以通过加热进行反应,也可以不加热仅通过光照进行反应或既不加热也不光照仅通过在室温下静置进行反应,制造自由基。需要说明的是,“室温”的定义没有特别限定,例如为5~35℃。由于无需加热,例如节省了利用电炉等加热的成本,可以大幅降低自由基的制造成本。另外,由于无需加热,例如可以抑制自由基链引起的意外失控反应及过氧化物的累积等,因此反应的安全性进一步提高,可以进一步降低成本。但是,这些说明为例示,丝毫不限定本发明。
[0159]
本发明中的第五发明的烯烃的氧化反应产物的制造方法可以进一步包含例如光照工序,即,对通过所述混合工序得到的混合物进行光照。并且,如上所述,可以通过利用所述光照产生的反应来制造自由基。照射光的波长例如如上所述。光源没有特别限定,例如利用阳光等自然光所含的可见光即可简单激发。另外,例如可以适当使用氙气灯、卤素灯、荧光灯、汞灯等光源代替所述自然光,或将氙气灯、卤素灯、荧光灯、汞灯等光源与所述自然光并用,也可以不使用。而且,可以适当使用对所需波长以外的波长进行拦截的滤光片,也可以不使用。
[0160]
在本发明中的第五发明的烯烃的氧化反应产物的制造方法中,所述路易斯酸的路易斯酸度为例如0.4ev以上。所述路易斯酸度的上限值没有特别限定,例如为20ev以下。需要说明的是,所述路易斯酸度可以通过例如ohkubo,k.;fukuzumi,s.chem.eur.j.,2000,6,4532,j.am.chem.soc.2002,124,10270-10271或j.org.chem.2003,68,4720-4726中记载的方法测定,具体而言,可以通过下述方法测定。
[0161]
(路易斯酸度的测定方法)对于包含下述化学反应式(1a)中的四苯基卟啉钴、饱和o2及路易斯酸度的测定目标物(例如金属等的阳离子,在下述化学反应式(1a)中,由m
n+
所表示)的乙腈(mecn),在室温下,测定紫外可见光吸收光谱的变化。可以由得到的反应速率常数(k
cat
)计算作为路易斯酸度的指标的δe值(ev)。k
cat
值越大,表示路易斯酸度越强。
[0162]
[数学式1a]
[0163]
另外,在本发明中的第五发明的烯烃的氧化反应产物的制造方法中,所述路易斯酸可以包含例如金属离子及非金属离子中的一者或两者。所述金属离子可以包含典型金属离子及过渡金属离子中的一者或两者。所述无机物质例如可以为选自由碱土金属离子(例如ca
2+
等)、稀土类离子、mg
2+
、sc
3+
、li
+
、fe
2+
、fe
3+
、al
3+
、硅酸根离子及硼酸根离子构成的组中的至少一种。作为碱土金属离子,例如可以举出:钙、锶、钡或镭的离子,更具体而言,例如可以举出:ca
2+
、sr
2+
、ba
2+
及ra
2+
。另外,“稀土类”为钪
21
sc、钇
39
y这两种元素和从镧
57
la至镥
71
lu的15种元素(镧系元素)共17种元素的总称。作为稀土类离子,例如可以举出:与所述17种元素各自相对应的三价阳离子。
[0164]
另外,所述路易斯酸(也包含反离子)例如可以为选自由alcl3、almecl2、alme2cl、bf3、bph3、bme3、ticl4、sif4及sicl4构成的组中的至少一种。其中,“ph”表示苯基,“me”表示甲基。
[0165]
在本发明中的第五发明的烯烃的氧化反应产物的制造方法中,所述布郎斯台德酸的酸解离常数pka为例如5以上。所述pka的上限值没有特别限定,例如为50以下。
[0166]
在本发明中的第五发明的烯烃的氧化反应产物的制造方法中,所述自由基产生源可以包含例如选自由卤素离子、次卤酸根离子、亚卤酸根离子、卤酸根离子及高卤酸根离子构成的组中的至少一种。所述自由基产生源特别优选包含例如亚氯酸根离子。所述自由基产生源可以包含例如含氧酸或其盐(例如卤素含氧酸或其盐)。作为所述含氧酸,例如可以举出:硼酸、碳酸、原碳酸、羧酸、硅酸、亚硝酸、硝酸、亚磷酸、磷酸、砷酸、亚硫酸、硫酸、磺酸、亚磺酸、铬酸、重铬酸及高锰酸等。卤素含氧酸可以举出:次氯酸、亚氯酸、氯酸及高氯酸等氯含氧酸;次溴酸、亚溴酸、溴酸及高溴酸等溴含氧酸;及次碘酸、亚碘酸、碘酸及高碘酸等碘含氧酸。所述自由基产生源例如可以根据用途,并考虑到自由基物种的反应性的强度等而适当选择。例如可以根据目的区分使用反应性强的次氯酸和反应性较次氯酸稍稳定,反应容易控制的亚氯酸。
[0167]
另外,在本发明中的第五发明的烯烃的氧化反应产物的制造方法中,在化合物(例如作为被氧化物的烯烃等)存在互变异构体或立体异构体(例:几何异构体、构象异构体及光学异构体)等异构体的情况下,除非另有说明,否则所有异构体均可用于本发明。另外,在化合物(例如所述烯烃等)可以形成盐的情况下,除非另有说明,否则所述盐也可用于本发明。所述盐可以为酸加成盐,也可以为碱加成盐。而且,形成所述酸加成盐的酸可以为无机酸也可以为有机酸,形成所述碱加成盐的碱可以为无机碱也可以为有机碱。作为所述无机酸,没有特别限定,例如可以举出:硫酸、磷酸、氢氟酸、盐酸、氢溴酸、氢碘酸、次氟酸、次氯酸、次溴酸、次碘酸、亚氟酸、亚氯酸、亚溴酸、亚碘酸、氟酸、氯酸、溴酸、碘酸、高氟酸、高氯
酸、高溴酸及高碘酸等。所述有机酸也没有特别限定,例如可以举出:对甲苯磺酸、甲磺酸、草酸、对溴苯磺酸、碳酸、琥珀酸、柠檬酸、苯甲酸及乙酸等。作为所述无机碱,没有特别限定,例如可以举出:氢氧化铵、碱金属氢氧化物、碱土金属氢氧化物、碳酸盐及碳酸氢盐等,更具体而言,例如可以举出:氢氧化钠、氢氧化钾、碳酸钾、碳酸钠、碳酸氢钠、碳酸氢钾、氢氧化钙及碳酸钙等。所述有机碱也没有特别限定,例如可以举出:乙醇胺、三乙胺及三(羟基甲基)氨基甲烷等。这些盐的制造方法也没有特别限定,例如可以通过利用公知方法向所述化合物适当加成如上所述的酸或碱等方法制造。
[0168]
另外,在本发明中的第五发明的烯烃的氧化反应产物的制造方法中,除非另有说明,否则链状取代基(例如烷基、不饱和脂肪族烃基等烃基)可以为直链状也可以为支链状,其碳原子数没有特别限定,例如可以为1~40、1~32、1~24、1~18、1~12、1~6或1~2(在不饱和烃基的情况下为2以上)。另外,在本发明中,环状基团(例如芳基、杂芳基等)的环元数(构成环的原子数)没有特别限定,例如可以为5~32、5~24、6~18、6~12或6~10。另外,在取代基等存在异构体的情况下,除非另有说明,否则可以为任意异构体,例如在简单称为“萘基”的情况下,可以为1-萘基可以为2-萘基。
[0169]
[2.氧化反应工序等]如上所述,本发明中的第五发明的烯烃的氧化反应产物的制造方法包含将所述自由基作为氧化剂氧化烯烃的氧化反应工序。
[0170]
本发明中的第五发明的烯烃的氧化反应产物的制造方法的实施方法没有特别限定,例如可以在所述混合工序中,除路易斯酸及布郎斯台德酸中的至少一者和自由基产生源以外,进一步混合所述烯烃。此时,如上所述,优选进一步混合溶剂。并且,在所述自由基产生工序中,可以使所产生的自由基和所述烯烃反应,从而生成所述氧化反应产物。即,所述氧化反应工序可以与所述自由基产生工序平衡地在同一反应系统中同时进行。在该情况下,所述烯烃、所述路易斯酸及布郎斯台德酸中的至少一者及自由基产生源的浓度没有特别限定,相对于所述溶剂,例如反应mol/l没有特别限定,可以分别适当设置。另外,例如由于所述被氧化物(烯烃)的浓度越高,反应速率越快,因此优选尽量提高浓度,为了使反应容易进行,优选所述氧化剂(自由基产生源)的浓度不过高。但是,该说明为例示,丝毫不限定本发明。
[0171]
在本发明中的第五发明的烯烃的氧化反应产物的制造方法的所述氧化反应工序中,如上所述,将所述自由基作为氧化剂氧化烯烃。例如所述自由基产生源为含氧酸,由所述含氧酸产生的自由基可以为氧化剂。作为一例,所述自由基产生剂为亚氯酸根离子clo
2-,可以将由亚氯酸根离子clo
2-产生的自由基clo2·
作为氧化剂,将所述被氧化物氧化,从而制造所述氧化反应产物。
[0172]
在本发明中的第五发明的烯烃的氧化反应产物的制造方法中,作为被氧化物的所述烯烃没有特别限定,例如可以为芳香族烯烃,也可以为脂肪族烯烃。所述烯烃可以为例如下述化学式(aa1)所表示的烯烃。另外,所述烯烃的氧化反应产物没有特别限定,例如如下述方案aa所示,可以包含环氧化物及二醇中的至少一者。在下述化学式(aa1)、(aa2)及(aa3)中,r分别为氢原子或任意的取代基,各r彼此可以相同也可以不同。所述任意的取代基为例如烷基、不饱和脂肪族烃基、芳基、杂芳基、卤素、羟基(-oh)、巯基(-sh)或烷硫基(-sr、r为烷基),可进一步被取代基取代,也可以不被取代。所述烷基更优选为碳原子数1~6
的直链或支链烷基。另外,作为被氧化物的所述烯烃可以为仅包含一个烯烃键(碳-碳双键)的烯烃,也可以为包含多个(两个以上)烯烃键的烯烃。
[0173]
[化学式aa1]
[0174]
[化学式saa][化学式saa]
[0175]
所述烯烃可以为例如芳香族烯烃。即,例如在所述化学式(aa1)中,r的至少一个可以为芳香环(芳基或杂芳基)。在本发明中,所述芳香族烯烃没有特别限制,若所述芳香族烯烃的芳香环上键合有供电子基团,例如所述原料芳香族化合物的氧化反应(包含氧化性取代反应)容易进行,故优选。所述供电子基团可以为一个也可以为多个,优选供电子性强的基团。更具体而言,所述原料芳香族化合物更优选为芳香环上共价键合有选自由-or
100
、-nr
2002
及ar
100
构成的组中的至少一种的取代基。所述r
100
为氢原子或任意的取代基,在r
100
为多个的情况下,各r
100
可以相同也可以不同。所述r
200
为氢原子或任意的取代基,各r
200
可以相同也可以不同。所述ar
100
为芳基,在ar
100
为多个的情况下,各ar
100
可以相同也可以不同。
[0176]
所述ar
100
为由苯环、萘环、蒽环、菲环、吡啶环、噻吩环、芘环等任意芳香环衍生的基团。所述芳香环可以在环上进一步具有一个或多个取代基,在所述取代基为多个的情况下,它们可以相同也可以不同。作为所述ar
100
,例如可以举出苯基等。
[0177]
另外,所述r
100
优选为选自由氢原子、烷基、芳基及酰基构成的组中的至少一种。所述烷基优选为碳原子数1~6的直链或支链烷基,特别优选甲基。所述酰基优选碳原子数1~6的直链或支链酰基。例如与所述ar
100
同样地,所述芳基为例如苯基。
[0178]
另外,所述r
200
优选选自由氢原子、烷基、芳基及酰基构成的组中的至少一种。所述烷基优选碳原子数1~6的直链或支链烷基,特别优选甲基。所述酰基优选碳原子数1~6的直链或支链酰基。例如与所述ar
100
同样地,所述芳基为例如苯基。作为所述-nr
2002
,二甲基氨基、二苯基氨基等被供电子性取代基取代的氨基的供电子性特别高,故优选。
[0179]
在本发明中的第五发明的烯烃的氧化反应产物的制造方法中,所述烯烃可以为选自由乙烯、丙烯、苯乙烯及丁二烯构成的组中的至少一种。另外,例如如上所述,所述氧化反应产物可以为环氧化物及二醇中的至少一者。下述方案aa1~aa3中示出其的例子。但是,下述方案aa1~aa3为例示,在本发明中的第五发明中,乙烯、丙烯及苯乙烯的氧化反应不限定于此。
[0180]
[化学式saa1-3]
[0181]
对烯烃(例如所述方案aa的烯烃(aa1))进行氧化时,例如可以通过对所述路易斯酸及布郎斯台德酸中的至少一者、所述自由基产生源及所述氧化剂中至少一种的浓度进行调整来分开制造所生成的氧化反应产物。若它们的浓度例如相对于所述被氧化物为低浓度,则存在容易获得环氧化物的倾向,若为高浓度,则存在容易获得二醇的倾向,但不限定于此。另外,例如除所述浓度以外,也可以通过由所述自由基产生源产生的自由基物种的反应性的强度,来分开制造所生成的氧化反应产物。例如反应性弱的自由基物种存在容易获得环氧化物的倾向,反应性强的自由基物种存在容易获得二醇的倾向,但不限定于此。需要说明的是,所述氧化反应产物的用途没有特别限定,例如在所述被氧化物(原料芳香族化合物)为苯乙烯的情况下,苯乙烯氧化物可以用作粘接剂,二醇可以用作香料等。这样一来,所述环氧化物和所述二醇分别被要求用于不同用途,因此若通过控制反应条件来分开制造,则本发明中的第五发明可以用于更广泛的用途。实施例
[0182]
下面,对本发明的实施例进行说明。但是,本发明不限定于下面的实施例。
[0183]
[第一~第四发明的实施例]首先,对本发明中的第一~第四发明的实施例进行说明。
[0184]
[实施例1~7]将作为基质(原料)的烃溶解在有机溶剂中,制备有机相。另一方面,将亚氯酸钠(naclo2)及酸溶解在水(h2o或d2o)中,通过氧气(o2)使该水溶液饱和,制备水相。然后,将所述水相和所述有机相加入同一反应容器中,并使其接触,制成二相系统。而且,在大气中,不进行加压及减压,在室温(约25℃)条件下,使用波长λ>290nm的氙气灯对所述二相系统进行光照。需要说明的是,光照中,所述二相系统分离为水层(水相)和有机层(有机相)两层,
保持该状态,不进行搅拌等。这样一来,制得所述基质(原料)、即烃的氧化反应产物。另外,光照结束之后,立刻对所述有机层(有机相)实施epr(electronic paramagnetic resonance,电子顺磁共振)测定。结果,与后述实施例8(第五发明的实施例)的图9的(b)同样地,观测到来自二氧化氯自由基clo2·
的峰。由此确认,在所述有机层(有机相)中生成了二氧化氯自由基clo2·
。
[0185]
实施例1~7各自中的溶剂(有机溶剂及水)、基质(原料)及酸的种类及使用量(浓度)和亚氯酸钠(naclo2)的使用量(浓度)示于下述表1及2。另外,氧化反应产物的收率及光照时间也一并示于下述表1及2。需要说明的是,下述表1及2中,“d”表示氘。实施例6中,苯(兼做基质及溶剂)使用芳香环上的六个氢全部被氘取代而成的氘化苯(苯d6)。另外,分别测定反应前的基质及反应后的氧化反应产物的1hnmr,并对比各成分的峰强度比,从而算出基质的转化率及氧化反应产物的收率。实施例4中,进一步分别分离并生成氧化反应产物,测定重量。需要说明的是,实施例4中,除下述表1中记载的乙酸及乙醇以外,检测到微量乙酸乙酯,推测乙酸乙酯是通过这些反应得到的物质。
[0186]
[表1]
[0187]
[表2]
[0188]
如实施例1~7所示,仅通过在大气中,常温、常压下进行光照,就可以由烃高效地制造醇、羧酸、酮、苯酚、醌等氧化反应产物。特别是,根据实施例2,仅通过在大气中,常温、常压下进行光照,就可以由甲烷高效地制造作为氧化反应产物的甲醇及甲酸。根据实施例1及3~5,仅通过在大气中,常温、常压下进行光照,就可以由乙烷高效地制造作为氧化反应产物的乙醇及乙酸。根据实施例7,仅通过在大气中,常温、常压下进行光照,就可以由环己烷高效地制造作为氧化反应产物的环己醇及环己酮。另外,在本实施例中,虽然使用氙气灯作为光源,但若使用阳光或led等作为光源,可以进一步节省能源及降低成本。
[0189]
另外,如实施例1~7所示,根据本发明,可以使用烃作为原料(基质),高效地制备工业利用价值极高的氧化反应产物。例如实施例2中得到的甲醇及甲酸、实施例1及3~5中得到的乙醇及乙酸均在燃料、溶剂、化工产品原料等各种用途中具有很高的利用价值。另外,实施例6中得到的羟基苯在药品、化工产品的原料等各种用途中具有很高的利用价值,对苯醌在氧化剂、脱氢剂、阻聚剂等用途中具有很高的利用价值。实施例7中得到的环己醇和环己酮的混合物通常被称为ka油(酮醇油)。ka油进一步氧化转化为己二酸,可以用作聚
酰胺树脂(商品名尼龙)的原料,因此工业利用价值极高。之前尚不存在可以像这样使用烃作为原料(基质),高效地获得工业利用价值极高的氧化反应产物的制造方法。即,根据本实施例,从工业利用价值的观点确认了本发明中的第一~第四发明相对于现有技术具有极大的优势。
[0190]
[第五发明的实施例]进而,对本发明中的第五发明的实施例进行说明。
[0191]
[实施例8]在本实施例中,确认了可以通过钪三氟甲磺酸酯和亚氯酸钠对苯乙烯进行高效的二羟基化。具体而言,在常温常压下,利用钪三氟甲磺酸酯和亚氯酸根离子(clo
2-)对苯乙烯进行二羟基化,可以高效地制造1-苯乙烷-1,2-二醇。确认了三氟甲基磺酸钪作为强路易斯酸起作用,使亚氯酸根离子(clo
2-)生成二氧化氯自由基(clo2·
),同时提高了二氧化氯自由基(clo2·
)的反应性。
[0192]
氧化烯烃制备1,2-二醇是重要的工业过程,用于在精细化工或特种化工中制造树脂、药品、染料、杀虫剂及香料组合物等各种化学物质的前体。目前已报道了使用无机金属氧络合物及重原子的金属氧化物将烯烃氧化转化为对应环氧化物及醇的数种方法。高原子价的osv
iii
o4是用于将烯烃转化为1,2-二醇的氧化的有效且具有选择性的试剂(参考文献等1~8[与非专利文献7~14相同])。但是,锇化合物的毒性及升华性和其废弃物会造成严重的问题。亚氯酸钠(naclo2)是无毒性且廉价的氧化试剂,一直被用作二氧化氯自由基(clo2·
)的前体(参考文献等9~12[与非专利文献15~18相同])。众所周知,clo2·
是具有反应性且稳定的自由基。但是,clo2·
在室温下是黄色的爆炸性气体。实验中,clo2·
可以通过naclo2的cl2氧化及氯酸钾(kclo3)和草酸进行反应而制得(参考文献等13)。另外,这些方法会引起cl2毒性及clo
3-爆炸性等严重的问题。尝试了使用naclo2作为clo2·
的前体对烯烃进行环氧化。但是,clo2·
的氧化能力在不存在酸的条件下不足以将烯烃氧化形成二醇,因此,未能得到1,2-二醇产物(参考文献等14~17)。clo2·
的cl=o双键的活化是一步且选择性地对烯烃进行二羟基化的关键所在。
[0193]
本实施例报道了如下合成法:通过将三氟甲基磺酸钪[sc(otf)3]作为路易斯酸(参考文献等18)对clo2·
进行活化,在常温常压下有效地合成苯乙烯的二羟基化物。二羟基化机理基于通过epr及uv-vis吸收分光法检测出自由基中间体而明确。
[0194]
在室温(25℃)、水性mecn溶液(mecn/h2o 1:1v/v)中,利用了通过naclo2(20mm)的苯乙烯(2.0mm)的反应中,未产生苯乙烯的二羟基化(参见图11)。需要说明的是,图11为使用1hnmr谱图测定用溶剂cd3cn/d2o(1:1v/v)作为mecn/h2o进行上述反应,并利用1hnmr对反应进行追踪的结果,它示出了反应开始0.3小时后及17小时后的1hnmr谱图。在温度增加至333k的情况下,未形成二羟基化产物,产生环氧化(图12)(参考文献等14,19)。需要说明的是,图12表示苯乙烯(66mm)及包含naclo2(200mm)的cd3cn/d2o(4:1v/v)混合后,在60℃(333k)下放置0小时及25小时之后的1hnmr谱图。*标记为来自苯乙烯氧化物的峰。相比之下,在添加作为布朗斯台德酸的cf3cooh(30mm)作为添加剂的情况下,混合17小时后,完全未形成环氧化物,反而分别以15%及69%的收率产生了1-苯乙烷-1,2二醇(1)及2-氯-1-苯基乙醇(2)[反应式(1)]。它们由1hnmr谱图测定(图13)(参考文献等20)。需要说明的是,图13表示苯乙烯(2.0mm)、包含naclo2(20mm)及sc(otf)3(30mm)的cd3cn/d2o(1:1v/v)混合后,
在25℃下放置0.6小时后及17小时后的1hnmr谱图。*标记及标记分别表示来自1-苯乙烷-1,2-二醇及2-氯-1-苯基乙醇的峰。需要说明的是,图14表示苯乙烯(2.0mm)、包含naclo2(20mm)及cf3cood(30mm)的cd3cn/d2o(1:1v/v)混合后,放置0.5小时及17小时之后的1hnmr谱图。*标记及标记分别为来自1-苯乙烷-1,2-二醇及2-氯-1-苯基乙醇的峰。另外,图18表示苯乙烯(2.0mm)、包含naclo2(6.0mm)及sc(otf)3(5.6mm)的cd3cn/d2o(1:1v/v)混合后,在ar气氛中,于25℃下放置0小时及45小时之后的1hnmr谱图。如图所示,在使用强效路易斯酸sc(otf)3(30mm)代替cf3cooh的情况下,二醇(1)的收率显著增加,达到51%[参见下述反应式(1)的表](图18)(参考文献等21)。
[0195]
[数学式1]
[0196]
为了明确反应机理及反应性中间体检测,而采用uv-vis吸收分光法。如图6所示,naclo2在水溶液中于260nm处显示出吸收带。如加入sc(otf)3(10mm),该吸收带消失,随之,新的吸收带在358nm处增大,该吸收带基于clo2·
鉴定(分配)(参考文献等22、23)。即使在cf3cooh存在下,也观察到了吸收谱图相同的变化(参考文献等24)。358nm处的吸收带的出现随时间的变化示于图6。图6为在298k的水溶液中与sc(otf)3(10mm)混合后,在0、4及16小时所采集的naclo2(5.0mm)的紫外线+可见光吸收光谱。该图中,横轴为波长(nm),纵轴为吸光度。另外,图7的(a)为与图6相同的反应(298k的水溶液(0.20m乙酸缓冲液ph2.9)中的sc(otf)3(10mm)和naclo2(5.0mm)进行反应,形成sc
3+
(clo2·
))在358nm处的uv-vis吸收的时间分布。该图中,横轴为时间(秒),纵轴为358nm处的吸光度。图7的(b)为图7的(a)的测定结果的二次作图。时间分布(图7的(a))与二次作图(图7的(b))完全吻合。这样一来,当使用sc(otf)3生成clo2·
时,双分子的clo
2-与限速步骤相关(下述参照)。由直线的斜率确定双分子的速率常数为0.16m-1
s-1
。
[0197]
在不存在基质下,也没有观察到358nm处的吸光度的任何衰减,该吸光度基于在298k下的mecn中使用sc(otf)3由naclo2所生成的clo2·
。图8的(a)为在298k的mecn/h2o(1:1v/v)溶液中,在苯乙烯(30~90mm)存在下,sc
3+
(clo2·
)的消耗在358nm处的uv-vis吸收的时间分布。该图中,横轴为时间(秒),纵轴为clo2·
浓度。(b)为准一阶速率常数相对于苯乙烯浓度的图表。在存在过剩量的苯乙烯时,衰减率依据准一阶(图8的(a))。关于二羟基增加所观察到的准一阶速率常数(k
obs
)随苯乙烯浓度的增加而线性增加(图8的(b))。clo2·
及苯乙烯的消耗的双分子速率常数确定为1.9
×
10-2
m-1
s-1
(参考文献等25)。为了明确自由基结构,实施epr(electronic paramagnetic resonance,电子顺磁共振)测定。将包含naclo2的mecn溶液在353k下回流1小时,制备纯clo2·
。冷却至298k之后,测定epr谱图,结果,在g=2.0151(
±
0.0002)下,发现了来自cl原子核的未成对电子的四根超精细线,同时发现了特
征性各向异性信号(在
35
cl及
37
cl中,i=3/2,分别具有0.821及0.683的相同磁矩(图9的(a))(参考文献等26)。g值通过添加cf3cooh(g=2.0106)及sc(otf)3(g=2.0103)而显著变化(图9的(b)及9(c))。(a(cl)=16.26g)cf3cooh(15.78g)及sc(otf)3(15.56g)存在下,clo2·
的超精细耦合常数降低(参考文献等27)。这说明,质子及sc
3+
与clo2·
键合,从而有效形成作为用于苯乙烯二羟基化的反应中间体的h
+
clo2·
及sc
3+
clo2(参考文献等28)。
[0198]
如图10所示,进行clo2·
、h
+
clo2·
及sc
3+
clo2·
的密度泛函理论(dft)计算,预测用于二羟基化的反应机理。利用理论计算的dft cam-b3lyp/6-311+g(d,p)水平进行结构优化。图10为通过cam-b3lyp/6-311+g(d,p)水平的理论计算得到的dft优化结构的键长(a)为clo2·
,(b)为h
+
clo2·
,(c)为sc
3+
clo2·
。算得clo2·
的cl-o双键的键长为(图10的(a))。算得h
+
clo2·
的cl-o双键的键长为(图10的(b))。图10的(c)表示:与clo2·
相比,sc
3+
clo2·
的键合强度也显著减弱cl-o键的断裂可能有助于在基质存在下生成作为强效氧化剂的clo
·
。需要说明的是,图15为表示(a)h
+
clo2·
及(b)sc
3+
clo2·
通过cam-b3lyp/6-311+g(d,p)水平的理论计算获得的自旋分布的图。
[0199]
基于上述结果,将利用clo2·
对苯乙烯进行二羟基化的机理示于反应式(2)~(5)及方案11。在h
+
或sc
3+
存在下,产生naclo2的歧化反应,形成clo-和clo
3-[反应式(2)](参考文献等29)。clo-容易与clo
2-及质子进行反应,生成cl2o2[反应式(3)]。接着,cl2o2被clo
2-还原,生成作为反应物种的clo2·
[反应式(4)]。总体化学计量由反应式(5)提供。clo2·
通过与h
+
及sc
3+
等酸键合而被活化。在与h
+
键合的情况下,基于dft计算(上述参照)未产生cl-o键的断裂。h
+
对苯乙烯的氧化通过向苯乙烯双键加成clo2·
而进行。与此相反,如方案11所示,通过sc
3+
clo2·
络合物的均裂sc
3+
cl-o键断裂,并对苯乙烯双键进行加成,从而通过sc
3+
对苯乙烯进行二羟基化。接着,钪络合物被水解,从而获得最终产物二醇和sc
3+
clo
·
(方案11)。sc
3+
clo
·
可以被大量过剩的clo
2-氧化从而形成sc
3+
clo2·
进行再利用。如反应式(2)所示,clo-也可以通过clo
2-再生。通过向苯乙烯的β碳加成由sc
3+
clo2·
的cl-o键断裂而形成的clo
·
,提供两个异构体。在形成了β碳-clo键的情况下,如方案11所示,作为最终次要产物,得到了氯化合物。
[0200]
[数学式2-5]clo-+clo
2-+2h
+
→
cl2o2+h2o
ꢀꢀꢀ
(3)cl2o2+clo
2-→
2clo2·
+cl-ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(4)4clo
2-+2h
+
→
2clo2
·
clo
3-+cl-+h2o
ꢀꢀꢀ
(5)
[0201]
[化学式s11]
[0202]
如上所示,根据本实施例确认了clo2·
作为sc
3+
存在下的路易斯酸,是一种用于苯乙烯的有效二羟基化试剂。根据本发明,可以提供不会产生重金属等有害废物的烯烃的独特的二羟基化路线。
[0203]
[参考文献等]1 m.schroeder,chem.rev.,1980,80,187-213.2 (a)e.n.jacobsen,i.marko,w.s.mungall,g.schroeder and k.b.sharpless,j.am.chem.soc.,1988,110,1968-1970;(b)s.g.hentges and k.b.sharpless,j.am.chem.soc.,1980,102,4263-4265.3 w.yu,y.mei,y.kang,z.hua and z.jin,org.lett.,2004,6,3217-3219.4 (a)a.j.delmonte,j.haller,k.n.houk,k.b.sharpless,d.a.singleton,t.strassner,and a.a.thomas,j.am.chem.soc.,1997,119,9907-9908.(b)j.s.m.wai,i.marko,j.s.svendsen,m.g.finn,e.n.jacobsen and k.b.sharpless,j.am.chem.soc.,1989,111,1123-1125.5 (a)s.kobayashi,m.endo and s.nagayama,j.am.chem.soc.,1999,121,11229-11230;(b)s.kobayashi,t.ishida and r.akiyama,org.lett.,2001,3,2649-2652.6 h.c.kolb,p.g.andersson and k.b.sharpless,j.am.chem.soc.,1994,116,1278-1291.7 e.j.corey and m.c.noe,j.am.chem.soc.,1996,118,11038-11053.8 s.y.jonsson,k.faernegrdh and j.-e.baeckvall,j.am.chem.soc.,2001,123,1365-1371.9 h.dodgen and h.taube,j.am.chem.soc.,1949,71,2501-2504.10 j.k.leigh,j.rajput,and d.e.richardson,inorg.chem.,2014,53,6715-6727.
11 c.l.latshaw,tappi,1994,163-166.12 (a)j.j.leddy,in riegel’s handbook of industrial chemistry,8
th edn.ed.,j.a.kent,van nostrand reinhold co.inc,new york,1983,pp.212-235;(b)i.fabian,coord.chem.rev.,2001,216-217,449-472.13 m.j.masschelen,j.am.works assoc.,1984,76,70-76.14 x.-l.geng,z.wang,x.-q.li,and c.zhang j.org.chem.,2005,70,9610-961315 a.jangam and d.e.richardson,tetrahedron lett.,2010,51,6481-6484.16 j.j.kolar and b.o.lindgren,acta chem.scand.b,1982,36,599-605.17 b.o.lindgren,t.nilsson,acta chem.scand.b,1974,28,847-852.18 (a)s.fukuzumi and k.ohkubo,j.am.chem.soc.,2002,124,10270-10271;(b)s.fukuzumi and k.ohkubo,chem.-eur.j.,2000,6,4532-4535.19 在mecn/h2o(4:1v/v)混合溶液中,于333k下,调查naclo2(200mm)引起的苯乙烯(66mm)的环氧化(参考文献等14)。苯乙烯氧化物的收率为44%,苯乙烯的转化率为61%。20 e.v.bakhmutova-albert,d.w.margerum,j.g.auer and b.m.applegate,inorg.chem.,2008,47,2205-2211.21 通过1hnmr确认,在利用cf3cooh或sc(otf)3的反应中,未观察到作为中间体的苯乙烯环氧化物。22 c.rav-acha,e.choushen(goldstein)and s.sarel,helv.chim.acta,1986,69,1728-1733.23 在clo2·
水溶液中,由乙酸酐和naclo2生成(参考文献等22)。clo2·
可能为质子化形式(h
+
clo2·
)。24 w.masschelein,ind.eng.chem.prod.res.devel.,1967,6,137-142.25 该数值稍大于利用clo2·
使苯乙烯向环氧化物转化(1.17
×
10-2
m-1
s-1
)(参考文献等10)。26 (a)t.ozawa and t.kwan,chem.pharm.bull.,1983,31,2864-2867;(b)t.ozawa,t.trends org.chem.,1991,2,51-58.27 sc
3+
clo2·
和h
+
clo2·
的自旋分布的计算值示于图10。由此,sc及h核未显示自旋密度。这表示,epr谱图未示出来自sc(i=7/2)或h(i=1/2)的超精细分裂。28 关于sc
3+
和金属氧络合物的氧代基的键合,请参考下述内容:(a)j.chen,x.wu,k.m.davis,y.-m.lee,m.s.seo,k.-b.cho,h.yoon,y.j.park,s.fukuzumi,y.n.pushkar and w.nam,j.am.chem.soc.,2013,135,6388-6391;(b)h.yoon,y.-m.lee,x.wu,k.-b.cho,y.n.pushkar,w.nam and s.fukuzumi,j.am.chem.soc.,2013,135,9186-9194;(c)s.fukuzumi,k.ohkubo,y.-m.lee and w.nam,chem.-eur.j.,2015,21,17548-17559.29 关于sc
3+
引起的中性自由基的歧化,请参考i.nakanishi,t.kawashima,k.ohkubo,t.waki,y.uto,t.kamada,t.ozawa,k.matsumoto and s.fukuzumi,s.chem.commun.,2014,50,814-816.。
[0204]
[实施例9]在本实施例中,确认了路易斯酸对naclo2的歧化反应的加速效果。
[0205]
正如实施例8中也已经确认,亚氯酸钠(naclo2)在中性水溶液/乙腈混合溶液中非常稳定,因此完全未观察到分解。若向该20mm溶液中添加sc(otf)3(40mm),则随着naclo2的吸收带的衰减,立刻在358nm处观察到clo2自由基(clo2·
)的特征吸收带增大(图16)。该图中,横轴为波长(nm),纵轴为吸光度。正如实施例8(图6)中已确认,当sc(otf)3的浓度减小时可以观察到该吸收带随时间的变化而增大。对路易斯酸度低于钪离子的镁离子及锂离子等也进行了相同的探讨,并分别确定了反应速率常数。一直以来,大家都知道路易斯酸可以催化各种歧化反应,在本反应中,也可以认为,通过相同的机理,根据实施例8的反应式(2),将clo
2-歧化为clo-和clo
3-。然后,所生成的clo-在酸存在下与大量过剩存在的clo
2-反应,从而提供cl2o2(实施例8的反应式(3))。然后,cl2o2进一步与clo
2-反应,从而提供作为活性自由基物种的clo2自由基(实施例8的反应式(4))。
[0206]
[参考例1]本参考例确认了使用路易斯酸并利用naclo2使基质进行氧化的反应也适用于由三苯基膦向三苯基氧化膦的氧化反应。更具体而言,确认了在作为路易斯酸的三氟甲基磺酸钪sc(otf)3存在下及不存在下,利用naclo2进行从三苯基膦向三苯基氧化膦的氧化反应,路易斯酸促进了反应。
[0207]
首先,按照下述条件,在sc(otf)3存在下或不存在下,在常温常压(无光照)下进行反应,利用紫外可见光吸收光谱追踪反应。图19的(a)的紫外可见光吸收光谱表示三苯基膦通过时间的变化而转化为三苯基氧化膦的情况。该图中,横轴为波长(nm),纵轴为吸光度。另外,图19的(b)的图形表示在sc(otf)3(sc
3+
)存在下及不存在下,三苯基膦(ph3p)浓度随时间的变化。横轴为时间(秒),纵轴为三苯基膦(ph3p)浓度(mm)。如图所示,由该曲线算出的反应速率常数k在sc
3+
不存在下为9.8
×
10-4
s-1
,而在sc
3+
存在下增大至1.7
×
10-3
s-1
,因此确认了sc
3+
(路易斯酸)促进反应。[ph3p]=0.4mm[naclo2]=0.4mmsc(otf)3=0或10mm0.12m乙酸缓冲液ph5.3mecn/h2o(4:6)
[0208]
另外,即使在脱氧乙腈mecn/h2o(0.9ml/0.1ml)中混合三苯基膦和naclo2(4.0mm),反应也完全未进行。向其中添加三氟甲基磺酸钪sc(otf)3(30mm)之后,有效提供氧化产物。将三苯基膦的初期浓度变为1.0mm、2.0mm、4.0mm及8.0mm,分别在25℃下进行所述反应15分钟。利用紫外可见光吸收光谱的谱图变化追踪反应(图17的(a))。图17的(a)中,横轴为波长(nm),纵轴为吸光度。认为这是因为,通过钪离子sc
3+
产生作为活性自由基物种的clo2自由基,ph3p向ph3p=o氧化。化学计量如下述反应式(6)所示,确认了反应基本定量进行(图17的(b))。图17的(b)中,横轴为ph3p的初期浓度,纵轴为所生成的ph3p=o的浓度。2ph3p+naclo2‑‑
》2ph3p=o+nacl
ꢀꢀꢀꢀꢀꢀ
(6)工业实用性
[0209]
[第一发明的工业实用性]如上所述,根据本发明中的第一发明的制造方法,可以以烃或其衍生物为原料,高效地制造所述烃或其衍生物的氧化反应产物。根据本发明中的第一发明,例如通过仅进行
光照这样极其简单的方法,即使在常温及常压等极其温和的条件下,也可以高效地将烃或其衍生物转化为氧化反应产物。并且,根据本发明中的第一发明,例如也可以以所述烃或其衍生物为原料,高效地获得醇、羧酸、酮、苯酚、醌等工业利用价值极高的氧化反应产物。目前,不能以烃为原料高效地获得这些氧化反应产物,因此很难将天然气等烃作为原料有效利用。与此相对,根据本发明中的第一发明,可以将天然气等烃作为原料有效利用。因此,根据本发明中的第一发明,过去只能以石油等为原料合成的化合物也可以以天然气等为原料非常简单且高效地合成,因此,可以对能源问题等做出巨大贡献。而且,根据本发明中的第一发明,例如也可以不使用有毒的重金属催化剂等而获得所述原料(烃或其衍生物)的氧化反应产物。由此,也可以通过可以在如上所述那样常温及常压等极其温和的条件下进行反应且环境负担非常小的方法高效地获得所述氧化反应产物。这样一来,本发明中的第一发明的工业实用性巨大。
[0210]
[第二发明的工业实用性]如上所述,根据本发明中的第二发明的制造方法,可以以甲烷为原料,高效地制造甲烷的氧化反应产物。根据本发明中的第二发明,例如通过仅进行光照这样极其简单的方法,即使在常温及常压等极其温和的条件下,也可以高效地将甲烷转化为氧化反应产物。而且,根据本发明中的第二发明,例如也可以以所述甲烷为原料,高效地获得甲醇、甲酸、甲醛及甲基过氧化氢等工业利用价值极高的氧化反应产物。目前,不能以甲烷为原料高效地获得这些氧化反应产物,很难将天然气等甲烷作为原料有效利用。与此相对,根据本发明中的第二发明,可以将天然气等甲烷作为原料有效利用。因此,根据本发明中的第二发明,过去只能以石油等为原料合成的化合物也可以以天然气等为原料非常简单且高效地合成,因此,可以对能源问题等做出巨大贡献。而且,根据本发明中的第二发明,例如也可以不使用有毒重金属催化剂等而获得所述甲烷的氧化反应产物。由此也可以通过可以在如上所述那样常温及常压等极其温和的条件下进行反应且环境负担非常小的方法高效地获得所述氧化反应产物。这样一来,本发明中的第二发明的工业实用性巨大。
[0211]
[第三发明的工业实用性]如上所述,根据本发明中的第三发明的制造方法,可以以乙烷为原料,高效地制造所述乙烷的氧化反应产物。根据本发明中的第三发明,例如通过仅进行光照这样极其简单的方法,即使在常温及常压等极其温和的条件下,也可以高效地将烃或其衍生物转化为氧化反应产物。并且,根据本发明中的第三发明,例如也可以以乙烷为原料,高效地获得乙醇、乙酸、乙醛、乙基过氧化氢等工业利用价值极高的氧化反应产物。目前,不能以烃为原料高效地获得这些氧化反应产物,因此很难将天然气等烃作为原料有效利用。与此相对,根据本发明中的第三发明,可以将天然气等烃所含的乙烷作为原料有效利用。因此,根据本发明中的第三发明,过去只能以石油等为原料合成的化合物也可以以天然气等所含的乙烷为原料非常简单且高效地合成,因此,可以对能源问题等做出巨大贡献。而且,根据本发明中的第三发明,例如也可以不使用有毒的重金属催化剂等而获得所述乙烷的氧化反应产物。由此,也可以通过可以在如上所述那样常温及常压等极其温和的条件下进行反应且环境负担非常小的方法高效地获得所述氧化反应产物。这样一来,本发明中的第三发明的工业实用性巨大。
[0212]
[第四发明的工业实用性]
如上所述,根据本发明中的第四发明的制造方法,可以以环己烷为原料,高效地制造所述环己烷的氧化反应产物。根据本发明中的第四发明,例如通过仅进行光照这样极其简单的方法,即使在常温及常压等极其温和的条件下,也可以高效地将环己烷转化为氧化反应产物。并且,根据本发明中的第四发明,例如也可以以所述环己烷为原料,高效地获得环己醇、环己酮、环己烷过氧化氢、开环氧化物(例如己二酸等)等工业利用价值极高的氧化反应产物。目前,不能以烃为原料高效地获得这些氧化反应产物。与此相对,根据本发明中的第四发明,可以将环己烷作为原料有效利用。因此,根据本发明中的第四发明,可以对能源问题等做出巨大贡献。而且,根据本发明中的第四发明,例如也可以不使用有毒的重金属催化剂等而获得环己烷的氧化反应产物。由此,也可以通过可以在如上所述那样常温及常压等极其温和的条件下进行反应且环境负担非常小的方法高效地获得所述氧化反应产物。这样一来,本发明中的第四发明的工业实用性巨大。
[0213]
[第五发明的工业实用性]如上所述,根据本发明中的第五发明的烯烃的氧化反应产物的制造方法,可以在温和的条件下进行反应。由于本发明中的第五发明的烯烃的氧化反应产物的制造方法可以在温和的条件下进行反应,因此,成本低,反应容易控制,可以用于广泛的用途。
[0214]
本发明涉及以下的技术方案:1、一种氧化反应产物的制造方法,其特征在于,其包含反应工序,所述反应工序在原料及二氧化氯自由基的存在下对反应系统进行光照,所述原料为烃或其衍生物,所述反应系统为包含有机相的反应系统,所述有机相包含所述原料及所述二氧化氯自由基,在所述反应工序中,通过所述光照,所述原料被氧化,从而生成所述原料的氧化反应产物。2、根据项1所述的制造方法,其中,在所述反应工序中,至少对所述有机相进行光照。3、根据项1或2所述的制造方法,其中,所述制造方法进一步包含生成所述二氧化氯自由基的二氧化氯自由基生成工序。4、根据项1或2所述的制造方法,其中,所述反应系统为进一步包含水相的二相反应系统。5、根据项4所述的制造方法,其中,所述制造方法进一步包含生成所述二氧化氯自由基的二氧化氯自由基生成工序,在所述二氧化氯自由基生成工序中,所述水相包含所述二氧化氯自由基的产生源,由所述二氧化氯自由基的产生源生成所述二氧化氯自由基。6、根据项5所述的制造方法,其中,在所述二氧化氯自由基生成工序中,所述二氧化氯自由基的产生源为亚氯酸根离子(clo
2-),使路易斯酸及布郎斯台德酸中的至少一者作用于所述亚氯酸根离子,生成所述二氧化氯自由基。7、根据项4~6中任一项所述的制造方法,其中,所述反应工序后,进一步包含所述氧化反应产物的回收工序,
所述回收工序为从所述反应系统中回收包含所述氧化反应产物的所述水相的工序。8、根据项4~7中任一项所述的制造方法,其中,在所述反应工序中,在所述水相溶解有氧(o2)的状态下进行光照。9、根据项1~8中任一项所述的制造方法,其中,在温度为0~40℃、压力为0.1~0.5mpa的气氛下进行。10、根据项1~9中任一项所述的制造方法,其中,所述有机相包含有机溶剂,所述有机溶剂为烃溶剂。11、根据项1~9中任一项所述的制造方法,其中,所述有机相包含有机溶剂,所述有机溶剂为卤化溶剂。12、根据项1~9中任一项所述的制造方法,其中,所述有机相包含有机溶剂,所述有机溶剂为氟溶剂。13、根据项1~12中任一项所述的制造方法,其中,所述原料为甲烷。14、根据项13所述的制造方法,其中,所述氧化反应产物包含选自由甲醇、甲酸、甲醛及甲基过氧化氢构成的组中的至少一种。15、根据项1~12中任一项所述的制造方法,其中,所述原料为乙烷。16、根据项15所述的制造方法,其中,所述氧化反应产物包含选自由乙醇、乙酸、乙醛及乙基过氧化氢构成的组中的至少一种。17、根据项1~12中任一项所述的制造方法,其中,所述原料为环己烷。18、根据项1~9中任一项所述的制造方法,其中,所述原料为环己烷,所述有机相包含有机溶剂,所述环己烷兼做所述氧化反应产物的原料和所述有机溶剂。19、根据项17或18所述的制造方法,其中,所述氧化反应产物包含选自由环己醇、环己酮、环己烷过氧化氢及开环氧化物构成的组中的至少一种。20、根据项19所述的制造方法,其中,所述开环氧化物为己二酸。21、一种烯烃的氧化反应产物的制造方法,其特征在于,其包含:自由基产生工序,所述自由基产生工序使路易斯酸及布郎斯台德酸中的至少一者和自由基产生源作用,从而产生自由基;和氧化反应工序,所述氧化反应工序将所述自由基作为氧化剂对烯烃进行氧化。22、根据项21所述的制造方法,其中,所述路易斯酸的路易斯酸度为0.4ev以上。
23、根据项21或22所述的制造方法,其中,所述路易斯酸包含金属离子。24、根据项21或22所述的制造方法,其中,所述路易斯酸为选自由碱土金属离子、稀土类离子、mg
2+
、sc
3+
、li
+
、fe
2+
、fe
3+
、al
3+
、硅酸根离子及硼酸根离子构成的组中的至少一种。25、根据项21或22所述的制造方法,其中,所述路易斯酸为选自由alcl3、almecl2、alme2cl、bf3、bph3、bme3、ticl4、sif4及sicl4构成的组中的至少一种。26、根据项21~25中任一项所述的制造方法,其中,所述布郎斯台德酸的酸解离常数pka为5以上。27、根据项21~26中任一项所述的制造方法,其中,所述自由基产生源包含含氧酸。28、根据项27所述的制造方法,其中,所述含氧酸为选自由硼酸、碳酸、原碳酸、羧酸、硅酸、亚硝酸、硝酸、亚磷酸、磷酸、砷酸、亚硫酸、硫酸、磺酸、亚磺酸、铬酸、重铬酸、高锰酸及卤素含氧酸构成的组中的至少一种。29、根据项28所述的制造方法,其中,所述卤素含氧酸为选自由次氯酸、亚氯酸、氯酸、高氯酸、次溴酸、亚溴酸、溴酸、高溴酸、次碘酸、亚碘酸、碘酸及高碘酸构成的组中的至少一种。30、根据项21~26中任一项所述的制造方法,其中,所述自由基产生源包含选自由卤素离子、次卤酸根离子、亚卤酸根离子、卤酸根离子及高卤酸根离子构成的组中的至少一种。31、根据项27所述的制造方法,其中,所述含氧酸为卤素含氧酸或其盐。32、根据项31所述的制造方法,其中,所述卤素含氧酸为氯含氧酸。33、根据项27所述的制造方法,其中,所述含氧酸包含亚氯酸根离子。34、根据项21~33中任一项所述的制造方法,其中,所述烯烃为芳香族烯烃。35、根据项34所述的制造方法,其中,所述芳香族烯烃为苯乙烯。36、根据项21~33中任一项所述的制造方法,其中,所述烯烃为选自由乙烯、丙烯、苯乙烯及丁二烯构成的组中的至少一种。37、根据项21~36中任一项所述的制造方法,其中,所述氧化反应产物为环氧化物及二醇中的至少一者。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1