利用从全血中分离的血浆和血球的氨基酸的制备方法与流程
1.本发明涉及利用从全血中分离的血浆和血球的氨基酸的制备方法。
背景技术:
2.在21世纪的人类的饮食环境中,作为食用手段的家畜和家禽类及鱼类的种类和个体数随着肉类消费的持续增长而呈现出爆发性增长的趋势。因此,作为食用消费最多的猪和牛的屠宰过程中产生的废弃血液在全球上一年可达1500万吨,如果包括家禽类和鱼类的血液,则实际产生非常庞大的废弃血液。只有这些废弃血液的5~10%左右被再利用为食用、饲料、医药品原料等,大部分以海洋处置方式进行废弃,但从2013年开始,根据用于防止海洋污染的伦敦公约,国际上全面禁止海洋处置,因此各国不仅为了陆上处理花费大量费用,而且在处理过程中产生大量的二次废弃物,因此废弃血液成为了严重的环境污染源。
3.屠宰血液除了约78~79%的水分外,由血浆(plasma)和血球(blood corpuscle)构成的蛋白质(protein)占约18%,脂肪(fat)占约0.9%,碳水化合物(carbohydrate)、矿物质(minerals)、维生素(vitamins)占约1.8%等,由潜在价值相当高的优质营养物质构成,如果确保在不废弃其的情况下能够扩大再利用的高性价比的相关技术和工艺,则将成为资源的再利用的模范事例。
4.可以再利用屠宰血液的技术性关键要素是将占全血大部分的作为高分子有机物的蛋白质(protein)分解成利用价值高的作为低分子有机物的氨基酸(amino acid),在现有技术中,只能制备将全血简单加热干燥的血粉蛋白质或将全血用血液专用离心分离机只分离出血浆(血清)并加热干燥的血浆(血清)蛋白质等,或者制备通过适用强酸或强碱的化学方式分解的氨基酸,但这些大部分的现有技术存在很多问题,例如高价的设备、过多的处理费用、质量降低、大量产生二次废弃物等,并且,屠宰血液被认为是产生腐败和污染的厌恶物质,因此相关研究和开发仍处于停止不前的状态。
5.作为再利用屠宰血液的现有技术,韩国专利授权公报第10-1390516(2014年4月23日)的“利用动物废弃血液的高浓度氨基酸组合物及其制备方法”中的有关将屠宰废弃血液的全血使用有机酸等进行一次ph校正和沉淀,使用氢氧化钠进行二次ph校正,对校正的蛋白质进行酶处理、杀菌处理等,韩国专利授权公报第10-1502376(2015年3月9日)的“利用屠宰血液的氨基酸液体肥料和蛋白质干燥饲料的制备装置”中的有关将屠宰血液的全血的血球细胞粉碎处理、超声波预处理、酶分解、固液分离、微波照射等,但查看上述的现有文献,在将屠宰血液进行酶分解处理上,为了破碎蛋白质含量最高的血球的细胞膜,因复杂的制备工艺和非效率性等,依旧在再利用上表现一定的局限性,因此,目前迫切需要可在短时间内提高由屠宰血液转化为氨基酸转化率的低成本、高效率结构的进一步的技术和工艺,如有效的血球细胞破碎等。
6.现有技术文献
7.专利文献
8.专利文献1:韩国专利授权公报第10-1390516(授权日:2014年4月23日)
9.专利文献2:韩国专利授权公报第10-1502376(授权日:2015年3月9日)
技术实现要素:
10.本发明为了解决如上所述的现有技术中的问题而提出,其目的在于,提供一种在从全血制备氨基酸时可以在短时间内提高氨基酸转化率的低成本、高效率的氨基酸的制备方法。
11.本发明提供一种氨基酸的制备方法,包括:步骤a),通过离心分离将家畜、家禽类及鱼类的全血分离成血浆和血球;步骤b),将在步骤a)中分离的血浆输送至血浆水解罐,将血浆的温度调整为45℃至65℃,将ph校正为4.5至10.5,添加血浆水解酶,将作为高分子有机物的血浆水解成作为低分子有机物的血浆氨基酸;步骤c),将在步骤a)中分离的血球输送至血球水解罐,添加低渗溶液,通过由渗透压原理产生的溶血作用破坏血球的细胞膜,将细胞膜被破坏的上述血球的温度调整为45℃至65℃,将ph校正为4.5至10.5,添加血球水解酶,将作为高分子有机物的血球水解成作为低分子有机物的血球氨基酸;步骤d),分别将水解的上述血浆氨基酸和血球氨基酸过滤来去除异物;步骤e),分别将过滤的上述血浆氨基酸和血球氨基酸输送至血浆氨基酸储存罐和血球氨基酸储存罐;以及步骤f),分别向上述血浆氨基酸储存罐和血球氨基酸储存罐中添加杀菌剂。
12.上述血浆水解酶和血球水解酶可以分别包含蛋白酶。
13.上述血浆水解酶和血球水解酶还可以分别包含选自脂肪酶、多糖酶及纤维素酶中的一种以上。
14.在上述血浆水解罐和血球水解罐中进行ph校正的情况下,当进行酸化时,可以使用选自柠檬酸(c6h8o7)及乙酸(c2h4o2)中的一种以上,当进行碱化时,可以使用选自氢氧化钠(naoh)及氢氧化钾(koh)中的一种以上。
15.添加到上述血浆氨基酸储存罐和血球氨基酸储存罐的杀菌剂可以为选自氯化钠(nacl)、碳酸氢钠(nahco3)及木醋液中的一种以上。
16.添加到上述血浆氨基酸储存罐和血球氨基酸储存罐的杀菌剂还可以包含选自添加浓度为0.01%w/w至2%w/w的南瓜叶热水提取物及红毛丹壳乙醇提取物中的一种以上。
17.发明的效果
18.根据本发明的氨基酸的制备方法,将全血分离成血浆和血球来使用,并通过溶血(hemolysis)作用破坏血球的细胞膜来使用,从而可以在短时间内提高氨基酸转化率,因此可以制备低成本且高效率的氨基酸。
19.并且,本发明通过不废弃具有相当高的潜在价值的屠宰血液并扩大再利用,从而可以提供食粮增产、安全食品、土壤改良、环境保护等有用的效果。
附图说明
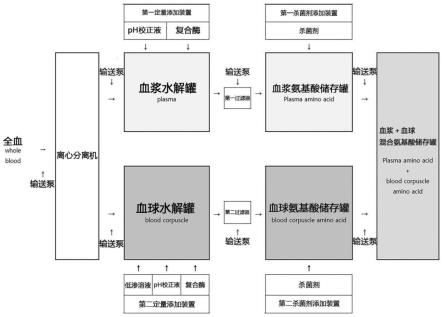
20.图1为根据本发明一实施例的将全血分离成血浆和血球来制备成氨基酸的整个系统的框图。
21.图2为根据本发明一实施例的将全血分离成血浆和血球来制备成氨基酸的整个系统的剖视图。
22.图3为将图2中使用的用于分离血浆和血球的离心分离机部分放大示出的简图。
23.图4为将图2中使用的用于向血浆水解罐定量提供ph校正液和水解酶的第一定量添加装置部分放大示出的剖视图。
24.图5为将图2中使用的用于向血球水解罐定量提供低渗溶液、ph校正液及水解酶的第二定量添加装置部分放大示出的剖视图。
具体实施方式
25.以下详细说明本发明。
26.本发明涉及一种氨基酸的制备方法和用于上述制备方法的系统,在该方法中,将作为高分子有机物的全血分离成血浆和血球来制备成作为低分子有机物的氨基酸。
27.上述氨基酸的制备方法的特征在于,首先,将在屠宰现场产生的家畜、家禽类及鱼类等的全血使用离心分离机分离成血浆和血球。将输送至血浆水解罐的血浆加热至适合激活水解酶的温度,并校正ph后,添加血浆水解酶进行水解,得到优质的血浆氨基酸。向输送至血球水解罐的血球中适当添加低渗溶液(hypotonic),并将作为水解酶激活的障碍因素的血球细胞膜通过由渗透压原理产生的溶血(hemolysis)作用破坏后,加热至适合激活水解酶的温度,并校正ph后,添加血球水解酶进行水解,得到优质的血球氨基酸。并且,分别对为了去除异物而经过过滤器的血浆氨基酸和血球氨基酸进行杀菌处理后储存(使用),以防止腐败等变质,或者根据需要将它们混合后储存(使用)。
28.上述的屠宰血液的全血大致划分为血浆和血球,作为液体成分的血浆(plasma)由白蛋白(albumin)、球蛋白(globulin)、纤维蛋白原(fibrinogen)等组成,作为细胞成分的血球(blood corpuscle)由红细胞(red blood cell)、白细胞(white blood cell)、血小板(blood platelet)等组成。具体成分结构要素如下表1所示。
29.表1
[0030][0031]
本发明的氨基酸的制备方法可以使用如图2所示的氨基酸制备系统来执行,具体地,上述氨基酸制备系统的特征在于,包括:离心分离装置10,将家畜、家禽类及鱼类的全血离心分离;血浆水解罐12,包括第一间接加热器12-1和第一定量添加装置18,在上述离心分离装置中分离的血浆输送至血浆水解罐12;血球水解罐13,包括第二间接加热器13-1和第二定量添加装置19,在上述离心分离装置中分离的血球输送至血球水解罐13;第一过滤器17,将在上述血浆水解罐12中水解的血浆氨基酸进行过滤;第二过滤器17-1,将在上述血球水解罐13中水解的血球氨基酸进行过滤;血浆氨基酸储存罐14,包括第一杀菌剂添加装置20,在上述第一过滤器中过滤的血浆氨基酸输送至血浆氨基酸储存罐14;以及血球氨基酸储存罐15,包括第二杀菌剂添加装置21,在上述第二过滤器中过滤的血球氨基酸输送至血
球氨基酸储存罐15。
[0032]
在本发明的一实施方式中,上述离心分离装置10与血浆水解罐12、离心分离装置10与血球水解罐13、上述血浆水解罐12与第一过滤器17、上述血球水解罐13与第二过滤器17-1、上述第一过滤器17与血浆氨基酸储存罐14以及上述第二过滤器17-1与血球氨基酸储存罐15可以各自通过输送管相连接。
[0033]
在本发明的一实施方式中,在上述离心分离装置10与血浆水解罐12之间的输送管、在离心分离装置10与血球水解罐13之间的输送管、在上述血浆水解罐12与第一过滤器17之间的输送管、在上述血球水解罐13与第二过滤器17-1之间的输送管可以各自具备输送泵。
[0034]
在本发明的一实施方式中,上述血浆水解罐12、上述血浆氨基酸储存罐14、上述血球水解罐13以及血球氨基酸储存罐15还可以包括为了将从各个罐中排出的产物进行再处理而使产物返回至原来的罐的循环管道24。
[0035]
在本发明的一实施方式中,各个上述循环管道24与用于将产物从各个罐输送至下一个步骤的输送管道的一端部相连通,另一端部与各个罐相连接,可在上述输送管道和循环管道的连接部设有阀门,该阀门用于使输送管道与循环管道相连通并阻断输送管道或者用于阻断输送管道与循环管道的连接。
[0036]
在本发明的一实施方式中,还可以包括低渗溶液供给罐,通过上述血球水解罐13的第二定量添加装置19供给低渗溶液。
[0037]
在本发明的一实施方式中,上述血球水解罐13可以利用从上述低渗溶液供给罐供给的低渗溶液起到通过由渗透压原理产生的溶血作用破坏血球细胞膜的作用。
[0038]
在本发明的一实施方式中,还可以包括混合氨基酸储存罐16,用于将从上述血浆氨基酸储存罐12和血球氨基酸储存罐13输送的血浆氨基酸和血球氨基酸混合并储存。
[0039]
在本发明的一实施方式中,上述第一杀菌剂添加装置20和第二杀菌剂添加装置21可以添加选自山梨酸钾、苯甲酸钠及水杨酸中的一种以上的食品添加剂作为杀菌剂。
[0040]
在本发明的一实施方式中,上述第一杀菌剂添加装置和第二杀菌剂添加装置还可以添加选自氯化钠(nacl)、碳酸氢钠(nahco3)、木醋液、南瓜叶热水提取物及红毛丹壳乙醇提取物中的一种以上作为杀菌剂。
[0041]
上述离心分离装置10作为利用离心力的装置,若添加屠宰血液的全血并高速旋转驱动电机,则可以通过比重差将全血分离成血浆和血球。在产业上,优选使用可以大量分离血浆和血球的连续式离心分离机。
[0042]
并且,通过上述第一定量添加装置18和第二定量添加装置19添加到血浆水解罐12和血球水解罐13的ph校正液用于将ph7.2~7.3的血浆和血球校正为对不同种类水解酶的激活最佳的ph4.5~10.5范围内,更优选地,校正为ph5.5~9.5范围内,因此,当进行酸化时,通常可使用柠檬酸(c6h8o7)、乙酸(c2h4o2)等作为校正液,当进行碱化时,通常可使用氢氧化钠(naoh)、氢氧化钾(koh)等作为校正液。
[0043]
通过上述第二定量添加装置19添加到血球水解罐的低渗溶液(hypotonic)为所溶解的物质比血球细胞更少的溶液的总称,其用于将作为水解酶激活的障碍因素的血球细胞膜通过由渗透压原理产生的溶血(hemolysis)作用破坏,通常可以适用比血球细胞液的浓度0.9%更低浓度的蒸馏水、自来水等,以100%v/v的血球为基准,用于破坏细胞膜的低渗
溶液的使用量可以为50~300%v/v(以蒸馏水为基准),更优选地,可以为80~250%v/v。
[0044]
上述第一杀菌剂添加装置20和第二杀菌剂添加装置21为了添加杀菌剂而使用。上述杀菌剂用于防止水解完的血浆氨基酸和血球氨基酸的腐败等变质并保持质量,可以使用选自用作食品添加剂的山梨酸钾、苯甲酸钠、水杨酸等中的一种以上。可以包含0.01~0.45%w/v的上述杀菌剂,更优选地,可以包含0.05~0.35%w/v的上述杀菌剂。
[0045]
并且,根据血浆氨基酸和血球氨基酸的用途和功能,可以使用氯化钠(nacl)、碳酸氢钠(nahco3)、木醋液等,氯化钠(nacl)的使用范围可以为5~30%w/v,更优选地,可以为10~20%w/v,碳酸氢钠(nahco3)的使用范围可以为0.5~5%w/v,更优选地,可以为1~4%w/v,木醋液的使用范围可以为10~60%v/v,更优选地,可以15~40%v/v,根据需要也可以将这些按适当的比例混合使用。
[0046]
通过根据附图说明的实施例可以充分理解本发明的特征。本发明可根据有机物的种类和规模等实际情况以多种不同形式实现,不仅限于这里说明的实施例。并且,优选地,为了说明本发明的特征,为了帮助理解说明书的结构要素而所标注的符号或单词并不限于词典上的意义,而是扩大解释为本发明所期望的技术概念。
[0047]
本发明涉及将全血分离成血浆和血球来制备成氨基酸的方法和系统,参照图1至图5进行更详细的说明。
[0048]
首先,为了实现本发明的具体实施例,适用于预处理的离心分离装置10为通过离心力和比重差分离混合液的成分的装置,将全血分离成血浆和血球的基本原理为,利用驱动部10-1和旋转体10-2将添加的全血进行高速旋转来施加强的离心力,使血浆(比重为1.02~1.03)和血球(比重为1.09~1.10)通过比重差分离。更优选地,比重越大,施加的离心力越大,因此,使血浆向内分离,血球向外分离。并且,将全血分离成血浆和血球的离心分离机的最佳旋转速度为10000rpm。需要注意,如果超过10000rpm会发生血球细胞的破碎现象,因此会降低效率性。
[0049]
并且,血浆水解罐12具备可以保持适当温度的第一间接加热器12-1、可以搅拌并混合内容物的第一搅拌器12-2以及可通过第一定量泵18定量添加ph校正液和水解酶的第一定量添加装置等,并形成用于水解通过第一输送泵11-1添加的血浆的各项条件。
[0050]
并且,血球水解罐13也具备可以保持适当温度的第二间接加热器13-1、可以搅拌并混合内容物的第二搅拌器13-2以及可通过第二定量泵19定量添加低渗溶液、ph校正液及水解酶的第二定量添加装置等,并形成用于水解通过第二输送泵11-2添加的血球的各项条件。
[0051]
其中,第一间接加热器12-1和第二间接加热器13-1为在三重结构罐的中间层内置加热棒而可以间接加热内容物的装置,由于热损失少,且容易控制温度,常用做独立的供热源。
[0052]
其中,将作为水解酶激活的重要要素的温度设定为45~65℃,更优选地,设定为50~60℃,将第一搅拌器12-2和第二搅拌器13-2的搅拌速度设定为60~360rpm,更优选地,设定为90~180rpm。
[0053]
其中,在第一定量添加装置和第二定量添加装置中的ph校正液用于将ph7.2~7.3范围内的血浆和血球校正为对为了水解而添加的不同种类水解酶最佳的ph4.5~10.5范围内,更优选地,校正为ph5.5~9.5范围内,当进行酸化时,通常使用柠檬酸(c6h8o7)、乙酸
(c2h4o2)等,当进行碱化时,通常使用氢氧化钠(naoh)、氢氧化钾(koh)等。考虑到添加的水解酶的底物特异性、适宜温度等,应按照通常的ph校正方法计算使用量。
[0054]
其中,在第二定量添加装置中的低渗溶液(hypotonic)为所溶解的物质比血球细胞更少的溶液的总称,其用于将作为水解酶激活的最大障碍因素的血球细胞膜通过由渗透压原理产生的溶血(hemolysis)作用破坏,通常可以适用比血球细胞液的浓度0.9%更低浓度的蒸馏水、自来水等。以100%v/v的血球为基准,用于破碎细胞膜的低渗溶液的使用量为50~300%v/v(以蒸馏水为基准),更优选为80~250%v/v。当然,若使用比在上面建议的%v/v更多的低渗溶液,则由于更快破碎细胞膜而可以缩短水解时间,但也应该考虑浓度的降低会对质量和效果方面不利。
[0055]
其中,通过第一定量添加装置和第二定量添加装置添加的血浆或者血球水解酶通过微生物来源的发酵及培养并浓缩而成,意味着可以对作为底物的血浆和血球的主要成分的蛋白质和虽然微量但残存的脂肪、多糖类、纤维素等进行复合性水解。作为上述的不同成分的分解酶,可以使用选自protex、胰蛋白酶(trypsin)、菠萝蛋白酶(bromeline)、木瓜蛋白酶(papain)、猕猴桃蛋白酶(actinidain)、风味蛋白酶(flavourzyme)、复合蛋白酶(protamex)、胶原蛋白酶(collagenase)、益瑞蛋白酶(esperase)、液体蛋白酶(liquanase)、赛威蛋白酶(savinase)、艾威蛋白酶(everlase)等中的一种以上作为蛋白酶,可以使用选自丽派脂肪酶(lipex)、lipopan、palatase、lecitase、半乳糖苷酶(lactozyme)等中的一种以上作为脂肪酶,可以使用选自去渍酶(stainzyme)、淀粉酶(termamyl)、葡糖淀粉酶(glucoamylase)、支链淀粉酶(pullulanase)等中的一种以上作为多糖酶,可以使用选自护色纤维素酶(carezyme)、celluclean、木聚糖酶(xylanase)、木纤维质酵素(cellulase)等中的一种以上作为纤维素酶。上述的不同成分的分解酶有很多种,例如商业用或者自制,但如果要提高水解效率,最好使用根据温度、ph、类型(endo,exe)等底物的特性,将不同成分按适当比例调配的水解酶。例如,可以使用0.1%v/v至2%v/v的上述水解酶,更优选地,可以使用0.2%v/v至0.6%v/v的上述水解酶。
[0056]
如上所述,在将全血分离成血浆和血球的状态下,如果具备适合水解酶活性的温度、搅拌速度、ph校正及使用低渗溶液破坏细胞膜等各项条件,则分别向血浆和血球中添加水解酶后,共同只需约120~150分钟就能达到98%以上的高氨基酸转化率。在常规方法中,在直接使用全血的情况下,若要达到90%以上的氨基酸转化率,则需要大约360~540分钟以上的时间,与这种常规方法相比,在本发明的方法中,短时间内的氨基酸转化率可谓是惊人的。
[0057]
如上所述,从血浆水解罐12中得到的血浆氨基酸通过第三输送泵11-3并经过用于去除残存的异物的第一过滤器17输送至血浆氨基酸储存罐14,并且,从血球水解罐13中得到的血球氨基酸通过第四输送泵11-4并经过用于去除残存的异物的第二过滤器17-1输送至血球氨基酸储存罐15。
[0058]
并且,血浆氨基酸储存罐14具备可以将水解完的血浆氨基酸搅拌并混合的第三搅拌器14-1和可通过第三定量泵定量添加杀菌剂的第一杀菌剂添加装置20等。
[0059]
并且,血球氨基酸储存罐15具备可以将水解完的血球氨基酸搅拌并混合的第四搅拌器15-1和可通过第四定量泵定量添加杀菌剂的第二杀菌剂添加装置21等。
[0060]
其中,在第一杀菌剂添加装置和第二杀菌剂添加装置中的杀菌剂用于防止水解完
的血浆氨基酸和血球氨基酸的腐败等变质并保持质量,可以使用选自用作食品添加剂的山梨酸钾(potassium sorbate)、苯甲酸钠(sodium benzoate)、水杨酸(salicylic acid)等中的一种以上作为成分。这些的使用浓度为0.01~0.45%w/v,更优选为0.05~0.35%w/v。
[0061]
并且,根据血浆氨基酸和血球氨基酸的用途和功能,可以使用选自氯化钠(nacl)、碳酸氢钠(nahco3)、木醋液等中的一种以上,氯化钠(nacl)的使用浓度为5~30%w/v,更优选为10~20%w/v,碳酸氢钠(nahco3)的使用浓度为0.5~5%w/v,更优选为1~4%w/v,木醋液的使用浓度为10~60%v/v,更优选为15~40%v/v,根据需要也可以将这些按适当的比例混合使用。
[0062]
将上述血浆氨基酸或血球氨基酸进行杀菌处理后,在添加0.01%w/w至2%w/w浓度的植物抗菌提取物的情况下,可以延长氨基酸的保存期。作为上述植物抗菌提取物,可以例举选自南瓜叶热水提取物及红毛丹壳乙醇提取物中的一种以上。特别是,在将这些以3:7至7:3的重量比混合使用的情况下,抗菌功能彼此互补,提供协同效应,因此优选。
[0063]
南瓜叶具有丰富的膳食纤维素和维生素且卡路里低,有助于减肥和皮肤美容,包含胡萝卜素成分,可以预防癌症,包含叶黄素成分,可以缓解眼疲劳,特别是具有丰富的钾,以清洁血管、降低胆固醇水平而闻名。
[0064]
并且,据悉,还具有抗氧化的功效,不仅可以防止老化,还可以预防成人病,有助于消除疲劳和口腔健康,且对手脚冰凉和有贫血的人有好处。
[0065]
本发明人在关注如上所述的南瓜叶的功效并进行研究的途中,发现南瓜叶热水提取物具有抗菌活性,并将其应用于本发明。
[0066]
上述红毛丹(rambutan)的印度尼西亚语为“rambut”,表示“毛发”。有红色和黄色,黄色更甜更好吃。用手把壳剥开就能看到透明的果肉,味甜。
[0067]
本发明人发现上述红毛丹壳乙醇提取物具有抗菌活性,并将其应用于本发明。
[0068]
在本发明中,第三搅拌器14-1和第四搅拌器15-1根据用于防止变质和保持质量的杀菌剂和用途具有使进一步添加的添加物均匀混合的功能。为了熟成和稳定化,将搅拌速度设定为10~60rpm,更优选地,设定为20~50rpm。
[0069]
如上所述,为了防止变质和保持质量而进行杀菌处理并进行熟成和稳定化的血浆氨基酸和血球氨基酸可以根据其各自的用途适当地使用或者储存在各自的储存罐内。
[0070]
并且,第一次储存在血浆氨基酸储存罐14的血浆氨基酸通过第五输送泵11-5输送至血浆血球混合氨基酸储存罐16,第一次储存在血球氨基酸储存罐15的血球氨基酸通过第六输送泵11-6输送至血浆血球混合氨基酸储存罐16。
[0071]
其中,血浆血球混合氨基酸储存罐16具备可将输送过来的血浆氨基酸和血球氨基酸搅拌并混合的第五搅拌器16-1和使入口和出口在罐内部循环而连接的第七输送泵11-7。为了熟成和稳定化,第五搅拌器16-1的搅拌速度与第三搅拌器14-1和第四搅拌器15-1相同,设定为10~60rpm,更优选地,设定为20~50rpm。
[0072]
其中,上述第三输送泵11-3至第七输送泵11-7不仅具有输送功能,还可以使入口和出口在罐内部循环而连接,因此可以期待将内容物搅拌并混合的辅助作用。
[0073]
像这样,如本发明实施例所述,本发明涉及将作为高分子有机物的家畜、家禽类及鱼类等的全血分离成血浆和血球来制备成作为低分子有机物的氨基酸的系统及其方法,包括:通过血液专用离心分离机等将全血分离成血浆和血球的步骤;分别将分离的血浆和血
球输送至具备加热、搅拌、添加剂等各自的水解条件的血浆水解罐和血球水解罐的步骤;水解步骤,添加到各个罐中的血浆和血球通过水解酶转化成氨基酸;第一次储存步骤,为了去除异物,分别使完成水解而得到的血浆氨基酸和血球氨基酸经过各自的过滤器后输送至血浆氨基酸储存罐和血球氨基酸储存罐,并且,为了防止腐败等变质,分别进行杀菌处理后储存或根据所需用途而使用;第二次储存步骤,将第一次储存到血浆氨基酸储存罐和血球氨基酸储存罐的血浆氨基酸和血球氨基酸输送至混合氨基酸储存罐并储存或根据所需用途而使用。本发明提出适用低成本且高效率结构的进一步的技术和工艺的系统及其方法,其可在短时间内提高由作为高分子有机物的全血转化为作为低分子有机物的氨基酸的转化率。
[0074]
如上所述,基于示出有限的实施例的附图说明本发明的特征,但本发明并不仅限于此,显而易见的是,在普通相关技术领域中,在与上述的说明书发明要求保护范围相似的条件和范围内,可以进行各种修改或扩展。
[0075]
为了证实在本发明实施例中提出的将全血分离成血浆和血球来制备成氨基酸的系统及其方法,通过实验进行详细说明,下述实验是为了示出本发明的一实例,但并不限于此。
[0076]
1.用于实验的材料
[0077]
试样1:屠宰牛的过程中产生的全血(在2℃下冷藏保管)
[0078]
试样2:将试样1添加到连续式离心分离机(以10000rpm、100升/小时分离的血浆和血球(在2℃下冷藏保管))
[0079]
(在使用少量的情况下,可利用由重力产生的血球的沉降效果,使血浆和血球分层而使用。)
[0080]
ph校正液:5%的氢氧化钠(naoh)水溶液(ph14.00),10%的柠檬酸(c6h8o7)水溶液(ph1.68)
[0081]
低渗溶液:蒸馏水(dw)
[0082]
水解酶:根据底物的最佳活性发挥条件,如ph、温度等特性,将6种市售酶混合使用。
[0083]
3种蛋白酶(菠萝蛋白酶(bromeline)20%v/v+赛威蛋白酶(savinase)30%v/v+风味蛋白酶(lavourzyme)40%v/v)+1种脂肪酶(丽派脂肪酶(lipex)6%v/v)+1种多糖酶(葡糖淀粉酶(glucoamylase)2%v/v)+1种纤维素酶(护色纤维素酶(carezyme)2%v/v)
[0084]
杀菌剂:混合2种使用-山梨酸钾(potassium sorbate)80%w/w+碳酸氢钠(nahco3)20%w/w
[0085]
实验结果:使用氨基酸分析仪(amino acid analyzer l-8900)进行游离氨基酸分析。
[0086]
氨基酸分析仪规格(specification of amino acid analyzer(l-8900))
[0087]
1.性能(performance):使用蛋白质水解物分析后续反应类型(茚三酮试剂)(using protein hydrolysate analysis post-reaction type(ninhydrin reagent))
[0088]
2.检测极限(detection limit(dl)):3pmol(s/n 2,asp)
[0089]
3.探测器(detecter):光度计440(photometer 440),570nm
[0090]
4.注入量(inject vol):20微升
[0091]
5.采样周期(sample cycle time):ph 53分钟,pf 148分钟
[0092]
实验1:测定本发明的血浆的不同时间水解物游离氨基酸含量
[0093]
根据aoac(美国分析化学家协会(association of official analytical chemists))标准分析法对使用连续式离心分离机分离的血浆的成分进行定量分析的结果如下表2所示。
[0094]
表2
[0095]
区分比重ph水分粗蛋白质(crude protein)粗灰分(crude ash)血浆1.027.2190.59
±
1.02%
1)
7.56
±
0.79%
1)
1.5
±
0.27%
1)
[0096]
*
1)
平均
±
标准偏差
[0097]
*定量分析法:水分(110℃常压加热干燥法),粗蛋白质(凯氏定氮法(kjeldahl)),粗灰分(600℃直接灰化法)
[0098]
首先,为了水解血浆,使用10%的柠檬酸(c6h8o7)水溶液(ph1.68)校正为对不同水解酶的激活最佳的ph5.50,将温度保持为52℃,将搅拌速度保持为120rpm。在具备如上所述的条件的状态下,将水解酶按不同的添加量0.3%v/v、0.5%v/v、0.7%v/v添加后,从经过60分钟后的时间点开始每隔30分钟分析一次水解物的游离氨基酸含量。将用于游离氨基酸分析的试样稀释成与游离氨基酸标准试样相同的浓度,以保持一致性和准确性,对表2的血浆的不同水解酶添加量、不同时间的水解物的分析结果如下表3所示。
[0099]
表3
[0100]
[0101][0102]
*
1)
添加复合酶后经过时间(分钟)
[0103]
2)
复合酶添加量(%v/v)
[0104]
*glu:谷氨酸酯(glutamate)+谷氨酰胺(glutamine)
[0105]
asp:天冬氨酸酯(asparate)+天冬酰胺(asparagine)
[0106]
如上表3所确认,游离氨基酸分析结果表明,0.5%v/v的水解酶和0.7%v/v的水解酶在不同时间段的水解能力几乎没有差异,在经过120分钟的时点,氨基酸转化率达到96~98%后,再经过多长时间,也没有太大的变化。在经过150分钟的时点,0.3%v/v的水解酶的氨基酸转化率达到89%后,再经过多长时间,转化率也没有变高。可从上述的结果判断,当水解酶添加量为0.5%v/v时,在经济性和效率层面上是合适的。并且,血浆不需要如血球一样破碎细胞膜,且水分含量为91%等对水解酶的激活创造最佳的环境,在最短时间的120分钟内,氨基酸转化率达到96~98%。
[0107]
实验2:血球的不同时间的水解物游离氨基酸含量
[0108]
根据aoac(美国分析化学家协会(association of official analytical chemists))标准分析法对使用连续式离心分离机分离的血球的成分进行定量分析的结果如下表4所示。
[0109]
表4
[0110]
区分比重ph水分粗蛋白质粗脂肪(crude fat)血球1.097.2168.84
±
0.76%
1)
29.23
±
1.41%
1)
1.24
±
0.58%
1)
[0111]
*
1)
平均
±
标准偏差
[0112]
*定量分析法:水分(110℃常压加热干燥法),粗蛋白质(凯氏定氮法(kjeldahl)),粗脂肪(索氏(soxhlet)提取法)
[0113]
首先,为了将作为水解酶激活的障碍因素的血球细胞膜进行溶血(破坏),使用蒸馏水(dw)作为低渗溶液。根据相对于血球总量的蒸馏水(dw)添加量的水分和蛋白质的含量如下表5所示。
[0114]
表5
[0115][0116]
根据上述表5的结果,针对相对于血球和血球总量的未添加馏水(dw)的1种、添加蒸馏水(dw)的3种(80%v/v,150%v/v,231%v/v)总共4种,使用10%的柠檬酸(c6h8o7)水溶液(ph1.68)校正为对不同水解酶的激活最佳的ph5.50,将温度保持为52℃,将搅拌速度保持为120rpm。在具备如上所述的条件的状态下,如实验1的结果相同,将水解酶的最佳添加量设定为0.5%v/v。添加水解酶后,在120分钟、150分钟、180分钟的时点分析水解物的游离氨基酸含量。并且,将用于游离氨基酸分析的试样稀释成与游离氨基酸标准试样相同浓度的,以保持一致性和准确性,对表5的血球的4种水解酶添加量、不同时间的水解物的分析结果如下表6所示。
[0117]
表6
[0118]
[0119][0120]
*
1)
复合酶添加后经过时间(分钟)
[0121]
2)
相对于血球总量的蒸馏水(dw)添加量(%v/v)
[0122]
*glu:谷氨酸酯(glutamate)+谷氨酰胺(glutamine)
[0123]
asp:天冬氨酸酯(asparate)+天冬酰胺(asparagine)
[0124]
如上述表6所确认,游离氨基酸分析结果表明,未添加蒸馏水(dw)的血球的氨基酸转化率在经过120分钟的时点为25%,在经过180分钟的时点为28%,表示不再进行水解。这表明,在血球细胞没有溶血(破坏)的情况下,细胞膜作用为水解酶激活的障碍因素。添加80%v/v的蒸馏水(dw)的血球的氨基酸转化率在经过120分钟的时点为65%,在经过180分钟的时点为72%,呈现出不再进行水解的局限性,表明血球细胞没有完全溶血(破坏)。添加150%v/v、231%v/v的蒸馏水(dw)的血球在经过120分钟的时点呈现出96~97%以上的高氨基酸转化率,可以看出血球细胞已经完全溶血(破坏)。根据上述的结果判断,考虑血球的氨基酸转化率的蒸馏水(dw)的添加量以150%v/v左右为合适。当然,为了快速溶血(破碎)血球细胞,使用150%v/v以上多的蒸馏水(dw),虽然可以快速提高氨基酸转化率,但也要考虑浓度降低等经济性因素。
[0125]
实验3:制备具有抗菌活性的植物提取物
[0126]
为了防止腐败等变质,分别将在本发明中制备的血浆氨基酸和血球氨基酸进行杀菌处理。此时,杀菌处理完成后,在将如下所述的南瓜叶热水提取物、红毛丹壳乙醇提取物
或者将它们混合的抗菌提取物以0.01%w/w至2%w/w添加的情况下,可以延长氨基酸的保存期。
[0127]
(1)制备南瓜叶热水提取物
[0128]
将500g的切碎的南瓜叶和1.5升的水放入提取容器中,煮至总体积为1升。然后,过滤提取液来分离后,再浓缩至体积为1/2,从而制备南瓜叶热水提取物。
[0129]
(2)制备红毛丹壳乙醇提取物
[0130]
将1kg的切碎的红毛丹(rambutan)壳与10升的50~70体积百分比浓度的乙醇混合后,利用搅拌器在60~80℃下以300rpm的搅拌速度搅拌3小时,从而制备提取溶液。
[0131]
然后,将上述提取溶液利用无纺布过滤纸进行一次过滤后,将一次过滤液使用硅藻土过滤器进行二次过滤,使其不产生沉淀物。
[0132]
将回收的二次过滤液利用浓缩机在60℃下进行减压浓缩,从而获得红毛丹壳乙醇提取物。
[0133]
(3)确认南瓜叶热水提取物及红毛丹壳乙醇提取物的安全性
[0134]
实验动物为4周龄斯普拉格道利鼠(sprague-dawley)种雄性白鼠(中心实验室动物(central lab animal),首尔,韩国),在调节完环境的饲养室(气温20℃,湿度55%,12小时光暗循环(dark/light cycle))用颗粒型固体饲料(jeil animal feed co.,大田市,韩国)饲养2周,使用饲养成平均体重为约200g的6周龄的白鼠进行上述南瓜叶热水提取物和红毛丹壳乙醇提取物的毒性测试。
[0135]
具体地,每天给上述4周龄白鼠各5只提供30毫升的上述南瓜叶热水提取物及红毛丹壳乙醇提取物与颗粒型固体饲料(jeil animal feed co.,大田市,韩国)4周,并进行毒性评价。
[0136]
根据上述毒性评价结果,可以确认参与实验的白鼠都没有死亡,在4周内10只都保持健康状态。
[0137]
(4)实验:测定抗菌活性
[0138]
通过如下方法评价上述南瓜叶热水提取物及红毛丹壳乙醇提取物的抗菌活性。
[0139]
使用典型的食物中毒菌(蜡样芽胞杆菌(bacillus cereus)、枯草芽孢杆菌(bacillus subtilis)、空肠弯曲杆菌(campylobacter jejuni)、大肠杆菌(escherichia coli)、大肠杆菌o-157(escherichia coli o-157)、李斯特菌(listeria monocytogenes)、绿脓假单胞菌(pseudomonas aeruginosa)、金黄色葡萄球菌(staphylococcus aureus)、肠炎沙门氏菌(salmonella enteritidis)、鼠伤寒沙门氏菌(salmonella typhimurium)、副溶血性弧菌(vibrio parahaemolyticus)、小肠结肠炎耶尔森氏菌(yersinia enterocolitica))。
[0140]
将上述细菌类在灭菌的10毫升的tsb培养基与50微升的培养物一起接种,在30℃下进行24
±
1小时的继代培养。该培养物的浓度在酶标仪(microplate reader)吸收波长为655nm下维持0.6
±
0.1的吸光度(abs)。将继代培养的试验菌与灭菌蒸馏水以10-3
倍稀释,进行纸片扩散法。即,用灭菌棉棒粘上稀释菌株后扩散涂抹在4毫米厚的平板培养基上,放上8毫米(厚度1毫米)的灭菌的滤纸,分别注入50微升的上述南瓜叶热水提取物、红毛丹壳乙醇提取物及它们的混合物(重量比=1:1)。充分吸入约20分钟后,在30℃下培养24
±
1小时,并确认生长环境。
[0141]
通过测量包括滤纸的透明带的大小来评价上述抗菌活性,其结果如下表7所示。
[0142]
表7
[0143][0144]
(注)a:美国菌种保藏中心(atcc,american type culture collection),韩国生命工学研究院微生物资源中心(kctc);kccm(社)韩国菌种协会
[0145]b:透明带的大小(直径:毫米)
[0146]
如上述表7所确认,上述南瓜叶热水提取物和红毛丹壳乙醇提取物对所有细菌类都呈现出优秀的抗菌活性。特别是,可以确认它们的混合物呈现出协同效应。
[0147]
以上,对本发明的优选实施例进行说明,但本发明不仅限于此,全血可以广泛应用于再利用领域,例如加工食品、家畜饲料、农作物的营养剂。并且,在本发明的发明要求保护范围和详细说明及附图范围内,可以变形为多种形式来实施,当然这也属于本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1