一种胶原蛋白水凝胶及其制备方法与流程
1.本发明属于水凝胶技术领域,具体涉及一种胶原蛋白水凝胶及其制备方法。
背景技术:
2.组织工程的核心是构建细胞与细胞支架结合的复合物,其三大关键要素是细胞、生物材料构成的细胞支架以及组织和器官的形成和再生。生物材料构成的细胞支架材料应该具有一定的生物降解速度、良好的生物相容性和细胞亲和性,且要具有一定的力学性能、能够灭菌消毒、具有孔隙结构的特征。胶原是细胞外基质主要成分之一,胶原具有独特的理化性质和优良的生物相容性、可降解性、低免疫性等优点,使得其在生物体内容易被吸收、亲水性强、无毒安全性好,成为生物医用材料的选择之一。分子自组装是指分子在一定平衡条件下,通过非共价键的作用自发形成一种稳定的、有序的超分子聚集体或超分子结构的过程。胶原蛋白本身具有自组装的性质,在体内,原胶原首尾错位四分之一排列自组装,通过共价键交联、形成具有d带特征的纤维结构,并进一步的聚集成束,形成胶原纤维,搭建成人体内的各种组织。影响胶原蛋白自组装的条件有胶原蛋白浓度、温度、ph值、溶液浓度及溶液的离子种类等因素。现有技术中制备的胶原蛋白水凝胶成胶速度慢,缓慢混合添加剂才能成胶,且人体浅层组织使用时可能发生温度变化,可逆不适合人体使用。
3.鉴于以上原因,特提出本发明。
技术实现要素:
4.为了解决现有技术存在的以上问题,本发明提供了一种胶原蛋白水凝胶及其制备方法,本发明制备的水凝胶成胶时间短,在低温及常温下均可以进行混合,且力学性能好,在使用前将a相和b相混合,更符合实际使用要求。
5.本发明的第一目的,提供了一种胶原蛋白水凝胶的制备方法,所述的方法包括如下步骤:(1)a相制备:向氯化钙溶液或氯化镁溶液中加入胶原蛋白,充分混合,得到胶原蛋白溶液;(2)b相制备:配制缓冲溶液体系,所述的缓冲溶液体系为磷酸盐缓冲溶液、tris-hcl缓冲溶液、巴比妥钠-盐酸缓冲溶液中的一种;(3)将a相和b相分别装入不同的容器中,在使用时,将a相和b相混合,得到所述的胶原蛋白水凝胶。
6.进一步的,步骤(1)中氯化钙溶液中氯化钙的浓度为125-350mm。
7.进一步的,氯化钙溶液中氯化钙的浓度为240mm。
8.进一步的,步骤(1)中氯化镁溶液中氯化镁的浓度为100-300mm。
9.进一步的,步骤(1)中胶原蛋白的质量分数为氯化钙溶液或氯化镁溶液的0.6-4.5%。
10.进一步的,步骤(2)中所述的磷酸盐缓冲溶液为磷酸氢二钠和磷酸二氢钾按照摩
尔比为(10:1)-(5:1)混合,加水至总磷酸盐的浓度为0.04-0.06m,用酸和碱调ph值为7-8而成。
11.进一步的,步骤(2)中所述的tris-hcl缓冲溶液为三羟甲基氨基甲烷与盐酸按照摩尔比(3-5):(3-5)混合,加水至三羟甲基氨基甲烷与盐酸总浓度为0.275-0.525m,用酸和碱调ph值为7.2-7.6而成。
12.本发明中缓冲溶液ph值大小与其中原料的配比有关,调节ph值前根据测定的ph值,通过酸和碱共同调节ph值达到所需的范围。
13.进一步的,步骤(2)中所述的巴比妥钠-盐酸缓冲溶液为巴比妥钠和盐酸按照摩尔比(5-8):(4-7)混合,加水至巴比妥钠和盐酸总浓度为0.175-0.315m,用酸和碱调ph值为7.2-7.6而成。
14.进一步的,步骤(3)中a相和b相混合体积比为(2:1)-(4:1)。
15.进一步的,混合温度为5-25℃,使用温度为5-37℃。
16.本发明的第二目的,提供了一种所述方法制备的胶原蛋白水凝胶。
17.本发明的胶原蛋白水凝胶基于胶原蛋白本身具有自组装性质,改变胶原蛋白浓度、溶液中离子浓度、ph值、温度等因素会影响自组装速率、时间及其自组装的能力,在适宜的条件下,胶原溶液可由液态逐步转变成凝胶状态。本发明中a相和b相中各原料的配比和条件是本发明人经过大量的试验获得的,只有在本发明的条件下制备的水凝胶才能实现在低温或室温条件下均可成胶,且力学性能更好。
18.本发明的a相和b相配制好后独立保存,在使用前混合。
19.与现有技术相比,本发明的有益效果为:(1)本发明的胶原蛋白水凝胶分别配制a相和b相,两相配制好后独立保存,使用前混合即可,现用现配,更符合实际使用要求,a相中不需要添加酸溶液,可以减少试剂的使用量和实验步骤,本发明的水凝胶在低温或室温条件下均可成胶,且力学性能更好;(2)本发明中胶原蛋白溶解在盐溶液中,使得溶液中存在更多的铵根离子,再加入缓冲溶液体系,使得胶原蛋白发生自组装,且钙离子或镁离子是二价离子,从各种离子对胶原膨胀能力的大小影响中可知,二价离子对胶原蛋白的膨胀能力更强,使得缓冲盐溶液中的离子与胶原蛋白链之间更容易发生反应,自组装的程度更高。
具体实施方式
20.为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
21.实施例1本实施例的胶原蛋白水凝胶的制备方法,包括如下步骤:(1)a相制备:向300mm的氯化钙溶液中加入2%的胶原蛋白,充分混合均匀,得到胶原蛋白溶液,即a相;(2)b相制备:磷酸氢二钠和磷酸二氢钾按照摩尔比5:1混合,加水至总磷酸盐的浓度为0.04m,用盐酸和氢氧化钠调节ph值为7-8,得到磷酸盐缓冲溶液,即b相。
22.本实施例制备的胶原蛋白水凝胶使用时a相和b相按照体积比4:1混合。
23.实施例2本实施例的胶原蛋白水凝胶的制备方法,包括如下步骤:(1)a相制备:向125mm的氯化钙溶液中加入0.6%的胶原蛋白,充分混合均匀,得到胶原蛋白溶液,即a相;(2)b相制备:磷酸氢二钠和磷酸二氢钾按照摩尔比10:1混合,加水至总磷酸盐的浓度为0.05m,用盐酸和氢氧化钠调节 ph值为7-8,得到磷酸盐缓冲溶液,即b相。
24.本实施例制备的胶原蛋白水凝胶使用时a相和b相按照体积比2:1混合。
25.实施例3本实施例的胶原蛋白水凝胶的制备方法,包括如下步骤:(1)a相制备:向350mm的氯化钙溶液中加入3%的胶原蛋白,充分混合均匀,得到胶原蛋白溶液,即a相;(2)b相制备:磷酸氢二钠和磷酸二氢钾按照摩尔比7.5:1混合,加水至总磷酸盐的浓度为0.06m,用盐酸和氢氧化钠调节 ph值为7-8,得到磷酸盐缓冲溶液,即b相。
26.本实施例制备的胶原蛋白水凝胶使用时a相和b相按照体积比3:1混合。
27.实施例4本实施例的胶原蛋白水凝胶的制备方法,包括如下步骤:(1)a相制备:向100mm的氯化镁溶液中加入2%的胶原蛋白,充分混合均匀,得到胶原蛋白溶液,即a相;(2)b相制备:三羟甲基氨基甲烷与盐酸按照摩尔比3:5混合,加水至三羟甲基氨基甲烷与盐酸总浓度为0.275m,用盐酸和氢氧化钠调ph值为7.2-7.6而成,即b相。
28.本实施例制备的胶原蛋白水凝胶使用时a相和b相按照体积比2:1混合。
29.实施例5本实施例的胶原蛋白水凝胶的制备方法,包括如下步骤:(1)a相制备:向200mm的氯化镁溶液中加入0.5%的胶原蛋白,充分混合均匀,得到胶原蛋白溶液,即a相;(2)b相制备:三羟甲基氨基甲烷与盐酸按照摩尔比1:1混合,加水至三羟甲基氨基甲烷与盐酸总浓度为0.4m,用盐酸和氢氧化钠调ph值为7.2-7.6而成,即b相。本实施例制备的胶原蛋白水凝胶使用时a相和b相按照体积比3:1混合。
30.实施例6本实施例的胶原蛋白水凝胶的制备方法,包括如下步骤:(1)a相制备:向300mm的氯化镁溶液中加入3%的胶原蛋白,充分混合均匀,得到胶原蛋白溶液,即a相;(2)b相制备:三羟甲基氨基甲烷与盐酸按照摩尔比5:3混合,加水至三羟甲基氨基甲烷与盐酸总浓度为0.525m,用盐酸和氢氧化钠调ph值为7.2-7.6而成,即b相。本实施例制备的胶原蛋白水凝胶使用时a相和b相按照体积比4:1混合。
31.实施例7本实施例的胶原蛋白水凝胶的制备方法,包括如下步骤:(1)a相制备:向300mm的氯化钙溶液中加入2%的胶原蛋白,充分混合均匀,得到胶
原蛋白溶液,即a相;(2)b相制备:巴比妥钠和盐酸按照摩尔比5:7混合,加水至巴比妥钠和盐酸总浓度为0.175m,用盐酸和氢氧化钠调ph值为7.2-7.6而成,即b相。
32.本实施例制备的胶原蛋白水凝胶使用时a相和b相按照体积比2:1混合。
33.实施例8本实施例的胶原蛋白水凝胶的制备方法,包括如下步骤:(1)a相制备:向100mm的氯化镁溶液中加入4.5%的胶原蛋白,充分混合均匀,得到胶原蛋白溶液,即a相;(2)b相制备:巴比妥钠和盐酸按照摩尔比7:5混合,加水至巴比妥钠和盐酸总浓度为0.245m,用盐酸和氢氧化钠调ph值为7.2-7.6而成,即b相。
34.本实施例制备的胶原蛋白水凝胶使用时a相和b相按照体积比3:1混合。
35.实施例9本实施例的胶原蛋白水凝胶的制备方法,包括如下步骤:(1)a相制备:向350mm的氯化钙溶液中加入3%的胶原蛋白,充分混合均匀,得到胶原蛋白溶液,即a相;(2)b相制备:巴比妥钠和盐酸按照摩尔比8:4混合,加水至巴比妥钠和盐酸总浓度为0.315m,用盐酸和氢氧化钠调ph值为7.2-7.6而成,即b相。
36.本实施例制备的胶原蛋白水凝胶使用时a相和b相按照体积比4:1混合。
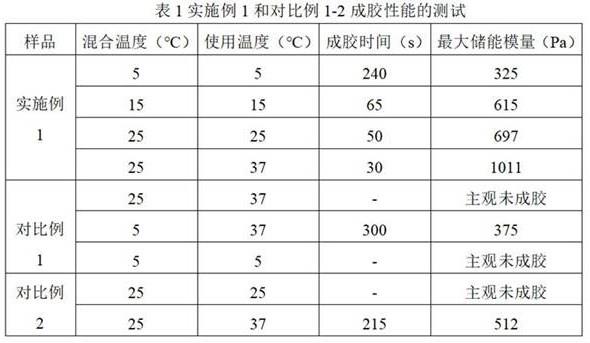
37.对比例1本对比例的胶原蛋白水凝胶的制备方法,包括如下步骤:(1)a相制备:在4℃条件下,将2.0%胶原蛋白溶于0.01m盐酸,得到胶原蛋白溶液,保存在4℃下;(2)b相制备:配制缓冲溶液,所述的缓冲溶液中含有680mm na
+
溶液、60mm hpo
42-/h2po
4-溶液,缓慢加入0.05m氢氧化钠溶液,调节溶液的ph至7.4,置于不同温度下(5℃、37℃)水浴。
38.本实施例制备的胶原蛋白水凝胶使用时a相和b相按照体积比4:1混合。
39.对比例2本对比例的胶原蛋白水凝胶的制备方法,包括如下步骤:(1)a相制备:将2.0%胶原蛋白溶于ph为2.5的盐酸溶液中,得到胶原蛋白溶液;(2)b相制备:配制ph为7.4 缓冲溶液,其中含有680mm na
+
溶液、60mm hpo
42-/h2po
4-的溶液,置于25℃条件下水浴。
40.本实施例制备的胶原蛋白水凝胶使用时a相和b相按照体积比4:1混合。
41.以下试验例中成胶时间均是5s观察一次,记录成胶时间。
42.试验例1测试实施例1和对比例1-2制备的水凝胶在不同的混合温度和使用温度下的成胶时间和最大储能模量。
43.通过流变性能测定储能模量和损耗模量表征胶原溶液自组装的能力,将混合后的样品在37℃环境下以固定频率进行检测,300s内每隔5s取点一次,共60个测量点,记录储能模量,以储能模量达到储能模量最大值90%的首个时间点作为成胶时间,结果如表1所示。
44.从表1中可以看出,本发明制备的水凝胶在低温或常温下混合,以及低温、常温、体温的条件下使用都可以成胶,并具有一定的力学性能。
45.本发明人对其他实施例制备的水凝胶也做了上述试验,结果基本一致,由于篇幅有限,不再一一列举。
46.试验例2将实施例1-9和对比例1-2制备的a相胶原蛋白溶液进行热变性温度分析,规定胶原变性吸热峰的峰值为热变性温度,峰面积积分为焓变值,焓变值是测试材料的固有属性,结果如表2所示。
47.从表2的数据可以看出,本发明实施例与对比例制备的水凝胶的热变性温度和焓
变值均无明显差异,说明本发明的方法并没有改变水凝胶的热变性温度。
48.试验例3将实施例1-9和对比例1-2制备的水凝胶进行降解试验测试,具体如下:混合温度25℃,在使用温度为37℃下进行成胶,称取实施例1-9和对比例1-2分别1500mg,浸泡在37℃ 100ml 5u/ml胶原酶的pbs缓冲溶液,评估其降解时间为24h时,通过溶液中的羟脯氨酸含量测定推测样品剩余量来评价样品的降解程度,如表3所示。
49.从表3的数据可以看出,由于溶液中羟脯氨酸含量越多,剩余样品量就越少,证明降解越快。在降解24h内,本发明的羟脯氨酸含量比对比例1-2均少。实施例1-9中均可成胶,成胶后的样品与胶原酶溶液接触的表面积减少,而对比例1不成胶,样品比较分散,与胶原酶溶液接触的表面积增加,使得降解更快,溶液中的羟脯氨酸含量则较高,结果表明本发明制备的水凝胶的降解时间比对比例1-2均长,这样本发明的方法促进了胶原蛋白的自组装,且本发明的方法制备的水凝胶的成胶能力强。
50.试验例4将实施例1-9制备的a相和b相混合后,混合温度25℃,直接打入37℃的pbs溶液中,可在短时间内形成一整块胶体,而对比例1-2会相对分散、无法成胶。表明本发明的水凝胶在水溶液环境中可成胶。
51.试验例5按照实施例1的方法制备水凝胶,只改变胶原蛋白的加入量,混合温度为25℃,使用温度为37℃,研究不同的胶原蛋白的含量对制备的水凝胶的性能影响,具体测试方法同试验例1和试验例3,结果见表4。
52.从表4结果可知,随着胶原蛋白浓度的增加,单位空间中分子越多,胶原分子聚集在一起的速率会加快,自组装程度及时间就越快,成胶时间缩短,形成的凝胶的降解时间更长,当胶原蛋白百分比大于5.0%时,成胶时间增加,这是因为胶原蛋白浓度高,在与氯化钙或氯化镁溶液进行混合形成铵根离子的过程中,会有更多的竞争性。同时,胶原蛋白浓度高,后再与其缓冲溶液混合导致黏度大,使得与缓冲溶液接触不均匀,则延长了其成胶所需要的时间。
53.试验例6按照实施例1的方法制备水凝胶,只改变氯化钙溶液的浓度,混合温度为25℃,使用温度为37℃,研究不同的胶原蛋白的含量下制备的水凝胶的性能影响,具体测试方法同试验例1和试验例3,结果见表5。
54.从表5结果可知,随着离子浓度的增加,使得溶液中离子与水分子之间更容易结合,将更多的胶原分子暴露出来发生自组装,降解时间更长,但离子浓度超出一定范围后(350mm),胶原盐析,成胶时间增加,反而抑制了自组装过程。
55.以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1