一种手性1,5-二硼基烷烃化合物及其合成方法和应用
1.本发明涉及一种手性1,5-二硼基烷烃化合物及其合成方法和应用。
背景技术:
2.二硼基烷烃化合物在有机合成、材料科学和药物化学领域有着广泛的应用[(a)xiong,y.;sun,y.-w.;zhang,g.-z.tetrahedron lett.2018,59,347.(b)li,g.-l.;huo,x.-h.;jiang,x.-y.;zhang,w.-b.chem.soc.rev.2020,49,2060.(c)kuang,z.-j.;yang,k.;zhou,y.;song,q.-l.chem.commun.2020,56,6469.]。目前为止,手性二硼基烷烃的合成方法有很多报道,主要应用于合成手性1,1-二硼基烷烃[(a)lee,j.c.h.;mcdonald,r.;hall,d.g.nat.chem.2011,3,894.(b)feng,x.;jeon,h.;yun,j.angew.chem.int.ed.2013,52,3989.(c)teo,w.j.;ge,s.-z.angew.chem.int.ed.2018,57,12935.(d)lee,y.;park,j.;cho,s.h.angew.chem.int.ed.2018,57,12930.],手性1,2-二硼基烷烃[(a)morgan,j.b.;miller,s.p.;morken,j.p.j.am.chem.soc.2003,125,8702.(b)kliman,l.t.;mlynarski,s.n.;morken,j.p.j.am.chem.soc.2009,131,13210.(c)mlynarski,s.n.;schuster,c.h.;morken,j.p.nature2014,505,386.(d)pelz,n.f.;woodward,a.r.;burks,h.e.;sieber,j.d.;morken,j.p.j.am.chem.soc.2004,126,16328.],手性1,3-二硼基烷烃[(a)stymiest,j.l.;bagutski,v.;french,r.m.;aggarwal,v.k.nature2008,456,778.(b)burns,m.;essafi,s.;bame,j.r.;bull,s.p.;webster,m.p.;balieu,s.;dale,j.w.;butts,c.p.;harvey,j.n.;aggarwal,v.k.nature2014,513,183.(c)leonori,d.;aggarwal,v.k.acc.chem.res.2014,47,3174.]和手性1,4-二硼基烷烃[(a)burks,h.e.;kliman,l.t.;morken,j.p.j.am.chem.soc.2009,131,9134.(b)schuster,c.h.;li,b.;morken,j.p.angew.chem.int.ed.2011,50,7906;]。但是,对于高对映选择性的手性1,5-二硼基烷烃的合成方法鲜有报道,难以从简单易得原料直接合成高附加值的手性1,5-二硼基烷烃。由于目前缺少有效的方法用于高效便捷地合成手性1,5-二硼基烷烃,这使得此类化合物的应用探索受到了极大地限制。手性1,5-二硼基烷烃具有两个含硼基团,可以进一步发生suzuki偶联反应、氧化反应、胺化反应等,而且两个含硼基团可以转化为不同的官能团,有着丰富的后续修饰和转化,具有极大的应用价值[xi,y.;hartwig,j.f.j.am.chem.soc.2016,138,6703.]。
[0003]
乙烯基环丙烷是一种有机合成领域常用的合成原料,通常用于环加成反应中,可以参与[5+n]环加成反应[(a)jiao,l.;yu,z.-x.j.org.chem.2013,78,6842.(b)wang,y.;yu,z.-x.acc.chem.res.2015,48,2288.(c)souillart,l.;cramer,n.chem.rev.2015,115,9410.(d)fumagalli,g.;stanton,s.;bower,j.f.;chem.rev.2017,117,9404.(e)cohen,y.;cohen,a.;marek,i.chem.rev.2021,121,140.(f)pirenne,v.;muriel,b.;waser,j.chem.rev.2021,121,227.]。同时,利用烯烃、炔烃、联烯和共轭烯烃等不饱和烃的多次硼氢化反应合成多硼化合物的方法已经被报道[(a)wang,x.-j.;wang,y.;huang,w.;xia,c.-g.;wu,l.-p.acscatal.2021,11,1.(b)zhang,l.;huang,z.j.am.chem.soc.2015,137,
15600.(c)hu,m.;ge,s.-z.nat.commun.2020,11,765.]。因此,申请人设想利用烯基环丙烷的两次硼氢化反应,来合成手性1,5-二硼基烷烃化合物。该反应存在许多困难:(1)存在多种选择性。由于烯基环丙烷化合物中存在一个不饱和双键和一个环丙烷,使得反应存在多种选择性,我们需要同时调控反应的化学选择性、区域选择性、立体选择性和对映选择性[chen,c.-h.;shen,x.-z.;chen,j.-h.;hong,x.;lu,z.org.lett.2017,19,5422.]。(2)存在多个副反应。反应过程中会生成一个三取代烯烃的中间体,这个中间体更倾向于发生氢化反应,而不是进一步发生第二次硼氢化反应。(3)在第二次硼氢化反应中,需要发生串联异构化/硼氢化反应,从热力学相对稳定的三取代烯烃得到热力学相对不稳定的二取代烯烃。因此,通过烯基环丙烷的不对称双硼氢化反应来合成手性1,5-二硼基烷烃具有重大的挑战性,目前仍未能实现,而手性1,5-二硼基二硼基化合物对有机合成化学、材料、医药等领域的发展具有重要的意义。
技术实现要素:
[0004]
本发明要解决的技术问题是,提供一种手性1,5-二硼基烷烃化合物及其合成方法和应用。
[0005]
本发明采用的技术方案是:一种手性1,5-二硼基烷烃化合物,如式iii所示:
[0006][0007]
式iii中,bpin是指4,4,5,5-四甲基-1,3-二氧代环戊-2-硼基,如式iv所示:
[0008][0009]
式iii中,*代表手性碳原子;式iii中的手性碳原子可以为r型也可以为s型,分别如式iii-r、式iii-s所示:
[0010][0011]
式iii中,r1任选自h、未取代的或被一个以上的取代基a取代的以下基团:c6~c20的芳基、c4~c20的杂环芳基;
[0012]
或者为未取代的或被一个以上的取代基b取代的以下基团:c1-c16的烷基或c3-c16的环烷基;
[0013]
所述的取代基a为下列基团中的一种或多种:卤素、c1-c16的烷基、c1-c16的烷氧基、c1-c16的烷硫基、c2~c8的烯基、c3~c8的炔基、苯基、三氟甲基、甲氧羰基、硝基、羟基、c1-c3的醛基、羧基、氨基、c1-c16的酯基、c1-c16的硅烷基、苄氧基、酰胺基、酰基;优选为为下列基团中的一种或多种:卤素、c1-c16的烷基、c1-c16的烷氧基、甲硫基、苯基、三氟甲基、甲氧羰基、羟基、甲醛基、氨基、c1-c10的酯基、c1-c10的硅烷基、酰胺基、乙酰基、乙烯基、乙
炔基;
[0014]
所述取代基b为下列基团中的一种或多种:c2~c8的烯基、c3~c8的炔基、c6~12的芳基a、c4~c12的杂环芳基b、硝基、卤素、三氟甲基、羟基、c1-c3的醛基、羧基、氨基、c1-c16的酯基、c1-c16的硅烷基、c1-c16的磺酰基、苄氧基、酰胺基或n,n-二乙基胺羰基;优选为下列基团中的一种或多种:c6~12的芳基a、c4~c12的杂环芳基b、卤素、三氟甲基、羟基、醛基、氨基、c1-c10的酯基、c1-c10的硅烷基、c1-c10的磺酰基、酰胺基或n,n-二乙基胺羰基;
[0015]
优选r1为未取代的或被一个以上的取代基a取代的以下基团:c6~c20的芳基、c4~c20的杂环芳基;
[0016]
所述c6~c20的芳基优选为苯基、萘基、四氢萘基;
[0017]
所述c4~c20的杂环芳基优选为吲哚基、n-甲基吲哚基、1,3-苯并二噁茂、呋喃基、噻吩基、吡啶基、苯并呋喃基、苯并噻吩基、二苯并呋喃基、二苯并噻吩基、喹啉基、萘啶基、或式a、式b所示基团;
[0018][0019]
式a为乙二醇保护的雌酚酮片段;
[0020]
式b为生育酚片段。
[0021]
所述取代基b中的c6~c12的芳香基a优选苯基或萘基;
[0022]
所述取代基b中的c4~c12的杂环芳基b优选四氢呋喃、吡啶、嘧啶、噻吩、咔唑、喹啉、吲哚、哌啶、喹唑啉、苯并噻吩或二苯并噻吩。
[0023]
进一步,式iii中,优选所述r1为未取代的或被一个以上的取代基a取代的以下基团:苯基、萘基、四氢萘基、吲哚基、n-甲基吲哚基、1,3-苯并二噁茂、呋喃基、噻吩基、吡啶基、嘧啶基、苯并呋喃基、苯并噻吩基、二苯并呋喃基、二苯并噻吩基、式a、式b所示基团;
[0024]
所述的取代基a更优选为下列基团中的一种或多种:卤素、c1-c10的烷基、c1-c10的烷氧基、甲硫基、苯基、三氟甲基、甲氧羰基、羟基、羟基甲基、氨基、c1-c10的酯基、酰胺基、甲醛基、乙酰基、乙烯基、乙炔基;
[0025]
更进一步,式iii中优选所述r1为邻甲氧基苯基、邻甲硫基苯基、邻三氟甲基苯基、邻甲基苯基、邻氟苯基、邻氯苯基、邻溴苯基、间甲氧基苯基、间甲硫基苯基、间三氟甲基苯基、间甲基苯基、间氟苯基、间氯苯基、间溴苯基、对甲氧基苯基、对甲硫基苯基、对三氟甲基苯基、对甲基苯基、对氟苯基、对氯苯基、对溴苯基、对羟甲基苯基、对醛基苯基、对乙酰基苯基、对c1-c3酯基苯基、对叔丁基苯基、对氨基苯基、对甲硫基苯基、对乙烯基苯基、对乙炔基苯基、2,3-二甲基苯基、3,4-二甲基苯基、3,5-二甲基苯基、3,4,5-三甲基苯基、3,5-二甲氧基苯基、3,4,5-三甲氧基苯基、1,3-苯并二噁茂、1-四氢萘基、2-四氢萘基、1-萘基、2-萘基、
2-吡啶基、3-吡啶基、2-嘧啶基、2-噻吩基、2-呋喃基、2-苯并噻吩基、2-苯并呋喃基、2-二苯并噻吩基、2-苯并呋喃基或式a、式b所示基团。
[0026]
本发明还提供所述手性1,5-二硼基烷烃化合物的合成方法,所述方法为:在惰性气体下,以式i所示的烯基环丙烷化合物和式ii所示的频哪醇硼烷为原料,以手性cox
2-tip络合物为催化剂,在活化试剂存在下,反应制得式iii所示的手性1,5-二硼基烷烃化合物。反应式如式(1)所示:
[0027][0028]
式i和式iii中,r1是相同基团,r1的定义如前所述;式ii中,bpin的定义如前所述。
[0029]
本发明所用的催化剂为手性cox
2-tip络合物(tip:噻唑啉亚胺吡啶配体),其中手性cox
2-tip络合物的结构式为式v所示的化合物或其对映体,所述对映体即为式v的镜像。
[0030][0031]
式v中,r
14
、r
15
、r
16
、r
17
、r
18
、r
19
、r
20
、r
21
、r
22
、r
23
、r
24
、r
25
任选自h、c1-c16的烷基、c1-c16的烷氧基、苯基、萘基、苄基、硝基、卤素、苯基、甲氧羰基、三氟甲基、羟基、c1-c3的醛基、c1-c3的羧基、氨基、c1-c3的酯基或酰胺基;x为f、cl、br、i、oac、cf3so3中的任意一种。
[0032]
式v中,*代表手性碳原子;式v中的手性碳原子可以为r型也可以为s型,s构型的手性cox
2-tip络合物如式v-s所示,r构型的手性cox
2-tip络合物如式v-r所示
[0033][0034]
催化剂手性cox
2-tip络合物的构型决定了产物式iii所示的手性1,5-二硼基烷烃化合物的构型,催化剂的手性碳原子的键位方向和产物的手性碳原子的键位方向相同。这是本领域技术人员公知的催化剂手性构型对产物手性构型的影响方式。
[0035]
催化剂v-s和产物iii-r的手性碳原子的键位方向相同,因此s构型的手性cox
2-tip络合物催化得到的产物为r构型的手性1,5-二硼基烷烃化合物,即式iii-r所示的产物;
[0036]
催化剂v-r和产物iii-s的手性碳原子的键位方向相同,因此r构型的手性cox
2-tip络合物催化得到的产物为s构型的手性1,5-二硼基烷烃化合物,即式iii-s所示的产物;
[0037]
在本发明中,虽然手性催化剂和手性产物的构型命名不同,但键位方向仍然是保持一致,而命名是人为的命名方式,命名不影响键位方向,因此产物的构型以催化剂的键位方向为准。
[0038]
优选手性cox
2-tip络合物为s构型。相应制备得到式iii-r所示的r构型的手性1,5-二硼基烷烃化合物。
[0039]
进一步,式v中,优选r
15
、r
16
、r
19
、r
21
、r
24
、r
25
均为h;r
14
为h、甲氧基或三氟甲基;r
17
为甲基或乙基;r
18
、r
20
、r
22
各自独立为甲基、乙基或异丙基,r
23
为c
1-c4的烷基、苄基或苯基;x为cl、br或i。
[0040]
更优选的,所用的手性cox
2-tip络合物如式v-1所示
[0041][0042]
本发明方法中,手性cox
2-tip络合物的合成方法可参考文献org.lett.2018,20,4028。
[0043]
作为进一步地改进,本发明所述的合成方法可在无溶剂或在有机溶剂中进行,在有机溶剂中反应时,所述的有机溶剂可以为苯、甲苯、四氢呋喃、乙醚、二氧六环、二氯甲烷、石油醚、环己烷、正己烷、乙酸乙酯中的任意一种或多种,优选乙醚。所述有机溶剂的体积用量一般以式i所示的烯基环丙烷的物质的量计为0.1-10ml/mmol。
[0044]
所述活化试剂为三乙基硼氢化钠、三仲丁基硼氢化钠、三乙基硼氢化锂、叔丁醇钠、叔丁醇钾、叔丁醇锂、叔戊醇钠、乙醇钠、甲醇钠、甲醇钾中的任意一种,优选为三乙基硼氢化钠、叔丁醇钠、乙醇钠、甲醇钠,更优选为三乙基硼氢化钠。
[0045]
所述合成方法中,所述反应温度为-30℃~80℃,优选为-10℃~30℃,更优选为0℃。反应时间为12-48小时,优选为24-36小时,更优选为36小时。
[0046]
本发明反应皆在惰性气体下进行,所述惰性气体可以为氮气或氩气。
[0047]
本发明所述合成方法中,式i所示的烯基环丙烷化合物、式ii所示的频哪醇硼烷、手性cox
2-tip络合物、活化试剂的物质的量之比为1:2-5:0.0000005-0.1:0.000003-0.3,优选为1:2-3:0.005-0.1:0.015-0.3,更优选为1:2.2-2.5:0.01-0.1:0.03-0.3;最优选为1:2.5:0.05:0.1。
[0048]
作为进一步地改进,本发明方法的反应结束后,所得粗产物经过后处理制得式iii所示的手性1,5-二硼基烷烃化合物,进一步,所述后处理方法为:硅胶过滤,乙醚为洗脱溶剂,收集洗脱液旋蒸除去溶剂后柱层析分离,洗脱溶剂为石油醚或石油醚和乙酸乙酯的混合物。
[0049]
合成方法式(1)最优选为式(1-1),如下所示:
[0050][0051]
本发明提供了一种有效的由手性cox
2-tip为催化剂,由烯基环丙烷化合物和频哪醇硼烷为原料,高效率、高对映选择性地合成手性1,5-二硼基烷烃化合物的方法。该方法反应条件温和,操作简便,原子经济性高,且反应具有良好至优秀的产率(55%-98%)和对映选择性(74-96%ee)。
[0052]
本发明提供的手性1,5-二硼基烷烃化合物中两个含硼基团可以同时进行进一步化学转化,可以用于氧化反应合成手性1,5-二醇化合物,胺化反应合成手性1,5-二胺化合物,偶联反应合成手性1,5-二芳基烷烃化合物,卤代反应合成手性1,5-二卤代烷烃化合物。此外,本发明提供的手性1,5-二硼基烷烃化合物中的两个含硼基团也可以进行逐级转化,通过选择性偶联反应得到手性5-芳基-1-硼基烷烃化合物。得到的5-芳基-1-硼基烷烃化合物可以进一步用于氧化反应合成手性5-芳基-1-戊醇化合物,胺化反应合成手性5-芳基-1-戊胺化合物,以及二次偶联反应得到手性1-芳基b-5-芳基a戊烷化合物。其中,使用的衍生化方法均可查阅已知文献报道,衍生化反应所的手性1,5-二官能团化产物在有机合成领域具有重要的合成意义以及潜在的应用价值。
[0053]
进一步,本发明的手性1,5-二硼基烷烃化合物可用于氧化反应合成手性1,5-二醇化合物,具体的,所述应用的方法为:在空气中,有机溶剂a中,将式iii所示的手性1,5-二硼基烷烃化合物和双氧水、氢氧化钠搅拌进行氧化反应,制得式vi所示的手性1,5-二醇化合物。反应式如式(2)所示:
[0054]
所述有机溶剂a为苯、甲苯、四氢呋喃、乙醚、二氧六环、二氯甲烷、石油醚、环己烷、正己烷、乙酸乙酯中的任意一种或多种,优选乙醚。
[0055][0056]
*代表手性碳原子,可以为s构型也可以为r构型。
[0057]
式iii所示的手性1,5-二硼基烷烃化合物为r构型时,相应得到r构型的手性1,5-二醇化合物,如下式(2-r)所示
[0058][0059]
所述氧化反应的反应温度为0℃~80℃,优选为0℃~50℃,更优选为常温。反应时间为1-10小时,优选为2-5小时,更优选为3小时。
[0060]
所述式iii所示的手性1,5-二硼基烷烃化合物、双氧水中的h2o2、氢氧化钠的物质的量之比为1:50~60:20~30。
[0061]
氢氧化钠浓度优选为2-6mol/l,优选为3mol/l;双氧水的质量分数为30%;双氧
水、氢氧化钠的体积比为1:1-3;双氧水、氢氧化钠的体积比优选为1:1.2~1.33。
[0062]
氧化反应结束后,所得反应液a后处理得到式vi所示的手性1,5-二醇化合物。进一步,反应液a的后处理方法优选为:反应液a中加水猝灭反应,用乙酸乙酯萃取、干燥后除去溶剂,经柱层析分离得到如式vi所示的手性1,5-二醇化合物
[0063]
进一步,本发明可以采用一锅法合成手性1,5-二醇,即手性1,5-二硼基烷烃化合物无需纯化,直接在反应液中加入双氧水和氢氧化钠,进行氧化反应制得式vi所示的手性1,5-二醇化合物。具体的,所述方法为:在惰性气体下,以式i所示的烯基环丙烷化合物和式ii所示的频哪醇硼烷为原料,以手性cox
2-tip络合物为催化剂,在活化试剂存在下,反应制得式iii所示的手性1,5-二硼基烷烃化合物;向反应液中加入双氧水、氢氧化钠搅拌进行氧化反应,制得式vi所示的手性1,5-二醇化合物。
[0064]
一锅法的反应式如式(2-1)所示:
[0065][0066]
所述一锅法反应中,式i所示的烯基环丙烷化合物、式ii所示的频哪醇硼烷、手性cox
2-tip络合物、活化试剂、双氧水中的h2o2、氢氧化钠的物质的量之比为1:2-5:0.0000005-0.1:0.000003-0.3:50~60:20~30,优选为1:2-3:0.005-0.1:0.015-0.3:50~60:20~30,更优选为1:2.2-2.5:0.01-0.1:0.03-0.3:50~60:20~30;最优选为1:2.5:0.05:0.1:50~60:24。
[0067]
进一步,优选的一锅法制备手性1,5-二醇化合物的反应步骤为:在氮气下,在反应管中依次加入催化剂cox
2-tip、式i所示的烯基环丙烷化合物、溶剂乙醚和频哪醇硼烷,冷却至0℃,随后加入活化试剂三乙基硼氢化钠,在0℃下反应36小时;反应结束后,加入双氧水和氢氧化钠溶液,室温搅拌3小时,反应结束后,所得反应液b后处理得到式vi所示的手性1,5-二醇化合物。进一步,反应液b的后处理方法优选为:反应液b中加水猝灭反应,用乙酸乙酯萃取、干燥后除去溶剂,经柱层析分离得到如式vi所示的手性1,5-二醇化合物。
[0068]
进一步,手性1,5-二醇化合物经过三步简单的反应可以制备市售药物丙克拉莫,所用的方法是:(1)制备式vi-1所示的s构型的手性2-间甲氧基苯基-1,5-二醇;(2)将式vi-1所示的s构型的手性2-间甲氧基苯基-1,5-二醇经过羟基保护、胺化以及脱甲基反应,得到式vii所示的市售药物丙克拉莫,反应式如式(3)所示:
[0069][0070]
所述步骤(1)制备式vi-1所示的s构型的手性2-间甲氧基苯基-1,5-二醇的方法按以下步骤进行:
[0071]
在反应管中依次加入r构型的coi
2-tip催化剂、1-(1-环丙基乙烯基)-3-甲氧基苯、溶剂乙醚和频哪醇硼烷,冷却至0℃,随后加入活化试剂三乙基硼氢化钠,在0℃下反应36小时,反应结束后,加入30wt%双氧水和氢氧化钠溶液,室温搅拌3小时,反应结束后,加水淬灭反应,乙酸乙酯萃取,干燥、旋蒸除去溶剂后,柱层析分离,得到产物式vi-1所示的s构型的手性2-间甲氧基苯基-1,5-二醇;所述1-(1-环丙基乙烯基)-3-甲氧基苯、频哪醇硼烷、r构型的coi
2-tip催化剂、三乙基硼氢化钠、双氧水中的h2o2、氢氧化钠的物质的量之比为1:2.5:0.05:0.1:50~60:24;
[0072]
所述r构型的coi
2-tip催化剂如式v-2所示
[0073][0074]
所述步骤(2)的反应步骤为:在空气中,反应管中加入式vi-1所示的2-间甲氧基苯基-1,5-二醇和二氯甲烷溶剂,在-20℃下依次滴加三乙胺和甲基磺酰氯,继续搅拌反应2小时,反应结束后,加入饱和碳酸氢钠溶液淬灭反应,二氯甲烷萃取,干燥、除去溶剂后加入正丙胺,继续搅拌反应15小时,反应结束后旋干,加入乙酸乙酯稀释,饱和碳酸氢钠溶液和饱和氯化钠溶液洗涤,无水硫酸钠干燥,除去溶剂后加入48wt%的氢溴酸水溶液,在120℃下搅拌反应2小时,反应结束后,加入饱和碳酸氢钠溶液淬灭反应,二氯甲烷萃取,干燥、除去溶剂后经柱层析分离得到如式vii所示的丙克拉莫。所述反应式(3)中手性2-间甲氧基苯基-1,5-二醇、三乙胺、甲基磺酰氯、正丙胺、氢溴酸的物质的量之比为1:3:2.5:30~40:15~25。
[0075]
进一步,手性1,5-二硼基烷烃化合物可以用于胺化反应合成手性1,5-二胺化合物,所述胺化反应的方法为:式iii所示的手性1,5-二硼基烷烃化合物与三氯化硼和苄基叠氮进行胺化反应,制得式viii所示的手性1,5-二胺化合物,反应式如式(4)所示:
[0076][0077]
进一步,优选手性1,5-二硼基烷烃化合物胺化反应合成手性1,5-二胺化合物的反
应步骤为:在氮气下,在反应管中加入式iii所示的手性1,5-二硼基烷烃,室温下滴加1mol/l的三氯化硼的二氯甲烷溶液,室温搅拌4~5小时后,于0℃下滴加苄基叠氮,滴加完毕回到室温反应12~15小时,反应结束后,加入3mol/l的氢氧化钠水溶液猝灭反应,乙醚萃取,干燥、除去溶剂后,经柱层析分离得到如式viii所示的手性1,5-二胺化合物;所述式iii所示的手性1,5-二硼基烷烃化合物、三氯化硼、苄基叠氮的物质的量之比为1:10~15:6~8,优选1:10:6。
[0078]
进一步,手性1,5-二硼基烷烃化合物可以用于suzuki偶联反应合成手性1,5-二芳基烷烃化合物,所述suzuki偶联反应的方法为:式iii所示的手性1,5-二硼基烷烃化合物,在醋酸钯和三苯基膦催化下,与式ix所示的芳基卤化物进行偶联反应,制得式x所示的手性1,5-二芳基烷烃化合物,反应式如式(5)所示:
[0079][0080]
式ix中,x基团优选为f、cl、br、i。更进一步,式ix中x基团最优选为cl、br、i;
[0081]
式ix或式x中,ar代表芳基基团,为c6~c20的芳香基或c4~c20的杂环芳基,所述芳基基团上的h不被取代或被一个以上的取代基c取代,所述取代基c为下列基团中的一种或多种:卤素、c1-c16的烷基、c1-c16的烷氧基、c1-c16的烷硫基、c2~c8的烯基、c3~c8的炔基、c3~c10的环烷基、苯基、四氢呋喃基、三氟甲基、甲氧羰基、硝基、羟基、c1-c3的醛基、羧基、氨基、c1-c16的酯基、c1-c16的硅烷基、苄氧基、酰胺基、酰基;优选为下列基团中的一种或多种:卤素、c1-c16的烷基、c1-c16的烷氧基、甲硫基、苯基、三氟甲基、甲氧羰基、羟基、甲醛基、氨基、c1-c10的酯基、c1-c10的硅烷基、酰胺基、乙酰基、乙烯基、乙炔基;更优选取代基c为下列基团中的一种或多种:卤素、c1-c10的烷基、c1-c10的烷氧基、甲硫基、苯基、三氟甲基、甲氧羰基、羟基、羟基甲基、氨基、c1-c10的酯基、酰胺基、甲醛基、乙酰基、乙烯基、乙炔基;
[0082]
进一步,优选ar为苯基、萘基、菲基、苯并呋喃基、4-甲氧酰基苯基、4
’‑
(1,2,2-三苯基乙烯基)苯基、或式c、式d、式e、式f、式g所示基团;苯基、萘基、菲基、苯并呋喃基上的h不被取代或被一个以上的取代基c取代;
[0083][0084]
进一步,优选手性1,5-二硼基烷烃化合物合成手性1,5-二芳基烷烃化合物的反应步骤为:在空气下,反应管中加入式iii所示的手性1,5-二硼基烷烃化合物和甲醇,室温下滴加4.5mol/l的氟氢化钾水溶液,室温搅拌2小时后,浓缩、过滤、乙醚洗涤,得到手性1,5-二氟硼酸钾盐;然后在氮气下,反应管中依次加入手性1,5-二氟硼酸钾盐、醋酸钯、三苯基膦、碳酸钾、式ix所示的芳基卤化物、甲苯和水(甲苯、水的体积比优选5:1),在95℃下加热搅拌24小时;反应完毕后,硅胶过滤,用乙酸乙酯作为洗脱剂,收集洗脱液除去溶剂后,经柱层析分离得到如式x所示的手性1,5-二芳基烷烃化合物;所述式iii所示的手性1,5-二硼基烷烃化合物、氟氢化钾、醋酸钯、三苯基膦、碳酸钾、对溴苯甲酸甲酯的物质的量之比为1:5~6:0.1:0.2:3~6:2。
[0085]
进一步,手性1,5-二硼基烷烃化合物可以用于卤代反应合成手性1,5-二卤代烷烃化合物,所述卤代反应的方法为:式iii所示的手性1,5-二硼基烷烃化合物与3,5-二(三氟甲基)溴苯、正丁基锂、nbs(n-溴代丁二酰亚胺)或nis(n-碘代丁二酰亚胺)进行卤代反应,相应得到式xi-1所示的手性1,5-二溴代烷烃或式xi-2所示的手性1,5-二碘代烷烃,反应式如式(6)所示:
[0086]
[0087]
进一步,优选的卤代反应的反应步骤为:在氮气下,反应管中加入3,5-二(三氟甲基)溴苯和四氢呋喃,冷却至-78℃,随后滴加正丁基锂(2.4mol/l),搅拌1小时,随后滴加式iii所示的手性1,5-二硼基烷烃化合物的四氢呋喃溶液,逐步升温至室温,继续搅拌1小时;最后滴加nbs或nis的四氢呋喃溶液,滴加完毕后在室温下搅拌2小时;反应结束后,用硫代硫酸钠水溶液猝灭反应,乙酸乙酯萃取,干燥、除去溶剂后经柱层析分离得到式xi-1所示的手性1,5-二溴代烷烃或式xi-2所示的手性1,5-二碘代烷烃;所述式iii所示的手性1,5-二硼基烷烃化合物、3,5-二(三氟甲基)溴苯、正丁基锂、nbs或nis的物质的量之比为1:4:2~4:4。
[0088]
进一步,手性1,5-二硼基烷烃化合物可以用于逐级偶联反应选择性合成手性5-芳基-1-硼基烷烃化合物,所述应用的方法为:式iii所示的手性1,5-二硼基烷烃化合物在醋酸钯和单磷配体ruphos(2-双环已基膦-2',6'-二异丙氧基联苯)催化下,与式xii所示的芳基卤化物或芳基酯进行偶联反应,制得式xiii所示的手性5-芳基-1-硼基烷烃化合物,反应式如式(7)所示:
[0089][0090]
式xii中,y基团优选为f、cl、br、i、otf、ots或oac。更进一步,式xii中y基团最优选为cl、br、i或otf;
[0091]
式xii、xiii中,r1、ar的定义如前所述。
[0092]
进一步,手性1,5-二硼基烷烃化合物逐级偶联反应选择性合成手性5-芳基-1-硼基烷烃化合物的反应步骤优选为:在氮气下,反应管中依次加入式iii所示的手性1,5-二硼基烷烃化合物、式xii所示的芳基卤化物或芳基酯、醋酸钯、单膦配体ruphos、叔丁醇钠、甲苯和水(甲苯、水的体积比优选10:1),加热至80℃搅拌反应24小时,反应结束后,硅胶过滤,用乙酸乙酯作为洗脱剂,收集洗脱液除去溶剂后,经柱层析分离得到如式xiii所示的手性5-芳基-1-硼基烷烃化合物。所述式iii所示的手性1,5-二硼基烷烃化合物、式xii所示的芳基卤化物、醋酸钯、单膦配体ruphos、叔丁醇钠的物质的量之比为1:1.5:0.05:0.1:3。
[0093]
进一步,手性5-芳基-1-硼基烷烃化合物可以进一步用于氧化反应合成手性5-芳基-1-戊醇化合物,所述应用的方法为:式xiii所示的手性5-芳基-1-硼基烷烃化合物在碱性条件下被双氧水氧化,反应得到式xiv所示的手性5-芳基-1-戊醇化合物,反应式如式(8)所示:
[0094][0095]
式xiii、xiv中,r1、ar的定义如前所述。
[0096]
进一步,手性5-芳基-1-硼基烷烃化合物氧化反应合成手性5-芳基-1-戊醇化合物的反应步骤优选为:在空气中,反应管中加入式xiii所示的手性5-芳基-1-硼基烷烃化合物和乙醚,随后依次加入(30wt%)双氧水和浓度为3mol/l的氢氧化钠溶液,室温搅拌3小时,反应结束后,加水淬灭反应,乙酸乙酯萃取,干燥、除去溶剂后,经柱层析分离得到式xiv所
示的手性5-芳基-1-戊醇化合物。所述式xiii所示的手性5-芳基-1-硼基烷烃化合物、双氧水中的h2o2、氢氧化钠的物质的量之比为1:50~60:20~30。
[0097]
进一步,手性5-芳基-1-硼基烷烃化合物可以进一步用于胺化反应合成手性5-芳基-1-戊胺化合物,所述的方法是将式xiii所示的手性5-芳基-1-硼基烷烃化合物与三氯化硼和苄基叠氮进行胺化反应,制得式xv所示的手性5-芳基-1-戊胺化合物,反应式如式(9)所示:
[0098][0099]
式xiii、xv中,r1、ar的定义如前所述。
[0100]
进一步,手性5-芳基-1-硼基烷烃化合物胺化反应合成手性5-芳基-1-戊胺化合物的反应步骤优选为:在氮气下,在反应管中加入式xiii所示的手性5-芳基-1-硼基烷烃化合物,室温下滴加1mol/l的三氯化硼的二氯甲烷溶液,室温搅拌4小时后,于0℃下滴加苄基叠氮,滴加完毕回到室温反应12小时,反应结束后,加入3mol/l的氢氧化钠水溶液猝灭反应,乙醚萃取,干燥、除去溶剂后,经柱层析分离得到如式xv所示的手性5-芳基-1-戊胺化合物。所述入式xiii所示的手性5-芳基-1-硼基烷烃化合物、三氯化硼、苄基叠氮的物质的量之比为1:5:3。
[0101]
进一步,手性5-芳基-1-硼基烷烃化合物可以进一步用于suzuki偶联反应合成手性1-芳基b-5-芳基a戊烷化合物,所述反应的方法为:式xiii所示的手性5-芳基-1-硼基烷烃化合物在醋酸钯和三苯基膦催化下,与式xvi所示的芳基卤化物发生偶联反应,反应得到式xvii所示的手性1-芳基b-5-芳基a戊烷化合物,反应式如式(10)所示:
[0102][0103]
式xiii、xvi、xvii中,ara、arb中的a、b用于区分不同位置的芳基基团ar,芳基基团ar的定义如前所述,ara、arb可以相同也可以不同。
[0104]
式xvi中,z优选为f、cl、br、i。更进一步,式xvi中z基团最优选为cl、br、i。
[0105]
进一步,手性5-芳基-1-硼基烷烃化合物进一步suzuki偶联反应合成手性1-芳基b-5-芳基a戊烷化合物的反应步骤优选为:在空气下,反应管中加入式xiii所示的手性5-芳基-1-硼基烷烃化合物和甲醇,室温下滴加4.5mol/l的氟氢化钾水溶液,30℃搅拌12小时后,浓缩、过滤、乙醚洗涤,得到手性5-芳基-1-氟硼酸钾盐,然后在氮气下,反应管中依次加入手性5-芳基-1-氟硼酸钾盐、醋酸钯、三苯基膦、碳酸钾、式xvi所示的芳基卤化物、甲苯和水,在95℃下加热搅拌24小时,反应完毕后,硅胶过滤,用乙酸乙酯作为洗脱剂,收集洗脱液,除去溶剂后,经柱层析分离得到如式xvii所示的手性1-芳基b-5-芳基a戊烷化合物。所述式xiii所示的手性5-芳基-1-硼基烷烃化合物、氟氢化钾、醋酸钯、三苯基膦、碳酸钾、式xvi所示的芳基卤化物的物质的量之比为1:2.5~4.5:0.1:0.2:3:1。
[0106]
本发明提供了一种利用噻唑啉亚胺吡啶碘化钴络合物作为催化剂,用于烯基环丙
烷的不对称双硼氢化反应,合成了一系列的手性1,5-二硼基烷烃。本发明反应使用简单易得的原料、催化剂和温和的反应条件,操作简单、催化体系高效,选择性高,对水、氧均不敏感,增加了该反应体系的实用性。
[0107]
本发明提供的手性1,5-二硼基烷烃可合成手性1,5-二醇化合物,或者也可通过手性1,5-二硼基烷烃,一锅法制备手性1,5-二醇化合物。手性1,5-二醇化合物通过一系列化学转化,可进一步合成市售药物丙莫拉克。本发明提供的手性1,5-二硼基烷烃也可以合成多种手性1,5-二官能团化产物,通过逐级选择性偶联反应,可以合成三芳基取代的戊烷,在医药领域和材料领域具有潜在的应用价值。
具体实施方式
[0108]
下面通过具体实施例对本发明的技术方案作进一步地具体说明,但本发明的保护范围不限于此:
[0109]
式i所示的烯基环丙烷化合物可参照org.lett.2017,19,5422.文献进行合成,配体tip可参照org.lett.2018,20,4028.文献进行合成。
[0110]
其中tip的具体制备方法如下:
[0111][0112]
(1)首先要合成oip配体,方法参考org.lett.2015,17,5939.文献进行合成。具体步骤如下:在氮气下,圆底烧瓶中加入(e)-1-(6-溴吡啶基)-n-(2,6-二乙基苯基)乙-1-亚胺(2.00g,6.0mmol)、(s)-4-乙基-4,5-噁唑啉(0.98g,7.2mmol)、醋酸钯(0.035g,0.15mmol)、1,2-二(二苯基膦)乙烷(0.074g,0.18mmol)、叔丁醇锂(1.96g,24mmol)和40毫升二氧六环,110℃加热搅拌24小时。反应结束后,硅胶过滤,乙酸乙酯作为洗脱剂,旋蒸除去溶剂后,用石油醚:乙酸乙酯(15:1)混合溶剂作为流动相,硅胶作为固定相,进行柱层析色谱分离得到黄色固体s构型的oip(1.74g,4.98mmol,83%产率)。ir(cm-1
):2969,2927,1644,1577,1454,1371.1h nmr(cdcl3,400mhz):δ8.50(dd,j=8.0,1.0hz,1h),8.16(dd,j=7.8,1.0hz,1h),7.88(dd,j=8.0,7.8hz,1h),7.11(d,j=7.6hz,2h),7.03(dd,j=8.4,6.6hz,1h),4.61(dd,j=9.6,8.4hz,1h),4.38-4.29(m,1h),4.17(dd,j=8.4,8.2hz,1h),2.45-2.28(m,4h),2.27(s,3h),1.91-1.79(m,1h),1.72-1.60(m,1h),1.12(td,j=7.6,0.8hz,6h),1.04(t,j=7.6hz,3h);
13
c nmr(cdcl3,100mhz):δ166.7,162.7,156.2,147.6,146.0,137.0,131.0,125.9,125.3,123.3,123.1,72.8,68.3,28.6,24.5,16.9,13.6,10.1.hrms(ei)calculated for[c
22h27
n3o]
+
requires m/z349.2154,found m/z349.2157.
[0113]
[0114]
(2)在氮气下,圆底烧瓶中加入s构型的oip配体(1.74g,5mmol)、五硫化二磷(1.67g,7.5mmol)和50毫升甲苯,100℃加热搅拌15小时。反应结束后,加入2mol/l的氢氧化钠水溶液淬灭反应,乙酸乙酯萃取三次,无水硫酸钠干燥。除去溶剂后,用石油醚:乙酸乙酯(15:1)混合溶剂作为流动相,硅胶作为固定相,进行柱层析色谱分离得到黄色固体(1,10g,3mmol,60%产率)。ir(cm-1
):2969,2926,1647,1454,1370.1h nmr(cdcl3,400mhz):δ8.45(dd,j=7.8,1.0hz,1h),8.18(dd,j=7.6,1.0hz,1h),7.87(dd,j=7.8,7.6hz,1h),7.11(d,j=7.6hz,2h),7.03(dd,j=8.4,6.6hz,1h),4.75-4.66(m,1h),3.45(dd,j=11.0,8.8hz,1h),3.04(dd,j=11.0,8.0hz,1h),2.45-2.27(m,4h),2.24(s,3h),2.02-1.90(m,1h),1.84-1.74(m,1h),1.16-1.08(m,9h);
13
c nmr(cdcl3,100mhz):δ169.1,166.4,155.6,150.1,147.6,136.9,131.1,125.9,123.3,122.6,122.4,80.0,36.3,28.3,24.5,16.7,13.7,11.0.hrms(ei)calculated for[c
22h27
n3s]
+
requires m/z365.1926,foundm/z365.1927.
[0115][0116]
(3)在氮气下,在反应管中加入s构型的tip配体(1.10g,3mmol)、碘化钴(0.90g,2.9mmol)和30毫升四氢呋喃,在室温下搅拌4小时,随后加入30毫升乙醚继续搅拌0.5小时。反应结束后,使用砂芯漏斗过滤,乙醚洗涤,得到如式v-1所示的s构型的coi
2-tip催化剂(1.52g,2.25mmol,78%产率)。
[0117]
制备r构型的coi
2-tip:
[0118]
步骤(1)中的(s)-4-乙基-4,5-噁唑啉改为(r)-4-乙基-4,5-噁唑啉,其他步骤和操作同上述步骤(1)(2)(3),最终得到r构型的coi
2-tip催化剂,如式v-2所示。
[0119][0120]
实施例1:钴催化烯基环丙烷不对称双硼氢化反应合成手性1,5-二硼基烷烃
[0121]
在氮气下,在反应管中依次加入催化剂s构型的coi
2-tip(v-1)(0.025mmol,5mol%)、烯基环丙烷(0.5mmol)、溶剂乙醚(1ml)和频哪醇硼烷(1.25mmol,187ul),冷却至0℃,随后加入活化试剂三乙基硼氢化钠(0.05mmol,1.0mol/l,50ul),在0℃下反应36小时。反应结束后,硅胶过滤,乙醚为洗脱溶剂,收集洗脱液旋蒸除去溶剂后柱层析分离(洗脱溶剂为石油醚或石油醚和乙酸乙酯的混合物)得到产物手性1,5-二硼基烷烃化合物。
[0122]
[0123]
iii-1:
[0124]
(r)-2-苯基-1,5-二频哪醇硼基戊烷
[0125]
(r)-2,2'-(2-phenylpentane-1,5-diyl)bis(4,4,5,5-tetramethyl-1,3,2-dioxaborolane)
[0126][0127]
无色油状液体,85%产率,对映选择性96%ee。ir(cm-1
):2982,2928,1456,1370,1320.1h nmr(cdcl3,400mhz):δ7.25-7.16(m,4h),7.14-7.09(m,1h),2.86-2.77(m,1h),1.63-1.54(m,2h),1.40-1.15(m,16h),1.08(s,12h),0.72(t,j=8.2hz,2h);
13
c nmr(cdcl3,100mhz):δ147.6,128.0,127.4,125.6,82.82,82.76,42.4,41.4,24.8,24.65,24.63,22.1.hrms(ei)calculated for[c
23h38
b2o4]
+
requires m/z400.2956,found m/z400.2958.
[0128]
iii-2:
[0129]
(r)-2-对甲硫基苯基-1,5-二频哪醇硼基戊烷
[0130]
(r)-2,2'-(2-(4-(methylthio)phenyl)pentane-1,5-diyl)bis(4,4,5,5-tetramethyl-1,3,2-dioxaborolane)
[0131][0132]
无色油状液体,83%产率,对映选择性95%ee。ir(cm-1
):2980,2927,1368,1319.1h nmr(cdcl3,400mhz):δ7.19-7.14(m,2h),7.13-7.09(m,2h),2.83-2.74(m,1h),2.45(s,3h),1.57(q,j=7.6hz,2h),1.35-1.15(m,16h),1.09(s,12h),0.71(td,j=8.0,2.2hz,2h);
13
c nmr(cdcl3,100mhz):δ145.1,134.7,128.0,127.1,82.9,82.8,42.3,40.9,24.8,24.7,24.6,22.0,16.5.hrms(ei)calculated for[c
24h40
b2o4s]
+
requires m/z446.2833,found m/z446.2829.
[0133]
iii-3:
[0134]
(r)-2-对羟甲基苯基-1,5-二频哪醇硼基戊烷
[0135]
(r)-(4-(1,5-bis(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pentan-2-yl)phenyl)methanol
[0136][0137]
无色油状液体,75%产率,对映选择性92%ee。ir(cm-1
):3401,2978,2925,1649,1512,1463,1371.1h nmr(cdcl3,400mhz):δ7.24(d,j=8.0hz,2h),7.18(d,j=8.0hz,2h),4.63(s,2h),2.88-2.78(m,1h),1.64-1.55(m,3h),1.35-1.15(m,16h),1.10(s,12h),0.71(td,j=8.0,2.0hz,2h);
13
c nmr(cdcl3,100mhz):δ147.4,138.1,127.6,126.9,82.9,82.8,65.4,42.3,41.1,24.8,24.7,24.6,22.1.hrms(esi)calculated for[c
24h40
b2o5na]
+
(m+na
+
)
requires m/z453.2954,found m/z453.2958.
[0138]
iii-4:
[0139]
(r)-2-(n-甲基吲哚基)-1,5-二频哪醇硼基戊烷
[0140]
(r)-5-(1,5-bis(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pentan-2-yl)-1-methyl-1h-indole
[0141][0142]
无色油状液体,70%产率,对映选择性95%ee。ir(cm-1
):2977,2927,1739,1370,1320.1h nmr(cdcl3,400mhz):δ7.42(s,1h),7.20(d,j=8.6hz,1h),7.08(dd,j=8.6,1.2hz,1h),6.98(d,j=3.0hz,1h),6.38(d,j=3.0hz,1h),3.74(s,3h),2.97-2.87(m,1h),1.70-1.58(m,2h),1.35-1.18(m,16h),1.08(s,6h),1.07(s,6h),0.78-0.64(m,2h);
13
c nmr(cdcl3,100mhz):δ138.6,135.4,128.4,128.3,121.4,119.1,108.6,100.5,82.74,82.71,42.8,41.4,32.8,24.8,24.71,24.65,22.2.hrms(esi)calculated for[c
26h42
b2no4]
+
(m+h
+
)requires m/z454.3294,found m/z454.3298.
[0143]
实施例2:钴催化烯基环丙烷不对称双硼氢化反应串联氧化反应一锅法合成手性1,5-二醇
[0144]
在氮气下,在反应管中依次加入催化剂coi
2-tip(v-1)(0.025mmol,5mol%)、烯基环丙烷(0.5mmol)、溶剂乙醚(1ml)和频哪醇硼烷(1.25mmol,187ul),冷却至0℃,随后加入活化试剂三乙基硼氢化钠(0.05mmol,1.0mol/l,50ul),在0℃下反应36小时。反应结束后,加入3毫升(30wt%)双氧水和4毫升浓度为3mol/l的氢氧化钠溶液,室温搅拌3小时。反应结束后,加入5毫升水淬灭反应,乙酸乙酯萃取三次,无水硫酸钠干燥。旋蒸除去溶剂后柱层析分离(洗脱溶剂为石油醚和乙酸乙酯的混合物)得到产物手性1,5-二醇。
[0145][0146]
vi-1:
[0147]
(s)-2-间甲氧基苯基-1,5-戊二醇
[0148]
(s)-2-(3-methoxyphenyl)pentane-1,5-diol
[0149][0150]
催化剂为r构型的coi
2-tip催化剂(v-2)
[0151]
无色油状液体,70%产率,对映选择性95%ee。1h nmr(cdcl3,400mhz):δ7.24(dd,j=7.8,8.0hz,1h),6.82-6.74(m,3h),3.80(s,3h),3.72(d,j=7.2hz,2h),3.57(t,j=6.4hz,2h),2.80-2.71(m,1h),1.95-1.77(m,3h),1.66-1.54(m,1h),1.52-1.40(m,2h);
13
c nmr(cdcl3,100mhz):δ159.8,143.8,129.6,120.3,114.0,111.7,67.3,62.6,55.1,48.3,
30.3,28.0.已知化合物,与文献chem.sci.2017,8,1811.数据相符。
[0152]
vi-2:
[0153]
(r)-2-苯基-1,5-戊二醇
[0154]
(r)-2-phenylpentane-1,5-diol
[0155][0156]
无色油状液体,81%产率,对映选择性96%ee。1h nmr(cdcl3,400mhz):δ7.36-7.29(m,2h),7.27-7.17(m,3h),3.73(d,j=7.4hz,2h),3.57(t,j=6.4hz,2h),2.83-2.73(m,1h),1.90-1.75(m,3h),1.67-1.56(m,1h),1.52-1.39(m,2h);
13
c nmr(cdcl3,100mhz):δ142.1,128.7,128.0,126.8,67.4,62.6,48.3,30.3,28.1.已知化合物,与文献chem.sci.2017,8,1811.数据相符。
[0157]
vi-3:
[0158]
(r)-2-对甲氧基苯基-1,5-戊二醇
[0159]
(r)-2-(4-methoxyphenyl)pentane-1,5-diol
[0160][0161]
无色油状液体,72%产率,对映选择性94%ee。1h nmr(cdcl3,400mhz):δ7.15-7.10(m,2h),6.90-6.85(m,2h),3.79(s,3h),3.76-3.65(m,2h),3.59(t,j=6.4hz,2h),2.79-2.70(m,1h),1.85-1.75(m,1h),1.64-1.40(m,5h);
13
c nmr(cdcl3,100mhz):δ158.4,133.9,128.9,114.1,67.6,62.7,55.2,47.5,30.4,28.2.已知化合物,与文献chem.sci.2017,8,1811.数据相符。
[0162]
vi-4:
[0163]
(r)-2-对甲基苯基-1,5-戊二醇
[0164]
(r)-2-(p-tolyl)pentane-1,5-diol
[0165][0166]
无色油状液体,83%产率,对映选择性95%ee。1h nmr(cdcl3,400mhz):δ7.13(d,j=7.8hz,2h),7.08(d,j=7.8hz,2h),3.68(d,j=7.0hz,2h),3.55(t,j=6.2hz,2h),2.78-2.68(m,1h),2.32(s,3h),2.08(brs,2h),1.87-1.76(m,1h),1.63-1.51(m,1h),1.50-1.39(m,2h);
13
c nmr(cdcl3,100mhz):δ139.0,136.2,129.3,127.8,67.4,62.4,47.7,30.2,28.0,20.9.已知化合物,与文献chem.sci.2017,8,1811.数据相符。
[0167]
vi-5:
[0168]
(r)-2-对氟苯基-1,5-戊二醇
[0169]
(r)-2-(4-fluorophenyl)pentane-1,5-diol
[0170][0171]
无色油状液体,85%产率,对映选择性91%ee。ir(cm-1
):3340,2977,2901,1510,1398.1h nmr(cdcl3,400mhz):δ7.21-7.14(m,2h),7.06-6.98(m,2h),3.78-3.66(m,2h),3.59(t,j=6.4hz,2h),2.83-2.74(m,1h),1.89-1.78(m,1h),1.66-1.40(m,5h);
13
c nmr(cdcl3,100mhz):δ161.7(d,j=245.0hz),137.8(d,j=3.0hz),129.4(d,j=8.0hz),115.5(d,j=21.2hz),67.4,62.6,47.6,30.3,28.2;
19
f nmr:(cdcl3,376.5mhz):δ-116.2.hrms(esi)calculated for[c
11h15
fo2na]
+
(m+na
+
)requires m/z221.0948,found m/z221.0949.
[0172]
vi-6:
[0173]
(r)-2-对氯苯基-1,5-戊二醇
[0174]
(r)-2-(4-chlorophenyl)pentane-1,5-diol
[0175][0176]
无色油状液体,83%产率,对映选择性92%ee。1h nmr(cdcl3,400mhz):δ7.30(d,j=8.2hz,2h),7.15(d,j=8.2hz,2h),3.80-3.66(m,2h),3.60(t,j=6.2hz,2h),2.83-2.78(m,1h),1.89-1.77(m,1h),1.70-1.38(m,5h);
13
c nmr(cdcl3,100mhz):δ140.7,132.5,129.3,128.8,67.3,62.6,47.7,30.3,28.1.已知化合物,与文献chem.sci.2017,8,1811.数据相符。
[0177]
vi-7:
[0178]
(r)-2-对溴苯基-1,5-戊二醇
[0179]
(r)-2-(4-bromophenyl)pentane-1,5-diol
[0180][0181]
无色油状液体,84%产率,对映选择性90%ee。ir(cm-1
):3333,2934,2871,1647,1596,1486.1h nmr(cdcl3,400mhz):δ7.48-7.43(m,2h),7.13-7.07(m,2h),3.78-3.67(m,2h),3.59(t,j=6.6hz,2h),2.81-2.72(m,1h),1.89-1.78(m,1h),1.65-1.54(m,2h),1.52-1.39(m,3h);
13
c nmr(cdcl3,100mhz):δ141.2,131.8,129.7,120.5,67.2,62.6,47.8,30.3,28.0.hrms(esi)calculated for[c
11h15
bro2na]
+
(m+na
+
)requires m/z281.0148,found m/z281.0148.
[0182]
vi-8:
[0183]
(r)-2-对三氟甲基苯基-1,5-戊二醇
[0184]
(r)-2-(4-(trifluoromethyl)phenyl)pentane-1,5-diol
[0185][0186]
无色油状液体,86%产率,对映选择性90%ee。ir(cm-1
):3339,2937,2876,1621,1421,1328.1h nmr(cdcl3,400mhz):δ7.58(d,j=8.2hz,2h),7.33(d,j=8.2hz,2h),3.82-3.72(m,2h),3.60(t,j=6.6hz,2h),2.91-2.83(m,1h),1.93-1.83(m,1h),1.81-1.60(m,3h),1.54-1.37(m,2h);
13
c nmr(cdcl3,100mhz):δ146.6,129.1(q,j=32.2hz),128.3,125.5(q,j=3.8hz),124.2(q,j=272.4hz),67.0,62.5,48.1,30.1,28.0;
19
f nmr:(cdcl3,376.5mhz):δ-180.9.hrms(esi)calculated for[c
12h15
f3o2na]
+
(m+na
+
)requires m/z271.0916,found m/z271.0920.
[0187]
vi-9:
[0188]
(r)-2-间甲基苯基-1,5-戊二醇
[0189]
(r)-2-(m-tolyl)pentane-1,5-diol
[0190][0191]
无色油状液体,81%产率,对映选择性95%ee。1h nmr(cdcl3,400mhz):δ7.21(dd,j=7.6,7.8hz,1h),7.05(d,j=7.6hz,1h),7.03-6.98(m,2h),3.77-3.67(m,2h),3.58(t,j=6.4hz,2h),2.79-2.70(m,1h),2.34(s,3h),1.87-1.57(m,4h),1.51-1.40(m,2h);
13
c nmr(cdcl3,100mhz):δ142.0,138.2,128.8,128.5,127.6,124.9,67.4,62.7,48.2,30.4,28.1,21.4.已知化合物,与文献chem.sci.2017,8,1811.数据相符。
[0192]
vi-10:
[0193]
(r)-2-间氟苯基-1,5-戊二醇
[0194]
(r)-2-(3-fluorophenyl)pentane-1,5-diol
[0195][0196]
无色油状液体,83%产率,对映选择性93%ee。ir(cm-1
):3330,2937,1589,1483,1449.1h nmr(cdcl3,400mhz):δ7.32-7.24(m,1h),6.99(d,j=7.8hz,1h),6.96-6.89(m,2h),3.77-3.68(m,2h),3.59(t,j=6.4hz,2h),2.84-2.74(m,1h),2.00-1.79(m,3h),1.66-1.54(m,1h),1.52-1.39(m,2h);
13
c nmr(cdcl3,100mhz):δ163.1(d,j=245.8hz),145.1(d,j=7.2hz),130.1(d,j=8.4hz),123.8(d,j=2.6hz),114.7(d,j=21.2hz),113.6(d,j=21.2hz),67.1,62.5,48.1,30.2,28.0;
19
f nmr:(cdcl3,376.5mhz):δ-113.0.hrms(esi)calculated for[c
11h15
fo2na]
+
(m+na
+
)requires m/z221.0948,found m/z221.0949.
[0197]
vi-11:
[0198]
(r)-2-邻氟苯基-1,5-戊二醇
[0199]
(r)-2-(2-fluorophenyl)pentane-1,5-diol
[0200][0201]
无色油状液体,55%产率,对映选择性74%ee。ir(cm-1
):3339,2976,2902,1487,1452,1397.1h nmr(cdcl3,400mhz):δ7.26-7.17(m,2h),7.14-7.08(m,1h),7.07-7.00(m,1h),3.79(d,j=6.8hz,2h),3.61(t,j=6.6hz,2h),3.23-3.14(m,1h),1.94-1.83(m,1h),1.80-1.62(m,3h),1.56-1.44(m,2h);
13
c nmr(cdcl3,100mhz):δ161.4(d,j=244.9hz),128.9(d,j=4.5hz),128.8(d,j=4.6hz),128.1(d,j=8.7hz),124.3(d,j=3.3hz),115.6(d,j=23.2hz),66.1,62.6,41.0,30.3,27.2;
19
f nmr:(cdcl3,376.5mhz):δ-118.1.hrms(esi)calculated for[c
11h15
fo2na]
+
(m+na
+
)requires m/z221.0948,found m/z221.0947.
[0202]
vi-12:
[0203]
(r)-2-(3,4-二甲基苯基)-1,5-戊二醇
[0204]
(r)-2-(3,4-dimethylphenyl)pentane-1,5-diol
[0205][0206]
无色油状液体,83%产率,对映选择性95%ee。ir(cm-1
):3339,2931,2871,1502,1453,1380.1h nmr(cdcl3,400mhz):δ7.09(d,j=7.6hz,1h),6.97(s,1h),6.96-6.92(m,1h),3.77-3.66(m,2h),3.59(t,j=6.6hz,2h),2.77-2.68(m,1h),2.25(s,3h),2.23(s,3h),1.84-1.74(m,1h),1.65-1.54(m,1h),1.54-1.35(m,4h);
13
c nmr(cdcl3,100mhz):δ139.3,136.8,135.0,129.9,129.3,125.3,67.6,62.8,47.9,30.5,28.1,19.9,19.3.hrms(esi)calculated for[c
13h20
o2na]
+
(m+na
+
)requiresm/z231.1356,found m/z231.1356.
[0207]
vi-13:
[0208]
(r)-2-(3,5-二甲基苯基)-1,5-戊二醇
[0209]
(r)-2-(3,5-dimethylphenyl)pentane-1,5-diol
[0210][0211]
无色油状液体,83%产率,对映选择性94%ee。ir(cm-1
):3340,2975,2911,1605,1456,1396.1h nmr(cdcl3,400mhz):δ6.88(s,1h),6.81(s,2h),3.78-3.67(m,2h),3.60(t,j=6.4hz,2h),2.76-2.67(m,1h),2.30(s,6h),1.84-1.73(m,1h),1.66-1.56(m,1h),1.53-1.30(m,4h);
13
c nmr(cdcl3,100mhz):δ141.9,138.2,128.5,125.8,67.5,62.8,48.3,30.5,28.1,21.3.hrms(esi)calculated for[c
13h20
o2na]
+
(m+na
+
)requires m/z231.1356,found m/z231.1356.
[0212]
vi-14:
[0213]
(r)-2-(4
’‑
(1,3-苯并二噁茂基))-1,5-戊二醇
[0214]
(r)-2-(benzo[d][1,3]dioxol-5-yl)pentane-1,5-diol
[0215][0216]
无色油状液体,84%产率,对映选择性91%ee。ir(cm-1
):3340,2976,2901,1492,1443,1395.1h nmr(cdcl3,400mhz):δ6.76(d,j=8.0hz,1h),6.70(d,j=1.4hz,1h),6.66(dd,j=8.0,1.4hz,1h),5.93(s,2h),3.74-3.62(m,2h),3.59(t,j=6.4hz,2h),2.76-2.66(m,1h),1.85-1.72(m,3h),1.60-1.41(m,3h);
13
c nmr(cdcl3,100mhz):δ148.0,146.3,135.8,121.3,108.4,107.8,100.9,67.5,62.7,48.1,30.3,28.3.hrms(ei)calculated for[c
12h16
o4]
+
requires m/z224.1049,found m/z224.1049.
[0217]
vi-15:
[0218]
(r)-2-(4
’‑
四氢萘基)-1,5-戊二醇
[0219]
(r)-2-(5,6,7,8-tetrahydronaphthalen-2-yl)pentane-1,5-diol
[0220][0221]
无色油状液体,83%产率,对映选择性94%ee。ir(cm-1
):3340,2976,2917,1445,1397.1h nmr(cdcl3,400mhz):δ7.02(d,j=7.8hz,1h),6.92(dd,j=7.8,1.6hz,1h),6.89(s,1h),3.77-3.66(m,2h),3.59(t,j=6.4hz,2h),2.79-2.67(m,5h),1.83-1.74(m,5h),1.65-1.56(m,1h),1.56-1.39(m,4h);
13
c nmr(cdcl3,100mhz):δ138.9,137.4,135.7,129.4,128.8,124.9,67.5,62.8,48.0,30.5,29.4,29.0,28.1,23.20,23.16.hrms(esi)calculated for[c
15h22
o2na]
+
(m+na
+
)requires m/z257.1512,found m/z257.1512.
[0222]
vi-16:
[0223]
(r)-2-(2
’‑
萘基)-1,5-戊二醇
[0224]
(r)-2-(naphthalen-2-yl)pentane-1,5-diol
[0225][0226]
无色油状液体,85%产率,对映选择性92%ee。ir(cm-1
):3339,2976,2904,1450,1396.1h nmr(cdcl3,400mhz):δ7.85-7.78(m,3h),7.67(s,1h),7.51-7.42(m,2h),7.36(dd,j=8.4,1.8hz,1h),3.88-3.79(m,2h),3.61(t,j=6.2hz,2h),3.02-2.93(m,1h),1.96-1.85(m,1h),1.81-1.69(m,1h),1.58-1.40(m,3h),1.29(brs,1h);
13
c nmr(cdcl3,100mhz):δ139.5,133.5,132.5,128.5,127.61,127.56,127.1,126.1,125.8,125.6,67.4,62.7,48.5,30.4,28.0.hrms(ei)calculated for[c
15h18
o2]
+
requires m/z230.1307,found m/z230.1307.
[0227]
vi-17:
[0228]
(r)-2-(2
’‑
二苯并呋喃基)-1,5-戊二醇
[0229]
(r)-2-(dibenzo[b,d]furan-2-yl)pentane-1,5-diol
[0230][0231]
无色油状液体,96%产率,对映选择性90%ee。ir(cm-1
):3339,2933,2873,1479,1446.1h nmr(cdcl3,400mhz):δ7.93(d,j=7.8hz,1h),7.78(d,j=1.4hz,1h),7.56(d,j=8.2hz,1h),7.51(d,j=8.4hz,1h),7.48-7.42(m,1h),7.33(dd,j=7.4,7.2hz,1h),7.28(dd,j=8.4,1.4hz,1h),3.86-3.75(m,2h),3.59(t,j=6.4hz,2h),2.99-2.89(m,1h),1.95-1.85(m,1h),1.82-1.62(m,3h),1.67-1.40(m,2h);
13
c nmr(cdcl3,100mhz):δ156.5,155.2,136.6,127.2,126.9,124.5,124.0,122.7,120.6,119.9,111.74,111.67,67.7,62.6,48.3,30.4,28.5.hrms(esi)calculated for[c
17h18
o3na]
+
(m+na
+
)requires m/z293.1148,found m/z293.1148.
[0232]
vi-18:
[0233]
(r)-2-(2
’‑
二苯并噻吩基)-1,5-戊二醇
[0234]
(r)-2-(dibenzo[b,d]thiophen-2-yl)pentane-1,5-diol
[0235][0236]
无色油状液体,89%产率,对映选择性90%ee。ir(cm-1
):3341,2931,2873,1465,1426.1h nmr(cdcl3,400mhz):δ8.15(dd,j=6.0,3.2hz,1h),7.99(s,1h),7.84(dd,j=6.0,3.2hz,1h),7.80(d,j=8.2hz,1h),7.49-7.42(m,2h),7.30(dd,j=8.2,1.4hz,1h),3.88-3.77(m,2h),3.59(t,j=6.4hz,2h),3.01-2.92(m,1h),1.96-1.85(m,1h),1.78-1.42(m,5h);
13
c nmr(cdcl3,100mhz):δ139.8,138.5,137.9,135.9,135.2,126.8,126.6,124.3,123.1,122.9,121.6,121.1,67.6,62.7,48.4,30.4,28.4.hrms(ei)calculated for[c
17h18
o2s]
+
requiresm/z286.1028,found m/z286.1030.
[0237]
vi-19:
[0238]
(r)-2-((8r,9s,13s,14s)-13-甲基-6,7,8,9,11,12,13,14,15,16-十氢螺环[环戊烯并[a]菲-17,2'-[1,3]二氧戊环]-3-yl)-1,5-戊二醇
[0239]
(r)-2-((8r,9s,13s,14s)-13-methyl-6,7,8,9,11,12,13,14,15,16-decahydrospiro[cyclopenta[a]phenanthrene-17,2'-[1,3]dioxolan]-3-yl)pentane-1,5-diol
[0240][0241]
无色油状液体,98%产率,对映选择性93%de。ir(cm-1
):3363,2977,2904,1451,
1396.1h nmr(cdcl3,400mhz):δ7.24(d,j=8.0hz,1h),6.97(d,j=8.0hz,1h),6.90(s,1h),4.00-3.85(m,4h),3.77-3.67(m,2h),3.60(t,j=6.6hz,2h),2.88-2.81(m,2h),2.76-2.67(m,1h),2.37-2.21(m,2h),2.07-1.99(m,1h),1.95-1.72(m,5h),1.68-1.29(m,11h),0.89(s,3h);
13
c nmr(cdcl3,100mhz):δ139.0,138.9,137.0,128.5,125.7,125.2,119.4,67.5,65.2,64.6,62.8,49.5,47.9,46.1,44.0,38.8,34.2,30.7,30.5,29.6,28.1,26.9,25.9,22.3,14.3.hrms(esi)calculated for[c
25h36
o4na]
+
(m+na
+
)requires m/z423.2506,found m/z423.2509.
[0242]
vi-20:
[0243]
(r)-2-((r)-2,8-二甲基-2-((4r,8r)-4,8,12-三甲基十三烷基)-6-色满基)-1,5-戊二醇
[0244]
(r)-2-((r)-2,8-dimethyl-2-((4r,8r)-4,8,12-trimethyltridecyl)chroman-6-yl)pentane-1,5-diol
[0245][0246]
无色油状液体,79%产率,对映选择性95%de。ir(cm-1
):3331,2926,2866,1477,1377.1h nmr(cdcl3,400mhz):δ6.77(s,1h),6.71(s,1h),3.75-3.57(m,4h),2.77-2.68(m,2h),2.68-2.59(m,1h),2.14(s,3h),1.85-1.69(m,3h),1.64-1.45(m,7h),1.43-1.24(m,15h),1.19-1.03(m,7h),0.89-0.82(m,12h);
13
c nmr(cdcl3,100mhz):δ151.0,131.5,127.7,126.4,120.5,76.0,67.6,62.9,47.6,40.4,39.4,37.5,37.44,37.41,37.3,32.8,32.7,31.2,30.6,28.3,28.0,24.84,24.79,24.4,24.3,22.7,22.6,22.4,21.0,19.7,19.6,16.2.hrms(esi)calculated for[c
32h56
o3na]
+
(m+na
+
)requires m/z511.4122,found m/z511.4124.
[0247]
实施例3:丙莫拉克的合成(应用实例一)
[0248]
在空气中,反应管中加入s构型的2-间甲氧基苯基-1,5-二醇(1.81g,8.6mmol)和50毫升二氯甲烷,在-20℃下依次滴加三乙胺(3.6ml,26mmol)和甲基磺酰氯(1.7ml,22mmol),继续搅拌2小时。反应结束后,加入饱和碳酸氢钠溶液淬灭反应,二氯甲烷萃取三次,无水硫酸钠干燥。旋蒸除去溶剂后加入正丙胺(25ml),继续搅拌15小时。反应结束后直接旋干,加入乙酸乙酯稀释,依次用饱和碳酸氢钠和饱和氯化钠溶液洗涤,无水硫酸钠干燥。旋蒸除去溶剂后加入48wt%的氢溴酸水溶液(25ml),在120℃下搅拌2小时。反应结束后,加入饱和碳酸氢钠淬灭反应,二氯甲烷萃取三次,无水硫酸钠干燥。旋蒸除去溶剂后经柱层析分离(石油醚/乙酸乙酯体积比=1/1-1/2)得到产物丙克拉莫(1.68g,7.7mmol,89%产率)。
2.75(m,3h),2.63-2.51(m,2h),2.37(brs,2h),1.78-1.67(m,1h),1.62-1.50(m,1h),1.47-1.33(m,2h);
13
c nmr(cdcl3,100mhz):δ143.3,139.8,139.0,128.6,128.43,128.38,128.3,128.1,127.7,127.2,126.9,126.6,54.8,53.7,53.5,48.7,45.7,31.9,27.3.hrms(esi)calculated for[c
25h31
n2]
+
(m+h
+
)requires m/z359.2482,found m/z359.2482.
[0263]
实施例5:手性1,5-二芳基烷烃化合物的合成(应用实例三)
[0264]
在空气下,反应管中加入手性1,5-二硼基烷烃(0.5mmol)和3毫升甲醇,室温下滴加4.5mol/l的氟氢化钾水溶液(0.6ml),室温搅拌2小时后,浓缩、过滤、乙醚洗涤,随后得到手性1,5-二氟硼酸钾盐。随后在氮气下,反应管中依次加入手性1,5-二氟硼酸钾盐、醋酸钯(0.012g,0.05mmol)、三苯基膦(0.027g,0.1mmol)、碳酸钾(0.42g,3mmol)、对溴苯甲酸甲酯(0.22g,1mmol)、10毫升甲苯和2毫升水,在95℃下加热搅拌24小时。反应完毕后,硅胶过滤,用乙酸乙酯作为洗脱剂,收集洗脱液旋蒸除去溶剂后经柱层析分离(石油醚/乙酸乙酯体积比=10/1)得到手性1,5-二芳基烷烃化合物。
[0265][0266]
x-1:
[0267]
(s)-2-苯基-1,5-二(4
’‑
甲氧羰基苯基)戊烷
[0268]
dimethyl4,4'-(2-phenylpentane-1,5-diyl)(s)-dibenzoate
[0269][0270]
无色油状液体,66%产率,对映选择性92%ee。ir(cm-1
):2931,1721,1609,1436.1h nmr(cdcl3,400mhz):δ7.89(d,j=8.2hz,2h),7.85(d,j=8.2hz,2h),7.26-7.20(m,2h),7.18-7.13(m,1h),7.13-7.09(m,2h),7.05-7.01(m,4h),3.89(s,3h),3.88(s,3h),2.96-2.77(m,3h),2.65-2.49(m,2h),1.73-1.64(m,2h),1.52-1.42(m,2h);
13
c nmr(cdcl3,100mhz):δ167.1,147.8,146.1,144.0,129.6,129.4,129.1,128.3,127.8,127.7,127.6,126.3,51.9,47.7,43.8,35.7,35.1,28.8.hrms(esi)calculated for[c
27h28
o4na]
+
(m+na
+
)requires m/z439.1880,found m/z439.1882.
[0271]
实施例6:手性1,5-二卤代烷烃化合物的合成(应用实例四)
[0272]
在氮气下,反应管中加入3,5-二三氟甲基溴苯(0.59g,2mmol)和2毫升四氢呋喃,冷却至-78℃,随后滴加正丁基锂(0.83ml,2.4mol/l),搅拌1小时。随后滴加手性1,5-二硼基烷烃(0.5mmol)的四氢呋喃溶液,逐步升温至室温,继续搅拌1小时。最后在反应中滴加nbs(0.36g,2mmol)或nis(0.45g,2mmol)的四氢呋喃溶液,滴加完毕后在室温下搅拌2小时。反应结束后,用硫代硫酸钠水溶液猝灭反应,乙酸乙酯萃取三次,无水硫酸钠干燥。旋蒸除去溶剂后经柱层析分离(石油醚/乙酸乙酯体积比=50/1)得到式xi-1所示的手性1,5-二溴代烷烃或式xi-2所示的手性1,5-二碘代烷烃。
dioxaborolane
[0291][0292]
无色油状液体,89%产率,对映选择性95%ee。ir(cm-1
):2978,1710,1605,1466.1h nmr(cdcl3,400mhz):δ7.56(d,j=2.0hz,1h),7.35(d,j=8.4hz,1h),7.30(s,1h),7.27-7.21(m,2h),7.20-7.10(m,3h),7.03(dd,j=8.4,1.0hz,1h),6.69-6.65(m,1h),2.88-2.79(m,1h),2.63(t,j=7.6hz,2h),1.70-1.59(m,2h),1.57-1.43(m,2h),1.22-1.08(m,2h),1.06(s,6h),1.04(s,6h);
13
c nmr(cdcl3,100mhz):δ153.5,147.3,144.9,137.1,128.1,127.4,127.3,125.7,124.9,120.3,110.8,106.3,82.9,41.5,38.8,35.7,30.0,24.6.hrms(esi)calculated for[c
25h31
bo3na]
+
(m+na
+
)requires m/z413.2258,found m/z413.2260.
[0293]
xiii-2:
[0294]
(r)-2-苯基-5-(4
’‑
(1,2,2-三苯基乙烯基)苯基)-1-频哪醇硼基戊烷
[0295]
(r)-4,4,5,5-tetramethyl-2-(2-phenyl-5-(4-(1,2,2-triphenylvinyl)phenyl)pentyl)-1,3,2-dioxaborolane
[0296][0297]
白色固体,73%产率,对映选择性96%ee。ir(cm-1
):2928,1599,1492,1446.1h nmr(cdcl3,400mhz):δ7.26-7.21(m,2h),7.18-7.11(m,3h),7.10-7.05(m,9h),7.03-6.98(m,6h),6.87(d,j=8.0hz,2h),6.82(d,j=8.0hz,2h),2.86-2.76(m,1h),2.53-2.37(m,2h),1.62-1.53(m,2h),1.52-1.33(m,2h),1.22-1.10(m,2h),1.08(s,12h);
13
c nmr(cdcl3,100mhz):δ147.3,143.91,143.89,141.0,140.84,140.76,140.4,131.34,131.28,131.1,128.1,127.60,127.56,127.5,127.4,126.3,126.2,125.7,82.9,41.4,38.9,35.5,29.0,24.6.hrms(esi)calculated for[c
43h45
bo2na]
+
(m+na
+
)requires m/z627.3405,found m/z627.3409.
[0298]
xiii-3:
[0299]
(r)-2-苯基-5-((8r,9s,13s,14s)-13-甲基-6,7,8,9,11,12,13,14,15,16-十氢-17h-环戊烯并[a]-17-氧代菲基)-1-频哪醇硼基戊烷
[0300]
(8r,9s,13s,14s)-13-methyl-3-((r)-4-phenyl-5-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pentyl)-6,7,8,9,11,12,13,14,15,16-decahydro-17h-cyclopenta[a]phenanthren-17-one
[0301][0302]
白色固体,56%产率,对映选择性97%de。ir(cm-1
):2929,1740,1498,1454.1h nmr(cdcl3,400mhz):δ7.26-7.21(m,2h),7.20-7.10(m,4h),6.90(d,j=8.0hz,1h),6.84(s,1h),2.89-2.79(m,3h),2.55-2.35(m,4h),2.30-2.21(m,1h),2.19-1.90(m,4h),1.70-1.35
(m,10h),1.22-1.09(m,2h),1.08(s,6h),1.07(s,6h),0.89(s,3h);
13
c nmr(cdcl3,100mhz):δ221.1,147.2,140.1,136.8,136.1,128.9,128.1,127.4,125.8,125.7,125.1,82.9,50.5,48.0,44.3,41.5,39.1,38.2,35.9,35.3,31.6,29.40,29.38,29.3,26.5,25.7,24.6,21.6,13.8.hrms(esi)calculated for[c
35h47
bo3na]
+
(m+na
+
)requires m/z549.3510,found m/z549.3515.
[0303]
xiii-4:
[0304]
(r)-2-苯基-5-(4-氯-3-(4-(((s)-3-四氢呋喃基)氧基)苄基)苯基)-1-频哪醇硼基戊烷
[0305]
2-((r)-5-(4-chloro-3-(4-(((s)-tetrahydrofuran-3-yl)oxy)benzyl)phenyl)-2-phenylpentyl)-4,4,5,5-tetramethyl-1,3,2-dioxaborolane
[0306][0307]
无色油状液体,73%产率,对映选择性96%de。ir(cm-1
):2932,1714,1610,1509,1473.1h nmr(cdcl3,400mhz):δ7.26-7.19(m,3h),7.17-7.11(m,3h),7.07(d,j=8.4hz,2h),6.91-6.87(m,2h),6.77(d,j=8.4hz,2h),4.91-4.86(m,1h),4.01-3.93(m,5h),3.92-3.86(m,1h),2.85-2.75(m,1h),2.52-2.39(m,2h),2.23-2.10(m,2h),1.61-1.57(m,2h),1.50-1.33(m,2h),1.20-1.08(m,2h),1.07(s,6h),1.06(s,6h);
13
c nmr(cdcl3,100mhz):δ155.7,147.1,141.4,138.3,132.1,131.1,131.0,129.9,129.2,128.1,127.6,127.3,125.8,115.2,82.9,73.1,67.2,41.4,38.8,38.3,35.1,33.0,29.2,24.6.hrms(esi)calculated for[c
34h42
bclo4na]
+
(m+na
+
)requires m/z583.2757,found m/z583.2763.
[0308]
xiii-5:
[0309]
(r)-2-苯基-5-(4-((e)-3,7-二甲基-2,6-辛烯-1-氧羰基)苯基)-1-频哪醇硼基戊烷
[0310]
(e)-3,7-dimethylocta-2,6-dien-1-yl(r)-4-(4-phenyl-5-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pentyl)benzoate
[0311][0312]
无色油状液体,43%产率,对映选择性95%ee。ir(cm-1
):2978,1718,1610,1509,1449.1h nmr(cdcl3,400mhz):δ7.91(d,j=8.0hz,2h),7.24(dd,j=7.4,7.2hz,2h),7.19-7.11(m,5h),5.45(t,j=7.0hz,1h),5.09(t,j=6.6hz,1h),4.81(d,j=7.0hz,2h),2.87-2.78(m,1h),2.65-2.53(m,2h),2.16-2.03(m,4h),1.75(s,3h),1.68(s,3h),1.65-1.57(m,5h),1.54-1.40(m,2h),1.20-1.09(m,2h),1.07(s,6h),1.06(s,6h);
13
c nmr(cdcl3,100mhz):δ166.7,148.1,147.0,142.1,131.8,129.6,128.3,128.1,127.9,127.3,125.8,123.7,118.5,82.9,61.7,41.4,39.5,38.7,35.8,29.0,26.3,25.7,24.6,17.7,16.5.hrms(esi)calculated for[c
34h47
bo4na]
+
(m+na
+
)requires m/z553.3460,found m/z553.3463.
[0313]
xiii-6:
[0314]
(r)-2-苯基-5-(4-((1r,2s,5r)-2-异丙基-5-甲基环己基氧羰基)苯基)-1-频哪
醇硼基戊烷
[0315]
(1r,2s,5r)-2-isopropyl-5-methyl cyclohexyl
[0316]
4-((r)-4-phenyl-5-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pentyl)benzoate
[0317][0318]
无色油状液体,69%产率,对映选择性95%de。ir(cm-1
):2930,1712,1610,1455.1h nmr(cdcl3,400mhz):δ7.91(d,j=8.0hz,2h),7.24(dd,j=7.0,6.6hz,2h),7.19-7.11(m,5h),4.90(td,j=10.6,4.0hz,1h),2.87-2.77(m,1h),2.59(t,j=7.2hz,2h),2.11(d,j=12.0hz,1h),2.01-1.89(m,1h),1.72(d,j=11.0hz,2h),1.65-1.42(m,6h),1.20-1.02(m,16h),0.97-0.85(m,7h),0.78(d,j=7.0hz,3h);
13
c nmr(cdcl3,100mhz):δ166.2,148.0,147.0,129.5,128.3,128.2,128.1,127.3,125.8,82.9,74.5,47.2,41.4,41.0,38.6,35.8,34.3,31.4,29.1,26.4,24.6,23.6,22.0,20.8,16.5.hrms(esi)calculated for[c
34h49
bo4na]
+
(m+na
+
)requires m/z555.3616,found m/z555.3619.
[0319]
xiii-7:
[0320]
(r)-2-苯基-5-(4-((3s,8s,9s,10r,13r,14s,17r)-10,13-二甲基
[0321]-2,3,4,7,8,9,10,11,12,13,14,15,16,17-十四烷-1h-环戊烯并[a]菲基)氧羰基)苯基)-1-频哪醇硼基戊烷
[0322]
(3s,8s,9s,10r,13r,14s,17r)-10,13-dimethyl-17-((r)-6-methylheptan-2-yl)-2,3,4,7,8,9,10,11,12,13,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-3-yl 4-((r)-4-phenyl-5-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pentyl)benzoate
[0323][0324]
白色固体,57%产率,对映选择性96%de。ir(cm-1
):2936,1715,1609,1465.1h nmr(cdcl3,400mhz):δ7.90(d,j=8.0hz,2h),7.24(dd,j=7.6,6.6hz,2h),7.19-7.11(m,5h),5.41(d,j=4.2hz,1h),4.89-4.78(m,1h),2.88-2.78(m,1h),2.59(t,j=7.2hz,2h),2.44(d,j=8.0hz,2h),2.06-1.94(m,3h),1.94-1.87(m,1h),1.87-1.78(m,1h),1.78-1.65(m,1h),1.65-1.40(m,10h),1.40-1.30(m,3h),1.30-0.95(m,28h),0.92(d,j=6.4hz,3h),0.87(d,j=6.6hz,6h),0.69(s,3h);
13
c nmr(cdcl3,100mhz):δ166.0,148.0,147.0,139.7,129.5,128.3,128.2,128.1,127.3,125.8,122.7,82.9,74.3,56.6,56.1,50.0,42.3,41.4,
39.7,39.5,38.7,38.2,37.0,36.6,36.1,35.81,35.77,31.9,31.8,29.1,28.2,28.0,27.8,24.6,24.3,23.8,22.8,22.5,21.0,19.4,18.7,11.8.hrms(esi)calculated for[c
51h75
bo4na]
+
(m+na
+
)requires m/z785.5651,found m/z785.5652.
[0325]
实施例8:手性5-芳基-1-戊醇化合物的合成(应用实例六)
[0326]
在空气中,反应管中加入手性5-芳基-1-硼基烷烃(0.2mmol)和2毫升乙醚,随后依次加入1.2毫升(30wt%)双氧水和1.5毫升浓度为3mol/l的氢氧化钠溶液,室温搅拌3小时。反应结束后,加入5毫升水淬灭反应,乙酸乙酯萃取三次,无水硫酸钠干燥。旋蒸除去溶剂后经柱层析分离(石油醚/乙酸乙酯体积比=5/1-3/1)得到产物手性5-芳基-1-戊醇化合物。
[0327][0328]
xiv-1:
[0329]
(r)-2-苯基-5-(5-苯并呋喃基)-1-戊醇
[0330]
(r)-5-(benzofuran-5-yl)-2-phenylpentan-1-ol
[0331][0332]
无色油状液体,99%产率,对映选择性96%ee。ir(cm-1
):3356,2931,1602,1536,1494,1466.1h nmr(cdcl3,400mhz):δ7.57(d,j=1.8hz,1h),7.39-7.28(m,4h),7.26-7.21(m,1h),7.18(d,j=7.4hz,2h),7.03(d,j=8.4hz,1h),6.70-6.66(m,1h),3.77-3.66(m,2h),2.86-2.75(m,1h),2.74-2.59(m,2h),1.81-1.68(m,1h),1.67-1.49(m,3h),1.29(brs,1h);
13
c nmr(cdcl3,100mhz):δ153.5,145.0,142.1,136.7,128.7,128.0,127.4,126.8,124.8,120.3,110.9,106.3,67.6,48.6,35.7,31.5,29.7.hrms(esi)calculated for[c
19h20
o2na]
+
(m+na
+
)requires m/z303.1356,found m/z303.1357.
[0333]
实施例9:手性5-芳基-1-戊胺化合物的合成(应用实例七)
[0334]
在氮气下,在反应管中加入手性5-芳基-1-硼基烷烃(0.1mmol),室温下滴加1mol/l的三氯化硼二氯甲烷溶液(0.5ml,0.5mmol),室温搅拌4小时后,于0℃下滴加苄基叠氮(0.04g,0.3mmol),滴加完毕回到室温反应12小时。反应结束后,加入3mol/l的氢氧化钠水溶液猝灭反应,乙醚萃取三次,无水硫酸钠干燥。旋蒸除去溶剂后经柱层析分离(石油醚/乙酸乙酯体积比=10/1-5/1)得到产物手性5-芳基-1-戊胺化合物。
[0335][0336]
xv-1:
[0337]
(r)-n-苄基-2-苯基-5-(4-氯-3-(4-(((s)-3-四氢呋喃基)氧基)苄基)苯基)-1-戊胺
[0338]
(r)-n-benzyl-5-(4-chloro-3-(4-(((s)-tetrahydrofuran-3-yl)oxy)benzyl)phenyl)-2-phenylpentan-1-amine
[0339][0340]
无色油状液体,78%产率,对映选择性96%de。ir(cm-1
):3027,2930,1609,1508,1475,1454.1h nmr(cdcl3,400mhz):δ7.32-7.24(m,4h),7.24-7.16(m,5h),7.13(d,j=7.4hz,2h),7.06(d,j=8.4hz,2h),6.89-6.84(m,2h),6.76(d,j=8.4hz,2h),4.90-4.84(m,1h),4.01-3.93(m,5h),3.92-3.85(m,1h),3.75(d,j=13.4hz,1h),3.67(d,j=13.4hz,1h),2.84-2.71(m,3h),2.53-2.38(m,2h),2.23-2.09(m,2h),1.69-1.50(m,3h),1.48-1.35(m,2h);
13
c nmr(cdcl3,100mhz):δ155.7,143.4,141.1,140.1,138.4,132.0,131.3,130.9,129.9,129.2,128.6,128.3,128.0,127.7,127.6,126.8,126.5,115.2,73.1,67.2,54.9,53.7,45.9,38.2,35.1,33.9,33.0,29.0.hrms(esi)calculated for[c
35h39
clno2]
+
(m+h
+
)requires m/z540.2664,found m/z540.2668.
[0341]
实施例10:手性1-芳基b-5-芳基a戊烷化合物的合成(应用实例八)
[0342]
在空气下,反应管中加入手性5-芳基-1-硼基烷烃(0.2mmol)和1毫升甲醇,室温下滴加4.5mol/l的氟氢化钾水溶液(0.2ml),30℃搅拌12小时后,浓缩、过滤、乙醚洗涤,随后得到手性5-芳基-1-氟硼酸钾盐。随后在氮气下,反应管中依次加入手性5-芳基-1-氟硼酸钾盐、醋酸钯(0.0045g,0.02mmol)、三苯基膦(0.011g,0.04mmol)、碳酸钾(0.085g,0.6mmol)、芳基卤化物(0.2mmol)、1毫升甲苯和0.2毫升水,在95℃下加热搅拌24小时。反应完毕后,硅胶过滤,用乙酸乙酯作为洗脱剂,收集洗脱液旋蒸除去溶剂后经柱层析分离(二氯甲烷/石油醚体积比=5/1)得到产物手性1-芳基b-5-芳基a戊烷化合物。
[0343][0344]
所有实例中,原料中xvi-1、xvi-2中的z基团是br。
[0345]
xvii-1:
[0346]
(s)-2-苯基-5-(5-苯并呋喃基)-1-(4-((e)-3,7-二甲基-2,6-辛烯-1-氧羰基)苯基)戊烷
[0347]
(e)-3,7-dimethylocta-2,6-dien-1-yl(s)-4-(5-(benzofuran-5-yl)-2-phenylpentyl)benzoatedimethyl
[0348][0349]
无色油状液体,63%产率,对映选择性97%ee。ir(cm-1
):2921,1717,1610,1446.1h nmr(cdcl3,400mhz):δ7.85(d,j=8.0hz,2h),7.79-7.55(m,1h),7.35(d,j=8.4hz,1h),7.26-7.19(m,3h),7.15(dd,j=7.4,6.8hz,1h),7.06-6.96(m,5h),6.67(s,1h),5.45(t,j=7.0hz,1h),5.09(t,j=6.0hz,1h),4.80(d,j=7.0hz,2h),2.97-2.77(m,3h),2.69-2.52(m,2h),2.16-2.03(m,4h),1.77-1.65(m,8h),1.60(s,3h),1.55-1.45(m,2h);
13
c nmr
(cdcl3,100mhz):δ166.7,153.4,146.1,145.0,144.3,142.2,136.7,131.8,129.4,129.1,128.3,128.0,127.7,127.3,126.2,124.8,123.7,120.3,118.4,110.9,106.3,61.7,47.8,43.8,39.5,35.6,35.1,29.8,26.3,25.7,17.7,16.5.hrms(esi)calculated for[c
36h40
o3na]
+
(m+na
+
)requires m/z543.2870,found m/z543.2871.
[0350]
xvii-2:
[0351]
(r)-2-苯基-5-(5-苯并呋喃基)-1-(4-((3s,8s,9s,10r,13r,14s,17r)-10,13-二甲基-2,3,4,7,8,9,10,11,12,13,14,15,16,17-十四烷-1h-环戊烯并[a]菲基)氧羰基)苯基)戊烷
[0352]
(3s,8s,9s,10r,13r,14s,17r)-10,13-dimethyl-17-((r)-6-methylheptan-2-yl)-2,3,4,7,8,9,10,11,12,13,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-3-yl 4-((s)-5-(benzofuran-5-yl)-2-phenylpentyl)benzoate
[0353][0354]
白色固体,74%产率,对映选择性97%de。ir(cm-1
):2936,1714,1610,1466.1h nmr(cdcl3,400mhz):δ7.84(d,j=8.0hz,2h),7.57(d,j=1.8hz,1h),7.35(d,j=8.2hz,1h),7.26-7.20(m,3h),7.16(dd,j=7.2,7.0hz,1h),7.07-6.96(m,5h),6.67(s,1h),5.41(d,j=3.8hz,1h),4.88-4.77(m,1h),2.97-2.78(m,3h),2.69-2.52(m,2h),2.44(d,j=7.6hz,2h),2.06-1.78(m,5h),1.77-1.64(m,3h),1.63-1.43(m,8h),1.40-1.29(m,3h),1.29-0.95(m,14h),0.92(d,j=6.4hz,3h),0.87(d,j=6.4hz,6h),0.68(s,3h);
13
c nmr(cdcl3,100mhz):δ166.0,153.4,146.0,145.0,144.3,139.7,136.8,129.3,129.0,128.4,128.3,127.7,127.3,126.2,124.8,122.7,120.3,110.9,106.3,74.3,56.6,56.1,50.0,47.8,43.8,42.3,39.7,39.5,38.2,37.0,36.6,36.2,35.8,35.6,35.1,31.9,31.8,29.8,28.2,28.0,27.9,24.3,23.8,22.8,22.6,21.0,19.4,18.7,11.8.hrms(esi)calculated for[c
53h68
o3na]
+
(m+na
+
)requires m/z775.5061,found m/z775.5060.
[0355]
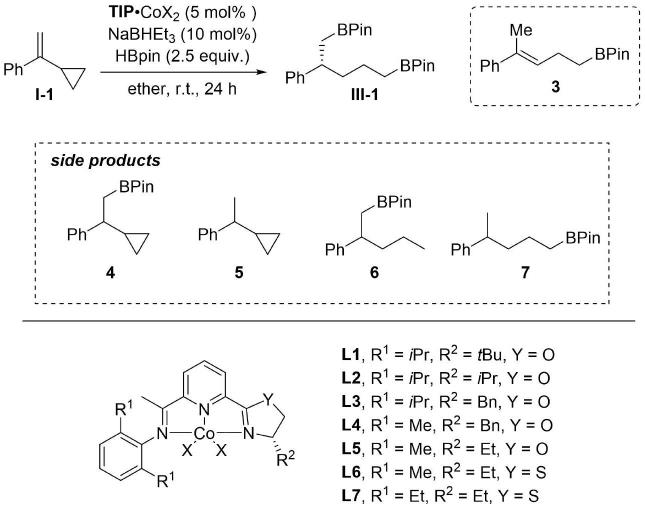
实施例11:手性1,5-二芳基烷烃的条件筛选
[0356][0357]
编号tip
·
cox2yield of iii-1(%)ee of iii-1(%)3/4/5/6/71l1
·
cocl2《2-27/6/39/0/102l2
·
cocl2107971/6/6/0/73l3
·
cocl2179064/6/0/0/134l4
·
cocl28689《1/7/0/《1/65l4
·
cobr28489《1/7/0/《1/56l4
·
coi28589《1/7/0/《1/37l5
·
coi28590《1/10/0/《1/48l6
·
coi28692《2/9/0/《1/《29l7
·
coi2829410/5/0/《1/《110al7
·
coi29396《1/4/0/《1/《1
[0358]
a 0℃下反应36小时
[0359]
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1