一种高耐酸能力的粟酒裂殖酵母菌及其构建方法
1.本发明属于生物技术领域,涉及一种过表达pap1基因的粟酒裂殖酵母及制备方法与应用。
背景技术:
2.酵母菌因生长速度快、发酵性能稳定、遗传操作简单等特点,成为绿色制造的优势底盘生物,广泛地应用于食品、生物医药、生物能源等多个领域。在工业发酵条件下,酵母菌经常受到高温、高渗透、高ph、有机酸等极端环境胁迫,严重限制了其在工业生长中的应用。其中,乙酸和乳酸是有机酸的典型代表。例如,在以纤维素和木质纤维素生物质为原料生产燃料酒精过程中,原料预处理阶段产生较多的乙酸,成为制约产物转化率的抑制物之一。在乳酸发酵过程中,目标产物自身的毒性是影响生物过程产量的一个重要限制因素。此外,乙酸和乳酸也是酱香型白酒发酵过程的两种主要的有机酸,这两种酸的积累严重抑制了酵母菌的生长和代谢,这是导致白酒产量下降的关键原因。
3.未解离的有机酸通过自由扩散和促进扩散进入细胞,然后解离成氢和酸阴离子。氢离子的增加导致细胞质酸化,抑制糖酵解过程、ras/pka途径和torc1途径,最终导致细胞内atp急剧下降并抑制酵母生长。此外,应激诱导的ros积累是对细胞的重要次级威胁,可能导致氧化应激甚至程序性细胞死亡。为了突破酸胁迫引起生产率低下的瓶颈,基于对微生物抗逆机制研究的深入,通过增强菌株胁迫耐受性的抗逆元件是构建高效微生物细胞工厂的有效手段。
4.细胞壁和细胞膜是微生物与抵御外界环境压力关键屏障。构成细胞壁的主要成分包括多糖,如β-1,3-葡聚糖、β-1,6-葡聚糖、几丁质和许多不同的糖蛋白,细胞壁任何成分的合成受阻都可能导致细胞壁防御功能下降。例如编码β-1,3-葡聚糖合酶基因fks1的缺失会引起更多的胞外酸向胞内扩散,造成胞内酸过量累积。细胞膜是外界胁迫条件作用细胞的主要靶点,也为酶的组装和功能提供合适的基质。细胞膜脂的主要成分包括磷脂、鞘脂、甾醇和膜蛋白其组成和结构的变化直接影响细胞膜的完整性、流动性和通透性。近年来,膜工程在增强微生物抗逆性能方面取得良好效果。通过在酿酒酵母中过表达acc1,fas1提升长链脂质比例、过表达ole1提高酰基链不饱和度、过表达sur1提高鞘脂含量以及过表达角鲨烯环氧酶家族基因提高麦角固醇的含量能够有效保持细胞膜的完整性,提高菌株对有机酸的耐受能力。由于有机酸造成细胞酸化的同时,还能产生较多ros,造成氧化胁迫、核损伤等多重破坏。因此与抗氧化相关的基因如ctt1、gpx1、sod1 等基因的过表达同样能够提升菌株的耐酸性能。除了以上模块化抗逆元件以外,一些转录因子如haa1,msn2,saa1等调控多种抗逆元件,作为靶标基因修饰后取得更为显著的效果。
5.相比较于酿酒酵母,一些非酿酒酵母如拜尔结合酵母、粟酒裂殖酵母、毕赤克鲁维酵母等具有更好的抗酸胁迫能力,以这些非酿酒酵母为出发菌株,通过基因工程技术能够更加高效地实现抗逆性能优良酵母的选育。
技术实现要素:
6.本发明的目的提供一种基因工程粟酒裂殖酵母(::pap1)及其制备方法,能够有效提升菌株对乙酸和乳酸的耐受能力,并且能提高菌株在酸胁迫下乙醇生产效率。
7.本发明利用基因工程技术在粟酒裂殖酵母中过表达基因pap1,以达到提高粟酒裂殖酵母对乙酸、乳酸耐受性能的目的。
8.一种粟酒裂殖酵母基因工程菌株,过表达pap1基因。
9.而且,所述pap1基因的核苷酸序列如seq id no.1所示或所述pap1基因的氨基酸序列如seq id no.2所示。
10.而且,过表达的出发菌株为粟酒裂殖酵母,分类命名:schizosaccharomyces probe;保藏编号cgmcc no.21792,于 2021年2月1日保存于中国微生物菌种保藏管理委员会普通微生物中心,保藏单位地址:北京市朝阳区北辰西路1号院3号。
11.而且,基因pap1整合表达到粟酒裂殖酵母基因组,所用的启动子为eno101,终止子为nmt1。
12.粟酒裂殖酵母基因工程菌株的构建方法,通过以下步骤获得:
13.(1)以粟酒裂殖酵母基因组为模板,pcr扩增得到上同源臂up、下同源臂low、eno101启动子、目的基因pap1片段、nmt1终止子,并以质粒pug6 为模板,pcr扩增筛选标记kanmx;
14.(2)通过融合pcr将eno101启动子、目的基因pap1片段、nmt1终止子融合在一起,作为pap1过表达盒;
15.(3)采用醋酸锂转化法将上同源臂up、下同源臂low、pap1过表达盒、筛选标记kanmx转化至粟酒裂殖酵母sp.65,获得重组菌株。
16.一种粟酒裂殖酵母基因工程菌株,将基因pap1整合表达到粟酒裂殖酵母基因组。
17.而且,所述基因pap1整合表达位点为基因pku70。
18.而且,菌株在糖度为16,且含有8g/l乙酸和30g/l乳酸的高粱水解液中培养下,乙醇的产量为61.93
±
0.09g/l 168h。
19.而且,所述pku70的核苷酸序列如seq id no.3所述。
20.本发明的有益成果是:
21.本发明相比较于出发菌株,本发明提供的重组粟酒裂殖酵母::pap1对乙酸、乳酸耐受能力得到显著提升。并且提高了菌株在酸胁迫发酵条件下的发酵效率。
22.本发明以耐酸性能优良的粟酒裂殖酵母sp.65为出发菌株,通过过表达基因 pap1进一步提高了菌株对乙酸、乳酸的耐受能力。16
°
bx高粱汁模拟发酵实验结果发现,在8g/l乙酸和30g/l乳酸同时胁迫下,重组菌株::pap1的乙醇产量为61.93
±
0.09g/l,比出发菌株高出56.27%。
附图说明
23.图1是重组菌株::pap1的构建流程图;
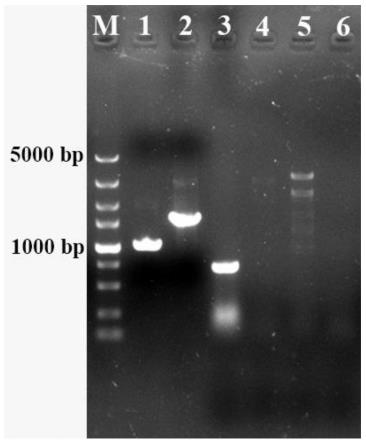
24.图2是阳性转化子的pcr验证图;
25.图3是重组菌株::pap1、pku70δ及出发菌株sp.65在固体培养基生长状态图;
26.图4是重组菌株::pap1、pku70δ及出发菌株sp.65在液体培养基生长曲线图;
27.图5是重组菌株::pap1及出发菌株sp.65的糖消耗情况;
28.图6是重组菌株::pap1及出发菌株sp.65的乙醇产生情况。
具体实施方式
29.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
30.一种同时提高乙酸、乳酸耐受能力的工程菌株(::pap1),其特征在于通过以下方式获得。以前期筛选自高酸环境的耐酸优势粟酒裂殖酵母sp.65(cgmccno.21792,中国微生物菌种保藏中心)为出发菌株,通过醋酸锂化学转化法将基因pap1核酸序列过表达盒导入,完成基因pap1的整合过表达。所述pap1的核酸序列如seq id no.1所示。所述的核苷酸序列,其编码的氨基酸序列参见seqid no.2。所述的pap1过表达盒的构建方法是选择粟酒裂殖酵母内源性强启动子 eno101、内源性终止子nmt1,通过融合pcr将启动子、pap1编码序列、终止子片段融合。所述整合过表达是基于同源重组原理,kanmx为筛选标记,以pku70 作为过表达位点,将pcr片段通过醋酸锂化学转化法将目的基因导入出发菌株 sp.65。
31.实施例1
32.菌株::pap1的构建
33.本实例所用的出发菌株为粟酒裂殖酵母cgmcc no.21792。所述ypd培养基为通用的完全培养基,固体培养基含2%进口琼脂粉。
34.根据genebank中的粟酒裂殖酵母基因组数据和整合质粒序列,设计了下述引物。
35.表1本实施例所用到引物
36.[0037][0038]
以粟酒裂殖酵母cgmcc no.21792基因组为模板,以pro-f和pro-r为引物,采用lataq酶通过pcr扩增目的基因过表达启动子pro(eno101),pcr反应条件:95℃5min;94℃40s,55℃1min,72℃30s,30个循环;72℃10min。 lataq酶pcr扩增体系如表2所示。
[0039]
以粟酒裂殖酵母cgmcc no.21792基因组为模板,以cds-f和cds-r为引物,采用la taq酶通过pcr扩增目的基因pap1,pcr反应条件:95℃5min; 94℃40s,56℃1min,72℃100s,30个循环;72℃10min。
[0040]
以粟酒裂殖酵母cgmcc no.21792基因组为模板,以ter-f和ter-r为引物,采用lataq酶通过pcr扩增目的基因过表达终止子ter(nmt1),pcr反应条件: 95℃5min;94℃40s,56℃1min,72℃60s,30个循环;72℃10min。
[0041]
以粟酒裂殖酵母cgmcc no.21792基因组为模板,以up-f/up-r、 low-f/low-r为引物,采用lataq酶通过扩增上同源与下同源臂。pcr反应条件:95℃5min;94℃40s,56℃1min,
72℃30s,30个循环;72℃10min。
[0042]
以质粒pug6为模板,以kanmx-f和kanmx-r为引物,采用lataq酶通过扩增筛选标记kanmx,pcr反应条件:95℃5min;94℃40s,56℃1min, 72℃100s,30个循环;72℃10min。
[0043]
表2本实施例中所用的lataq酶pcr扩增体系
[0044][0045]
将目的基因过表达启动子pro(eno101)片段、目的基因pap1片段、目的基因过表达终止子ter(nmt1)片段混合后,以pro-f和ter-r作为pcr引物,采用 primestar max酶将这三个片段融合在一起。融合pcr反应条件为:95℃5min; 98℃10s,56℃5s,72℃20s,35个循环;72℃10min。primestar max 酶pcr扩增体系如表3所示。
[0046]
表3本实施例中所用的primestar max酶pcr扩增体系
[0047][0048][0049]
前期实验研究表明,pku70作为粟酒裂殖酵母的非必需基因,其敲除对于菌株的基本生长性能以及耐酸性能无影响,因此将pku70作为过表达位点。基于同源重组原理,采用醋酸锂化学转化法将上同源臂、pap1过表达盒、kanmx、下同源臂导入出发菌株(图1)。
[0050]
具体方法如下:(1)菌株经过夜活化,以10%的接种比例重新转接至新鲜 ypd培养基。继续培养约3个小时,取10ml菌液于转速为4000
×
g、温度为4℃的条件下离心2分钟,去除上清收集菌体;(2)加入预冷的pbs缓冲液洗涤菌体两次,并采用1
×
te/liac工作液洗涤一次,收集菌体;(3)重新加入1
×
te/lia 工作液悬浮菌体,并于100r/min、30℃的条件,摇床孵育1小时;(4)孵育结束后,再次离心收集菌体,并加入10μl的1
×
te/liac工作液重悬菌体。然后依次加入5μl预变性的单链dna以及30μl用于转化的dna片段。吹吸混匀后,于30℃水浴30分钟;(5)加入700μl的1
×
te/liac-peg混合液,吹吸混匀,再次30℃水浴1小时;(6)30℃水浴结束后,转移至42℃水浴锅,热击15min;(7)自然冷却至室温,4000
×
g离心去除上
清,加入1mlypd培养基,100r/min、30℃修复培养3个小时;(8)离心收集菌体,无菌水洗涤后,取适量菌液涂布于含有150ug/l的kanamycin的ypd固体培养基,30℃培养 72小时;(9)挑取转化子,转接培养后提取基因组,采用验证引物进行定点pcr 验证。
[0051]
分别以t1-f/t1-r、t2-f/t2-r、t3-f/t3-r作为验证引物得到阳性转化子pcr 产物长度分别为1013bp、1450bp、718bp(图2,泳道1-3),出发菌株则没有对应的条带(图2,泳道4-6)。验证正确的菌株命名为::pap1。
[0052]
实施例2
[0053]
重组菌株耐酸性能评价-半定量点种
[0054]
通过半定量点种实验评估菌株::pap1对于乙酸、乳酸的耐受性能,并以出发菌株sp.65以及pku70缺失突变株pku70δ作为对照菌株。菌株::pap1、出发菌株以及pku70δ经过夜活化后,以10%接种比例转接至新鲜ypd液体培养基,继续摇床培养(30℃,180r/min)。培养至对数中期后离心收集菌体,并用无菌生理盐水洗涤两次。重新加入生理盐水重悬菌体,根据酶标仪测定结果,将菌悬液 od
600
调整为1
±
0.05。采用梯度稀释法将菌悬液依次稀释至10-1
、10-2
、10-3
、10-4
,取每个梯度样品2μl点种至乙酸浓度18g/l、乳酸浓度65g/l以及不添加酸的 ypd固体培养基。30℃恒温培养箱中培养2-3天,观察菌株三种情况并拍照记录。
[0055]
由图3所示,在没有添加酸的培养条件下,菌株::pap1、pku70δ、出发菌株生长状态表现一致,表明基因pku70的敲除以及pap1的过表达对于菌株的基本生长性能没有影响。乙酸或者乳酸胁迫下,pku70δ与出发菌株具有相似的生长状态,说明基因pku70与粟酒裂殖酵母的耐酸性无关。菌株::pap1则表现出明显的生长优势,这说明pap1的过表达能够显著地提升粟酒裂殖酵母对乙酸和乳酸的耐受能力。
[0056]
实施例3
[0057]
重组菌株耐酸性能评价-液体培养基生长
[0058]
菌株::pap1、pku70δ以及出发菌株经过夜活化后,以5%接种比例接种至含有16g/l乙酸、65g/l乳酸以及不添加酸的ypd液体培养基,调整各菌株以及不同处理下初始od600间差距不大于0.05。采用全自动生长曲线(oy growthcurves ab,helsinki,finland)测定仪监测各菌株生长状况,每2小时记录一次数据。
[0059]
如图4所示,三株菌在没有胁迫的条件下生长无差别,均在12h进入稳定期。16g/l乙酸胁迫下,出发菌株与pku70δ均在30h进入稳定期,菌株::pap1 则在第20h进入到稳定期,具有更快的生长速度。同样的,我们也在乳酸胁迫下观察到类似的结果。这些结果与点种实验结果一致。
[0060]
实施例4
[0061]
重组菌株发酵性能分析
[0062]
(1)高粱水解液制备:
[0063]
以优质高粱为原料,要求通过20目孔筛,按照高粱粉与水按1:3(w/v)混合,添加耐高温α-淀粉酶(10u/g原料)90℃水浴作用1h,然后继续加热煮沸 30min,之后补水至原体积,立即降温到60℃。糖化:以250u/g原料的比例添加糖化酶,在60℃糖化作用4h。糖化完成后降温到40℃,添加酸性蛋白酶 (30u/g原料)水浴作用4h。冷却至室温并使用4层纱布过滤获得清液,将糖度分别调整至8
°
bx、12
°
bx、16
°
bx,备用。
[0064]
(2)种子培养基:
[0065]8°
bx和12
°
bx水解液中各加入0.5%的酵母浸粉分别作为一级种子培养基和二级种子培养基,121℃高温灭菌20min,备用。
[0066]
(3)发酵培养基:
[0067]
无胁迫模拟液态培养基:16
°
bx水解液中加入0.5%酵母浸粉,并添加预先配制的营养液(硫酸铵6g/l、硫酸镁1.2g/l、磷酸氢二钾2.4g/l)作为基础发酵培养基,121℃高温灭菌20min,备用。在此基础上同时加入乙酸和乳酸,终浓度分别为8g/l、30g/l,作为酸胁迫培养基。
[0068]
(4)发酵方法
[0069]
一级种子培养:从固体培养基上刮一环酵母菌体至装有一级种子培养基的试管中,装液量10ml/30ml,30℃静止培养24h;
[0070]
二级种子培养:将一级种子液按照10%的比例接种至二级种子培养基,装液量100ml/250ml,30℃静置培养16h,得到酵母二级种子液。
[0071]
发酵接种:酵母二级种子液按照1
×
107cfu/ml的接种量接种到液态发酵培养基,装液量为150ml/250ml,30℃条件下静置培养7d。每隔12h取样,用于发酵液中还原糖以及乙醇的测定。
[0072]
(5)残糖测定采用斐林试剂滴定法。先进行空白滴定,准确吸取斐林甲乙液各5ml,然后加入10ml蒸馏水,预先再用滴定管滴入9ml葡萄糖标准溶液,放在电炉上加热,待溶液微微沸腾后再次缓慢滴入葡萄糖标准溶液,直至溶液由蓝色变为微黄色,多次滴定直至误差≤0.1ml,记录下消耗的葡萄糖标准溶液的体积v0。然后进行样品滴定,准确吸取斐林甲乙液各5ml,然后加入9ml 蒸馏水,再加入1ml待测样品,放在电炉上加热(如果还未滴入葡萄糖标准溶液就变色,那么说明待测样品的含糖量比较高,需要稀释后再进行滴定),待溶液微微沸腾后滴入葡萄糖标准溶液,速度由快变慢,直至蓝色完全消失变为微黄色,多次滴定直至误差≤0.1ml,记录下消耗的葡萄糖标准溶液的体积v1。然后按照如下公式计算样品里的残糖:
[0073][0074]
式中:
[0075]
x——残糖的含量,g/l;
[0076]v0
——空白液消耗葡萄糖的体积,ml;
[0077]v1
——样品或稀释液消耗标准葡萄糖溶液的体积,ml;
[0078]
c——标准葡萄糖溶液浓度,g/l,本公式中为1.0000g/l;
[0079]
n——试样稀释倍数;
[0080]
vs——所取试样稀释液体积,ml。
[0081]
在没有酸胁迫的时,出发菌株和::pap1表现出相近的还原糖消耗速率。在8 g/l乙酸和30g/l乳酸同时存在的条件下,出发菌株在168h的残糖量为53.33
±ꢀ
3.20g/l,而::pap1的残糖含量为2.87
±
0.33g/l,表明大部分糖已被消耗,发酵完成。
[0082]
(6)乙醇的检测
[0083]
采用高效液相色谱法检测发酵液中乙醇含量。色谱柱为aminex 87h,300
×ꢀ
7.8mm(bio-rad,hercules,ca),检测器为示差检测器(waters 2414,milford, ma)。流动相为流
速为0.6ml/min的5mmol/l硫酸;检测器温度为45℃,柱温为65℃。
[0084]
不添加酸的情况下,出发菌株和::pap1的最终乙醇产量分别为60.65
±
0.11 和62.14
±
0.29g/l,没有显著的差异。酸胁迫下,出发菌株在168h时乙醇产量为39.63
±
0.88g/l。重组菌株::pap1的乙醇产量为61.93
±
0.09g/l,比出发菌株高出56.27%。这说明基因pap1的过表达能够有效提高粟酒裂殖酵母在酸胁迫下乙醇产生效率。
[0085]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1