MRTX849化合物的晶型及其制备方法和用途与流程
mrtx849化合物的晶型及其制备方法和用途
技术领域
1.本发明涉及药物化学领域。具体而言,涉及mrtx849化合物的晶型及其制备方法和用途。
背景技术:
2.kras基因编码蛋白是细胞内信号传导途径中的一种信号传导蛋白,对细胞的生长存活和分化等功能具有重要的影响。当kras基因突变时,不能产生正常的ras蛋白,使细胞内信号传导紊乱,细胞增殖失控而癌变。kras g12c突变通常发生在约13%的肺癌患者、3%的结直肠癌和阑尾癌患者以及1%~3%的其他实体瘤患者中。kras是癌基因ras家族的成员,其突变可能诱导组成性信号转导,导致肿瘤细胞生长、增殖、侵袭和转移。
3.mrtx849是一种可口服的kras g12c小分子抑制剂,靶向致癌性kras取代突变g12c,具有潜在的抗肿瘤活性。mrtx849可以通过不可逆地与kras g12c结合并将其锁定在其不活跃的、与gdp结合的状态,从而阻断kras信号传导。临床ii期研究结果显示,在非小细胞肺癌,结直肠癌和阑尾癌患者中mrtx849均表现出良好的临床疗效。
4.mrtx849化合物的化学名称为(2s)-4-[7-(8-氯-1-萘)-5,6,7,8-四氢-2-[[((2s)-1-甲基-2-吡咯烷基]甲氧基]吡啶基[3,4-d]嘧啶-4-基]-1-(2-氟-1-氧代-2-丙烯-1-基)-2-哌嗪乙腈(以下称为“化合物i”),其结构式如下:
[0005][0006]
晶型是化合物固体分子在微观三维结构中长程有序排列而形成晶格的固体形态。药物多晶型现象是指固体药物分子存在两种或两种以上的不同晶型的现象。因为不同的晶型其理化性质不同,固态药物分子的不同晶型可能在体内有不同的溶出、吸收,进而在一定程度上影响药物的临床疗效和安全性,特别是对于难溶性固体药物而言,晶型对生物利用度的影响会更大。因此,药物晶型是固态药物研究及开发过程中的重要一环,也是药物质量控制的重要内容。
[0007]
本技术的发明人意外发現了本发明提供的化合物i的不同晶型,其在理化性质、制剂加工性能及生物利用度等方面具有优势,例如在熔点、溶解度、引湿性、提纯作用、稳定性、黏附性、可压性、流动性、体内外溶出、生物有效性等方面中的至少一方面存在优势,为
含化合物i的药物开发提供了更好的选择,具有非常重要的意义。
技术实现要素:
[0008]
本发明的主要目的是提供化合物i的新晶型及其制备方法和用途。
[0009]
根据本发明的目的,本发明提供化合物i的晶型。
[0010]
进一步地,本发明提供化合物i的晶型可以为晶型dciii(以下称为晶型dciii)。
[0011]
一方面,使用cu-ka辐射,所述晶型dciii的x射线粉末衍射在衍射角2theta值为4.4
°±
0.2
°
,14.2
°±
0.2
°
,16.8
°±
0.2
°
中的1处、或2处、或3处有特征峰。
[0012]
进一步地,使用cu-ka辐射,所述晶型dciii的x射线粉末衍射在衍射角2theta值还为8.9
°±
0.2
°
,13.3
°±
0.2
°
,16.1
°±
0.2
°
中的1处、或2处、或3处有特征峰;优选地,所述晶型dciii的x射线粉末衍射在衍射角2theta值还为8.9
°±
0.2
°
,13.3
°±
0.2
°
,16.1
°±
0.2
°
中的3处有特征峰。
[0013]
进一步地,使用cu-ka辐射,所述晶型dciii的x射线粉末衍射在衍射角2theta值还为18.0
°±
0.2
°
,20.8
°±
0.2
°
,22.6
°±
0.2
°
中的1处、或2处、或3处有特征峰;优选地,所述晶型dciii的x射线粉末衍射在衍射角2theta值还为18.0
°±
0.2
°
,20.8
°±
0.2
°
,22.6
°±
0.2
°
中的3处有特征峰。
[0014]
另一方面,使用cu-ka辐射,所述晶型dciii的x射线粉末衍射在衍射角2theta值为4.4
°±
0.2
°
,8.9
°±
0.2
°
,13.3
°±
0.2
°
,14.2
°±
0.2
°
,16.1
°±
0.2
°
,16.8
°±
0.2
°
,18.0
°±
0.2
°
,20.8
°±
0.2
°
,22.6
°±
0.2
°
中或1处、或2处、或3处、或4处、或5处、或6处、或7处、或8处、或9处有特征峰。
[0015]
限制性地,在一个实施方案中,晶型dciii的x射线粉末衍射图基本如图1所示。
[0016]
非限制性地,在一个实施方案中,晶型dciii在100度附近开始出现吸热峰,差示扫描量热分析图基本如图2所示。
[0017]
限制性地,在一个实施方案中,晶型dciii的x射线粉末衍射图基本如图3所示。
[0018]
非限制性地,在一个实施方案中,晶型dciii在30度及95度附近开始出现吸热峰,差示扫描量热分析图基本如图4所示。
[0019]
根据本发明的目的,本发明还提供所述晶型dciii的制备方法,所述制备方法包括:
[0020]
将化合物i的固体置于醇类溶剂中形成溶液,然后在该溶液中逐滴加入水至溶液浑浊,在一定温度下搅拌一段时间,分离、干燥,得到化合物i的晶型。
[0021]
进一步的,所选醇类优选乙醇;所述水与醇的溶剂体积比优选2:1~1:1.5,更优选1.2:1;所述搅拌温度优选-20度~30℃,更优选5度;所述干燥条件优选20-50度。
[0022]
进一步的,在逐滴加入水至溶液浑浊与在一定温度下搅拌一段时间之间还需要加入晶种;在一定温度下搅拌一段时间与分离、干燥之间还需要静置。
[0023]
如上所述的化合物i的晶型的另一种制备方法为:将化合物i的固体置于含醚类与醇类的混合溶剂中形成溶液,然后在该溶液中逐滴加入水至溶液浑浊,在一定温度下搅拌一段时间,静置、分离、干燥,得到化合物i的晶型。
[0024]
进一步的,所述分离指离心。
[0025]
进一步的,在该制备方法中,醚类选自四氢呋喃(thf);醇类选自叔丁醇;所述混合
溶剂中thf/叔丁醇的体积比为1:1-3,优选为1:2。
[0026]
本发明提供的晶型dciii具有如下有益效果:
[0027]
1)本发明晶型dciii具有较高的溶解度。
[0028]
相较于cn113429405a的晶型dci,本发明晶型dciii在sgf(模拟胃液),fassif(禁食状态模拟肠液)中,具有更高的溶解度。在sgf中,本发明晶型dciii的溶解度也大于8mg/ml,表明晶型dciii在胃液中方停留阶段,可获得较高的溶解度,进而提供生物利用度;在fassif(禁食状态模拟肠液)中,本发明的晶型dciii比cn113429405a的晶型dci更有更高的溶解度,而较高的溶解度有利于提高药物在人体内的吸收,提高药物的生物利用度;此外,在保证药品疗效的前提下,较高的溶解度也可促进降低药物载药量,降低药物的毒副作用,提高药物使用的安全性,具有重要的临床意义。
[0029]
2)本发明提供的晶型dciii具有良好的机械稳定性。
[0030]
晶型dciii具有良好的机械稳定性。晶型dciii在研磨前后,未发生转晶,且样品结晶度未观察到明显的下降,由此说明晶型dciii具有良好的机械稳定性。良好的机械稳定性可确保样品在后期制剂工艺过程中,不会因为机械研磨、粉碎等外力轻易发生转晶,降低了制剂工艺过程转晶的风险,提高了制剂工艺的可开发性。
[0031]
根据本发明的目的,本发明还提供一种药物组合物,所述药物组合物包含有效治疗量的化合物i的晶型dciii及药学上可接受的载体或辅料。
[0032]
进一步地,本发明提供化合物i的晶型dciii在制备kras g12c抑制剂药物中的用途。
[0033]
更进一步地,本发明提供化合物i的晶型dciii在制备治疗非小细胞肺癌、结直肠癌或阑尾癌药物中的用途。
[0034]
本发明中,所述“搅拌”,采用本领域的常规方法完成,例如磁力搅拌或机械搅拌,搅拌速度为50-1800转/分钟,其中,磁力搅拌优选为300-900转/分钟,机械搅拌优选为100-300转/分钟。
[0035]
所述“分离”,采用本领域的常规方法完成,例如离心或过滤,“离心”的操作为:将欲分离的样品置于离心管中,以10000转/分速率进行离心,至固体全部沉至离心管底部。
[0036]
所述“干燥”可以在室温或更高的温度下进行。干燥温度为室温到约50℃,或者到40℃。干燥时间可以为2~48小时,或者过夜。干燥在通风橱、鼓风烘箱或真空烘箱里进行。
[0037]
本发明中,“晶体”或“多晶型”指被x射线粉末衍射图表征证实的固体。本领域技术人员能够理解,这里所讨论的理化性质可以被表征,其中的实验误差取决于仪器的条件、样品的准备和样品的纯度,特别是,本领域技术人员公知,x射线粉末衍射图通常会随着仪器条件的不同而有所改变,特別需要指出的是,x射线粉末衍射图中衍射峰的相对强度也可能随着实验条件的变化而变化,所以衍射峰强度的顺序不能作为唯一或决定性因素。事实上,x射线粉末衍射图中衍射峰的相对强度与晶体的择优取向有关,本发明所示的衍射峰强度为说明性而非用于绝对比较。另外,衍射峰位置的实验误差通常在5%或更少,这些位置的误差也应该被考虑进去,通常允许有
±
0.2的误差。另外,由于样品厚度等实验因素的影响,会造成衍射峰角度的整体偏移,通常允许一定的偏移。因而,本领城技术人员可以理解的是,本发明保护晶型的x射线粉末衍射图不必和这里所指的实施例中的x射线粉末衍射图完全一致,任何具有和这些图谱中的特征峰相同或相似的x射线粉末衍射图的晶型均属于本
发明的范畴之内。
[0038]
本领域技术人员能够将本发明所列的x射线粉末衍射图和一个未知晶型的x射线粉末衍射图相比较,以证实这两组图反映的是相同还是不同的晶型。
[0039]
在一些实施方案中,本发明的晶型dciii是纯的,基本没有混合任何其他晶型。本发明中“基本没有”当用来指新晶型时指这个晶型含有少于20%(重量)的其他晶型,尤其指少于10%(重量)的其他晶型,更指少于5%(重量)的其他晶型,更指少于1%(重量)的其他晶型。
[0040]
本发明中术语“约”,当用来指可測量的数值时,例如质量、时间、温度等,意味着可围绕具体数值有一定的浮动的范围,该范围可以为
±
10%,
±
5%,
±
1%,
±
0.5%或
±
0.1%。
[0041]
本发明中用“度”来作为温度的单位,应理解为摄氏度。
附图说明
[0042]
图1为根据实施例1b所得化合物i的晶型dciii的xrpd图。
[0043]
图2为根据实施例1b所得化合物i的晶型dciii的dsc图。
[0044]
图3为根据实施例1c所得化合物i的晶型dciii的xrpd图。
[0045]
图4为根据实施例1c所得化合物i的晶型dciii的dsc图。
[0046]
图5为化合物i的晶型dciii研磨前后xrpd叠图(上面为研磨前的xrpd图,下面为研磨后的xrpd图)。
具体实施方式
[0047]
结合以下实施例对本发明做详细说明,所述实施例详细描述本发明的晶型的制备和使用方法。对本领域技术人员显而易见的是,对于材料和方法两者的许多改变可在不脱离本发明范围的情况下实施。
[0048]
本发明中所用到的缩写的解释如下:
[0049]
xrpd:x射线粉末衍射
[0050]
dsc:差示扫描量热
[0051]
采集数据所用的仪器及方法:
[0052]
本发明所述的x射线粉末衍射图在bruker d2 phaser x射线粉末衍射仪上采集。
[0053]
本发明所述的x射线粉末衍射的方法参数如下:
[0054]
x射线光源:cu ka
[0055]
kal(a):1.54060;ka2(a)1.54439
[0056]
ka2/ka1强度比例:0.50
[0057]
电压:30千伏特(kv)
[0058]
电流:10毫安培(ma)
[0059]
扫描范围:自3.0至40.0度
[0060]
本发明所述的差示扫描量热分析(dsc)图在梅特勒dsc3上采集,差示扫描量热分析(dsc)的方法参数如下:
[0061]
扫描速率:10℃/min
[0062]
保护气体:氮气
[0063]
除非特殊说明,以下实施例均在室温条件下操作,所述“室温”不是特定的温度值,是指10-30℃温度范围。
[0064]
根据本发明,作为原料的所述化合物i和/或其盐包括但不限于固体形式(结晶或无定形)、油状、液体形式和溶液。优选地,作为原料的化合物i和/或其盐为固体形式。
[0065]
以下实施例中所使用的化合物i可文献所记載的方法制备获得。
[0066]
实施例1:晶型dciii的制备方法
[0067]
实施例1a:
[0068]
称量31mg化合物i加入5ml玻璃瓶中,在室温下加入1.155ml etoh并充分震荡搅拌使溶液澄清,放置于磁力搅拌器上搅拌。逐滴滴加1.55ml h2o至溶液呈现浑浊,并转移至5℃环境搅拌23h,离心干燥后测试xrpd,得到晶型dciii。
[0069]
实施例1b:
[0070]
称量100mg化合物i加入20ml玻璃瓶中,在室温下加入3.465ml etoh并充分震荡搅拌使溶液澄清,放置于磁力搅拌器上搅拌。逐滴滴加3ml h2o至溶液呈现浑浊,加入1.5mg实施例1a获得的晶种,并在室温下搅拌40min之后转移至5℃环境继续搅拌3h,随后5℃静置16h,离心干燥后测试xrpd,得到晶型dciii。
[0071]
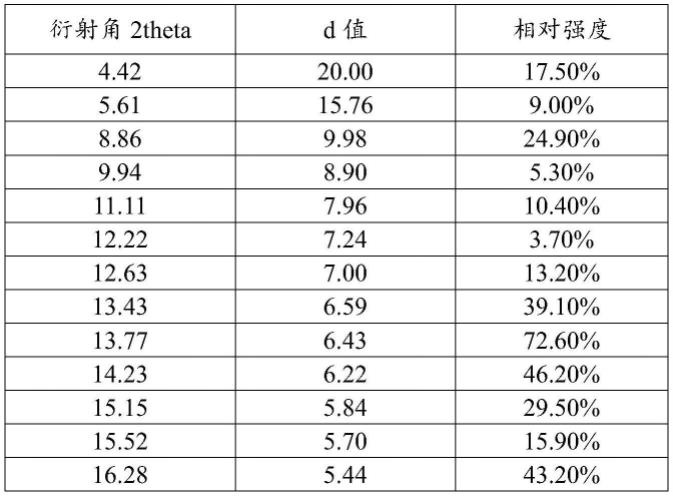
选取实施例1b所得晶型dciii的xrpd图如图1所示,xrpd数据如表1所示。
[0072]
dsc如图2所示,加热至100℃附近开始出现一个吸热峰。
[0073]
表1、实施例1b所得化合物i晶型的xrpd数据
[0074]
[0075][0076]
实施例1c:
[0077]
称量50mg化合物i加入20ml玻璃瓶中,在室温下加入1.5ml thf/叔丁醇(v/v=1:2)混合溶剂并充分震荡搅拌使溶液澄清,后逐滴滴加3.124ml h2o至溶液呈现浑浊,转移至5℃环境继续搅拌4h,随后5℃静置70h,离心干燥后得到粉末固体,35℃干燥2h,随后-20℃保存,得到的即为本发明所示晶型dciii。
[0078]
选取实施例1c所得晶型dciii的xrpd图如图3所示,dsc图如图4所示。xrpd数据如表2所示。
[0079]
表2、实施例1c所得化合物i晶型的xrpd数据
[0080]
[0081][0082]
实施例2:晶型dciii的动态溶解度
[0083]
进行药物溶解度测试以预测药物体内性能的时候,很重要的一点是尽可能的模拟体内条件,对口服药,用sgf(模拟胃液),fassif(禁食状态模拟肠液),可以模拟体内条件的影响,在此类介质中测试的溶解度与人体环境中的溶解度更加接近。
[0084]
取本发明的晶型dciii约20mg分别悬浮于1.5ml的sgf,1.5的ml的fassif配置成悬浮液,平衡1小时、4小时和24小时后分别用高效液相色谱法测试溶液中样品的含量(mg/ml)。实验结果如下表3所示:
[0085]
表3、化合物i的晶型dciii在sgf或fassif中的溶解度
[0086][0087]
动态溶解度实验结果表明:相较于cn113429405a的晶型dci,本发明的晶型dciii在sgf(模拟胃液)中溶解度也较高(大于8mg/ml),由此推测药品在胃液中也能较快的吸收;此外,在fassif(禁食状态模拟肠液)中,本发明晶型dciii比cn113429405a的晶型dci具有更高的溶解度。以上数据表明,本发明晶型dciii在模拟生物介质中具有更高的溶解度,可促进药物吸收,提高药物在体内的生物利用度。
[0088]
实施例3:晶型dciii的机械稳定性
[0089]
将晶型dciii置于研钵中,手动研磨5分钟,研磨前后进行xrpd测试。研磨前后xrpd对比如图5所示。结果表明,本发明晶型dciii经过研磨后晶型不变,且结晶度未观察到明显的下降,由此说明晶型dciii具有良好的机械稳定性。
[0090]
实施例4:化合物i的晶型dciii的制剂制备
[0091]
片剂:取适量化合物i的晶型dciii,与辅料混合均匀,辊压制成薄片并粉碎成颗粒,与外加辅料混合均匀,选用合适的模具压制成形。
[0092]
胶囊:取适量化合物i的晶型dciii,与辅料混合均匀,辊压制成薄片并粉碎成颗粒,与外加辅料混合均匀,罐装至合适大小的胶囊。
[0093]
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围,而根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1