一种下呼吸道样本处理试剂、诺卡菌检测试剂盒及核酸扩增方法
1.本发明涉及医疗领域,尤其涉及一种下呼吸道样本处理试剂、诺卡菌检测试剂盒及核酸扩增方法。
背景技术:
2.诺卡菌主要引起人类肺部感染。然而,肺诺卡菌病和肺结核病临床症状和影像学表现难以区分。前者目前主要依赖于临床微生物实验室培养技术,但该方法灵敏度低,这在很大程度上制约了诺卡菌病的精确诊治。基于此,本项目拟开展研发一款以16s rrna基因为靶点、高灵敏度和特异性的多重实时荧光pcr产品用于检测诺卡菌。本项目利用患者的痰和肺泡灌洗液展开回顾性研究,以16s rrna基因扩增子测序为金标准,对前期设计的taqman-mgb探针和引物进行效能评估,以期为临床诊断肺诺卡菌病提供依据,为诺卡菌病的早期精准治疗提供帮助。
3.诺卡菌在环境中广泛存在,可感染免疫功能正常人群,其引起感染性疾病的诊断目前主要依赖于传统培养和染色技术,然而较低的灵敏度在很大程度上制约了诺卡菌病的准确诊断。有相当数量的诺卡菌病例被误诊为结核病,抗结核治疗不仅无法起到治疗效果,还会导致患者菌群失衡。伴随着诺卡菌病的发病率逐步升高,其与结核病的鉴别诊断越发重要,是临床的迫切需求。
4.所以,发展多重实时荧光pcr法检测诺卡菌不仅可满足临床鉴别诊断的需求,还可促进诺卡菌病的精准用药治疗,节约国家医疗资源。
技术实现要素:
5.(一)发明目的
6.有鉴于此,本发明的目的在于提出一种下呼吸道样本处理试剂、诺卡菌检测试剂盒及核酸扩增方法,以实现对肺诺卡菌病进行诊断,可提高诺卡菌病确诊率,从而避免误诊误治,并且有效降低社会医疗费用支出。
7.(二)技术方案
8.为达到上述技术目的,本发明提供了一种下呼吸道样本处理试剂,包括下呼吸道处理试剂,下呼吸道处理试剂的处理试剂配方为质量分数2%氢氧化钠、蒸馏水和体积分数60%异丙醇。
9.优选的,处理试剂配方每100ml的配比比例为:2g氢氧化钠、40ml蒸馏水和60ml异丙醇。
10.优选的,处理试剂配方每1000ml的配比比例为:20g氢氧化钠、400ml蒸馏水和600ml异丙醇。
11.优选的,处理试剂加入呼吸道标本,呼吸道标本分为痰和支气管肺泡灌洗液,加入比例计算方式为每x体积(ml)的痰放入2x体积(ml)的处理试剂,每x体积(ml)的支气管肺泡
灌洗液放入2x体积(ml)的处理试剂。
12.优选的,如上权利要求1-4任一所述的下呼吸道样本处理试剂,还包括以下步骤:
13.步骤一:将下呼吸道标本加入处理试剂,用振荡器震荡15s,室温静置15min,充分进行消化;
14.步骤二:取200μl步骤1中液体加入至核酸提取的提取试剂盒中;
15.步骤三:将提取试剂盒放入gp全自动快速核酸提取仪nextrator48,选择程序protocol1进行核酸提取;
16.步骤四:待提取结束后,将核酸产物用移液器吸出至1.5ml ep管中,并放4℃环境下存储箱中备用。
17.步骤五:按比例配制pcr反应液,并进行分装至pcr八连管,每管23μl。
18.步骤六:将2μl核酸产物加入至步骤五的pcr反应液中,在abi-7500核酸扩增仪上设置如下程序进行核酸扩增反应。
19.步骤七:待pcr反应完成后,进行结果判读。
20.优选的,步骤五中pcr反应液配方为nocardia-f primer、nocardia-r primer、nocardia-taqman probe、globin-f primer、globin-r primer、globin-taqman probe、ddh2o和pcr master mix。
21.优选的,步骤五中pcr反应液配比为0.8μl的nocardia-f primer、0.8μl的nocardia-r primer、0.4μl的nocardia-taqman probe、0.3μl的globin-f primer、0.3μl的globin-r primer、0.3μl的globin-taqman probe、7.6μl的ddh2o和12.5μl的pcr master mix,总体积23μl,步骤五中pcr反应液中nocardia-f primer、nocardia-r primer、nocardia-taqman probe、globin-f primer、globin-r primer和globin-taqman probe的最终浓度为0.32μm、0.32μm、0.16μm、0.12μm、0.12μm和0.12μm。
22.优选的,步骤七中结果判读方法为:nocardia-taqman probe为阴性,globin-taqman probe为阳性,则诺卡菌检测阴性;
23.nocardia-taqman probe为阳性,globin-taqman probe为阳性或阴性,则诺卡菌检测阳性;
24.nocardia-taqman probe与globin-taqman probe皆为阴性,结果无法确定,pcr反应抑制,需对提取核酸产物进行5倍稀释后重新进行试验。
25.优选的,步骤六中程序设置方法为:
26.步骤一、循环一次,温度设定95℃,工作时间3min;
27.步骤二、温度设定95℃,工作时间15s,温度设定60℃,工作时间1min,循环40次;
28.优选的,所述诺卡菌检测试剂盒应用于放置pcr扩增试剂与处理试剂。
29.从以上技术方案可以看出,本技术具有以下有益效果:
30.通过在该产品对肺诺卡菌病进行诊断,可提高诺卡菌病确诊率,从而避免误诊误治,并且有效降低社会医疗费用支出。
附图说明
31.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本
发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
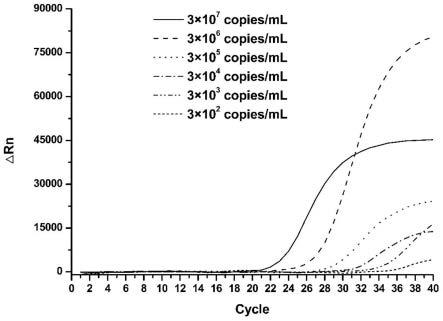
32.图1为本发明提供的不同浓度阳性质控品的实时荧光pcr结果示意图。
具体实施方式
33.下文的描述本质上仅是示例性的而并非意图限制本公开、应用及用途。应当理解,在所有这些附图中,相同或相似的附图标记指示相同的或相似的零件及特征。各个附图仅示意性地表示了本公开的实施方式的构思和原理,并不一定示出了本公开各个实施方式的具体尺寸及其比例。在特定的附图中的特定部分可能采用夸张的方式来图示本公开的实施方式的相关细节或结构。
34.参照图1:
35.实施例一
36.一种下呼吸道样本处理试剂,包括下呼吸道处理试剂,下呼吸道处理试剂的处理试剂配方为质量分数2%氢氧化钠、蒸馏水和体积分数60%异丙醇。
37.进一步的,处理试剂配方每100ml的配比比例为:2g氢氧化钠、40ml蒸馏水和60ml异丙醇。
38.进一步的,处理试剂配方每1000ml的配比比例为:20g氢氧化钠、400ml蒸馏水和600ml异丙醇。
39.参考表格:
[0040][0041]
进一步的,处理试剂加入呼吸道标本,呼吸道标本分为痰和支气管肺泡灌洗液,加入比例计算方式为每x体积(ml)的痰放入2x体积(ml)的处理试剂,每x体积(ml)的支气管肺泡灌洗液放入2x体积(ml)的处理试剂。
[0042]
参考表格:
[0043]
标本类型标本体积(ml)处理液体积(ml)痰x2x支气管肺泡灌洗液xx
[0044]
一种核酸扩增方法,其特征在于,如上权利要求1-4任一所述的下呼吸道样本处理试剂,还包括以下步骤:
[0045]
步骤一:将下呼吸道标本加入处理试剂,用振荡器震荡15s,室温静置15min,充分进行消化;
[0046]
步骤二:取200μl步骤1中液体加入至核酸提取的提取试剂盒中;
[0047]
步骤三:将提取试剂盒放入gp全自动快速核酸提取仪nextrator48,选择程序protocol1进行核酸提取;
[0048]
步骤四:待提取结束后,将核酸产物用移液器吸出至1.5ml ep管中,并放4℃环境下存储箱中备用。
[0049]
步骤五:按下表比例配制pcr反应液,并进行分装至pcr八连管,每管23μl。
[0050][0051]
具体的:pcr反应液配方为nocardia-f primer、nocardia-r primer、nocardia-taqman probe、globin-f primer、globin-r primer、globin-taqman probe、ddh2o和pcr master mix。
[0052]
进一步的,步骤五中pcr反应液配比为0.8μl的nocardia-f primer、0.8μl的nocardia-r primer、0.4μl的nocardia-taqman probe、0.3μl的globin-f primer、0.3μl的globin-r primer、0.3μl的globin-taqman probe、7.6μl的ddh2o和12.5μl的pcr master mix,总体积23μl,步骤五中pcr反应液中nocardia-f primer、nocardia-r primer、nocardia-taqman probe、globin-f primer、globin-r primer和globin-taqman probe的最终浓度为0.32μm、0.32μm、0.16μm、0.12μm、0.12μm和0.12μm。
[0053]
进一步的,步骤七中结果判读方法为:nocardia-taqman probe为阴性,globin-taqman probe为阳性,则诺卡菌检测阴性;
[0054]
nocardia-taqman probe为阳性,globin-taqman probe为阳性或阴性,则诺卡菌检测阳性;
[0055]
nocardia-taqman probe与globin-taqman probe皆为阴性,结果无法确定,pcr反应抑制,需对提取核酸产物进行5倍稀释后重新进行试验
[0056]
步骤六:将2μl核酸产物加入至步骤五的pcr反应液中,在abi-7500核酸扩增仪上设置如下程序进行核酸扩增反应;
[0057]
程序设定方法为:
[0058]
步骤一、循环一次,温度设定95℃,工作时间3min;
[0059]
步骤二、温度设定95℃,工作时间15s,温度设定60℃,工作时间1min,循环40次;
[0060]
具体如下表所示:
[0061][0062][0063]
步骤七:待pcr反应完成后,进行结果判读。
[0064][0065]
阴性:样本无ct值和s形曲线,如图1所示;
[0066]
阳性:样本有ct值和s形曲线,如图1所示;
[0067]
不确定:pcr反应抑制,对提取核酸产物进行5倍稀释后重新进行试验。
[0068]
引物和探针序列及探针修饰:
[0069]
引物和探针序列(5
‘
至3’)及探针修饰nocardia-f primercatgcaagtcgagcggtnocardia-r primeraccccaccaacaagctgatagnocardia-taqman probefam-acgagcggcg-mgbglobin-f primergaagagccaaggacaggtacglobin-r primercaacttcatccacgttcaccglobin-taqman proberox-ctgtcatcacttagacctc-mgb
[0070]
阳性质控(nocar-pc)的制备:
[0071]
克隆载体:topo
[0072]
阳性质控序列已在第三方公司进行验证,序列如下:
[0073]
catgcaagtcgagcggtaaggcccttcggggtacacgagcggcgaacgggtgagtaacacgtgggtgatctgcctcgcactctgggataagcctgggaaactgggtctaataccggatatgaccttacatcgcatggtgtttggtggaaagatttatcggtgcgagatgggcccgcggcctatcagcttgttggtggggt
[0074]
一种诺卡菌检测试剂盒,其特征在于,所述诺卡菌检测试剂盒应用于放置pcr扩增试剂与处理试剂。
[0075]
实施例二
[0076]
收集怀疑肺部感染且常规进行细菌培养下呼吸道样本,将标本分装成2份,1份进行核酸提取,另1份-80℃保存。核酸提取采用gp全自动快速核酸提取仪nextrator48进行,-80℃保存备用。
[0077]
采用mega6.0、primer-blast和primer 5等软件设计探针和引物。探针设计时保证不同种诺卡菌序列一致,而其余相关菌种序列不同,至少存在单个核苷酸不同。
[0078]
探针5’端第一个碱基不能为g;探针tm值尽量保持在65-70℃;探针长度在10-20个碱基;避免同一碱基出现过多,尤其不可出现连续4个g或更多;尽量保证探针序列c比g多;多态位点应尽量位于探针中央,可疑
±
3个碱基。
[0079]
引物设计时应尽可能接近探针,但不可与探针重叠;引物长度在15-40bp;gc含量尽量在40%-60%;避免同一碱基重复过多;引物tm值在57-60℃之间,上下游引物tm值差值不超过2℃;引物3’端碱基不能为a;避免引物自身或引物之间形成4个或4个以上连续配对;避免引物自身形成发卡结构;扩增片段长度尽量控制在50-250bp。保证探针自身、引物自身或相互间不易形成二聚体结构。
[0080]
将痰标本中常见菌种,诺卡菌和结核分枝杆菌,以及两者相近菌种进行核酸提取,如微黄奈瑟菌,口腔链球菌,大肠杆菌,肺炎克雷伯菌,鲍曼不动杆菌,铜绿假单胞菌,嗜麦芽窄食单胞菌,肺炎链球菌,卡他莫拉菌,流感嗜血杆菌,金黄色葡萄球菌,化脓性链球菌,马红球菌,鸟分枝杆菌,脓肿分枝杆菌等,直接提取核酸,进行灵敏度和特异性验证,优化实时荧光pcr反应中各组分浓度。
[0081]
将验证好的探针,进一步用临床保存诺卡菌培养阳性呼吸道标本(痰和肺泡灌洗液)进行验证。首先进行核酸提取,接着进行实时荧光pcr反应,进一步优化pcr反应中各组分浓度,确定提取后的核酸加入量。
[0082]
对临床未知结果标本进行测试:诺卡菌培养,诺卡菌实时荧光pcr,16s rrna扩增子测序同时进行,进一步筛选出适宜的诺卡菌探针和引物以及优化各组分比例,筛选出最佳产品。
[0083]
下呼吸道标本验证:以16s扩增子测序为金标准对试剂盒进行验证,灵敏度和特异性均为100%。结果如下表所示:
[0084][0085]
上文中参照优选的实施例详细描述了本公开所提出的方案的示范性实施方式,然而本领域技术人员可理解的是,在不背离本公开理念的前提下,可以对上述具体实施例做出多种变型和改型,且可以对本公开提出的各种技术特征、结构进行多种组合,而不超出本公开的保护范围,本公开的保护范围由所附的权利要求确定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1