一种分离、纯化奶牛血液中CD14
一种分离、纯化奶牛血液中cd14
+
单核细胞的方法
技术领域:
1.本发明涉及生物工程领域,尤其涉及一种奶牛血液中cd14
+
单核细胞的分离方法。
背景技术:
2.1882年,ilya metchnjkoff首次描述了单核细胞,作为白细胞的一个亚群,是连接先天免疫和适应性免疫的“哨兵”细胞。其在维持机体稳态、病原体识别和清除以及炎症中发挥关键作用。单核细胞作为最大的血细胞,其直径为10~20um。核呈肾形、马蹄铁形或扭曲折叠的不规则形。其在人和小鼠白细胞中占比分别为10%和4%。在骨髓中,单核细胞前体正常发育并增殖,进入外周组织如肝脏,肺脏中分化为树突状细胞或巨噬细胞。在血液中,异常的单核细胞比例增加意味着机体可能被炎症性疾病所困扰,所以单核细胞对于生物体内的稳态和健康至关重要。奶牛单核细胞子集包括cd14和cd16。cd14是一种细胞膜上的锚定蛋白,其是一种存在于单核细胞表明的模式识别受体。cd14作为细菌脂多糖lps的细胞膜受体,它与其他蛋白质协同作用,在机体免疫、防御系统引起的一系列病理反应中起关键作用。在疾病检验过程中,针对机体的免疫功能和生理学特征的检测与细胞分离和纯化技术密切相关,从血液中分离单核细胞是单核细胞进行免疫学研究和细胞生物学的重要预处理,分离目的细胞的数量和纯度是保证后续实验可靠性的重要环节,建立一套可循环的cd14
+
单核细胞分离方法尤为重要。
3.目前,关于奶牛血液中单核细胞的报道并不多,尤其是对cd14
+
单核细胞报道更是少之又少。探索一种能高效获取奶牛cd14
+
单核细胞方法,为了更深入的了解奶牛免疫系统功能已成为本领域技术人员急需解决的技术问题。
4.因此,有必要提供一种既能保证细胞活性又能保证分离效率、纯度并兼顾循环使用的奶牛cd14
+
单核细胞分离方法。
技术实现要素:
5.本发明的目的是为了克服上述现有技术存在的不足之处,而提供一种分离、纯化奶牛血液中cd14
+
单核细胞的方法。
6.本发明的一种分离、纯化奶牛血液中cd14
+
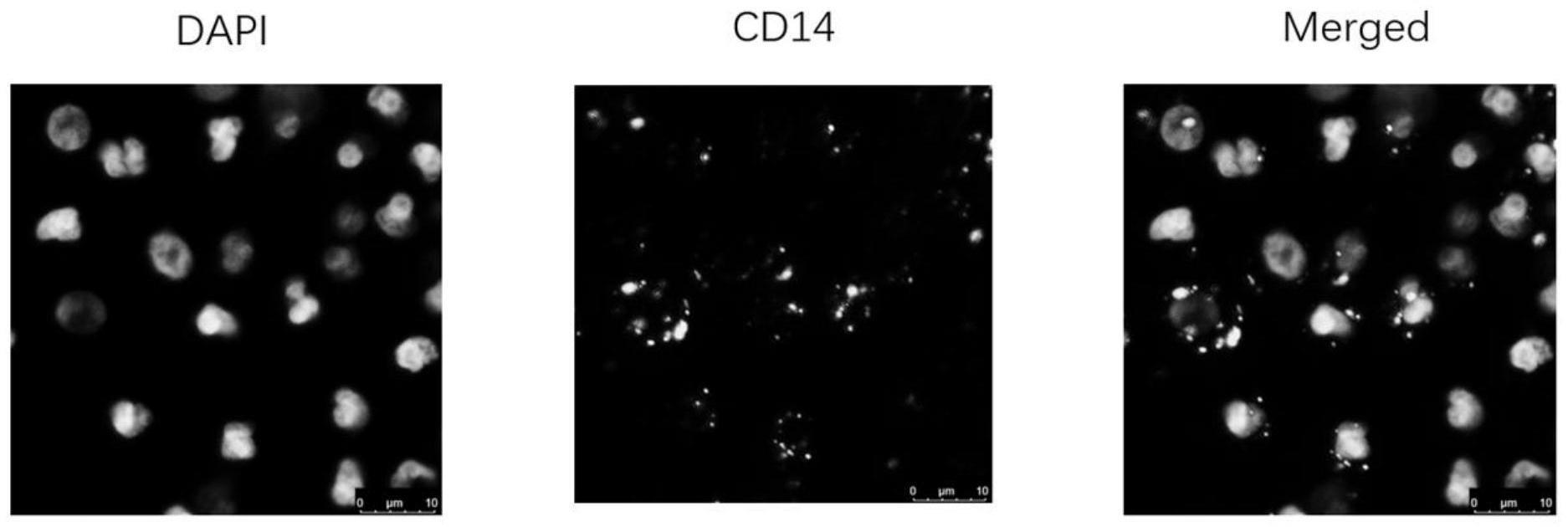
单核细胞的方法,包括以下步骤:
7.步骤(1)、血液的获取:通过尾骨静脉穿刺对荷斯坦奶牛取血,并将血液收集在无菌肝素钠抗凝管中,得到抗凝奶牛血,且抗凝奶牛血需在2h内带回实验室处理;
8.步骤(2)、血液的稀释:将步骤(1)取得的抗凝奶牛血与稀释液(牛外周血单核细胞分离液试剂盒,solarbio,p5280)按照1:1的体积比例混合,得到稀释血液;
9.步骤(3)、血液和分离液混合:将步骤(2)得到的稀释血液缓慢倒入单个细胞分离液中,得到混合液(眼观可见明显分层);其中稀释血液与单个细胞分离液的体积比为1:1;
10.步骤(4)、粗提单个核细胞:在室温下,将步骤(3)得到的分层液,800g离心力下离心10min,离心后液体分层(最上层为血浆层;次上层为环状乳白色单个核细胞层;中间层为单个核细胞分离液;最下层,为红细胞层),弃去最上层的血浆,收集第二层单个细胞层后,
重悬,并在室温离心机下250g,离心10min,弃上清,得到粗分单个核细胞沉淀;
11.步骤(5)、精制单个核细胞:将步骤(4)得到的粗分单个核细胞沉淀与红细胞裂解液(红细胞裂解液,solarbio,r1010)混匀,在37℃水浴锅中预热2min后,加入等量imdm培养基终止裂解,使用250g,室温离心10min(如细胞底部有明显的红色沉淀需增加一遍裂解),弃上清,得到红细胞单个核细胞沉淀;
12.步骤(6)、洗涤单个核细胞:将步骤(5)得到的去红细胞单个核细胞沉淀用细胞洗涤液(牛外周血单核细胞分离液试剂盒,solarbio,p5280)清洗一遍后,室温250g,离心10min后,得到纯净单个核细胞沉淀;
13.步骤(7)、去细胞黏连:将步骤(6)获得的纯净单个核细胞沉淀悬浮在缓冲液中,并使用预分离过滤器去除细胞聚集体,得到单个核细胞悬浮液;
14.步骤(8)、计数及cd14孵育一抗:对步骤(7)获得的单个核细胞悬浮液中的单个核细胞进行计数(采用希利格式细胞计数,参照严家来等发表于《包头医学院学报》的《〈临床检验基础〉课程中细胞计数的常用方法》),并与牛抗cd14单克隆抗体(cd14 antibody,cc-g33,bio-red,mca2678ga)在上述缓冲液中于4℃孵育30min后,得到cd14一抗孵育的单个核细胞悬浮液;
15.步骤(9)、二抗磁珠孵育:将步骤(8)制得的孵育悬浮液在250g下,离心5min后,弃上清,将得到孵育细胞悬浮在上述缓冲液中,然后添加10ul磁珠二抗(anti-mouse igg1microbeads,miltenyi biotec,130-047-101)在4℃下孵育15min,得到二抗磁珠孵育单个核细胞悬浮液;
16.步骤(10)、洗涤二抗磁珠:将步骤(9)得到的二次孵育悬浮液在250g下,离心5min,并悬浮在上述缓冲液中,得到纯净二抗磁珠孵育的细胞悬液;
17.步骤(11)、磁珠分离cd14
+
单核细胞:使用ms柱(ms柱,美天旎,130-042-201)进行单核细胞分离,加500ul上述缓冲液润洗两次,后用步骤(10)制得的500ul细胞悬液加入到ms柱中,待液体自然流尽,用500ul上述缓冲液冲洗两次并自然流尽,加入500ul上述缓冲液,将ms柱从磁柱架上取下,针头部分快速放入1.5ml离心管中,并使用磁柱塞快速下压,将液体全部打入离心管中,得到的细胞即为cd14
+
单核细胞混悬液;
18.步骤(12)、离心得纯化cd14
+
单核细胞:将步骤(11)中得到的牛cd14
+
单核细胞混悬液在250g下,离心5min,弃上清液,所得沉淀即为奶牛cd14
+
单核细胞。
19.作为本发明的进一步改进,所述的步骤(5)中,每20ml血液分离所得单个核细胞与4ml红细胞裂解液混合。
20.作为本发明的进一步改进,所述的步骤(7)和步骤(9)中,每20ml血液分离所得纯净单个核细胞沉淀悬浮于1ml缓冲液中。
21.作为本发明的进一步改进,所述的步骤(7)、步骤(9)和步骤(10)中的缓冲液为5g/lbsa和2mm edta的pbs(ph=7.2)的混合溶液。
22.作为本发明的进一步改进,所述的步骤(8)中,1.5ul cd14单抗与107总的细胞孵育。
23.作为本发明的进一步改进,所述的步骤(9)中,20ul二抗磁珠与107总的细胞孵育。
24.作为本发明的进一步改进,所述的步骤(10)中,107总的细胞悬浮于500ul缓冲液。
25.本发明的牛cd14
+
单核细胞的分离方法,分离时间短、细胞污染少以及对细胞的损
伤低,以该方法获得的牛血液cd14
+
单核细胞活力高,数量多,纯度高,方法简单,方便操作,省时省力并兼顾可循环使用。
附图说明:
26.图1为鉴定奶牛血液中cd14
+
单核细胞分离后的纯度图。
具体实施方式:
27.本实施例的动物血液采集:于黑龙江省大庆市某2000头采用自由卧栏、tmr(total mixd rations全混合日粮)饲喂的集约化荷斯坦奶牛场。选取具有相似泌乳期(中位数=3,范围=2至4)和产奶天数(days in milk,dim:中位数=8天,范围=3至14天)的奶牛。
28.一种奶牛血液中cd14
+
单核细胞的分离方法,包括以下步骤:
29.步骤(1)、血液的获取:采用20ml注射器进行尾静脉采血,每个样品迅速加入含有150iu的负压抗凝管中。在2h内带回实验室进行分离以保证细胞活性;
30.步骤(2)、血液的稀释:在室温无菌台内将血液与稀释液(牛外周血单核细胞分离液试剂盒,solarbio,p5280)按照1:1的体积比例置于新的无菌离心管中;
31.步骤(3)、血液和分离液混合:在无菌台内取一支50ml离心管,添加单个细胞分离液,将稀释后的血液按照和分离液1:1的比例缓慢加在分离液上方。眼观可见明显分层;
32.步骤(4)、粗提单个核细胞:室温800g,离心10min,离心后液体分层(最上层,血浆层;次上层,为环状乳白色单个核细胞层;中间层,单个核细胞分离液;最下层,为红细胞层),弃去血浆,收集第二层单个细胞层,转移到另一个15ml离心管并重悬。并在室温离心机下250g,离心10min;
33.步骤(5)、精制单个核细胞:弃上清,加入4ml红细胞裂解液,混匀,在37℃水浴锅中预热2min,以便充分混匀。加入适量imdm培养基终止裂解,使用250g,室温离心10min(如细胞底部有明显的红色沉淀需增加一遍裂解);
34.步骤(6)、洗涤单个核细胞:弃上清,用细胞洗涤液清洗一遍,室温250g,离心10min已得到单个核细胞;
35.步骤(7)、去细胞黏连:将单个核细胞悬浮在200μl含有5g/l bsa和2mm edta的pbs(ph=7.2)缓冲液中,并使用预分离过滤器去除细胞聚集体;
36.步骤(8)、计数及cd14孵育一抗:对单核细胞进行计数并与5μl牛抗cd14单克隆抗体(cd14 antibody,cc-g33,bio-red,mca2678ga)在上述缓冲液中于4℃孵育30min;
37.步骤(9)、二抗磁珠孵育:250g,5min离心,弃上清并悬浮在200μl上述缓冲液中,然后添加10μl磁珠二抗(anti-mouse igg1 microbeads,miltenyi biotec,130-047-101)在4℃下孵育15min;
38.步骤(10)、洗涤二抗磁珠:250g,5min离心并悬浮在500μl上述缓冲液中;
39.步骤(11)、磁珠分离cd14
+
单核细胞:使用ms柱进行单核细胞分离,加500μl上述缓冲液润洗两次,后用已重悬的细胞悬液加入到ms柱中,待液体自然流尽,用500μl上述缓冲液冲洗两次并自然流尽,加入500μl上述缓冲液,将ms柱从磁柱架上取下,针头部分快速放入1.5ml离心管中,并使用磁柱塞快速下压,将液体全部打入离心管中;
40.步骤(12)、离心得纯化cd14
+
单核细胞:250g,5min离心,弃上清液,沉淀即为牛
cd14
+
单核细胞;
41.步骤(13)、ms柱的重复利用:使用无水乙醇加入使用过的ms柱,并快速排出液体反复三次,以去除ms柱中残余细胞并放入带有无菌纱布的铁饭盒中,使用牛皮纸包裹铁饭盒并放入高压灭菌锅121℃、10min并放入烘箱干燥4h以上,以备下次分离时使用;
42.步骤(14)、验证cd14
+
单核细胞纯度:在孵育二抗时使用带cd14对应二抗fitc荧光染料,在提取完细胞后,使用细胞核染料dapi对细胞进行8min染色,最后使用甘油封片,用共聚焦显微镜观察。结果如图(1)所示,cd14在纯化后的单核细胞中被标记;
43.步骤(15)、cd14
+
单核细胞体外培养基:使用iscove改良杜尔贝科培养基(imdm,包括4.0mml-谷氨酸;sh30228.01b,hyclone,los angeles,usa),添加10%胎牛血清(胎牛血清;fb15015,clark,cordova,argentina),100u/ml青霉素/链霉素(p1400,solarbio,china)进行细胞培养,已用于后续实验。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1