蜻蜓凤梨AfFT3基因、克隆方法、表达载体及应用
蜻蜓凤梨afft3基因、克隆方法、表达载体及应用
技术领域
1.本发明属于生物技术领域,涉及凤梨ft基因、克隆、表达特性分析、表达载体构建、对乙烯的响应途径和对开花的调控作用。
背景技术:
2.凤梨科植物为多年生单子叶草本植物,包括重要的热带花卉(观赏凤梨)和重要的热带水果(菠萝)。为了满足市场需求,利用乙烯及其衍生物促进凤梨开花,调节上市时间,已经成为凤梨栽培中采用的重要技术。但实际生产中常有催花质量不佳造成经济损失的情况发生,解决这一问题的理论依据匮乏。已有的研究表明,外源乙烯通过提高内源乙烯的含量诱导凤梨植物开花,而内源乙烯如何启动开花仍是未解问题。
3.flowering locus t(ft)是调控植物开花的重要基因,对成花转变具有重要作用,是典型的促花因子。ft属于磷脂酰乙醇胺结合蛋白(phosphatidylethanolamine-binding protein,pebp)家族基因,本身受光周期途径中的锌指蛋白诱导,其蛋白由叶片经维管束移动到茎顶端组织。ft是光周期途径关键基因constans(co)、春化途径和自主途径关键基因flowering locus c(flc)等的直接靶基因,它几乎可将所有的开花信号传导途径进行整合。研究表明,拟南芥ft在接收到光周期信号后,先从叶片中被诱导表达,然后ft蛋白在ft-interacting protein 1(ftip1)蛋白的协助下,经过维管束转运至顶端分生组织(shoot apical meristem,sam),并与flowering locus d(fd)相互作用形成ft-fd蛋白复合体,从而激活下游的花分生组织决定基因,例如apetala 1(ap1)和fruitfull(ful),从而诱导开花。乙烯是最早发现的一种具有生物活性的植物激素,可以调节植物的生长发育和各种生理活动。根据乙烯特有的“三重反应”,研究人员在近几十年中对植物乙烯信号通路中的关键组分进行了筛选、分离及鉴定,最终构建了乙烯信号转导通路的基本模型。乙烯信号是被膜结合蛋白(乙烯受体)所感知。但ft基因是否响应乙烯信号并进一步调控植物开花的相关研究尚处于初始阶段。目前,关于凤梨科植物ft基因作用及其功能的报道也较少。
4.通过蜻蜓凤梨(aechmea fasciata)比较转录组信息分析获得了ft基因的片段,blast对比显示均与其他植物中的ft基因具有较高的同源性,定名为afft3。实时荧光定量pcr结果表明,外源乙烯和不同温度处理凤梨后,afft3基因的表达量明显提高。利用pcr克隆了基因的全长序列并构建表达载体,在拟南芥中过表达后抑制了拟南芥开花。利用酵母单杂技术,表明乙烯信号途径基因ein3蛋白可直接结合到afft3的启动子,诱导afft3的表达。说明,蜻蜓凤梨afft3基因具有响应外源乙烯及温度并抑制开花的功能。
技术实现要素:
5.本发明的目的在于提供一种蜻蜓凤梨afft3基因,提取蜻蜓凤梨总rna,反转录合成cdna,以此为模板,设计特异引物,利用pcr方法获得afft3基因的全长cdna,与载体连接,转化大肠杆菌trans-t1感受态细胞,挑取阳性克隆得到蜻蜓凤梨afft3基因,该基因的cdna全长570bp。afft3基因的获得,为研究蜻蜓凤梨乙烯诱导开花
机理奠定了基础,为凤梨植物栽培中乙烯催花技术的提高提供了理论参考,具有重要的理论及实践意义。
6.为了实现上述目的,本发明的技术方案为:提供一种蜻蜓凤梨afft3基因,该基因序列具有序列表中seq id no.1所示的核苷酸序列。
7.本发明的另一目的在于提供一种蜻蜓凤梨afft3基因的克隆方法,包括以下步骤:
8.(1)以蜻蜓凤梨(aechemia fasciata)为材料,利用ctab法提取总rna;
9.(2)afft3基因的克隆;
10.(2-1)利用uni one-step gdna removal and cdna synthesis supermix(transgene)试剂盒将rna反转录为cdna,作为pcr模板备用;
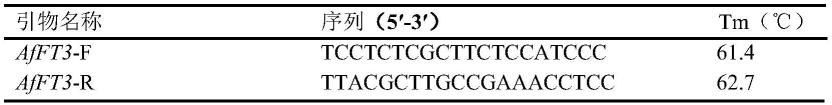
11.(2-2)设计全长cdna扩增引物;
12.afft3基因cdna全长克隆引物
[0013][0014]
(2-3)根据引物的tm值进行pcr条件的优化后,进行pcr扩增,并将获得的产物连接到载体,并转化大肠杆菌感受态trans-t1,经pcr和酶切鉴定后进行测序。
[0015]
pcr体系及条件为:
[0016][0017][0018]
获得全长的cdna为570bp,包括部分起始密码子前的5’utr和终止密码子后的3’utr。开放阅读框部分为465bp,由此推得编码含155个氨基酸残基的蛋白质,将此氨基酸序列在国际基因库中进行保守结构域分析,表明其具有pebp家族保守功能结构域。
[0019]
进一步地,步骤(1)总rna的提取具体如下:
[0020]
(1-1)准备工作:将研钵提前放入烘箱180℃烘4h后冷却至室温待用,实验过程中所要用的移液枪、实验台均用酒精擦拭,离心管、枪头均无rna酶。
[0021]
(1-2)取850μl ctab缓冲液到2ml离心管中,放入65℃水浴锅预热。
[0022]
(1-3)称取0.2g材料于加入液氮的研钵中充分研磨,待材料呈粉末状即可转入(1-2)中预热的离心管中,加入材料前先加入25μlβ-巯基乙醇。
[0023]
(1-4)立即涡旋30s混匀,65℃水浴6min。
[0024]
(1-5)加入等体积氯仿、异戊醇(24:1),剧烈震荡,开盖放气,涡旋30s,室温11000rpm离心15min。
[0025]
(1-6)吸取上清于新2ml离心管中,加入等体积氯仿/异戊醇(24:1)再抽提一次,涡旋30s,室温11000rpm离心15min。
[0026]
(1-7)吸取上清于新1.5ml离心管中,加入1/3体积8mol/l licl,颠倒混匀,在4℃下沉淀10-12h,不要超过16h。
[0027]
(1-8)4℃下,11000rpm离心30min,弃上清,用75%乙醇500μl洗涤沉淀两次,弃去液体,风干。
[0028]
(1-9)加入30-40μl rnase-free水溶解沉淀。
[0029]
(1-10)取2μl rna样品用1.2%琼脂糖凝胶电泳检测,取2μl rna样品用simplinano微量分光光度计测定样品的浓度与纯度,剩余rna样品于-80℃保存备用,保存时间不要超过一周。
[0030]
进一步地,步骤(2-2)中的扩增引物包括afft3-f和afft3-r的序列,序列分别如序列表中的seq id no.2、seq id no.3所示。
[0031]
本发明的另一目的在于提供一种蜻蜓凤梨afft3基因表达载体,利用蜻蜓凤梨afft3基因为目的基因的表达载体。
[0032]
进一步地,用蜻蜓凤梨afft3基因插入到植物表达载体camv35s-gfp上,构建成在camv35s启动子下游含有蜻蜓凤梨afft3基因的高效表达载体。
[0033]
蜻蜓凤梨afft3基因表达载体的构建,具体如下:
[0034]
根据已测序的afft3基因序列,设计在5’端加上15bp含kpni酶切位点的同源重组接头的上游引物p1(序列如序列表中的seq id no.4所示:5
’‑
cgggggacgagctcggtacc tcctctcgcttctccatccc-3’)和含xbali酶切位点的同源重组接头的下游引物p2(序列如序列表中的seq id no.5所示:5
’‑
accatggtgtcgactctaga ttacgcttgccgaaacctcc-3’)。以afft3基因测序验证正确的菌液为模板,pcr扩增全长,并利用kpni和xbai限制性内切酶将camv35s-gfp载体线性化。采用clonexpresstmii one step cloning kit(vazyme)构建重组载体。经过菌液pcr及双酶切检测验证后获得afft3基因表达载体。
[0035]
本发明的再一目的在于提供蜻蜓凤梨afft3基因在不同环境温度下影响乙烯催花效率中的应用(蜻蜓凤梨afft3基因在响应乙烯调控植物开花技术中的应用)。
[0036]
afft3基因表达特性与乙烯诱导开花的关联分析:
[0037]
利用实时荧光定量pcr测定了外源乙烯及不同温度处理蜻蜓凤梨后afft3基因的表达水平,结果显示,在高、低温下,afft3在在蜻蜓凤梨中的表达量均升高,低温下提高幅度更大。乙烯处理后,afft3在在蜻蜓凤梨中的表达量均升高,且低温比高温下升高幅度更大。这说明,afft3基因在蜻蜓凤梨中明显受乙烯及温度诱导,可能与开花有关。
[0038]
afft3基因的功能鉴定:
[0039]
利用农杆菌介导法转化拟南芥。取拟南芥哥伦比亚(ecotype columbia)野生型
(wt),开花后使用携带有afft3基因的植物表达载体的农杆菌进行侵染,并获得潜在的转基因种子,然后在30mg/l潮霉素的ms固体平板培养基上进行抗性筛选,获得t1代阳性转基因植株,待其成熟,再在40mg/l潮霉素的ms固体平板培养基上进行抗性筛选,获得稳定遗传的t2代阳性转基因植株。通过观察发现转afft3基因拟南芥植株比野生型晚花8d。
[0040]
本发明利用实时荧光定量pcr测定了蜻蜓凤梨幼株(6-7个月)和成株(12-15个月)乙烯处理后afft2基因的表达水平,证实的乙烯处理后成株中的表达水平明显高于幼株。连接到植物表达载体camv35s-gfp上,构建一个新的植物表达载体,命名为camv35s-afft3。该基因会影响拟南芥开花。因此,afft3基因的获得,为研究蜻蜓凤梨乙烯诱导开花机理奠定了基础,为凤梨植物栽培中乙烯催花技术的提高提供了理论参考,具有重要的理论及实践意义。
附图说明
[0041]
图1是拟南芥表型图。其中wt是野生型拟南芥,vector是转空载体拟南芥,afft3-l3和l6是35s::afft3转基因拟南芥的两个株系。
具体实施方式
[0042]
通过以下详细说明可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0043]
实施例1:蜻蜓凤梨基因的克隆方法
[0044]
1、总rna的提取:改良的ctab法。
[0045]
(1)准备工作:将研钵提前放入烘箱180℃烘4h后冷却至室温待用,实验过程中所要用的移液枪、实验台均用酒精擦拭,离心管、枪头均无rna酶。
[0046]
(2)取850μl ctab缓冲液到2ml离心管中,放入65℃水浴锅预热。
[0047]
(3)称取0.2g材料于加入液氮的研钵中充分研磨,待材料呈粉末状即可转入(2)中预热的离心管中,加入材料前先加入25μlβ-巯基乙醇。
[0048]
(4)立即涡旋30s混匀,65℃水浴6min。
[0049]
(5)加入等体积氯仿、异戊醇(24:1),剧烈震荡,开盖放气,涡旋30s,室温
[0050]
(6)11000rpm离心15min。
[0051]
(7)吸取上清于新2ml离心管中,加入等体积氯仿/异戊醇(24:1)再抽提一次,涡旋30s,室温11000rpm离心15min。
[0052]
(8)吸取上清于新1.5ml离心管中,加入1/3体积8mol/l licl,颠倒混匀,在4℃下沉淀10-12h,不要超过16h。
[0053]
(9)4℃下,11000rpm离心30min,弃上清,用75%乙醇500μl洗涤沉淀两次,弃去液体,风干。
[0054]
(10)加入30-40μl rnase-free水溶解沉淀。
[0055]
(11)取2μl rna样品用1.2%琼脂糖凝胶电泳检测,取2μl rna样品用simplinano微量分光光度计测定样品的浓度与纯度,剩余rna样品于-80℃保存备用,保存时间不要超
过一周。
[0056]
2、afft3基因的克隆及序列分析
[0057]
(1)利用transgene公司的one-step gdna removal and cdna synthesis supermix kit将rna反转录为cdna,作为pcr模板备用。
[0058]
(2)设计全长cdna扩增引物:
[0059][0060]
(3)根据引物的tm值进行pcr条件的优化后,按照发明内容一所述的方法进行pcr扩增,并将获得的产物连接到载体,经pcr和酶切鉴定后进行序列测定。
[0061]
(4)同源检索:利用blast软件将分离出的序列与genebank中的序列进行比较。
[0062]
实施例2:蜻蜓凤梨afft3基因在幼株和成株中实时荧光定量rt-pcr表达检测:
[0063]
提取蜻蜓凤梨幼株与成株rna,并反转录合成cdna,根据qpcr引物设计原则设计特异引物,内参基因为蜻蜓凤梨afactin。引物序列如下:
[0064][0065]
以sybr green i作为荧光染料,利用qpcr测定afft3基因在外源因素处理过程中的相对表达水平,用2-δδct
法计算afft2基因在各样品中的相对表达量。反应在quantstudio
tm
3荧光定量pcr仪(thermo fisher scientific)上进行。反应体系为20μl(模板2μl,正反向引物各0.4μl,50
×
rox reference dye2染料0.4μl,qpcr master mix混合液10μl,灭菌去离子水补齐至20μl)。反应程序为:95℃预变性30s;95℃10s,60℃30s,40个循环。融解曲线采集使用仪器默认程序。
[0066]
实施例3:蜻蜓凤梨afft3基因植物表达载体camv35s-gfp的构建
[0067]
1、根据分离出的蜻蜓凤梨afft3基因的核苷酸序列,设计引物:
[0068]
正向引物:
[0069]5’‑
cgggggacgagctcggtacctcctctcgcttctccatccc-3’[0070]
反向引物:
[0071]5’‑
accatggtgtcgactctaga ttacgcttgccgaaacctcc-3’[0072]
以总rna反转录的cdna为模板,进行聚合酶链式反应。
[0073]
2、利用kpni和xbai限制性内切酶将camv35s-gfp载体线性化,将上述pcr产物纯化回收后与线性载体进行连接,操作步骤按vazyme公司产品按clonexpresstmii one step cloning kit试剂盒说明书进行,反应体系如下:
[0074][0075]
体系配制完成后,用移液枪上下轻轻吹打几次混匀各组分,避免产生气泡。置于pcr仪上,37℃反应30min。待反应完成后,立即将反应管置于冰上冷却5min。
[0076]
3、将连接产物转化大肠杆菌trans-t1感受态,在含卡那青霉素(100微克/毫升)的lb固体平板上培养过夜。挑取单克隆,在lb液体培养基中培养5-6h。对菌落进行pcr和酶切鉴定。将构建好的重组子命名为camv35s-afft3。
[0077]
实施例4:afft3基因对温度及乙烯的响应
[0078]
1、dna的提取,改良的ctab法。
[0079]
(1)用2ml离心管在65℃水浴上预热1ml ctab缓冲液;
[0080]
(2)取0.2g材料在液氮中研磨后,迅速转入含有ctab缓冲液的离心管中,立即涡旋30s,然后65℃水浴中温浴30min,不断混匀;
[0081]
(3)加入等体积的氯仿/异戊醇(24:1),颠倒混匀,室温,11000g离心10min;
[0082]
(4)取上清,加入等体积的氯仿/异戊醇,颠倒混匀,室温,11000g离心10min;
[0083]
(5)取上清,加入2倍体积的无水乙醇,颠倒混匀,-20℃沉淀30min,4℃,6000g离心10min;
[0084]
(6)沉淀用70%乙醇洗涤2次,风干,用200μl高盐te溶解;
[0085]
(7)4℃,6000g离心10min,上清转入新的离心管,加入3μl10mg/ml的rnasea,37℃温浴30min;
[0086]
(8)加入等体积的苯酚:氯仿:异戊醇(25:24:1),混匀,4℃,11000g离心10min;
[0087]
(9)取上清,加入等体积的氯仿/异戊醇,混匀,4℃,11000g离心10min;
[0088]
(10)取上清,加入2倍体积无水乙醇,混匀,-20℃沉淀30min,4℃,6000g离心10min;
[0089]
(11)沉淀用70%乙醇洗涤2次,风干,用30μl te溶解沉淀;
[0090]
(12)取2μl电泳检测,并利用simplinano微量分光光度计检测其浓度和纯度,其余样品-20℃保存。
[0091]
2、afft3启动子的克隆与分析
[0092]
根据蜻蜓凤梨基因组数据,选取2000bp的afft3启动子序列,以afein3可能结合的位点将启动子分成3个片段,设计引物:
[0093]
[0094]
以dna为模板,pcr克隆获得启动子序列。
[0095]
3、酵母单杂交分析
[0096]
将3段afft3启动子序列分别构建入phis2载体中,同时将afein3的编码序列构入pgadt7-rec2载体中,通过酵母单杂交验证afein3与各分段启动子的相互作用。
[0097]
(1)酵母单杂交诱饵载体的构建
[0098]
分别在启动子分段引物5’端加上含smai酶切位点的15bp同源重组接头,设计分段引物如下:
[0099][0100][0101]
通过pcr反应扩增目的片段,回收pcr产物,经测序无误后,与通过ecori和saci双酶切的phis2载体进行同源重组,参考clonexpresstmii one step cloning kit试剂盒(vazyme)说明书构建重组载体,即酵母单杂交的诱饵载体。
[0102]
(2)酵母单杂交猎物载体的构建
[0103]
根据分离出的蜻蜓凤梨afein3基因的核苷酸序列,采用同源重组的方法设计带有pgadt7-rec2载体酶切位点同源臂序列的引物,正向引物:5'-gaggccagtgaattccctccctctttctttctctctct-3',反向引物:5'-acccgggtggaattccgaatagaagttaaaaactatat-3'。通过pcr反应扩增目的片段,回收pcr产物,经测序无误后,与通过ecorⅰ酶切的pgadt7-rec2载体进行同源重组,参考clonexpresstmii one step cloning kit试剂盒(vazyme)说明书构建重组载体,即酵母单杂交的猎物载体。
[0104]
(3)双转化酵母
[0105]
参考酵母y187感受态细胞说明书将诱饵载体和猎物载体双转化酵母感受态细胞中,涂布于二缺(sd/-trp/-leu)营养缺陷型培养基,30℃倒置培养2~4d,观察菌落生长情况。挑取饱满单克隆菌落,30℃,200rpm摇10h,按照梯度(10倍,100倍,1000倍)稀释后分别用移液枪滴至加3-at(3-aminotriazole)(60mmol/l)和x-α-gal(40mg/ml)的三缺营养缺陷型(sd/-trp/-leu/-his/)固体培养基上,30℃培养2~4d,观察其生长情况及颜色变化。
[0106]
实施例5:afft3基因的开花功能鉴定
[0107]
1、种植野生型拟南芥
[0108]
(1)将适量干燥过后的拟南芥野生型种子装入1.5ml离心管中,加入1ml无菌水,放入4℃冰箱春化3天。
[0109]
(2)种植拟南芥的营养土提前在98kpa,121℃下,灭菌30min,杀死营养土内部的虫卵,待其冷却后备用。
[0110]
(3)将春化好的种子用移液枪点播到育苗穴盘里,每穴点播1-2粒即可。播种完成后,用与穴盘大小匹配的透明盖罩好,保持环境湿润,有利于种子萌发。待观察到种子生长
出四片真叶即可揭盖。
[0111]
(4)一般每2-3天浇一次水,等待拟南芥开花时准备侵染。
[0112]
2、花序侵染法转化拟南芥
[0113]
(1)取100μl已经检测正确的农杆菌菌液于1ml lb液体培养基中(含100μg/ml rif和50μg/ml kana),28℃,200rpm摇床中振荡培养2天。
[0114]
(2)取800μl活化好的菌液于200ml lb液体培养基中(含100μg/ml rif和50μg/ml kana),28℃,200rpm摇床中振荡培养至od600值为0.8-1.2。
[0115]
(3)离心机提前预冷,将菌液4℃,3500g离心10min,弃去上清。
[0116]
(4)配制转化液:在200ml纯水中加入5%蔗糖,0.02%silwet,搅拌混匀。
[0117]
(5)用配制好的转化液重悬菌体至od600值为0.8-1.0。
[0118]
(6)侵染前一天给拟南芥浇充足的水,侵染时将拟南芥花序浸泡在转化液中40s,侵染完毕后转移至黑暗处避光24h。
[0119]
(7)将拟南芥移至光照下生长。侵染3-5次。每次侵染间隔时间为5-6天。全部侵染完成后等待收取拟南芥种子,并标记为t0代。
[0120]
3、转基因植株的筛选
[0121]
取适量已干燥过的t0代拟南芥种子,在超净工作台对种子进行灭菌处理:加入75%乙醇浸泡4min,瞬时离心后倾去乙醇;加入84消毒液浸泡6min,瞬时离心后倾去消毒液。将种子用无菌水反复洗涤4-5次,直至84消毒液被清洗干净。洗涤完毕后加入无菌水悬浮种子。用枪头吸取种子,播于潮霉素浓度为30mg/l的ms固体培养基上。4℃黑暗条件下春化48h,转移至气候培养箱,温度23℃,光周期16h光照/8h黑暗的条件下培养。约两周后,选取叶片绿色、根系发育正常的抗性植株移植到栽培基质中继续培养。移植前栽培基质充分吸水,移植后罩好透明盖,约3d去除,以后管理同上,收获t2代种子,做好标记,继续筛选,至得到纯合转化植株。
[0122]
4、转基因植株的分子鉴定
[0123]
提取转基因、野生型和转空载体拟南芥叶片总rna,并反转录为cdna。以cdna为模板,使用特异引物afft3-f/r进行pcr检测,琼脂糖凝胶电泳显示转基因拟南芥植株中扩增出目的基因条带,而野生型拟南芥和转空载体拟南芥中没有条带,基因afft3已经成功转入拟南芥中。
[0124]
5、转基因表型观察
[0125]
对转基因拟南芥在生长不同阶段进行观察,发现转afft2的拟南芥比野生型晚花8d,说明afft3的高表达抑制了拟南芥开花,符合理论推测。
[0126]
以上所揭露的仅为本发明的较佳实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,仍属于本发明所涵盖的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1