一类生物碱的提取方法与应用
1.本发明涉及微生物技术领域,具体涉及从黑翅土白蚁体表链霉菌(streptomycestanashiensis)byf112液体发酵物中提取一类生物碱的制法和应用。
背景技术:
2.目前,临床所用的大部分化疗药物毒副作用大,且肿瘤细胞受本身的耐药性及外界药物的影响,出现大量肿瘤多药耐药细胞株,致使化疗药物疗效大打折扣;另一方面,由于抗生素滥用现象日益严重,导致临床上原本有特效的抗生素对耐药菌作用越来越小。若该现象不能得以改善,将对全球医疗卫生安全构成极大威胁。因此,寻找新型具有抗肿瘤或抗生素活性的先导化合物迫在眉睫。
3.随着人们对合成化学药品毒副作用的深入认识及全球范围内提倡回归自然的态度,国际上对天然药物的重视程度在不断加强,并且天然药物具有高效低毒的特点,故而天然药物是未来药物发展的大趋势。
4.链霉菌属是放线菌目中最庞大的成员,为革兰氏阳性、好氧、丝状菌,广泛分布于自然环境中,产生多种生物活性的次级代谢产物,如抗生素、维生素、酶抑制剂等。据统计,临床抗生素有60%以上来自链霉菌。近年来研究发现昆虫共生菌特殊生境中的链霉菌具有代谢产物特殊、化学结构新颖、生物活性强等作为药用资源的巨大潜力。例如,从一株假单胞菌分离出一种新的双吲哚类抗癌药雷贝卡霉素(van arnam,e.b.;ruzzini.a.c.;sit, c.s.;horn,h.;pinto-t,a.a.;currie,c.r.;clardy,j.j.am.chem.soc.2015,137,14272
‑ꢀ
14274.)。
技术实现要素:
5.本发明要解决的技术问题是提供一种黑翅土白蚁共生链霉菌(streptomycestanashiensis)byf112及其产生的具有抗癌活性化合物的制备与用途-作为一种抗癌先导化合物。
6.为了解决上述技术问题,本发明提供链霉菌产生的具有抗癌活性化合物,其结构式为:
[0007][0008]
本发明还同时提供了一株具有强力抗癌活性的链霉菌byf-112,保藏号为cctcc no:m 2019474,保藏日期为2019年06月20日,保藏地址为中国典型培养物保藏中心(cctcc)湖北省武汉市武昌区八一路珞珈山。
[0009]
本发明还同时提供了上述新吩嗪抗癌活性代谢产物制备方法,包括如下步骤:
[0010]
1)、保藏号为cctcc no:m 2019474的链霉菌byf-112接种到高氏培养基上,于摇床上,在160~200rpm(较佳为180rpm)、27.5~28.5℃(较佳为28℃)条件下培养2~3天作为种子液;
[0011]
2)、将种子液接种于高氏培养基中,在160~200rpm(较佳为180rpm)27.5~28.5℃ (较佳为28℃)条件下发酵6.5~7.5天(较佳为7天);
[0012]
一般而言,每10ml种子液接种于350~450ml(较佳为400ml的高氏培养基中);
[0013]
3)、将步骤2)所得发酵液过滤(经两层纱布过滤),滤液用乙酸乙酯萃取(共萃取 3次,每次乙酸乙酯的用量=发酵液的体积量),真空浓缩干燥(于0.1个负压的真空度, 45℃干燥30-50分钟),得浸膏(呈黑色);
[0014]
4)、将步骤3)所得浸膏进行硅胶柱层析分段,采用二氯甲烷/甲醇进行梯度洗脱,所述二氯甲烷与甲醇的体积比依次为100:0、100:1、100:2、100:4、100:8;从而分别得到 5个洗脱部分f1-f5;
[0015]
5)、将步骤4)所得组分f2干燥处理后,在甲醇中重结晶,经tlc分析得到化合物8。
[0016]
6)、将步骤4)所得组分f3干燥处理后,在甲醇中重结晶,经tlc分析得到化合物11 和组分f3-1,将组分f3-1干燥后,在乙酸乙酯中重结晶,经tlc分析分别得到化合物5和 10和组分f3-1-1,将组分f3-1-1经凝胶柱层析分离,以甲醇为洗脱剂,经tlc分析得到化合物2。
[0017]
7)、将步骤4)所得组分f4干燥处理后,在甲醇中重结晶,经tlc分析得到化合物9和组分f4-1,f4-2,f4-3,f4-4,将组分f4-1和f4-2合并经凝胶柱层析分离,以甲醇为洗脱剂,经tlc分析分别得到化合物1,6和7;将组分f4-3采用采用二氯甲烷/甲醇进行梯度洗脱,所述二氯甲烷与甲醇的体积比依次为100:0、100:1、50:1、20:1、10:1;将二氯甲烷与甲醇的体积比为10:1干燥处理后,在甲醇中重结晶,经tlc分析得到化合物3;将组分f4-4采用二氯甲
烷/甲醇进行梯度洗脱,所述二氯甲烷与甲醇的体积比依次为100:0、100:1、100:2、 100:4、100:8,将二氯甲烷与甲醇的体积比为100:4干燥处理后,在甲醇中重结晶,经tlc 分析得到化合物4。
[0018]
进一步的,步骤(1)中,将链霉菌(streptomyces tanashiensis)byf-112经高氏培养基活化后接种于高氏液体培养基中发酵培养6.5~7.5d,温度为27.5~28.5℃(较佳为28℃),转速为160~200rpm(较佳为180rpm)。
[0019]
本发明所使用的高氏液体培养基为,20g可溶性性淀粉,0.5g kno3,0.5g k2hpo4·
3h2o, 0.5g mgso4·
7h2o,0.5g nacl,0.01g feso4·
7h2o g,用蒸馏水配制1l,ph 7.0~8.0。
[0020]
本发明还同时提供了上述次级代谢产物在抗癌方面的应用,所述化合物可作为制备的抗肿瘤、抗菌、除草的药物。
[0021]
上述化合物可作为抑制黑色素细胞瘤、胃癌、乳腺癌和卵巢癌细胞生长、抑制四链球菌生长、抑制稗草根生长的药物。
[0022]
本发明所述链霉菌,链霉菌的分类学命名为streptomyces tanashiensis byf-112,分离于中国江苏江阴郊区,该菌株于2019年6月20日保藏于中国典型培养物保藏中心,保藏编号为cctcc no:m 2019474。保藏单位地址为中国.武汉。
[0023]
本发明具有如下有益效果:
[0024]
1.本发明的链霉菌byf-112次级代谢产物(1-4和7)是新化合物,(5-6,8-11)是已知物,可以作为具有抑制黑色素细胞瘤、胃癌、乳腺癌和卵巢癌细胞生长、抑制四链球菌生长、抑制稗草根生长的先导化合物。
[0025]
2.本发明的链霉菌byf-112次级代谢产物可以利用微生物进行液体发酵生产,工艺简便,周期短,成本低,来源有保证。
[0026]
3.本发明利用生物法合成链霉菌byf-112次级代谢产物对环境无污染。
[0027]
保藏信息
[0028]
保藏时间:2019年6月20日
[0029]
保藏单位:中国典型培养物保藏中心;
[0030]
保藏编号:cctcc no:m 2019474;
[0031]
保藏单位地址:中国典型培养物保藏中心(cctcc)湖北省武汉市武昌区八一路珞珈山武汉大学;
[0032]
分类命名:streptomyces tanashiensis byf-112。
附图说明
[0033]
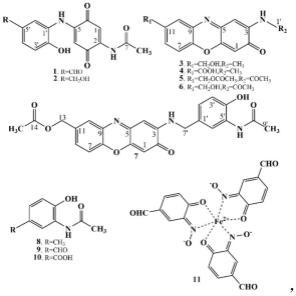
图1为本发明实施例提供的11种生物碱类化合物的结构式。
[0034]
图2为本发明实施例提供的化合物vegfrecine a(1)的1h nmr(agilent dd2, dmso-d6.)光谱图。
[0035]
图3为本发明实施例提供的化合物vegfrecine a(1)的
13
c nmr(agilent dd2, dmso-d6.)光谱图。
[0036]
图4为本发明实施例提供的化合物vegfrecine a(1)的cosy(agilent dd2, dmso-d6.)光谱图。
[0037]
图5为本发明实施例提供的化合物vegfrecine a(1)的hsqc(agilent dd2, dmso-d6.)光谱图。
[0038]
图6为本发明实施例提供的化合物vegfrecine a(1)的dept(agilent dd2, dmso-d6.)光谱图。
[0039]
图7为本发明实施例提供的化合物vegfrecine a(1)的hmbc(agilent dd2, dmso-d6.)光谱图。
[0040]
图8为本发明实施例提供的化合物vegfrecine a(1)的hr-esi-ms图。
[0041]
图9为本发明实施例提供的化合物vegfrecine b(2)的1h nmr(agilent dd2, actone-d6.)光谱图。
[0042]
图10为本发明实施例提供的化合物vegfrecine b(2)的
13
c nmr(agilent dd2, actone-d6.)光谱图。
[0043]
图11为本发明实施例提供的化合物vegfrecine b(2)的cosy(agilent dd2, actone-d6.)光谱图。
[0044]
图12为本发明实施例提供的化合物vegfrecine b(2)的hsqc(agilent dd2, actone-d6.)光谱图。
[0045]
图13为本发明实施例提供的化合物vegfrecine b(2)的dept(agilent dd2, actone-d6.)光谱图。
[0046]
图14为本发明实施例提供的化合物vegfrecine b(2)的hmbc(agilent dd2, actone-d6.)光谱图。
[0047]
图15为本发明实施例提供的化合物vegfrecine b(2)的hr-esi-ms图。
[0048]
图16为本发明实施例提供的化合物exfoliazone a(3)的1h nmr(agilent dd2, dmso-d6.)光谱图。
[0049]
图17为本发明实施例提供的化合物exfoliazone a(3)的
13
c nmr(agilent dd2, dmso-d6.)光谱图。
[0050]
图18为本发明实施例提供的化合物exfoliazone a(3)的cosy(agilent dd2, dmso-d6.)光谱图。
[0051]
图19为本发明实施例提供的化合物exfoliazone a(3)的hsqc(agilent dd2, dmso-d6.)光谱图。
[0052]
图20为本发明实施例提供的化合物exfoliazone a(3)的dept(agilent dd2, dmso-d6.)光谱图。
[0053]
图21为本发明实施例提供的化合物exfoliazone a(3)的hmbc(agilent dd2, dmso-d6.)光谱图。
[0054]
图22为本发明实施例提供的化合物exfoliazone a(3)的hr-esi-ms图。
[0055]
图23为本发明实施例提供的化合物venezueline h(7)的1h nmr(agilent dd2, dmso-d6.)光谱图。
[0056]
图24为本发明实施例提供的化合物venezueline h(7)的
13
c nmr(agilent dd2, dmso-d6.)光谱图。
[0057]
图25为本发明实施例提供的化合物venezueline h(7)的cosy(agilent dd2, dmso-d6.)光谱图。
[0058]
图26为本发明实施例提供的化合物venezueline h(7)的hsqc(agilent dd2, dmso-d6.)光谱图。
[0059]
图27为本发明实施例提供的化合物venezueline h(7)的hmbc(agilent dd2, dmso-d6.)光谱图。
[0060]
图28为本发明实施例提供的化合物venezueline h(7)的hmbc(agilent dd2, dmso-d6.)光谱图。
[0061]
图29为本发明实施例提供的化合物venezueline h(7)的hr-esi-ms图。
[0062]
图30为本发明实施例提供的化合物对稗草根的生长抑制测定结果
具体实施方式
[0063]
为了更好的理解本发明的内容,下面结合具体实施例进一步说明,但本专利的保护内容不仅限于此。
[0064]
下面结合具体实施例对本发明做进一步的解释。
[0065]
实施例1:链霉菌(streptomyces tanashiensis)byf-112分离与纯化链霉菌byf-112的分离:
[0066]
分离前让黑翅土白蚁饥饿24h,用无菌镊子分别取出年轻工蚁(20头)置于灭菌离心管中。加入1ml ph7.4的无菌pbs缓冲液,震荡得到漂洗液。用无菌水对震荡液梯度稀释成10-1
、10-2
、10-3
,分别取各梯度稀释液0.1ml涂布于m3培养基平板上,28℃恒温箱中培养4天。待菌落长出后,从组织块菌落边缘挑取少量菌丝,再次转接高氏培养基平板上,经纯化得到单菌落,经形态学与分子生物学鉴定为田无链霉菌(streptomyces tanashiensis) byf-112
[0067]
培养基:20g可溶性性淀粉,0.5g kno3,0.5g k2hpo4·
3h2o,0.5g mgso4·
7h2o,0.5gnacl,0.01g feso4·
7h2o,用蒸馏水配制1l,ph 7.0~8.0,1.1个大气压,121℃下灭菌20min (为常规灭菌)。
[0068]
上述链霉菌(streptomyces tanashiensis)byf-112进行了保藏,保藏单位:中国典型培养物保藏中心;保藏名称为:streptomyces tanashiensis byf-112,保藏地址:中国武汉,武汉大学;保藏日期:2019.06.20;保藏号为cctcc no:m 2019474。
[0069]
上述链霉菌(streptomyces tanashiensis)byf-112可接种至高氏斜面试管保存备用。
[0070]
实施例2:昆虫共生菌
‑‑
田无链霉菌(streptomyces tanashiensis)byf-112的液体发酵
[0071]
将新鲜的链霉菌(streptomyces tanashiensis)byf-112的菌丝体块(约2~3g)接种到 250ml锥形瓶中,每瓶含有150ml的高氏培养基,接种10~15瓶于摇床上,在180rpm、28℃条件下培养2~3天作为种子液,然后将10ml种子液接种于装有400ml的高氏培养基的 1000ml锥形瓶中,在180rpm、28℃条件下发酵7天。
[0072]
备注说明:田无链霉菌(streptomyces tanashiensis)byf-112经常规的高氏培养基活化后,即可得新鲜的田无链霉菌(streptomyces tanashiensis)byf-112。
[0073]
所述高氏培养基的配方为:20g可溶性性淀粉,0.5g kno3,0.5g k2hpo4·
3h2o,0.5gmgso4·
7h2o,0.5g nacl,0.01g feso4·
7h2o,用蒸馏水配制1l,ph 7.0~8.0,1.1个
大气压,121℃下灭菌20min(为常规灭菌)。
[0074]
实施例3、链霉菌byf-112次级代谢产物的提取与分离
[0075]
将实施例2制备而得的15.6l发酵液经两层纱布过滤,滤液用乙酸乙酯萃取3次(乙酸乙酯每次的用量为50l),所得的萃取液真空浓缩干燥(于0.1个负压的真空度,45℃干燥 30-50分钟)得黑色浸膏。对该浸膏进行硅胶柱层析分段(所述硅胶柱选用200~300目的硅胶,重量为200g),所述二氯甲烷与甲醇的体积比依次为100:0、100:1、100:2、100:4、100:8;从而分别得到5个洗脱部分f1-f5;每种洗脱液的用量分别为2700~3000、1200~ 1400、5600~5900、2000~2300、1200~1500、1800~2000、800~1200ml;从而分别得到5个洗脱部分f1-f5;
[0076]
将所得组分f2干燥处理后,在甲醇中重结晶,经tlc分析得到化合物8。所得组分f3 干燥处理后,在甲醇中重结晶,经tlc分析得到化合物11和组分f3-1,将组分f3-1干燥后,在乙酸乙酯中重结晶,经tlc分析分别得到化合物5和10和组分f3-1-1,将组分f3-1-1经凝胶柱层析分离,以甲醇为洗脱剂,经tlc分析得到化合物2。将所得组分f4干燥处理后,在甲醇中重结晶,经tlc分析得到化合物9和组分f4-1,f4-2,f4-3,f4-4,将组分f4-1和 f4-2合并经凝胶柱层析分离,以甲醇为洗脱剂,经tlc分析分别得到化合物1,6和7;将组分f4-3采用采用二氯甲烷/甲醇进行梯度洗脱,所述二氯甲烷与甲醇的体积比依次为100:0、 100:1、50:1、20:1、10:1;将二氯甲烷与甲醇的体积比为10:1干燥处理后,在甲醇中重结晶,经tlc分析得到化合物3;将组分f4-4采用二氯甲烷/甲醇进行梯度洗脱,所述二氯甲烷与甲醇的体积比依次为100:0、100:1、100:2、100:4、100:8,将二氯甲烷与甲醇的体积比为100:4干燥处理后,在甲醇中重结晶,经tlc分析得到化合物4。
[0077]
其结构式为:
[0078][0079]
实施例4田无链霉菌byf-112代谢产物的结构解析
[0080]
化合物1为紫红色粉末,hr-esi-ms在m/z 323.0642[m+na]
+
处给出分子离子峰(如图8所示),推测化合物的分子式为c
15h12
n2o5。对该化合物的1h-nmr(如图2所示)和
13c‑ꢀ
nmr谱图(如图3所示)分析发现该化合物与vegfrecine具有相同的母核结构,通过二维 hsqc(如图5所示)、cosy(如图4所示)和hmbc(如图7所示)的谱图分析,最终确定化合物的结构如
式(1)中所示。化合物1命名为vegfrecinea(1),该化合物的1h 和
13
c nmr(dmso-d6)归属如表1所示。
[0081]
化合物2为紫红色粉末,hr-esi-ms在m/z 325.0975[m+na]
+
处给出分子离子峰(如图15所示),推测化合物的分子式为c
15h14
n2o5。对该化合物的1h-nmr(如图9所示)和
13
c-nmr谱图(如图10所示)分析发现与化合物1具有相同的母核结构,唯一区别是苯环5,被氧化成醛基。通过二维hsqc(如图12所示)、cosy(如图11所示)和hmbc(如图 14所示)的谱图分析,最终确定化合物的结构如式(1)中所示。化合物2命名为vegfrecineb (2),该化合物的1h和
13
c-nmr(acetone-d6)归属如表1所示。
[0082]
化合物3为红色固体,hr-esi-ms在m/z 257.0930[m+h]
+
处给出分子离子峰(如图22 所示),推测化合物的分子式为c
14h12
n2o3。对该化合物的1h-nmr(如图16所示)和
13c‑ꢀ
nmr谱图(如图17所示)分析发现该化合物与exfoliazone具有相同的母核结构,通过二维hsqc(如图19所示)、cosy(如图18所示)和hmbc(如图21所示)的谱图分析,最终确定化合物的结构如式(1)中所示。化合物3命名为exfoliazone a(3),该化合物的1h和
13
c nmr(dmso-d6)归属如表2所示。
[0083]
化合物7为红色粉末,hr-esi-ms在m/z 470.1320[m+na]
+
处给出分子离子峰(如图29 所示),推测化合物的分子式为c
24h21
n3o6。对该化合物的1h-nmr(如图23所示)和
13c‑ꢀ
nmr谱图(如图24所示)分析发现该化合物与venezueline具有相同的母核结构,通过二维hsqc(如图26所示)、cosy(如图25所示)和hmbc(如图28所示)的谱图分析,最终确定化合物的结构如式(1)中所示。化合物7命名为vegfrecinea(7),该化合物的1h和
13
c nmr(dmso-d6)归属如表3所示。
[0084]
表1化合物1(vegfrecinea,dmso-d6)和2(vegfrecineb,acetone-d6)的1h和
13
cnmr归属
[0085]
[0086][0087]
表2化合物3(exfoliazonea)的1h和
13
cnmr(dmso-d6)归属.
[0088][0089]
表3化合物7(venezueline h)的1h和
13
cnmr(dmso-d6)归属.
[0090]
[0091][0092]
实施案例5化合物的细胞毒性活性测定
[0093]
细胞培养细胞培养于含10%胎牛血清的dmem培养基中,置于37℃、5%二氧化碳胞培养箱中培养,稳定传2~3代后,取对数生长期的细胞做后续实验。
[0094]
细胞增殖实验收集对数期细胞,计数,调整细胞悬液浓度,以4000个/100μl/孔,接种于 96孔板,37℃、5%二氧化碳条件下培养24h后至细胞单层铺满孔底面积的2/3。从孔边缘小心吸弃培养基,各加入一定浓度梯度的化合物,100μl/孔,每组设4个平行复孔,分别培养24、48、72h。避光条件下,加入mtt溶液20μl/孔,继续放入培养箱中培养4h。小心吸去孔内培养液,加入dmso,150μl/孔,置摇床上低速振荡15min。在酶标仪492nm处测量各孔的吸光度值(optical density,od),以对照孔调零。记录结果并计算细胞抑制率,抑制率 (inhibitory concentration,ic)(%)=(1-(实验组od均值-空白组od均值)/(对照组od均值-空白组od均值]
×
100%,实验重复操作3次,并计算均值和半数抑制浓度(ic
50
)。阳性对照为阿霉素(adriamycin),空白对照为溶剂处理的肿瘤细胞.
[0095]
表4链霉菌byf-112次级代谢产物的ic
50
[0096][0097]
阿霉素:阳性对照。b:未测试。c:浓度》100μm。a375:人恶性黑色素瘤细胞。skov-3,人卵巢癌细胞。mda-mb231:人乳腺癌细胞。mgc-803:人胃癌细胞。l-02:正常细胞。
[0098]
如表4所示,新化合物1中对skov-3ic
50
值为76.18
±
2.09μm,与阳性对照0.72
±
0.12 μm相比,细胞毒活性极弱,但对正常细胞的毒活性也很弱;新化合物2对a375 ic50值
为47.25
±
0.98μm,与阳性对照1.01
±
0.48μm相比,细胞毒活性较弱,但强于化合物 1对skov-3的细胞毒活性,对正常细胞毒活性也很弱;新化合物3对四种细胞株毒性较弱。化合物5、6、11对a375表现出显著活性,ic
50
值分别为7.32、5.85、5.46和8.20μ m,与阳性对照ic50=1.01μm相当,同时,化合物11对正常细胞(l-02)没有毒性。此外,化合物5、6对skov-3表现出较好毒活性,ic
50
值为6.09-11.09μm,与阳性对照阿霉素ic
50
值0.72
±
0.12μm细胞毒活性相当。化合物6,8,9,10对a375有一定活性,ic
50
值为22.01
±
0.38μm,与阳性对照1.01
±
0.48μm相比,活性一般。单体8,9对四种细胞株的活性都比较弱。
[0099]
实施案例6化合物的抑菌活性测定
[0100]
采用滤纸片扩散法检测化合物对四联球菌(mlicrococcus tetragenus),将化合物和硫酸庆大霉素(阳性对照)用丙酮溶解浓度为6mg/ml的溶解液,用0.22μm的有机相微孔滤膜过滤除菌。用划线法将四联球菌(mlicrococcus tetragenus)接种至lb固体培养基中,置于37℃恒温培养24h活化。取1ml无菌水于1.5ml离心管中,用接种环蘸取少量细菌于无菌水中混合均匀制成菌悬液,比对比浊管将菌悬液浓度调整为约106cfμ/ml,然后用孔直径为6mm的单孔打孔机将滤纸打成若干滤纸圆片灭菌备用。取100μl菌悬液加入100ml 50-60℃lb固体培养基中混合均匀倒平板,待培养基凝固后,将无菌滤纸小心贴在培养基上,每滤纸片滴加5μl的代谢产物或硫酸庆大霉素,最后置于37℃恒温培养24h,十字交叉法测量抑菌圈直径,每组三个重复
[0101]
表5链霉菌byf-112次级代谢产物11对四链球菌抑菌圈直径(mm)
[0102][0103]
测定结果如表5所示,在供试浓度为30μg时化合物11对mlicrococcus tetragenus抑菌圈平均直径为14.1mm,与阳性对照硫酸庆大霉素28.0mm相比具有中等的抑菌能力。
[0104]
实施案例7化合物对稗草根生长抑制测定
[0105]
采用滤纸-培养皿法测定化合物对稗草根生长的抑制活性。采用滤纸-培养皿法测定粗浸膏对反枝苋及常见农作物根生长的抑制活性。具体操作如下:(1)用次氯酸钠浸泡稗草15 min,清水洗涤2-3次。将处理过的上述种子置于含水的滤纸-培养皿中,光照培养箱(27℃、 80%相对湿度,12/12白天/黑夜)中催芽1d,去除浮于水面的种子,剩余的种子用蒸馏水冲洗干净,备用。(2)取适量丙酮将待测粗浸膏充分溶解、配制成100μg/ml的样品溶液,取5ml均匀喷洒于铺有滤纸的培养皿中,使滤纸与药液充分饱和,待丙酮充分挥发后加入5ml无菌水。空白对照用丙酮作同样处理,同浓度2,4-d作为阳性对照。 (3)选取刚刚露白的上述供试种子(每皿20粒)均匀置于上述处理过的滤纸-培养皿中, 27℃、80%相对湿度、定时光照(12/12白天/黑夜)条件的人工气候培养箱培养4d。(4) 测量幼根长度,以平均根生长抑制率表示化合物的除草活性,每个处理重复3皿。平均生长抑制率(%)=[对照平均根长-处理平均根长]/对照平均根长
×
100%。
[0106]
如图30所示,单体化合物11和5在测定浓度为100μg/ml时能有效抑制稗草根的生长,抑制率分别达到了55.3%和41.7%,表现出良好的抑制能力;化合物6在高浓度时对稗草根生长抑制活性较弱,抑制率为6.1%,而阳性对照2,4-dichlorophenoxyacetic acid在100μg/ml 能基本抑制稗草根的生长。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1