一种引物组合物及其核酸扩增检测方法与应用与流程
1.本发明涉及核酸诊断试剂技术领域,尤其涉及一种引物组合物及其核酸扩增检测方法与应用。
背景技术:
[0002][0003]
荧光pcr是核酸检测中最主要的方法,但其检测周期相对较长,需要核酸提取、pcr扩增,整个流程至少需要70分钟。
[0004]
重组酶介导的恒温扩增技术(rpa技术)扩增效率迅速,参与的酶种类最多。
[0005]
转录介导扩增技术(tma)的核酸诊断技术以rna为模板进行扩增,利用 t7 dna聚合酶和逆转录酶对转录生成的rna产物进行分析检测,但该技术对扩增条件要求比较高。
[0006]
lamp技术的核酸诊断需要搭配特定仪器进行检测,定位为poct快速检测,且该技术的扩增周期相对比较长,需要50分钟左右。
[0007]
因此,亟需一种引物组合物及其核酸扩增检测方法与应用。
技术实现要素:
[0008]
本发明的目的是针对现有技术中的不足,提供一种引物组合物及其核酸扩增检测方法与应用。
[0009]
为实现上述目的,本发明采取的技术方案是:
[0010]
本发明的第一方面是提供一种引物组合物,用于核酸快速扩增与检测,包括:第一茎环引物、第二茎环引物、通用引物以及前导引物;
[0011]
其中,所述第一茎环引物的核苷酸序列自5’端至3’端依次包括:第一茎序列、突环序列、第二茎序列以及第一引物;所述第一茎序列、所述突环序列以及所述第二茎序列构成第一茎环结构,靶序列的互补序列与且仅与所述第一引物特异性结合;
[0012]
其中,所述第二茎环引物的核苷酸序列自5’端至3’端依次包括:所述第一茎序列、所述突环序列、所述第二茎序列以及第二引物;所述第一茎序列、所述突环序列以及所述第二茎序列构成所述第一茎环结构,靶序列与且仅与所述第二引物特异性结合;
[0013]
其中,所述通用引物的核苷酸序列包括:所述突环序列;
[0014]
其中,所述前导引物与所述靶序列的互补序列特异性结合,且所述前导引物与所述靶序列的互补序列特异性结合的位点位于所述第一引物与所述靶序列的互补序列特异性结合位点的5’端上游。
[0015]
优选地,所述第一茎序列由6-20个碱基组成。
[0016]
优选地,所述突环序列由12-25个碱基组成。
[0017]
优选地,所述第二茎序列由6-20个碱基组成。
[0018]
优选地,所述第一引物由14-30个碱基组成,tm值为50-70。
[0019]
优选地,所述通用引物为第一通用引物或/和第二通用引物;所述第一通用引物以
及所述第二通用引物的核苷酸序列均包括:所述突环序列。
[0020]
更优选地,所述第一通用引物的核苷酸序列为所述突环序列。
[0021]
更优选地,所述第二通用引物的核苷酸序列自5’端至3’端依次包括:具有第二茎环结构的信标序列以及所述突环序列。
[0022]
本发明的第二方面是提供一种上述引物组合物的核酸扩增检测方法,步骤包括:
[0023]
s1、所述第二茎环引物与rna靶序列特异性结合,在逆转录酶的作用下合成cdna;
[0024]
s2、所述第一茎环引物与所述cdna特异性结合,在dna聚合酶的作用下合成dna;
[0025]
由于所述前导引物与所述cdna特异性结合的位点位于所述第一茎环引物与所述cdna特异性结合位点的5’端上游,故而所述第一茎环引物引导合成的 dna被所述前导引物替换并成为ssdna,该ssdna的核苷酸序列自5’端至3’端依次包括:所述第一茎环引物、所述rna靶序列逆转录合成的dna序列以及所述第二茎环引物的互补序列;
[0026]
s3、在dna聚合酶的作用下,前一步骤获得的ssdna,自最末端的所述第二茎环引物的互补序列的3’端延伸合成dsdna;
[0027]
s4、所述通用引物与前一步骤合成的dsdna中所述第二茎环引物中所述突环序列的互补序列特异性结合,在dna聚合酶的作用下,合成包括所述第一茎环引物的互补序列的dna;
[0028]
由于前一步骤合成的dsdna中未作为本步骤中dna合成模板的核苷酸序列与本步骤新合成的dna的核苷酸序列相同,故而前一步骤合成的dsdna中未作为本步骤中dna合成模板的核苷酸序列被本步骤新合成的dna替换并成为ssdna;
[0029]
s5、在dna聚合酶的作用下,前一步骤获得的ssdna,自最末端的所述第一茎环引物的互补序列的3’端延伸合成dsdna;
[0030]
s6、所述通用引物与前一步骤合成的dsdna中所述第一茎环引物中所述突环序列的互补序列特异性结合,在dna聚合酶的作用下,合成包括所述第二茎环引物的互补序列的dna;同时,前一步骤合成的dsdna成为ssdna;
[0031]
s7、循环步骤s3至步骤s6若干次。
[0032]
优选地,所述核酸扩增检测方法采用恒定温度扩增检测,所述恒定温度扩增检测中的温度为40℃-70℃。
[0033]
优选地,所述dna聚合酶为带链置换的dna聚合酶。
[0034]
更优选地,所述dna聚合酶选自bst dna聚合酶、bsu dna聚合酶、phi29 dna聚合酶或sd taq dna聚合酶中的至少一种。
[0035]
本发明上述核酸扩增检测方法仅以rna扩增检测为例,对于本领域技术人员而言,应当能够意识到运用上述核酸扩增检测方法至dna扩增检测之中。
[0036]
本发明的第三方面是提供一种上述引物组合物或上述核酸扩增检测方法在制备病原体检测试剂盒中的应用。
[0037]
本发明采用以上技术方案,与现有技术相比,具有如下技术效果:
[0038]
本发明的引物组合物及其核酸扩增检测方法能快速检测,且除与靶序列结合的序列外,其他序列均为通用序列,极大地提高了核酸检测的准确性以及广谱性。
附图说明
[0039]
图1为本发明一实施例中引物组合物的基本结构示意图;
[0040]
图2为本发明一实施例中引物组合物的核酸扩增检测方法图;
[0041]
图3为本发明一实施例中引物组合物的核酸扩增检测结果;
[0042]
图中的附图标记包括:
[0043]
第一茎环引物1;第一茎序列11;突环序列12;第二茎序列13;第一引物14;第二茎环引物2;第二引物21;通用引物3;第一通用引物31;第二通用引物32;信标序列321;前导引物4。
具体实施方式
[0044]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0045]
需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
[0046]
下面结合附图和具体实施例对本发明作进一步说明,但不作为本发明的限定。
[0047]
实施例1
[0048]
本实施例提供一种引物组合物,用于核酸快速扩增与检测,包括:第一茎环引物1、第二茎环引物2、通用引物3以及前导引物4;
[0049]
其中,所述第一茎环引物1的核苷酸序列自5’端至3’端依次包括:第一茎序列11、突环序列12、第二茎序列13以及第一引物14;所述第一茎序列11、所述突环序列12以及所述第二茎序列13构成第一茎环结构,靶序列的互补序列与且仅与所述第一引物14特异性结合;
[0050]
其中,所述第二茎环引物2的核苷酸序列自5’端至3’端依次包括:所述第一茎序列11、所述突环序列12、所述第二茎序列13以及第二引物21;所述第一茎序列11、所述突环序列12以及所述第二茎序列13构成所述第一茎环结构,靶序列与且仅与所述第二引物21特异性结合;
[0051]
其中,所述通用引物3的核苷酸序列包括:所述突环序列12;所述通用引物3为第一通用引物31或/和第二通用引物32;所述第一通用引物31以及所述第二通用引物32的核苷酸序列均包括:所述突环序列12;所述第一通用引物31 的核苷酸序列为所述突环序列12;所述第二通用引物32的核苷酸序列自5’端至 3’端依次包括:具有第二茎环结构的信标序列321以及所述突环序列12;
[0052]
其中,所述前导引物4与所述靶序列的互补序列特异性结合,且所述前导引物4与所述靶序列的互补序列特异性结合的位点位于所述第一引物14与所述靶序列的互补序列特异性结合位点的5’端上游。
[0053]
实施例2
[0054]
本实施例提供一种采用如实施例1所述引物组合物的核酸扩增检测方法;
[0055]
扩增体系包括:4μl rna模板;1μl第一茎环引物1;1μl第二茎环引物2; 0.2μl前导
引物4;1μl第一通用引物31或第二通用引物32;2.5μl10
×
reactionbuffer;4μldntpmix(10mm);8ubstdna聚合酶;4urtx逆转录酶;1μlstyo染料;剩余用水补齐至50μl;
[0056]
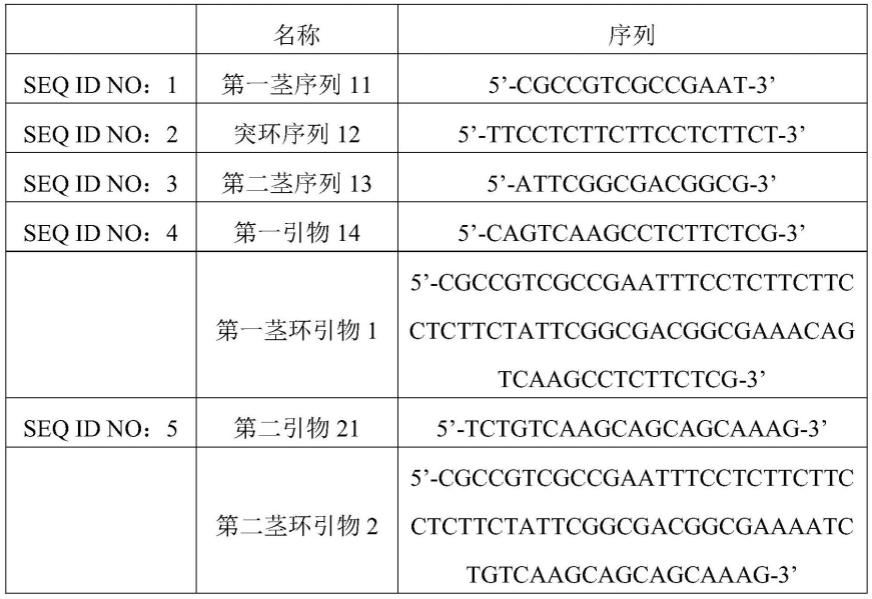
扩增体系中所涉及的各核苷酸序列如表1所示;
[0057]
表1
[0058]
[0059]
[0060][0061]
扩增步骤包括:
[0062]
s1、所述第二茎环引物2与rna模板特异性结合,在逆转录酶的作用下合成cdna;
[0063]
s2、所述第一茎环引物1与所述cdna特异性结合,在dna聚合酶的作用下合成dna;
[0064]
由于所述前导引物4与所述cdna特异性结合的位点位于所述第一茎环引物1与所述cdna特异性结合位点的5’端上游,故而所述第一茎环引物1引导合成的dna被所述前导引物4替换并成为ssdna,该ssdna的核苷酸序列自5’端至3’端依次包括:所述第一茎环引物1、所述rna靶序列逆转录合成的dna 序列以及所述第二茎环引物2的互补序列;
[0065]
s3、在dna聚合酶的作用下,前一步骤获得的ssdna,自最末端的所述第二茎环引物2的互补序列的3’端延伸合成dsdna;
[0066]
s4、所述通用引物3与前一步骤合成的dsdna中所述第二茎环引物2中所述突环序
列12的互补序列特异性结合,在dna聚合酶的作用下,合成包括所述第一茎环引物1的互补序列的dna;
[0067]
由于前一步骤合成的dsdna中未作为本步骤中dna合成模板的核苷酸序列与本步骤新合成的dna的核苷酸序列相同,故而前一步骤合成的dsdna中未作为本步骤中dna合成模板的核苷酸序列被本步骤新合成的dna替换并成为ssdna;
[0068]
s5、在dna聚合酶的作用下,前一步骤获得的ssdna,自最末端的所述第一茎环引物1的互补序列的3’端延伸合成dsdna;
[0069]
s6、所述通用引物3与前一步骤合成的dsdna中所述第一茎环引物1中所述突环序列12的互补序列特异性结合,在dna聚合酶的作用下,合成包括所述第二茎环引物2的互补序列的dna;同时,前一步骤合成的dsdna成为 ssdna;
[0070]
s7、循环步骤s3至步骤s6若干次。
[0071]
扩增程序包括:60℃恒温扩增,每30秒一个循环,共检测30循环,并收集荧光。
[0072]
扩增结果如图3所示:检测高浓度模板5分钟左右出峰;低浓度模板在10 分钟左右出峰。
[0073]
综上所述,本发明的引物组合物及其核酸扩增检测方法能快速检测,且除与靶序列结合的序列外,其他序列均为通用序列,极大地提高了核酸检测的准确性以及广谱性。
[0074]
以上所述仅为本发明较佳的实施例,并非因此限制本发明的实施方式及保护范围,对于本领域技术人员而言,应当能够意识到凡运用本发明说明书及图示内容所作出的等同替换和显而易见的变化所得到的方案,均应当包含在本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1