一种高亲和力抗人巨细胞病毒的全人源单克隆抗体及其用途
1.本发明涉及生物免疫学领域,具体地说,涉及一种高亲和力抗人巨细胞病毒的全人源单克隆抗体及其用途。
背景技术:
2.人巨细胞病毒(human cytomegalovirus,hcmv)感染又称巨细胞包涵体病,为广泛感染人类的病毒之一,既可以通过母婴先天性传播,也可以通过唾液、乳汁、尿液以及手术、器官移植等医源性方式进行后天性传染。1956年,人们首次发现hcmv与健康个体的传染性单核细胞样病变相关。hcmv具有广泛的细胞取向性,能感染大多数细胞类型和器官,与其他疱疹病毒相比,其发病率和死亡率更高。感染hcmv后会导致脑炎、胃肠道炎、视网膜炎、肝炎、肺炎等并发症,先天性感染也是产生精神性迟钝和先天性耳聋的重要原因。hcmv在其庞大的基因组中有大量的基因专门用于宿主免疫逃逸,它可以阻断固有的细胞防御,并干扰细胞免疫反应。20世纪30年代初,在医学上hcmv被认为是一种非常重要的病毒,当时研究者发现巨细胞包涵体病是一种严重的先天性hcmv 病,在婴儿的多器官细胞中都出现猫头鹰眼样包涵体;到了20世纪70年代,病原器官疾病与hcmv的联系已经建立起来,hcmv样病毒也被人类从其他哺乳动物中分离出来。
3.人巨细胞病毒是疱疹病毒组的一种dna病毒,感染hcmv后,病毒最初在进入部位的上皮细胞中复制,随后通过血液传播到其他器官和细胞中,其中包括胎盘的滋养层细胞。大部分免疫功能较好的健康人群感染hcmv后并不会出现临床症状,而免疫功能低下者如新生儿和免疫功能缺陷者如艾滋病患者,实体器官移植或造血干细胞移植接受者在被hcmv感染后会出现严重的临床症状甚至死亡。据文献报道,hcmv感染率极高,发达国家hcmv感染率约为60%,而在发展中国家,绝大部分的成年人都感染过hcmv。另外先天性感染是hcmv 重要的传播途径之一。孕妇感染hcmv后,会通过胎盘将病毒传播给胎儿,部分新生儿在出生后有明显症状,主要表现为肝脾肿大、小头畸形、精神迟钝和运动障碍等,严重者可导致流产、死胎、早产和新生儿死亡。据估计,每年全球hcmv感染导致的医疗费用高达44亿美元,hcmv感染已经给世界各国造成了极大的疾病负担和经济压力。
4.目前治疗hcmv感染的首选药物是静脉注射更昔洛韦(ganciclovir,gcv)。 gcv是一种核苷类似物,当被细胞激酶磷酸化成三磷酸更昔洛韦时,优先抑制病毒dna聚合酶ul54。然而,gcv剂量受到细胞毒性的限制,可导致中性粒细胞减少和血小板减少,并在动物研究中引起暂时性和永久性不孕。这种gcv 介导的中性粒细胞减少会增加细菌和真菌感染的死亡率,并且gcv的骨髓抑制作用可能会干扰hsct后免疫系统的重建。此外,耐药hcmv菌株(ul97、 ul54突变)的出现也大大限制了gcv在临床上的应用。hcmv感染的二线治疗药物包括西多福韦和膦甲酸钠,但它们都会引起肾毒性,并导致耐药感染发生。 hcmv疫苗的研制早在七十年代就已经开始,然而到目前为止,没有哪个领域的疫苗研制进展如hcmv疫苗这样令人沮丧。
5.在过去的三十年里,单克隆抗体已经从科学工具转变为强大的人类治疗手段。目
前,大约有30种治疗性单克隆抗体在美国和欧洲市场上销售,仅在美国,2010 年的销售额就达185亿美元。然而,国内外目前尚无针对人巨细胞病毒感染的单克隆抗体药物上市,市场几乎空白,到目前为止,国内外仍然没有在抗hcmv 单克隆抗体药物方面取得较好的进展,因此,申请人希望通过本实验室特有的人记忆性b细胞体外活化后特异筛选法筛选到一株甚至多株广谱的具有治疗作用的抗人巨细胞病毒感染的全人源单克隆抗体,为临床治疗人巨细胞病毒感染开发新药物。
技术实现要素:
6.本发明人经过深入的研究,获得一种具有广谱结合人巨细胞病毒的全人源单克隆抗体,本发明的单克隆抗体是全人源的,其重链、轻链可变区以及恒定区均来源于人的基因,因此具有免疫原性低、靶向性强、安全性高等特点。
7.人巨细胞病毒的结构是由包膜、被膜和含有dsdna的衣壳组成。hcmv直径为150~200nm,核心是一个约235kbp线性双链dna基因组,该基因组编码 220多个开放阅读框并被包裹在一个直径为100nm的二十面体衣壳(t=16)中,衣壳被蛋白质基质包裹,并被脂质双分子层包围,脂质双分子层是宿主和病毒蛋白质的混合物。hcmv包膜中含有20多种糖蛋白,其中gb和gh是最主要的2种糖蛋白。在诱导中和抗体方面,gb占主导地位,它能与多种细胞表面分子结合,介导病毒和细胞膜的融合,这种蛋白对于病毒的进入和细胞间的传播是必不可少的。此外,gb占包膜蛋白数量的50%以上,在病毒感染的细胞中最容易被检测到,并且它是唯一一种无需免疫技术即可在sds-page检测到的病毒糖蛋白。gb是诱导机体产生中和抗体的重要表位抗原,其中121-640位氨基酸序列高度保守且具有良好的抗原性,因此在抗原靶点的选择时,选定gb糖蛋白中的121-640位氨基酸序列作为抗原表位,最终获得了具有高安全性,高亲和力的抗人巨细胞病毒的全人源单克隆抗体。
8.本发明的一个方面在于提供一种抗人巨细胞病毒的全人源单克隆抗体,其具有重链可变区和轻链可变区:
9.(i)所述重链可变区的氨基酸序列具有seq id no:8、9任一项所示的重链可变区的氨基酸序列;或具有seq id no:8、9任一项所示氨基酸序列经替换、缺失或增加一个或几个氨基酸形成的具有同等功能的氨基酸序列;
10.(ii)所述轻链可变区的氨基酸序列具有如seq id no:10、11、12、13、14 任一项所示的轻链可变区的氨基酸序列;或具有seq id no:10、11、12、13、 14任一项所示氨基酸序列经替换、缺失或增加一个或几个氨基酸形成的具有同等功能的氨基酸序列。
11.优选地,该单克隆抗体具有如下任一组重链可变区和轻链可变区:
12.(i)重链可变区的氨基酸序列如seq id no:8所示(h1);轻链可变区的氨基酸序列如seq id no:10所示(2λ1);
13.(ii)重链可变区的氨基酸序列如seq id no:9所示(h2);轻链可变区的氨基酸序列如seq id no:11所示(2λ
10
);
14.(iii)重链可变区的氨基酸序列如seq id no:8所示(h1);轻链可变区的氨基酸序列如seq id no:12所示(2λ5);
15.(iv)重链可变区的氨基酸序列如seq id no:8所示(h1);轻链可变区的氨基酸序列如seq id no:13所示(2λ
17
);
16.(v)重链可变区的氨基酸序列如seq id no:8所示(h1);轻链可变区的氨基酸序列如seq id no:14所示(2λ7)。
17.在本发明的另一方面,本发明还提供一种编码上述单克隆抗体的核酸分子。
18.优选地,该核酸分子具有如seq id no:1、2任一项所示的重链可变区的核苷酸序列;和如seq id no:3、4、5、6、7任一项所示的轻链可变区的核苷酸序列。
19.更优选地,该核酸分子具有如下任一组重链可变区和轻链可变区:
20.(i)重链可变区的核苷酸序列如seq id no:1所示(h1);轻链可变区的核苷酸序列如seq id no:3所示(2λ1);
21.(ii)重链可变区的核苷酸序列如seq id no:2所示(h2);轻链可变区的核苷酸序列如seq id no:4所示(2λ
10
);
22.(iii)重链可变区的核苷酸序列如seq id no:1所示(h1);轻链可变区的核苷酸序列如seq id no:5所示(2λ5);
23.(iv)重链可变区的核苷酸序列如seq id no:1所示(h1);轻链可变区的核苷酸序列如seq id no:6所示(2λ
17
);
24.(v)重链可变区的核苷酸序列如seq id no:1所示(h1);轻链可变区的核苷酸序列如seq id no:7所示(2λ7)。
25.在本发明的另一方面,提供一种表达载体,所述的表达载体包括上述核酸分子。
26.该表达载体除包含上述的核酸分子,还可以包含适当启动子或者控制序列。该载体可以用于转化适当的宿主细胞,以使其能够表达蛋白质。
27.在本发明的另一方面,提供一种宿主细胞,所述的宿主细胞包括上述表达载体。
28.宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。代表性例子有:细菌细胞如大肠杆菌,链霉菌属;鼠伤寒沙门氏菌;真菌细胞如酵母;植物细胞;昆虫细胞如果蝇s2或 sf9;动物细胞如cho、cos7、nso或bowes黑素瘤细胞等。特别适用于本发明的宿主细胞是真核宿主细胞,尤其是哺乳动物细胞,如293细胞。
29.在本发明的另一方面,提供上述单克隆抗体的制备方法,包括以下步骤:
30.(1)记忆b细胞分选:从感染过人巨细胞病毒的志愿者的血液样品中分离外周血单核细胞,从外周血单核细胞中分选得到记忆性b细胞;
31.(2)记忆b细胞的体外活化培养及阳性孔筛选:将记忆性b细胞活化为浆细胞,elisa检测记忆性b细胞体外活化成浆细胞后分泌性的igg抗体,筛选获得阳性孔;
32.(3)抗体可变区基因文库的构建及筛选:对阳性孔细胞进行反转录得到 cdna,扩增抗体重链可变区和轻链可变区基因;
33.(4)抗体基因重链可变区和轻链可变区文库的构建:将扩增的抗体重链可变区和轻链可变区基因分别连接到表达载体上;
34.(5)抗体重链可变区和轻链可变区基因的筛选:将重组质粒共转染 hek293t细胞进行表达。
35.在本发明的另一方面,提供所述的单克隆抗体或其片段在制备用于检测、治疗、预防人巨细胞病毒感染的药物中的用途。
36.在本发明的另一方面,提供一种组合物,包括治疗有效量的所述的单克隆抗体中
的一种或多种抗体组成的抗体混合物,以及药学上可接受的载体。
37.本文所用的术语“药学上可接受的”是指当分子本体和组合物适当地给予动物或人时,它们不会产生不利的、过敏的或其它不良反应。本文所用的“药学上可接受的载体”应当与本发明的单克隆抗体或其片段相容,即能与其共混而不会在通常情况下大幅度降低组合物的效果。
38.可作为药学上可接受的载体或其组分的一些物质的具体例子是糖类,如乳糖、葡萄糖和蔗糖;淀粉,如玉米淀粉和土豆淀粉;纤维素及其衍生物,如羧甲基纤维素钠、乙基纤维素和甲基纤维素;西黄蓍胶粉末;麦芽;明胶;滑石;固体润滑剂,如硬脂酸和硬脂酸镁;硫酸钙;植物油,如花生油、棉籽油、芝麻油、橄榄油、玉米油和可可油;多元醇,如丙二醇、甘油、山梨糖醇、甘露糖醇和聚乙二醇;海藻酸;乳化剂,如tween;润湿剂,如月桂基硫酸钠;着色剂;调味剂;压片剂、稳定剂;抗氧化剂;防腐剂;无热原水;等渗盐溶液;和磷酸盐缓冲液等。
39.本发明的组合物可根据需要制成各种剂型,并可由医师根据患者种类、年龄、体重和大致疾病状况、给药方式等因素确定对病人有益的剂量进行施用。给药方式可以采用注射或其它治疗方式。
40.上述药物组合物可包含两个或多个对于人巨细胞病毒具有结合活性的单克隆抗体或其片段。
41.在本发明的另一方面,提供一种检测人巨细胞病毒的试剂盒,其包括所述的单克隆抗体或其片段。
42.以所述的单克隆抗体或其片段为基础,可制备方便、快速且准确地检测人巨细胞病毒的试剂盒。作为本发明的一种检测方式,采用间接elisa法,将待测的抗原包被于固相载体上,利用本发明的单克隆抗体或其片段进行检测。作为本发明的一种优选方式,所述的单克隆抗体或其片段是抗体,可根据双抗夹心法的原理来检测。双抗夹心法常规的做法是将一抗(如本发明的单克隆抗体)固定于载体,然后使一抗与抗原反应,洗涤后再与二抗反应(所述的二抗携带可检测信号,或可与携带可检测信号的物质结合),最后进行化学发光或酶联显色反应检测信号。双抗夹心法特别适用于具有两个或两个以上表位的抗原的检测。
43.为了在检测时更方便,所述试剂盒中除了含有本发明的单克隆抗体或其片段以外,还可以包含其它检测试剂或辅助试剂,所述的辅助试剂例如是elisa试剂盒中常规使用的一些试剂,这些试剂的特性以及它们的配制方法均是本领域技术人员所熟知的,如显色剂、标记物、二抗、抗抗体、增敏剂等。本领域人员应理解,各种变化形式的检测试剂盒均是包含在本发明中的,只要在其中利用了本发明的单克隆抗体或其片段作为识别人巨细胞病毒的试剂。
44.此外,在所述试剂盒中还可包含使用说明书,用于说明其中装载的试剂的使用方法。
45.在获得了本发明提供的单克隆抗体或其片段后,可以利用多种免疫学相关方法来检测样品中人巨细胞病毒gb糖蛋白,从而得知待测样品的供体是否感染人巨细胞病毒,这些方法均被包含在本发明中。较佳地,所述的方法是以非疾病诊断为目的的。
46.在本发明的另一方面,提供一种非治疗性地抑制人巨细胞病毒的方法,所述的方
法包括给予患者有效量的所述的单克隆抗体或其片段。
47.在本发明的另一方面,提供一种非治疗性检测人巨细胞病毒的方法,所述的单克隆抗体或其片段与待测样品进行接触,通过检测所述的单克隆抗体或其片段与受试样品的结合情况,获得人巨细胞病毒的存在情况以及存在量。
48.如本文所用,术语“待测样品”涵盖了多种样品类型,包括生物学来源的血液及其它体液样品,实体组织样品如活检组织样品或者组织培养物,或者衍生自其中的细胞或者其后代。该术语还包括在获得后已经通过任何方式处理的样品,例如用试剂处理、溶解、或者富集某些成分如蛋白质或者多核苷酸。该术语涵盖了得自任何物种的各种临床样品,也包括培养的细胞、细胞上清和细胞溶解产物。
49.有益效果:与现有技术相比,本发明成功制备了抗人巨细胞病毒的全人源单克隆抗体,该单克隆抗体具有高亲和力的特点,所述单克隆抗体能特异性结合人巨细胞病毒,能显著抗人巨细胞病毒。本发明所述抗体为全人源性单克隆抗体,相比鼠源抗体,全人源抗体的基因完全来源于人的基因,没有其他种属的成分,在人体内不发生抗鼠抗抗体等毒副作用,具有更好的生物相容性,更适合和更有潜力成为治疗人巨细胞病毒的大分子药物,为此类抗体的标准化生产成药提供了很大的保障。
附图说明
50.图1elisa筛选分泌特异性抗体的记忆b细胞阳性孔。
51.图2抗体重链vh、vh’与轻链vκ、vλ可变区基因文库扩增电泳结果。
52.图3抗体重轻链可变区基因文库的构建。
53.图4elisa筛选单克隆抗体流程图。
54.图5抗体重轻链可变区基因组合筛选结果。
具体实施方式
55.以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
56.实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook 等人,分子克隆:实验室手册(new york:cold spring harborlaboratorypress,1989) 中所述的条件,或按照制造厂商所建议的条件。
57.实施例1:抗人巨细胞病毒的全人源单克隆抗体的制备
58.1.记忆b细胞的分选
59.1.1提取外周血单核细胞
60.采集感染过人巨细胞病毒志愿者的新鲜全血于抗凝管中。将pbs与新鲜抗凝全血1:1进行稀释,加入到50ml离心管中,充分混匀。取新的15ml离心管若干,每个离心管加入7ml淋巴分离液,再缓慢加入7ml稀释后的新鲜抗凝全血。2000rpm,升速为4,降速为0,室温离心20min。小心拿出离心管,吸取第二层云雾状细胞层至装有pbs的15ml离心管中吹打洗涤,1200rpm,离心5min,弃上清。再加入pbs重悬沉淀,收集到的细胞即为外周血单核细胞。
61.1.2记忆b细胞分选
62.将分离出的外周血单核细胞300g,离心10min,彻底去除上清。每107个细胞用40μl缓冲液重悬细胞沉淀,加10μl biotin-antibody cocktail,充分混匀,4℃冰箱内孵育5min。每107个细胞加30μl缓冲液及20μl anti-biotin micro beads,充分混匀,置于4℃冰箱内孵育10min。再加2ml缓冲液洗涤细胞,300g,离心 10min,弃上清,再加3ml缓冲液重悬细胞。将ls柱子放置到磁铁上,用3ml 缓冲液冲洗柱子。将细胞悬液缓慢加入到柱中,避免产生气泡,收集流出的细胞。用3ml缓冲液洗柱3次,洗涤过程中要等柱中液体流干后再添加新的洗涤液,收集所有的洗脱液,即为含b细胞的悬液。将含b细胞的悬液300g,离心10min,彻底去除上清。每107细胞加80μl缓冲液重悬,加20μl cd27 microbeads,充分混匀,置于4℃冰箱内孵育15min。加2ml缓冲液洗涤,300g,离心10min,弃上清,再加500μl缓冲液重悬。将ms柱子放置于磁铁上,用500μl的缓冲液冲洗柱子。将细胞悬液缓慢加入到柱中,收集流出的细胞并用500μl缓冲液洗柱子 3次。收集所有的洗脱液,即为含未标记细胞的悬液,洗涤过程中要等柱中液体流干以后再加洗液。从分离器上取下柱子,放到一个收集管上,吸取缓冲液至柱子上,立即用力推活塞洗出磁珠标记的细胞。此细胞即为记忆性b细胞。计数分选出的记忆性b细胞。以上实验用的是“人b细胞cd27分选磁珠”试剂盒(德国miltenyi,cat.no.99-130-051-601)。
63.2.记忆b细胞的体外活化培养及阳性孔筛选
64.采集了6名血清中hcmv igg抗体表达较高的志愿者新鲜全血,利用密度梯度离心法从全血中分离出pbmc细胞,再通过cd27磁珠分选试剂盒分选出记忆性b细胞。将得到的记忆性b细胞与被辐照后的饲养层3t3细胞共同加入到u型96孔板中,放于37℃,5%co2培养箱中孵育10天。10天后,通过elisa 实验检测上清中特异性抗体的表达,结果见表1(图1为其量化图),从中筛选出3个od值较高的阳性细胞孔依次编号为ⅰ、ⅱ、ⅲ(分别对应od值为 0.5347,0.4374和0.3148孔),提取rna,再通过rt-pcr反转录为cdna,用于后期的基因文库构建。
65.表1 elisa筛选分泌抗人巨细胞病毒抗体阳性孔细胞
[0066][0067]
表1.使用酶联免疫吸附测定(enzyme-linked immunosorbent assay,elisa)方法检测b细胞上清特异性。
[0068]
3.抗体可变区基因文库的构建及筛选
[0069]
将ⅰ、ⅱ、ⅲ号样本反转录得到的cdna进行巢式pcr两轮扩增,扩增抗体的重链vh、vh’和轻链vκ、vλ,由于重链可变区分子量大,氨基酸序列较长,将其分为vh、vh’两部分分别
进行扩增。得到pcr产物后,再通过琼脂糖凝胶电泳检测,结果如图2所示,抗体重链vh、vh’及轻链vλ在400bp处均有明显条带,这表明扩增成功,而ⅰ、ⅲ号样本轻链vκ在400bp处条带较浅,ⅱ号样本轻链vκ几乎无条带,经多次实验证明都是如此。因此,后期主要针对轻链vλ进行抗体筛选。凝胶电泳后,再对pcr产物进行大体积胶回收,获得扩增后的抗体重链vh、vh’及轻链vκ、vλ可变区片段的dna。
[0070]
3.4.2抗体重轻链可变区基因文库的构建
[0071]
根据酶切试剂盒说明书指示,将胶回收产物即扩增后的ⅰ、ⅱ、ⅲ号样本抗体重链vh、vh’及轻链vκ、vλ可变区片段dna以及恒定区载体质粒pigh、 pigκ、pigλ进行酶切,再通过琼脂糖凝胶电泳检测酶切产物,电泳结果如图3a 所示,可变区目的dna在400bp处有明显的条带,恒定区载体质粒在5000bp 有明显的条带,这表明酶切成功。随后进行胶回收得到质粒产物,并将目的质粒与载体质粒进行过夜酶连得到重组质粒。为了验证酶连是否成功,将重组质粒进行酶切与pcr验证(ⅰ和ⅲ号样本轻链vκ进行pcr验证),再通过琼脂糖凝胶电泳验证酶切与pcr产物,结果如图3b所示,重组质粒ⅰ、ⅱ、ⅲ号样本重链vh、vh’以及轻链vλ经酶切后得到两条不同分子量大小条带,其中目的质粒在 400bp处均有明显条带,载体质粒在5000bp处有均明显条带,而ⅰ和ⅲ号样本轻链vκ在400bp处也有明显条带,这说明抗体重轻链可变区基因文库重组质粒构建成功。将重组质粒转入trans10感受态细胞进行表达,结果如图3c所示,空白对照组无菌落生长,实验组都长满菌落。
[0072]
3.5单克隆抗体的筛选
[0073]
从总基因文库中筛选出几种抗hcmv单克隆抗体重轻链序列,筛选方法如图4所示:
①
:将ⅰ、ⅱ、ⅲ号样本重轻链组合成ⅰh+ⅰκ、ⅰh+ⅰλ、ⅱh+ⅱλ、ⅲh+ⅲκ、ⅲh+ⅲλ,然后依次转染到hek293t细胞,再通过elisa实验筛选出od值最高的重轻链质粒组合;
②
:根据elisa结果显示筛选出ⅲh、ⅲλ,分别对其进行转化并将菌落平分为8份,过夜摇菌,第二天小提质粒并依次编号为1h、2h、3h、4h、5h、6h、7h、8h和1λ、2λ、3λ、4λ、5λ、6λ、7λ、8λ。分别将ⅲh+1λ、ⅲh+2λ、ⅲh+3λ......ⅲh+8λ和ⅲλ+1h、ⅲλ+2h、ⅲλ+3h......
ꢀⅲ
λ+8h这16种组合依次转染到hek293t细胞,通过elisa筛选出od值最高的重轻链质粒组合;
③
:筛选出1h和2λ,取20ng质粒进行转化,分别挑选单克隆菌落30份,过夜摇菌,第二天小提质粒并依次编号为1h1、1h2、1h3、1h4、 1h5.......1h
30
和2λ1、2λ2、2λ3、2λ4、2λ5.......2λ
30
。然后将1h与2λ1、2λ2、2λ3、2λ4、 2λ5.......2λ
30
,2λ与1h1、1h2、1h3、1h4、1h5.......1h
30
组合转染到hek239t细胞中,通过elisa筛选出od值较高的重轻链质粒组合;
④
:从60个单克隆菌落中挑选出od值较高的10个重链质粒:1h2、1h4、1h5、1h6、1h9、1h
12
、1h
15
、 1h
16
、1h
17
、1h
22
与10个轻链质粒:2λ1、3λ2、2λ5、2λ7、2λ9、2λ
10
、2λ
11
、2λ
17
、 2λ
18
、2λ
22
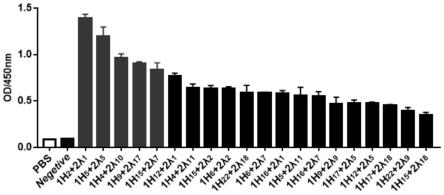
。将这20种重轻链质粒两两组合,并将这100种质粒组合依次转染到 hek293t细胞中,并通过elisa筛选出分泌特异性抗体的单克隆质粒组合。表2 (图5为量化图)为100个组合中od较高的前20名质粒组合elisa检测结果。
[0074]
表2 elisa筛选单克隆抗体重轻链组合质粒
[0075]
[0076][0077]
筛选得到重轻链单克隆序列各挑选5条进行“一对一”配对体外转染表达, 5条重链单克隆序列:1h2,1h4,1h5,1h9,1h
15
和5条轻链单克隆序列:2λ
1,
2λ5,2λ7, 2λ
10
,2λ
17
,elisa筛选后最终得到5株高亲和力的单克隆抗体,抗体组合:1h2+2λ1、 1h4+2λ
10
、1h5+2λ5、1h9+2λ
17
、1h
15
+2λ7(结果对应图5)。经测序得知1h2,1h5, 1h9和1h
15
氨基酸序列是完全一样的,因此获得的抗体组合包括2条不同的重链和5条不同的轻链,将两条不同的重链重新命名为h1和h2,轻链命名不变依旧为2λ
1,
2λ5,2λ7,2λ
10
,2λ
17
,最终获得的抗体组合是:h1+2λ1、h2+2λ
10
、h1+2λ5、 h1+2λ
17
、h1+2λ7。
[0078]
前述对本发明的具体示例性实施方案的描述是为了说明和例证的目的。这些描述并非想将本发明限定为所公开的精确形式,并且很显然,根据上述教导,可以进行很多改变和变化。对示例性实施例进行选择和描述的目的在于解释本发明的特定原理及其实际应用,从而使得本领域的技术人员能够实现并利用本发明的各种不同的示例性实施方案以及各种不同的选择和改变。本发明的范围意在由权利要求书及其等同形式所限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1