circDHTKD1的抑制剂在制备调控气道上皮炎症的药物中的应用
circdhtkd1的抑制剂在制备调控气道上皮炎症的药物中的应用
技术领域
1.本发明涉及circdhtkd1的抑制剂在制备调控气道上皮炎症的药物中的应用,属于生物医药领域。
背景技术:
2.支气管哮喘是一种以气道炎症、气道高反应性和气道重塑为特征的慢性气道疾病,气道上皮是气道炎症和气道先天免疫的重要参与者。环状rna(circular rna,circrna)是一种闭合环状非编码rna,越来越多研究证实circrna广泛涉及多种疾病的生理病理过程。
3.但是,环状rna参与调节气道上皮炎症反应的机制目前尚不清楚。因此,深入研究circrna调控气道炎症的作用机制,可以为哮喘的诊断治疗提供新的策略,具有重要意义。
技术实现要素:
4.本发明的目的是探讨circdhtkd1的抑制剂在制备调控气道上皮炎症的药物中的应用及lps对人支气管上皮细胞(beas-2b)的致炎效应,以及环状rna(circdhtkd1)在其中的调控作用。
5.为了实现以上技术方案,本发明提供了以下技术方案:
6.技术方案一:一种检测circdhtkd1表达水平的试剂在制备诊断和/或检测气道上皮炎症的试剂盒中的应用。
7.技术方案二:一种检测circdhtkd1表达水平的试剂在制备诊断和/或检测哮喘的试剂盒中的应用。
8.进一步地,所述circdhtkd1是通过海绵吸附mir-338-3p调控erk通路激活和炎症因子分泌,以实现气道上皮炎症或哮喘的诊断或检测。
9.进一步地,所述炎症因子为il-6和vegf。
10.技术方案三:一种circdhtkd1的抑制剂在制备调控气道上皮炎症的药物中的应用。
11.技术方案四:一种circdhtkd1的抑制剂在制备治疗哮喘的药物中的应用。
12.进一步地,所述抑制剂是以circdhtkd1为靶点,实现调控气道上皮炎症或治疗哮喘的目的。
13.与现有技术相比,本发明的有益效果:
14.本发明研究结果显示,circdhtkd1促进lps诱导旳beas-2b细胞发生炎症反应,circdhtkd1通过mir-338-3p调控erk通路并影响lps诱导的炎症反应。本发明证实circdhtkd1是调控气道上皮炎症的关键分子,circdhtkd1有望成为气道炎症的治疗靶点,为临床上提供了一种潜在的具有抑制人气道上皮炎症损伤中的靶点,为相关药物靶点的研究提供了理论依据。本发明的研究结果为支气管哮喘的发生提供了一个新的病理生理学机
制,可用于支气管哮喘的预防与治疗。
附图说明
15.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
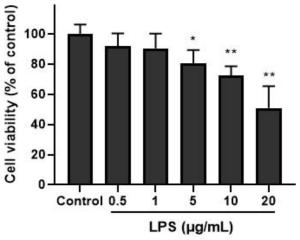
16.图1为cck8检测lps对beas-2b细胞活力的影响分析结果图;
17.图2为lps对beas-2b细胞炎症因子(il-6、il-8、tnf-α和vegf)表达的影响,a图是mrna相对表达量,b图是蛋白表达量;
18.图3为qrt-pcr检测circdhtkd的相对表达量结果图;
19.图4为sanger测序结果图;
20.图5为核质分离实验检测circdhtkd1亚细胞定位结果图;
21.图6为qrt-pcr检测敲减circdhtkd1对circdhtkd1表达水平的影响;
22.图7为敲减circdhtkd1后检测炎症因子改变,其中,a图是il-6的mrna表达变化;b图是检测il-8的mrna表达变化;c图是检测tnf-α的mrna表达变化;d图是检测vegf的mrna表达变化;e图是检测炎症因子蛋白表达水平的变化;
23.图8是circdhtkd/mir-338-3p的靶向验证示意图;
24.图9是双荧光素酶实验结果图;
25.图10是敲减circdhtkd1检测mir-338-3p表达水平变化;
26.图11改变mir-338-3p表达后检测蛋白表达结果示意图;
27.图12是检测erk、p-erk的蛋白表达示意图;
28.图13是检测的il-6和vegf蛋白表达示意图,其中,图a为vegf蛋白表达示意图;图b为il-6蛋白表达示意图。
具体实施方式
29.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
30.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
31.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
32.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多
种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本技术说明书和实施例仅是示例性的。
33.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
34.实施例中所用到的opti-mem培养基来自gibco公司;双荧光素酶报告基因检测试剂盒使用北京全式金生物技术公司,型号fr201;il-6、il-8、tnf-α和vegf elisa试剂盒均购自上海碧云天生物技术有限公司。
35.实施例1
36.材料和方法
37.1.实验对象
38.人支气管上皮细胞系(beas-2b)购于中国科学院上海细胞库。
39.2.实验方法
40.2.1主要分组:
41.(1)lps对细胞活力的影响:0μg/ml、0.5μg/ml、1μg/ml、5μg/ml、10μg/ml、20μg/ml组。
42.(2)lps对气道上皮细胞的影响:分对照组和lps处理组。
43.(3)circdhtkd1对基因表达的影响:分
①
对照组、
②
lps处理组、
③
si-nc+lps处理组和
④
si-circ#1+lps组。
44.(4)双荧光素酶报告基因实验分组如下:
①
circ-wt+mir-nc、
②
circ-wt+mir-338-3p mimics、
③
circ-mut+mir-nc和
④
circ-mut+mir-338-3p mimics。
45.(5)mir-338-3p对基因表达的影响:
①
对照组、
②
lps处理组、
③
mir-nc+lps处理组和
④
mir-338-3p mimics+lps组。
46.(6)功能拯救实验分组如下:
①
对照组、
②
lps处理组、
③
lps+si-nc组、
④
lps+si-circ#1组、
⑤
lps+si-circ#1+mir inhibitor nc组和
⑥
lps+si-circ#1+mir-338-3p inhibitor组。
47.2.2细胞培养
48.将beas-2b细胞培养在加有10%牛血清白蛋白(bsa;sigmaaldrich)和100u/ml青霉素和100μg/ml链霉素的rpmi-1640培养基(thermo fishier scientific)中,在5%co2的湿润环境中于37℃进行培养。
49.2.3构建lps诱导的支气管上皮细胞炎症模型
50.取生长状态良好并铺满细胞培养皿80%以上的beas-2b细胞,进行消化、离心、弃上清,加入1ml不含双抗的rpmi-1640完全培养基重悬,用细胞计数板进行计数。按照每孔5
×
105个细胞接种至6孔板,每孔5
×
104个细胞接种于96孔板,轻晃混匀,使细胞分布均匀,将培养皿平放,置于37℃,5%co2培养箱中培养。待培养板中的细胞培养至80%融合时,弃去原培养基,分别加入不同浓度lps(0μg/ml、0.5μg/ml、1μg/ml、5μg/ml、10μg/ml、20μg/ml)培养基进行继续培养24h。
51.2.4 cck8测定细胞的活力
52.将细胞悬液浓度调整为5
×
105个/ml,按每孔100μl加到96孔细胞培养板中并设置空白对照组(只加入100μl培养基),同一样本设置三个复孔;四周边缘孔加入100μl pbs以
减少误差,37℃,5%培养箱中培养24h后,移去原有培养基,各组取100μl新配制的含不同浓度lps的培养基(0μg/ml、0.5μg/ml、1μg/ml、5μg/ml、10μg/ml、20μg/ml),加入至对应每组孔中,对照组加入含等体积pbs的培养基,继续培养24h,在超净台中避光加入10μl/孔的cck-8试剂,轻晃混匀,置于培养箱中继续1-2小时,打开酶标仪预热至37℃,在波长450nm处测定吸光度。
53.2.5细胞转染
54.转染前一天,根据上述方法处理细胞,用不含抗生素的rpmi-1640完全培养基调整密度后将5
×
105个细胞接种于6孔细胞培养板中,培养过夜,确保第二天细胞汇合度达到50%~70%。吸去原来的培养基,用pbs轻轻润洗细胞两次。每孔加入1.5ml opti-mem培养基。取两个1.5ml无酶ep管,分别标记为a和b,在a、b管中各加入125μl opti-mem培养基,多孔可批量制备。在标记a的ep中加入5μl lipofectamine tm
3000,移液器吹打混匀;在标记b的ep管中加入5μl si-rna或者mir-mimic/mir-inhibitor,移液器吹打混匀。将a管和b管内溶液混合,吹打混匀,室温静置15min。将250μl混合液加入对应的细胞孔中,摇晃混匀后置于37℃,5%co2培养箱中培养8h后弃去转染培养基,更换为不含抗生素的rpmi-1640完全培养基继续培养。后续进行lps处理。转染实验所用的所有rna序列见表1。
55.表1细胞转染实验的rna序列
[0056][0057]
2.6 rt-pcr和定量rt-pcr
[0058]
用rnaiso plus提取细胞总rna,根据primescript
tm rtreagent试剂盒说明书配制逆转录反应体系(如表2所示),逆转录程序设定如下:37℃15min(反转录反应);85℃5sec(反转录酶的失活反应);4℃∞。根据tbpremix ex taq
tm
试剂盒说明书配制反应体系(如表3所示),实时荧光定量pcr反应程序为:预变性95℃30s;pcr反应95℃5s,40个循环;引物退火60℃30s;引物延伸60℃60s。反应结束后,获取ct值,采用2-δδct
法分析的mrna的相
对表达量,并进行统计学分析(结果见图1)。
[0059]
实验所用引物序列(如表4所示)
[0060]
表2 20μl逆转录反应体系
[0061]
试剂名称加入量5
×
primescript
tm buffer4μlprimescript
tm rt enzyme mix1μloligo dt primer(50μm)1μlrandom 6 mers(100μm)1μltotal rna1μlrnase-free water12μltotal20μl
[0062]
表3 20μl实时荧光定量pcr反应体系
[0063][0064]
表4 rt-qpcr实验所用引物
[0065][0066]
2.7双重荧光素酶报告基因检测
[0067]
合成包含circdhtkd1全长且具有mir-338-3p结合位点的野生型circ-wt片段,以及结合位点发生突变的突变型circ-mut片段并插入到psicheck2载体中。将野生型和突变型双荧光素酶报告质粒与mir-338-3p-mimic或mimic nc及lipofectamine
tm 3000配制的复合物共转染细胞,转染同上文同理。孵育48小时后,收集并裂解细胞,使用双荧光素酶检测试剂盒测定萤火虫荧光素酶和海肾荧光素酶的相对光单位(rlu)。
[0068]
转染前一天,根据上述方法处理细胞,用不含抗生素的rpmi-1640完全培养基调整密度后将5
×
105个细胞接种于6孔细胞培养板中,培养过夜,确保第二天细胞汇合度达到50%~70%。吸去原来的培养基,用pbs轻轻润洗细胞两次。每孔加入1.5ml opti-mem培养基。取两个1.5ml无酶ep管,分别标记为a和b,在a、b管中各加入125μl opti-mem培养基,多孔可批量制备。在标记a的ep中加入5μl lipofectamine
tm 3000,移液器吹打混匀;在标记b的ep管中加入5μl si-rna或者mir-mimic/mir-inhibitor,移液器吹打混匀。将a管和b管内溶液混合,吹打混匀,室温静置15min。将250μl混合液加入对应的细胞孔中,摇晃混匀后置于37℃,5%co2培养箱中培养8h后弃去转染培养基,更换为不含抗生素的rpmi-1640完全培养基继续培养。后续进行lps处理。转染实验所用的所有rna序列见表1。
[0069]
2.8蛋白质印迹
[0070]
使用ripa裂解液从培养的beas-2b细胞中提取总蛋白。通过碧云天生产的bca蛋白质检测试剂盒检测蛋白质浓度。随后,将蛋白与5
×
蛋白上样缓冲液混匀后于95℃煮沸
5min,通过sds-page电泳分离蛋白并转移至pvdf膜上。在室温下用5%牛血清蛋白溶液封闭2h后,然后将带有蛋白质的pvdf膜与稀释的一抗在4℃孵育过夜,tbst洗膜3次后,将二抗与pvdf膜在室温下孵育2h,tbst洗膜3次后,使用ecl发光液进行显影,凝胶成像系统拍照、保存。基因gapdh作为内参标准化。
[0071]
2.9核质分离提取rna
[0072]
按照paris
tm
试剂盒分离提取beas-2b细胞的细胞质和细胞核的总rna。通过qrt-pcr实验对circrna进行亚细胞定位。gapdh和neat1分别用作胞质及胞核对照。
[0073]
2.10酶联免疫吸附试验(elisa)
[0074]
将beas-2b细胞以每孔2
×
105个细胞的密度接种于12孔板中。无菌1.5ml ep管收集细胞培养皿上清液,2000rpm离心20分钟,收集上清液。参照试剂盒说明书,通过酶联免疫吸附试验检测炎性细胞因子il-6、il-8、tnf-α和vegf的水平。用全功能酶标仪测量450nm波长处测量od
450
值。
[0075]
2.11核酸电泳及sanger测序
[0076]
上述pcr实验产物在2%琼脂糖凝胶中电泳分离,在紫外成像系统观察后切胶送上海生工生物工程有限公司进行测序。
[0077]
2.12统计分析方法
[0078]
本研究使用spss 20.0软件分析定量数据,以均值
±
标准差表示。通过student t检验或anova(方差分析)方法评估两组或更多组之间的差异。p值《0.05时认为存在显着差异。
[0079]
3.lps能诱导beas-2b细胞炎症模型
[0080]
3.1用含有10%fbs、不含双抗的rpmi-1640培养液稀释lps至不同浓度(0μg/ml、0.5μg/ml、1μg/ml、5μg/ml、10μg/ml、20μg/ml),培养beas-2b细胞12h。cck-8法检测不同浓度hdm对细胞增殖的影响。结果如图1所示,与对照组相比,5μg/ml及以上浓度的lps能显著抑制beas-2b细胞的活力。
[0081]
3.2实验组用5μg/ml的lps刺激细胞24h,对照组给予等体积的pbs,提取rna后用实时荧光定量pcr检测il-6、il-8、tnf-α和vegf的mrna表达量。结果如图2所示,与对照组相比,lps组的il-6、il-8、tnf-α和vegf的相对mrna表达水平和上清液蛋白含量均显著增高。
[0082]
4.circdhtkd1促进lps诱导旳beas-2b细胞发生炎症反应。
[0083]
4.1 qrt-pcr实验结果如图3所示,与阴性对照组相比,lps处理导致circdhtkd1表达增加。
[0084]
4.2 circdhtkd1定位细胞质,sanger测序证实其为反向剪接形成的环状rna分子。sanger测序结果显示了包含反向剪接位点的序列,表明产物为环状rna(详见图4)。此外,通过核质分离实验检测了circdhtkd1在beas-2b细胞中的亚细胞定位,发现circdhtkd1在beas-2b细胞的细胞质中显着富集(详见图5)
[0085]
4.3 circdhtkd1在lps诱导的beas-2b细胞炎症损伤中的作用:设计2对靶向circdhtkd1(si-circ#1和si-circ#2)的sirna进行了基因表达干扰。
[0086]
设计2对靶向circdhtkd1(si-circ#1和si-circ#2)的sirna进行了基因表达干扰,转染48h后,qrt-pcr检测circdhtkd1的表达情况。结果详见图6,相较于si-nc,circdhtkd1的表达水平在瞬时转染这2对sirna 48 h后明显下降,其中,转染si-circ#1引起的
circdhtkd1水平下调更为明显。选择si-circ#1进行后续实验。
[0087]
4.4干扰circdhtkd1表达再给予lps刺激24小时,发现beas-2b细胞il-6和vegf的mrna表达水平及细胞培养上清的蛋白表达水平均发生显著下降(详见图7)。
[0088]
5.circdhtkd1充当mir-338-3p的海绵
[0089]
5.1生物信息学预测circdhtkd1有mir-338-3p结合位点(详见图8),双荧光素酶报告基因实验证实circdhtkd1和mir-338-3p具有结合关系。将mir-338-3p mimic与circ-wt/circ-mut质粒转染细胞后,发现mir-338-3p可明显降低circ-wt荧光素酶活性,而对circ-mut荧光素酶活性无抑制作用。提示circdhtkd1可与mir-338-3p靶向结合(详见图9)。
[0090]
5.2在beas-2b细胞中转染sirna干扰circrna表达后,mir-338-3p相对表达量上调(详见图10)。
[0091]
6.circdhtkd1通过mir-338-3p调控erk通路并影响lps诱导的炎症反应
[0092]
6.1 mir-338-3p靶向erk信号通路:转染mir-338-3p mimic后,细胞内mir-338-3p的表达量明显上调。将转染mir-338-3p mimic的细胞再次给予lps刺激24小时,il-6及vegf的蛋白水平均显著下降,erk蛋白磷酸化水平也降低(详见图11)。
[0093]
6.2 circdhtkd1/mir-338-3p轴调控erk蛋白磷酸化水平和il-6及vegf合成分泌:将circdhtkd1 sirna分别与mir-338-3p inhibitor共同转染beas-2b细胞后,lps+si-nc组相比,lps+si-circ#1组erk磷酸化水平降低;与lps+si-circ#1+mir inhibitor nc组相比,lps+si-circ#1+mir-338-3p inhibitor组的p-erk蛋白水平升高。敲减circdhtkd1抑制了lps诱导的erk信号通路激活,转染mir-338-3p inhibitor可逆转circdhtkd1敲减导致的erk蛋白磷酸化水平降低(详见图12)。通过elisa实验检测细胞上清液中il-6和vegf的表达,转染mir-338-3p inhibitor可逆转circdhtkd1敲减引起的il-6和vegf蛋白表达降低(详见图13)。
[0094]
本研究表明,在lps处理beas-2b细胞中,circdhtkd1通过海绵吸附mir-338-3p调控erk通路激活和炎症因子分泌。
[0095]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1