用于培养细胞的装置、系统和方法与流程
用于培养细胞的装置、系统和方法
1.本技术是申请日为2016年10月13日、发明名称为“用于培养细胞的装置、系统和方法”的中国专利申请201680058635.4(国际申请号pct/us2016/056879)的分案申请。本技术要求于2015年10月13日提交的美国临时专利申请号62/240,612的优先权,其通过引用并入本文。
技术领域
2.本技术属于细胞培养领域,提供了用于培养组织和细胞的装置,方法和系统。具体地,例如,提供了用于在甚至在长期培养后,能够维持原代细胞类型特征(包括形态,基因和蛋白质表达水平以及代谢功能)的条件下培养漂浮的原代人体组织外植体和细胞的装置,方法和系统。
背景技术:
3.肥胖是越来越常见的疾病,折磨着超过7900万美国人。肥胖可能与多种疾病有关,包括2型糖尿病,心脏病,中风,关节炎和一些癌症。除了健康影响之外,仅在美国,与治疗肥胖症和相关疾病有关的直接财务费用估计超过1500亿美元。目前,强烈需要批准用于人类干预的抗肥胖治疗剂。
4.肥胖可以被描述为体内白色脂肪组织(wat)的过度生长。一般来说,wat可以被认为是人体内的一个器官,作为可以储存额外卡路里的能量储存器。wat在整个人体中都有发现,并且可能是皮下来源的,或者来源于各种解剖学区域,其中包括腹部,胸部,臀部和四肢。wat也可被认为是产生激素以调节多种生理系统例如饥饿/饱腹感,葡萄糖代谢和脂质代谢的内分泌器官。功能正常的wat器官至关重要。事实上,wat不足可能导致疾病或死亡。
5.作为器官,wat包括成熟的脂肪细胞(wads),其可以在形态学上被描述为具有超过细胞体积95%的单室脂滴的大细胞。这种大脂滴的存在使wads漂浮。人wads也可能被认为是特别脆弱的细胞,这在很大程度上是由于它们的尺寸。例如,人类wads的尺寸范围为约100至约140μm,其为啮齿动物wads体积的九(9)倍。
6.尝试培养原代的人类wads在很大程度上是不成功的。常规的体外培养方法学采用诸如酶处理和机械处理等技术来解离原代wat组织并分离wads。这种处理通常破坏或严重损害大部分wads,其中大部分wads在处理后72小时内经历细胞裂解。因此,不存在来自wads的人wat的研究模型。
7.尝试克服与wads培养相关的挑战包括将wads包埋在胶原蛋白基质中。但是,这种技术的成功有限。图1显示用碘化丙锭染色的胶原包埋的人wat的显微照片,显示培养2天后程序性细胞死亡,即细胞凋亡的诱导。除了它们的脆弱性之外,脂肪细胞也被认为是终末分化的并且有丝分裂惰性的。因此,wads在不改变它们的分化状态(即去分化)的情况下可能不会在培养物中扩增。
8.与大多数其他模型细胞类型(细胞原种可以被冷冻用于长期储存)不同,必须从手术室或诊所新鲜获得人wat/wads,并立即用于每个实验。因此,研究人员必须依靠手术获得
的人wat组织作为来源材料,这会限制wat/wads向非临床研究人员的可及性。事实上,缺乏与临床医生关系的研究人员可能无法获得人wat。然后研究实验可能受临床医师的时间表限制,而所述时间表可能是不可预测的。此外,组织获得可能是耗时的,并且通常需要旅行,穿上手术服装以及医院批准调查方案。获得来源wat的这些障碍已经放慢了科学发现的整体速度,并可能阻止研究人员研究人类wat的生物学。
9.目前,研究人员依赖于模型,包括化学分化成脂肪细胞的啮齿动物模型或基质/干细胞模型(即diffads)。然而,这些实验模型无法重演原代的人类wat生物学。例如,最早确定的抗肥胖途径之一受到β-3肾上腺素受体(β3-ar)的控制。使用选择性β3-ar激动剂,肥胖症和糖尿病在几种啮齿动物模型中被成功治愈。然而,在啮齿动物肥胖模型中成功的相同的选择性β3-ar对人类β3-ars没有活性,导致多次失败的临床试验。
10.类似地,某些模型细胞类型,例如基质和干细胞可以化学分化成脂肪细胞(diffads)。然而,diffads仅以降低的水平表达人类wads标记,包括ccaat/增强子结合蛋白α,脂蛋白脂肪酶,脂肪酸结合蛋白4和激素敏感性脂肪酶。此外,基于diffads的肥胖模型在测量甘油释放,脂连蛋白释放和葡萄糖摄取的代谢测定中不能重演wads功能。
11.遗传学上,体外细胞模型与wads不共享相似的基因表达模式。图2图示了常规培养模型和原代wat之间的脂肪细胞身份基因表达的变化。图2中的绿色条形代表使用标准方案分化成多室“脂肪细胞”(diffads)的干细胞的表达水平。图2中的红色条形代表使用表达pparg的慢病毒构建体分化成“脂肪细胞”的干细胞的表达水平。图2中的蓝色条形代表原代脂肪组织的表达水平。如图所示,原代脂肪组织以比体外模型高10至100倍的水平表达脂肪细胞基因。因此,常规模型无法重演原代脂肪组织的基因表达水平。
技术实现要素:
12.在示例性实施方案中,提供了用于体外培养人wat的漂浮组织外植体的装置,方法和系统。
13.本公开的实施方案提供了用于在加入含水培养基中时培养漂浮组织和细胞的系统,方法和装置。本公开的实施方案提供了用于培养从个体(例如患者)获得的原代人组织外植体和细胞的系统,方法和装置。本公开的实施方案提供了用于在延长的时间段(例如几周)以稳定的未分化状态培养人组织和细胞的系统,方法和装置。
14.本公开的实施方案提供了用于配置微生理学,例如芯片上器官模型系统的系统,方法和装置。本公开的实施方案提供了评估化学化合物例如药物对通过本文公开的系统,方法和装置培养的人组织外植体和细胞的影响。
15.通常,体外组织和细胞培养系统使用培养容器,例如培养皿,平板,烧瓶,载玻片,组织或细胞以及富营养培养基一起添加到所述培养容器。在某些情况下,培养皿可提供可粘附组织或细胞的基质,并且培养基可提供必要的组分以支持和促进添加到其中的组织和细胞的代谢功能。建立组织或细胞的新培养物需要将样品组织或细胞转移到具有含水培养基的培养皿中。不漂浮的组织和细胞类型可以停留在培养容器的表面上,其中通常称为细胞粘附的复杂过程发生对表面的组织或细胞粘附。然而,某些组织和细胞类型是漂浮的,因此漂浮在它们的培养基中而不是附着到培养皿的表面。对于某些细胞类型,不附着可能会导致细胞死亡。
16.本公开的实施方案提供用于体外培养漂浮组织和细胞的系统,方法和装置。在具体的实施方案中,本文所述的系统,方法和装置可以适用于培养所有组织和细胞类型,包括但不限于:白色脂肪组织(wat),棕色脂肪组织(bat),脑,神经系统组织,甲状腺,胰腺,脾脏,软骨,肝脏,肾脏和骨骼。
17.附图简述
18.本专利或申请文件至少包含一张彩图。具有彩图的本专利或专利申请公布的副本将根据要求并支付必要的费用后由专利局提供。
19.图1a显示了2天的常规胶原包埋的培养后,在胶原基质中培养的人白色脂肪组织(wat)的显微图像。
20.图1b显示了显微图像,其图解了分化的“脂肪细胞”(diffads)和原代脂肪细胞之间的形态学差异。
21.图2是比较常规培养模型和原代wat之间的脂肪细胞身份基因的基因表达的图解说明。
22.图3是根据本公开的示例性实施方案的具有设置在温敏盘中的支持细胞层和用于从盘中移除支持细胞层的插入装置的培养装置的等距视图。
23.图4是图3所示的插入装置的等距视图,其中支持细胞层附着到插入装置的基部。
24.图5是图4所示的培养装置的等距视图,附着于插入装置基部的支持细胞层从温敏盘中移除。
25.图6是培养装置的等距视图,根据本公开的示例性实施方案,所述培养装置具有沉积在温敏盘中的第一层支持细胞上的漂浮细胞或组织外植体。
26.图7是图6所示的培养装置的等距视图,根据本公开的示例性实施方案,插入装置具有附着到插入装置的基部的第二层支持细胞,所述第二层支持细胞将沉积在组织外植体和第一层支持细胞的顶部。
27.图8是根据本公开的示例性实施方案,夹在两层支持细胞之间的白色脂肪组织的等距视图。
28.图9显示了显微图像,其图解了根据本公开的示例性实施方案,夹心的白色脂肪组织(swat)细胞培养系统的形态稳定性。
29.图9a示出根据本公开的示例性实施方案,具有围绕wat细胞簇的双层支持细胞的swat培养系统的显微图像。
30.图9b显示了显微图像,其图解了根据本公开的示例性实施方案,swat细胞培养系统中wat细胞簇的形态稳定性。
31.图10是一系列显微镜图像,显示了根据本公开的示例性实施方案,swat培养系统中wat细胞簇的长期稳定性。
32.图11是图解说明,显示了根据本公开的示例性实施方案,swat培养物具有转录活性并表达与脂肪组织身份相关的基因。
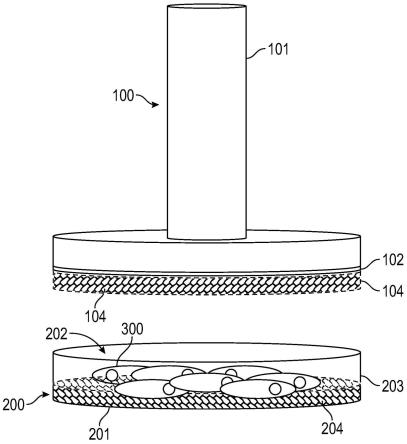
33.图12显示了显微图像,指出根据本公开的示例性实施方案,swat培养物具有翻译活性并表达与脂肪组织身份相关的蛋白质。
34.图13a是图解说明,显示了根据本公开的示例性实施方案,swat培养物在反映原代wat的培养的第1天和第5天以基础水平分泌瘦蛋白。
35.图13b是图解说明,显示了根据本公开的示例性实施方案,swat培养物在反映原代wat的培养的第1天和第5天以基础水平分泌脂连蛋白。
36.图13c是图解说明,显示了根据本公开的示例性实施方案,swat培养物在培养的第1天和第5天后响应于儿茶酚胺刺激进行脂解。
37.图14示出了图像,说明根据本公开的示例性实施方案,swat培养物完全植入免疫受损的egfp标记的小鼠。
具体实施方式
38.参考图3至8,显示了用于培养漂浮细胞类型的系统的不同视图。图3示出了用于培养漂浮细胞类型的培养装置500的示例性实施方案。培养装置500可以包括培养容器200(例如培养皿200)和插入件100。在某些非限制性实施方案中,培养容器200和插入件100可以包含促进组织或细胞粘附到容器或插入件表面的材料。
39.在一些实施方案中,粘附促进材料本身可以是容器200或插入件100的组件。在其他实施方案中,可以向容器200和/或插入件100添加粘附促进材料。在该实施方案中,容器200和/或插入件100的相应基底/表面可以涂覆有蛋白质基质或细胞外物质。粘附促进材料的非限制性实例包括但不限于聚(n-异丙基丙烯酰胺)(pnipaam/pnipam),改性甲基纤维素和温敏性材料,例如温敏性聚电解质多层膜,明胶,胶原,透明质酸和纤维素。
40.在本公开的一个示例性实施方案中,培养容器200可以包括具有基底201,侧壁203和开口202的培养皿200。培养皿200的基底201可以被配置为允许培养至少一层支持细胞204。培养皿200可配置为包括用于插入插入件100装置的开口202。
41.如图3所示,插入件100可以包括基底102和手柄101。手柄101可以被配置为允许插入穿过培养皿开口202。基底102可以被配置成允许培养至少一层支持细胞104。
42.在多种实施方案中,可以在培养支持细胞之前将温敏层添加至培养皿基底201的表面。可以在覆盖培养皿基底201或插入件表面102的温敏层的表面上培养支持细胞层204。参见图3。用温敏层处理培养皿200和插入件100表面可允许将完整的支持细胞层从培养皿200或插入件100转移到另一个培养皿或插入件。参见图3,图4和图5。
43.在一个示例性实施方案中,在第一培养皿基底201的表面上具有一层温敏材料的第一培养皿200可用于培养支持细胞层204。插入件100可通过第一培养皿200的开口202放置,使得插入件100的表面102可以接触支持细胞层204。培养环境中的条件可以被改变以激活温敏材料,例如温度变化,并且将支持细胞层204从第一培养皿200的基底表面201释放,允许支持细胞层204粘附到插入件100的表面102。参见图4。通过活化温敏材料从培养皿200的基底表面201移除支持细胞204并且附着到插入件100的表面102也在图5中示出。
44.在一个示例性实施方案中,皮下wat样品可以在选择性外科手术过程中从人类受试者获得。在该实施方案中,样品尺寸可以在约100至约5000克wat组织的范围内。在特定实施方案中,可以为各种实验目的将实验样品分开。在一个特定的实施方案中,可将皮下wat样品的一部分(例如10克)切碎,快速冷冻并作为匹配的原代wat样品进行储存。在一个具体实施方案中,皮下wat样品的一部分,例如10克,可以作为用于转录确认的匹配的原代wat样品储存在核酸裂解缓冲液,例如rneasy lipid tissue mini kit
tm
(qiagen)中。在特定实施方案中,根据本公开的实施方案,皮下wat样本的一部分(例如25克)可用于生产swat培养
物。在一个具体的实施方案中,当wat被切碎,酶促消化并离心时,可以使用皮下wat样品的一部分(例如25克)来分离匹配的支持细胞,例如用于使用标准方案分化成diffad的脂肪细胞adsc。
45.在本公开的示例性实施方案中,可将原代人wat从患者分离并机械切碎成碎片300。将wat组织碎片300转移到培养皿400中,培养皿400具有在培养皿基底401上生长的支持细胞层304。参见图6。
46.然后可以将具有支持细胞层204的插入件100插入培养皿400中,包括在支持细胞层204顶上的wat组织300。参见图7。在该实施方案中,原代人类wat组织300然后可以夹在两层支持细胞204,304之间以形成夹层wat(swat)共培养系统800。参见图8。上方支持细胞层104可以附着到插入件100的基底102并且用于保持漂浮的wat组织300与附着于培养皿200的下层支持细胞204接触直至发生附着。在示例性实施方案中,wat组织300与支持细胞层104,204之间的附着在几分钟内发生。在某些实施方案中,swat系统的双层构建体可以是完全细胞的或可以含有多种合成组分或无细胞组分。
47.在一个示例性实施方案中,将人类主要wat组织的0.5-1mm碎片夹在两层支持细胞(例如脂肪来源的基质细胞(adsc))之间以形成本文所述的swat共培养系统。支持细胞,例如adsc,可以在包被温敏基质的标准组织培养板上培养。如本文所公开的swat培养系统也可以是标准的培养基。标准培养基的实例包括至少低葡萄糖dmem,约10%新生小牛血清和约1%青霉素/链霉素抗生素溶液。
48.在示例性实施方案中,本文描述的swat系统可以用作旨在修饰脂肪组织或脂肪细胞的生物学或生理学的任何外在因素或系统的测试模型。在多种实施方案中,可以将测试因子引入细胞培养基中,并在分离的人脂肪细胞或原代人wat的碎片中评估它们的影响。测试因子的非限制性实施方案可以包括但不限于药物化合物,重组或天然病毒,重组或分离的核酸构建体,表达载体,sirna构建体,微rna构建体,遗传工具,细菌和环境调节,包括温度,压力和气体的调节。
49.如图9a的显微照片所示,在双层支持细胞之间建立swat培养物。将wat添加到未标记的支持细胞的底层,并添加表达增强型绿色荧光蛋白(egfp)的支持细胞的顶层。如图9a所示,将wat簇细胞夹在双层支持细胞(例如,egfp阴性(底层)和egfp阳性(顶层))之间以形成示例性swat培养体系。而且,图9b显示了swat培养物随时间的显微图像。swat培养物内的wat细胞簇能够保持其形态稳定性达至少47天或约6.7周。参见图9b。
50.在多种实施方案中,本文描述的swat共培养系统展示长期生存力和稳定性,这些是终末分化细胞(包括wat)的微生理学模型的重要特征。在本公开的一个示例性实施方案中,在图10中的swat簇的染色中说明了长期形态学稳定性。在图10a中,通过将中性脂质仅限于wat细胞阐明了wat细胞簇的结构稳定性,即使在swat培养物中51天后。同样,swat培养物中wat细胞的碘化丙锭染色如图10b所示为阴性。碘化丙锭阴性wat细胞表明,在swat培养至少18天后,wat细胞没有经历程序性细胞死亡,即细胞凋亡。最后,将亲脂性染色限制于swat共培养物的脂肪细胞进一步证明了本文所述系统和方法的长期生存力。参见图10c。与常规方法相反,本公开的示例性实施方案证明,swat培养物内的wat细胞簇保持其细胞内结构,例如图10a,是可行的并且不进入程序性细胞死亡状态,例如图10b,并且保持为不同的人群。
51.图11证明本文所述的swat系统能够维持至少六(6)个关键脂肪细胞身份基因的基因表达谱,包括:作为脂肪细胞分化/同一性的主要调节剂的活化受体γ(pparγ);脂肪酸结合蛋白4(fabp4),其是终端脂肪细胞分化所必需的转录因子;ccaat/增强子结合蛋白α(cebpa),其将长链脂肪酸和视黄酸递送至核受体;脂蛋白脂肪酶(lpl),其是水解甘油三酯的酶;激素敏感性脂肪酶(hsl),其将存储的甘油三酯水解为游离脂肪酸;和脂连蛋白(adipoq),其是控制脂肪代谢和胰岛素敏感性的中心脂肪因子。在实验上,从swat培养物收集总rna,并使用逆转录聚合酶链式反应(rt-pcr)将表达水平与受试者匹配的原代wat进行比较。在转录水平上,本公开内容的swat培养系统保持了脂肪组织的身份。参见图11。
52.在翻译水平上,本公开的swat培养系统也维持脂肪细胞蛋白质。如图12所示,swat培养物的免疫细胞化学染色证明了脂肪细胞标记物的蛋白质产生,所述标记物包括:pparg,fabp4,与脂肪细胞脂解有关的β-3肾上腺素能受体(b3-ar)和perillipin,其已知为蛋白质脂滴相关蛋白并在脂肪细胞中包被脂滴。
53.除了表达与脂肪细胞相关的基因和蛋白质标记物之外,本公开的swat培养物还执行基础内分泌功能。在本公开的某些实施方案中,可能需要将培养模型中组织和细胞的功能维持为尽可能接近天然组织。在各种实施方案中,swat簇保持其天然内分泌功能。原代人体wat是分泌至少2种激素的内分泌组织,所述激素包括:瘦蛋白和脂连蛋白。基于标准化的定量elisa测定,如图13a和图13b所示,在培养一(1)和五(5)天后,swat培养物以与受试者匹配的wat相似的水平分泌瘦蛋白和脂连蛋白。参见图13a和图13b。
54.此外,本文所述的swat培养系统响应于外源信号以与原代wat相似的水平进行脂解。参见图13c。脂解作用是wat的核心功能,是将储存的脂肪转化为代谢燃料的过程。在体内,脂解以基础速率发生并被儿茶酚胺上调。在体外,脂解可以通过使用常规bradford总蛋白质测定法测量释放的游离甘油的量并对总蛋白质水平归一化来定量。在本公开的一个具体实施方案中,将swat培养物暴露于100μm毛喉素+1μm肾上腺素三(3)小时。在培养1天和5天后,swat培养物响应刺激以类似于原代wat的水平进行脂解。
55.在另一个示例性实施方案中,本文描述的swat培养系统可以在swat培养至少十天后维持原生功能性。如图14所示,在swat培养十天后收获swat培养物并皮下注射到免疫受损的egfp标记的小鼠(nod-scid il2rγnull)中。已知植入的组织必须招募新的血液供应,即诱导血管形成,或者组织将在48小时内死亡,即坏死并随后由宿主液化。在一个示例性实施方案中,swat移植物在皮下注射后10天从它们的小鼠宿主重新收获。目视检查时,注射的swat组织很容易被肉眼看到。参见图14(重新收获)。此外,组织学分析显示swat移植物保持了wat的结构特征,并且不表达小鼠宿主的内源性egfp。参见图14(swat和neg)。这些数据表明swat培养物甚至在swat培养中十天后可以保留足够的原生功能,以使swat组织能够移植。因为招募新的宿主血液供应,即血管形成是一个非常复杂的过程,所以这个数据进一步表明,本文描述的swat系统可以是人wat的稳健的微观生理学模型。
56.本公开的示例性实施方案提供了可以允许研究有效的抗肥胖策略的系统。先前了解到,只有棕色脂肪组织(bat)能够在被称为产热的过程中燃烧能量。然而,在啮齿动物和diffads模型中,已知可以诱导白色脂肪细胞(wads)成为产热的浅褐色/“brite”脂肪细胞(brads),其可以基于响应升高的细胞内环amp(camp)水平,解偶联蛋白1(ucp1)的上调被生化鉴定。具体而言,ucp1的诱导将wat转化为产热细胞并导致细胞形态的改变。
57.形态学上,brads从与wat细胞相关的大的单室表型转变为多室表型。brads的wat特异性来源已通过啮齿类动物的谱系追踪研究得到证实:brads是肌源性因子5(myf5)阴性,而棕色脂肪细胞(bads)与骨骼肌细胞共有myf5+谱系。在啮齿动物中,在大多数皮下和内脏wat仓库中观察到褐变。在啮齿类动物模型中,褐色的wat所带来的体重减轻可能是深远的。因此,本文公开的swat培养系统可以提供微生理模型系统,用于评估培养原代人wat的受控褐变作为可行和有效的抗肥胖策略。
58.本公开的实施方案提供了用于研究在啮齿动物和diffads模型中鉴定的褐变途径的生物化学的系统和方法,所述模型可以通过以下控制:β-3肾上腺素受体(b3-ar),冷受体,心利钠肽受体受体,janus抑制剂激酶3jak3)和notch 1。这些内源性生化途径中的每一个为药物干预提供了许多候选靶标。几种化合物在啮齿类动物和diffads中褐变了wat。在啮齿类动物中,化学诱导褐变的wat成功改善了肥胖并治愈了2型糖尿病。因此,本文公开的swat培养系统可提供用于评估原代人体wat组织中候选药物的微生理模型系统。
59.本公开的示例性实施方案提供了体外系统,其可以允许研究和评估化学化合物(例如药物)对人类wat和其他漂浮细胞类型的作用。非限制性的示例性候选药物可以包括但不限于:β-3肾上腺素受体的激动剂和拮抗剂,例如1&3-ar;migrabegron,其是fda批准用于膀胱活动过度综合征的第四代1&3激动剂,但已知它能激活人体内的bat;cl-316243,其是特异性1&3激动剂,例如1&1,1&2,1&3=0:1:100,000),其改善了肥胖的糖尿病黄kk小鼠中的肥胖症;l-796568,其是苯磺酰胺家族特异性1&3激动剂,例如1&1,1&2,1&3=1:230:660,其改善了能量消耗,但在肥胖的人类男性中不产生显著的抗肥胖作用;brl 26830a,其是1&3激动剂,在双盲试验中显示体重减轻的显著改善。
60.在其他示例性实施方案中,本文所述的培养系统可以维持培养物中其他漂浮细胞的天然功能。内源性生物化学途径可以通过应用和评估外源性刺激物(例如化学化合物)的影响来评估药物干预。无论组织类型或来源物种如何,任何漂浮的细胞类型都可以是用于本公开的实施方案中的候选物。可用于使用本文公开的装置,系统和方法进行评估的候选者的漂浮组织和细胞类型的示例性实施方案包括但不限于:肝细胞,肾组织和细胞,脑组织和细胞,甲状腺组织和细胞,脾组织和细胞,肝组织和细胞,中枢和外周神经组织和细胞,以及免疫组织和细胞。而且,漂浮细胞可以从任何来源生物获得。示例性的来源生物可以包括但不限于:植物,动物,原生生物,真菌,古细菌和真细菌。使用本文公开的装置,系统和方法进行评估的组织或细胞的另外示例性来源包括但不限于:人,小鼠,大鼠,猴,狗,猫,猪,非人灵长类和鱼。
61.本公开的示例性实施方案提供了用于研究示例性,非限制性细胞类型的生物学响应的系统和方法。例如,建立的漂浮组织类型可以包括神经元组织。如果例如过量的气泡被引入含水培养基中,神经元组织可能不容易粘附到培养皿的表面。因此,本文公开的漂浮组织培养装置,系统和方法可以直接应用于神经组织的研究。
62.本公开的实施方案提供用于培养可包括胚胎或成人神经元组织的神经元组织的装置,系统和方法。在一个示例性实施方案中,本公开提供了可用于评估神经发生的模型系统。在其他实施方案中,本公开可提供可评估神经元疾病进展的系统。
63.在示例性实施方案中,本公开的装置,系统和方法可用于评估导致通常称为阿尔茨海默氏病(ad)的神经元疾病的生物化学途径以及多种药物干预的影响。例如,ad疾病的
中心是正常相对于疾病状态下整合膜蛋白淀粉状蛋白前体蛋白(app)的差异化加工。在正常状态下,app首先被α-分泌酶切割以产生sapp和c83羧基末端片段。sapp的存在与正常突触信号传导相关并导致突触可塑性,学习和记忆,情绪行为和神经元存活有关。在疾病状态下,app被α-分泌酶和γ-分泌酶顺序切割以释放称为a40/42的细胞外片段。这种神经毒性片段经常聚集并导致a 40/42寡聚化和斑块形成。40/42的聚集导致阻断的离子通道,钙稳态的破坏,线粒体氧化应激,受损的能量代谢和异常葡萄糖调节,并最终导致神经元细胞死亡。本公开的微生理系统提供了用于快速和有效评估体外漂浮神经元组织同时维持神经元组织处于天然状态的模型。
64.本公开的实施方案提供了用于评估涉及心血管疾病(cvd)的生物化学途径的装置,系统和方法。心血管疾病(cvd)仍然是美国的主要死因,每年有超过600,000人死亡,每年的直接成本接近3000亿美元。高血压(htn)和肥胖是cvd的两种最常见和可改变的危险因素。htn影响29.1%的美国成年人,并且成功地治疗血压将cvd风险降低20-50%。肥胖比htn更普遍,影响36%的成年美国人,并被认为是全球性流行病。然而,尽管有几类抗高血压药物可用,但没有广泛有效的抗肥胖药物被批准用于患者使用。
65.在示例性实施方案中,本公开的装置,系统和方法可用于评估涉及心血管疾病和肥胖症的重叠生物化学途径。例如,htn的发病机制通常涉及肾素-血管紧张肽系统(ras)的过度激活。ras过度激活也与肥胖有关,这是一种涉及wat过度生长的疾病。此外,ras共享与肥胖生物化学途径重叠的生物化学信号传导途径,如通过以下事实证明:(i)ras的分子组分存在于脂肪组织中,(ii)wat分泌血管紧张肽原(agt),(iii)血管紧张肽ii(ang ii)可诱导分离的脂肪细胞和分化的脂肪细胞(diffads)中的脂肪形成,(iv)ang ii刺激抑制了离体人脂肪细胞中的脂肪分解,因此有利于脂肪生成。
66.此外,本公开的实施方案证实swat培养物能够维持ras途径组分表达。例如,使用rt-pcr,确定swat培养物保留了关键ras组分(n=5)的表达:(i)swat agt表达:原代wat的62%(范围47-79%);swat ace表达:原代wat的58%(范围45-71%),swat at1r表达:原代wat的14%(范围6-19%);swat at2r表达:原代wat的231%(范围72-617%),swat肾素:无可检测的表达。此外,就内分泌功能而言,如通过酶联免疫吸附测定法(elisa)测定,swat分泌agt,瘦蛋白和脂连蛋白。最后,swat分泌77至204ng agt/mg总蛋白,并且elisa测试在来自培养的swat的培养基中未鉴定到ang ii。总之,这些数据表明ras过度激活可能以全身和自分泌的方式驱动脂肪生成。在实施方案中,通过现有的经批准的药物疗法的ras抑制可以改善高血压和肥胖。本公开的实施方案提供了用于研究该系统的装置,系统和方法。
67.尽管参考各种实现和利用来描述实施方案,但将理解,这些实施方案是说明性的,并且本发明的范围不限于它们。许多变型,修改,添加和改进都是可能的。此外,本文描述的任何步骤可以以任何期望的顺序执行,并且可以添加或删除任何期望的步骤。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1