一种含氮衍生物为Linker的HDAC8降解剂其制备方法和应用与流程
一种含氮衍生物为linker的hdac8降解剂其制备方法和应用
技术领域
1.本发明属于医药化学领域,具体涉及一种含氮衍生物为linker的异羟肟酸类化合物及其用途。
背景技术:
2.组蛋白去乙酰化酶(hdacs)是一类能够催化组蛋白或非组蛋白中的n-乙酰赖氨酸残基上乙酰基去除的酶家族。到目前为止,已鉴定出18种hdac亚型,并将其分为四个大类。hdac在基因调控、转录、细胞增殖以及分化等过程中都发挥着重要作用。因此在过去十年中对于hdac抑制剂的研究得到了人们的广泛关注,基于此,hdac抑制剂被认为对于癌症、炎症以及神经系统等疾病具有治疗潜力。
3.迄今为止已有5种hdac抑制剂被批准上市,均为非选择性的泛抑制剂。由于缺乏选择性,其在治疗过程中存在多种不良反应,如腹泻、白细胞以及血小板减少等。这些问题在一定程度上限制了其使用范围。因此开发具有亚型选择性的hdac抑制剂有望克服现有药物存在缺陷。hdac8是一种i类hdac,主要位于细胞核中,越来越多的证据表明hdac8异常表达在许多疾病中发挥关键作用,例如t细胞淋巴瘤、神经母细胞瘤等。在过去十年中,一系列的hdac8抑制剂被研究人员开发出来。
4.最近,蛋白降解靶向嵌合体(protacs)作为一种有效的蛋白降解技术引起了人们的广泛关注。protacs是一种由e3泛素连接酶配体、靶蛋白配体(poi)以及两者中间的接头三部分组成的双功能分子。protacs能够与poi以及e3泛素连接酶结合形成三元体复合物,进而通过泛素蛋白酶体系统促进靶蛋白降解。迄今为止protacs已应用于许多疾病相关蛋白的降解,例如ar、bet、btk等蛋白受体。
5.相较于传统小分子抑制剂,protacs优势主要体现在靶向性更强,在微量条件下便可发挥作用,安全性更高等方面。基于以上研究,开发和寻找一种有效的protac分子能够克服传统小分子药物缺陷,获得更好的治疗效果。
技术实现要素:
6.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种含有式(i)所示结构的含氮衍生物为linker的异羟肟酸类化合物及其制备方法和用途,所述化合物可选择性降解hdac8蛋白。
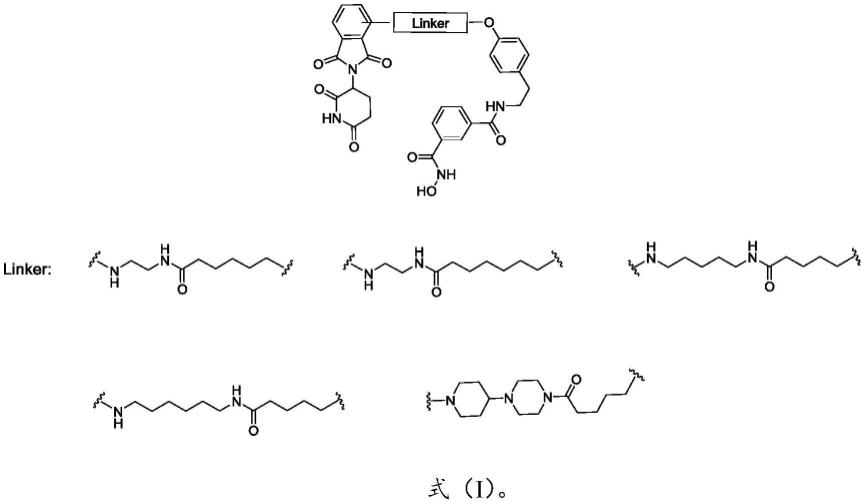
7.本发明的第一方面,提供式(i)所示化合物或其药学上可接受的盐、异构体、溶剂合物或前药:
[0008][0009]
linker.
[0010]
在本发明的一些实施方式中,所述hdac包括hdac1、hdac3、hdac6、hdac8中的至少一种,优选hdac8。
[0011]
本发明的第二方面,提供上述式(i)所示化合物或其药学上可接受的盐、异构体、溶剂合物或前药,在降解hdac8蛋白中的应用。
[0012]
本发明的式(i)所示化合物,尤其是化合物n1-(4-((5-((6-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异喹啉-4-基)氨基)己基)氨基)-5-氧开基)苯乙基)-n3-羟基间苯二甲酰胺,可以有效引起hdac8蛋白表达量减少,而不影响其他蛋白的表达。
[0013]
在本发明的一些实施方式中,所述缩合在溶剂存在的条件下进行,所述溶剂为n,n-二甲基甲酰胺。
[0014]
在本发明的一些实施方式中,所述缩合在缩合剂以及有机碱存在的条件下进行。
[0015]
在本发明的一些优选的实施方式中,所述缩合剂为n,n,n',n'-四甲基氯甲脒六氟磷酸盐和n-甲基咪唑或2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯,所述有机碱为三乙胺。
[0016]
在本发明的一些优选的实施方式中,所述n,n,n',n'-四甲基氯甲脒六氟磷酸盐和n-甲基咪唑的摩尔比为1:1.5。
[0017]
在本发明的一些优选的实施方式中,所述羧酸:胺:缩合剂:有机碱的摩尔比为1:1~1.2:2~3:3~4。
[0018]
在本发明的一些实施方式中,所述缩合的温度为缩合的时间为2-4h。
[0019]
根据本发明实施方式的化合物,至少具备如下有益效果:
[0020]
(1)本发明提供了一种含有式(i)所示结构的含氮衍生物为linker的异羟肟酸类化合物,五种化合物在人结肠癌细胞hct116中均显示出有效的hdac8降解活性,可用做hdac8降解剂。进一步的降解机制研究证明该化合物可通过泛素-蛋白酶体途径有效降解hdac8蛋白,而不是通过溶酶体途径降解。同时,该化合物能够选择性降解hdac8蛋白而不影响hdac1、hdac3的表达,但在高浓度下能引起微弱的hdac6降解。
[0021]
(2)本发明的式(i)所示化合物的制备方法具有产率高,后处理简便,经济性好的优点。
[0022]
本技术中术语:“药学上可接受的盐”包括与药学上可以接受的无机酸或者有机
酸、或者无机碱或有机碱形成的常规盐。
附图说明
[0023]
下面结合附图和实施例对本发明作进一步的说明,其中:
[0024]
图1为本发明式(i)所示化合物n1-(4-((5-((6-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异喹啉-4-基)氨基)己基)氨基)-5-氧开基)苯乙基)-n3-羟基间苯二甲酰胺(zq-23)的核磁共振氢谱图。
[0025]
图2为本发明式(i)所示化合物n1-(4-((5-((6-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异喹啉-4-基)氨基)己基)氨基)-5-氧开基)苯乙基)-n3-羟基间苯二甲酰胺(zq-23)的核磁共振碳图。
[0026]
图3为本发明式所示化合物n1-(4-((5-((6-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异喹啉-4-基)氨基)己基)氨基)-5-氧开基)苯乙基)-n3-羟基间苯二甲酰胺(zq-23)的hplc图。
[0027]
图4为本发明式(i)所示化合物n1-(4-((6-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异喹啉-4-基)氨基)乙基)氨基)-6-氧杂己基)氧基)苯乙基)-n3-羟基间苯二甲酰胺(zq-4)的核磁共振氢谱图。
[0028]
图5为本发明式(i)所示化合物n1-(4-((6-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异喹啉-4-基)氨基)乙基)氨基)-6-氧杂己基)氧基)苯乙基)-n3-羟基间苯二甲酰胺(zq-4)的核磁共振碳图。
[0029]
图6为本发明式所示化合物n1-(4-((6-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异喹啉-4-基)氨基)乙基)氨基)-6-氧杂己基)氧基)苯乙基)-n3-羟基间苯二甲酰胺(zq-4)的hplc图。
[0030]
图7为本发明式(i)所示化合物n1-(4-((7-((2-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异喹啉-4-基)氨基)乙基)氨基)-7-氧庚基)氧基)苯乙基)-n3-羟基间苯二甲酰胺(zq-5)的核磁共振氢谱图。
[0031]
图8为本发明式(i)所示化合物n1-(4-((7-((2-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异喹啉-4-基)氨基)乙基)氨基)-7-氧庚基)氧基)苯乙基)-n3-羟基间苯二甲酰胺(zq-5)的核磁共振碳图。
[0032]
图9为本发明式所示化合物n1-(4-((7-((2-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异喹啉-4-基)氨基)乙基)氨基)-7-氧庚基)氧基)苯乙基)-n3-羟基间苯二甲酰胺(zq-5)的hplc图。
[0033]
图10为本发明式(i)所示化合物n1-(4-((5-((5-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异喹啉-4-基)氨基)戊基)氨基)-5-氧开基)苯乙基)-n3-羟基间苯二甲酰胺(zq-18)的核磁共振氢谱图。
[0034]
图11为本发明式(i)所示化合物n1-(4-((5-((5-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异喹啉-4-基)氨基)戊基)氨基)-5-氧开基)苯乙基)-n3-羟基间苯二甲酰胺(zq-18)的核磁共振碳图。
[0035]
图12为本发明式所示化合物n1-(4-((5-((5-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异喹啉-4-基)氨基)戊基)氨基)-5-氧开基)苯乙基)-n3-羟基间苯二甲酰胺(zq-18)的
hplc图。
[0036]
图13为本发明式(i)所示化合物n1-(4-((5-(4-(1-(2-(2,6-二氧哌啶-3-基)-1,3-二氧异辛醇-4-基)哌啶-4-基)哌嗪-1-基)-5-氧基)苯乙基)-n3-羟基间苯二甲酰胺(zq-31)的核磁共振氢谱图。
[0037]
图14为本发明式(i)所示化合物n1-(4-((5-(4-(1-(2-(2,6-二氧哌啶-3-基)-1,3-二氧异辛醇-4-基)哌啶-4-基)哌嗪-1-基)-5-氧基)苯乙基)-n3-羟基间苯二甲酰胺(zq-31)的核磁共振碳图。
[0038]
图15为本发明式所示化合物n1-(4-((5-((5-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异喹啉-4-基)氨基)戊基)氨基)-5-氧开基)苯乙基)-n3-羟基间苯二甲酰胺(zq-31)的hplc图。
[0039]
图16为式(i)所示化合物zq-23对hdac8蛋白表达水平的影响,a:western blot检测式(i)所示化合物zq-23随时间改变对hdac8蛋白表达水平的影响;b:western blot检测式(i)所示化合物zq-23随浓度改变对hdac8蛋白表达水平的影响。
[0040]
图17为式(i)所示化合物zq-23对hdac1、hdac3、hdac6、ac-α-tubulin、ac-smc3表达水平的影响,a:western blot检测式(i)所示化合物zq-23对hdac6蛋白表达水平的影响;b:western blot检测式(i)所示化合物zq-23对hdac1、hdac3、ac-α-tubulin、ac-smc3表达水平的影响。
[0041]
图18为式(i)所示化合物zq-23对hdac8蛋白降解的机制研究。用zq-37和zq-36、hdac6/8抑制剂brd73954、e3连接酶配体泊马度胺(a)或蛋白酶体抑制剂mg132、溶酶体酶抑制剂巴佛洛霉素a1或e3连接酶抑制剂(b)或dmso预处理hct-116细胞4小时,然后用5μm zq-23或dmso预处理10小时对hdac8蛋白表达水平的影响。其中所述zq-36、zq-37均由zq-23改造获得,zq-36在结合crbn方面存在缺陷,而zq-37用thp基团取代异羟肟酸。
具体实施方式
[0042]
以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
[0043]
实施例
[0044]
实施例1合成方法:
[0045][0046]
中间体的制备
[0047]
中间体:2-(2,6-二氧哌啶-3-基)-4-氟异吲哚啉-1,3-二酮(3)的制备
[0048]
将3-氟酞酐,3-氨基哌啶-2,6-二酮盐酸盐于冰醋酸中120度回流5小时。反应结束后,将反应液倒入冰水中,抽滤得紫灰色固体2-(2,6-二氧哌啶-3-基)-4-氟异吲哚啉-1,3-二酮,产率:60%。
[0049]
中间体:4-((2-氨基乙基)氨基)-2-(2,6-二氧代哌啶-3-基)异吲哚啉-1,3-二酮盐酸盐(6a)的制备
[0050]
将3(1.0g,3.62mmol),n-叔丁氧羰基-1,2-乙二胺(696.03mg,4.34mmol)溶于5ml dmf,加入dipea(1.26ml,7.24mmol),90℃反应4h。反应结束后,向反应体系中加入水、乙酸乙酯(25ml
×
3)萃取,有机层经水洗、饱和食盐水洗,无水硫酸钠干燥,减压蒸发溶剂,快速柱层析(0.5%-2%甲醇/二氯甲烷),得黄色固体0.36g,收率36%。将所得黄色固体溶于20ml二氯甲烷中,冰浴下滴加1ml 4.0m氯化氢/二氧六环溶液,室温反应1h,反应结束后有固体析出。抽滤、干燥得黄绿色固体0.32g,收率91%。
[0051]
中间体:4-((5-氨基戊基)氨基)-2-(2,6-二氧哌啶-3-基)异吲哚-1,3-二酮盐酸盐(6b)的制备
[0052]
6b的合成方法参照6a,化合物5a~5c制备过程中用n-(叔丁氧羰基)-1,5-戊二胺代替n-叔丁氧羰基-1,2-乙二胺,其余合成过程不变。收率39%。
[0053]
中间体:4-((6-氨基己基)氨基)-2-(2,6-二氧哌啶-3-基)异吲哚-1,3-二酮盐酸盐(6c)的制备
[0054]
6c的合成方法参照6a,化合物5a~5c制备过程中用n-(6-氨基己基)氨基甲酸叔丁酯代替n-叔丁氧羰基-1,2-乙二胺,其余合成过程不变。收率41%。
[0055]
中间体:3-(((四氢-2h-吡喃-2-基)氧基)氨基甲酰基)苯甲酸(10)的制备
[0056]
将间苯二甲酸单甲酯(5.0g,27.75mmol)和o-(四氢-2h-吡喃-2-基)羟基胺(3.58g,30.53mmol),溶于10mldmf中,加入hatu(12.66g,33.30mmol)、三乙胺(11.57ml,83.26mmol),室温搅拌4h。反应结束后,向反应体系中加入水、乙酸乙酯(25ml
×
3)萃取,有机层经水洗、饱和食盐水洗,无水硫酸钠干燥,减压蒸发溶剂,得到黄色油状物1a-3。将所得
油状物溶于20ml甲醇中,加入饱和氢氧化钠水溶液,室温搅拌1h,反应结束后,减压蒸发溶剂,用1.0m hcl调ph 4-5,有沉淀析出,抽滤、干燥得白色固体7.5g,收率87%。
[0057]
中间体:5-(4-(2-(3-(((四氢-2h-吡喃-2-基)氧基)氨基甲酰基)苯甲酰氨基)乙基)苯氧基)戊酸(16a)的制备
[0058]
将n-boc-酪胺(1.0g,4.21mmol)和碳酸钾(1.16g,8.43mmol)溶于dmf中,80℃反应1h后加入5-溴戊酸甲酯(1.21ml,8.43mmol),继续反应2h,tlc监测,反应结束后,向反应体系中加入水、乙酸乙酯(25ml
×
3)萃取,有机层经水洗、饱和食盐水洗,无水硫酸钠干燥,减压蒸发溶剂,得到白色油状物13a。将所得白色油状物溶于15ml二氯甲烷中,冰浴下滴加1ml 4.0m氯化氢/二氧六环溶液,室温反应1h,反应结束后有固体析出。抽滤、干燥得白色固体14a。将10(800mg,3.02mmol)和14a(954mg,3.32mmol)溶于5ml dmf中,加入hatu(1.38g,3.62mmol)、三乙胺(1.68ml,12.06mmol),室温搅拌4h。反应结束后,向反应体系中加入水、乙酸乙酯(25ml
×
3)萃取,有机层经水洗、饱和食盐水洗,无水硫酸钠干燥,减压蒸发溶剂,得到白色油状物15a。将所得油状物溶于10ml甲醇中,加入饱和氢氧化钠水溶液,室温搅拌1h,反应结束后,减压蒸发溶剂,用1.0m hcl调ph 4-5,有沉淀析出,抽滤、干燥得白色固体5-(4-(2-(3-(((四氢-2h-吡喃-2-基)氧基)氨基甲酰基)苯甲酰氨基)乙基)苯氧基)戊酸1.5g,收率83%。
[0059]
中间体:6-(4-(2-(3-((四氢-2h-吡喃-2-基)氧基)氨甲酰)苯甲酰)乙基)苯氧基)己酸(16b)的制备
[0060]
16b的合成方法参照16a,化合物13a~13c制备过程中用6-溴己酸甲酯代替5-溴戊酸甲酯,其余合成过程不变。收率54%。
[0061]
中间体:7-(4-(2-(3-((四氢-2h-吡喃-2-基)氧基)氨甲酰)苯甲酰)乙基)苯氧基)庚酸(16c)的制备
[0062]
16c的合成方法参照16a,化合物13a-13c制备过程中用7-溴庚酸甲酯代替5-溴戊酸甲酯,其余合成过程不变。收率52%。
[0063]
式i化合物(化合物zq-4):n1-(4-((6-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异喹啉-4-基)氨基)乙基)氨基)-6-氧杂己基)氧基)苯乙基)-n3-羟基间苯二甲酰胺的制备:
[0064]
将化合物6a(0.21mmol)和16b(0.23mmol)溶于dmf中,加入tcfh(0.43mmol)、n-甲基咪唑(0.68mmol)、三乙胺(0.83mmol),室温搅拌4h。反应结束后,向反应液中加入水,有沉淀析出,抽滤、干燥得黄色固体。将所得黄色固体溶于10ml二氯甲烷中,冰浴下滴加1ml 4.0m氯化氢/二氧六环溶液,室温反应1h,反应结束后减压蒸发溶剂,快速柱层析(2%-5%甲醇/二氯甲烷),得黄色固体n1-(4-((6-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异喹啉-4-基)氨基)乙基)氨基)-6-氧杂己基)氧基)苯乙基)-n3-羟基间苯二甲酰胺,收率21.2%。具体鉴定结果为:1h nmr(400mhz,dmso-d6)δ11.28(s,1h),11.09(s,1h),9.11(s,1h),8.64(s,1h),8.23(s,1h),8.03(s,1h),7.94(d,j=7.4hz,1h),7.86(d,j=7.6hz,1h),7.63
–
7.47(m,2h),7.16(dd,j=15.9,8.4hz,3h),7.03(d,j=6.9hz,1h),6.83(d,j=8.2hz,2h),6.72(s,1h),5.06(dd,j=12.7,5.2hz,1h),3.89(t,j=6.1hz,2h),3.47
–
3.42(m,4h),3.26(d,j=5.6hz,2h),2.87(d,j=12.4hz,1h),2.78(t,j=7.2hz,2h),2.62
–
2.55(m,2h),2.09(t,j=7.2hz,2h),2.01(d,j=6.8hz,1h),1.72
–
1.64(m,2h),1.61
–
1.51(m,2h),1.41
–
1.33(m,2h).
13
c nmr(101mhz,dmso-d6)δ173.21,173.15,170.45,169.10,167.69,166.03,
164.26,157.46,146.76,136.60,135.23,133.36,132.57,131.58,130.03,129.96,129.62,128.83,126.39,117.56,114.67,110.96,109.61,67.59,48.92,41.87,41.59,38.39,35.72,34.58,31.36,28.89,25.58,25.37,22.56.purity:98.9%by hplc(tr=12.49min).
[0065]
式i化合物(化合物zq-5):n1-(4-((7-((2-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异喹啉-4-基)氨基)乙基)氨基)-7-氧庚基)氧基)苯乙基)-n3-羟基间苯二甲酰胺的制备:化合物zq-5合成参照化合物zq-4,化合物13a~13c制备过程中用7-溴庚酸甲酯代替6-溴己酸甲酯,其余合成过程不变。具体鉴定结果为:1h nmr(400mhz,dmso-d6)δ11.31(s,1h),11.09(s,1h),8.67(s,1h),8.25(s,1h),8.03(s,1h),7.94(d,j=7.1hz,1h),7.86(d,j=7.2hz,1h),7.64
–
7.49(m,2h),7.16(dd,j=14.3,8.3hz,3h),7.03(d,j=6.4hz,1h),6.83(d,j=7.6hz,2h),6.71(s,1h),5.06(dd,j=12.4,4.2hz,1h),3.88(s,2h),3.45(s,4h),3.25(s,2h),2.95
–
2.84(m,1h),2.83
–
2.75(m,2h),2.58(d,j=21.2hz,2h),2.10
–
1.99(m,3h),1.65(s,2h),1.50(s,2h),1.37(s,2h),1.27(s,2h).
13
c nmr(101mhz,dmso-d6)δ173.20,173.14,170.47,169.11,167.70,165.99,157.50,146.78,136.60,135.24,133.35,132.60,131.61,130.05,129.97,129.63,128.82,126.41,117.59,114.71,110.96,109.63,67.69,48.94,41.89,41.61,38.40,35.74,34.60,31.39,29.00,28.79,25.73,25.55,22.58.purity:96.0%by hplc(tr=13.13min).
[0066]
式i化合物(化合物zq-18):n1-(4-((5-((5-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异喹啉-4-基)氨基)戊基)氨基)-5-氧开基)苯乙基)-n3-羟基间苯二甲酰胺的制备:化合物zq-18合成参照化合物zq-4,化合物5a~5c、13a~13c制备过程中分别用n-叔丁氧羰基-1,4-丁二胺、5-溴戊酸甲酯代替n-叔丁氧羰基-1,2-乙二胺、6-溴己酸甲酯,其余合成过程不变。具体鉴定结果为:1h nmr(400mhz,dmso-d6)δ11.30(s,1h),11.09(s,1h),8.65(s,1h),8.22(s,1h),7.94(d,j=6.7hz,1h),7.86(d,j=6.8hz,1h),7.80(s,1h),7.63
–
7.51(m,2h),7.14(d,j=7.3hz,2h),7.09(d,j=8.1hz,1h),7.02(d,j=6.3hz,1h),6.84(d,j=7.3hz,2h),6.52(s,1h),5.05(d,j=8.3hz,1h),3.91(s,2h),3.59(s,2h),3.29(s,2h),3.10
–
2.99(m,2h),2.86(d,j=13.7hz,1h),2.78(s,2h),2.59(d,j=17.3hz,2h),2.11(s,2h),2.02(s,1h),1.61(d,j=27.4hz,6h),1.44(s,2h),1.32(d,j=13.0hz,2h).
13
c nmr(101mhz,dmso-d6)δ173.27,172.28,170.53,169.40,167.77,166.09,157.51,146.88,136.76,135.30,133.42,132.63,131.69,130.09,130.03,129.67,128.89,126.45,117.65,114.78,110.87,109.47,67.50,49.01,42.28,41.66,38.73,35.50,34.64,31.44,29.31,28.84,28.75,24.17,22.63,22.43.purity:98.2%by hplc(tr=13.24min).
[0067]
式i化合物(化合物zq-23):n1-(4-((5-((6-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异喹啉-4-基)氨基)己基)氨基)-5-氧开基)苯乙基)-n3-羟基间苯二甲酰胺的制备:化合物zq-23合成参照化合物zq-4,化合物5a~5c、13a~13c制备过程中分别用n-(6-氨基己基)氨基甲酸叔丁酯、5-溴戊酸甲酯代替n-叔丁氧羰基-1,2-乙二胺、6-溴己酸甲酯,其余合成过程不变。具体鉴定结果为:1h nmr(400mhz,dmso-d6)δ11.30(s,1h),11.10(s,1h),8.66(s,1h),8.23(s,1h),7.97
–
7.75(m,3h),7.61
–
7.49(m,2h),7.15(d,j=6.5hz,2h),7.10(s,1h),7.03(s,1h),6.84(d,j=6.8hz,2h),6.52(s,1h),5.06(d,j=7.4hz,1h),3.92(s,2h),3.29(s,4h),3.04(s,2h),2.87(d,j=13.4hz,1h),2.79(s,2h),2.60(d,j=17.0hz,2h),2.11(s,2h),2.03(s,1h),1.65(s,4h),1.57(s,2h),1.39(s,2h),1.32(s,4h).
13
c nmr
(101mhz,dmso-d6)δ173.24,172.19,170.51,169.36,167.72,166.04,157.46,146.83,136.70,135.24,133.36,132.59,131.64,130.04,129.97,129.63,128.84,126.40,117.57,114.72,110.80,109.41,67.43,48.95,42.19,41.60,38.75,35.43,34.58,31.37,29.49,29.04,28.69,26.54,26.43,22.56,22.37.purity:96.8%by hplc(tr=13.78min).
[0068]
实施例2合成方法:
[0069][0070]
中间体的制备
[0071]
中间体:2-(2,6-二氧代哌啶-3-基)-4-(4-氧代哌啶-1-基)异吲哚啉-1,3-二酮(18)的制备
[0072]
将3(1.0g,3.62mmol),4-羟基哌啶(439.42mg,4.34mmol)溶于5ml dmf,加入dipea(1.26ml,7.24mmol),90℃反应4h。反应结束后,向反应体系中加入水、乙酸乙酯(25ml
×
3)萃取,有机层经水洗、饱和食盐水洗,无水硫酸钠干燥,减压蒸发溶剂,得黄色固体1.1g,收率78.6%。将所得黄色固体溶于20ml二氯甲烷中,冰浴下缓慢加入戴斯马丁氧化剂(2.37g,5.60mmol),室温反应2h,反应结束后向反应液中加入饱和碳酸氢钠和饱和硫代硫酸钠溶液(v/v=1/1)调ph=7-8,向反应体系中加入二氯甲烷(25ml
×
3)萃取,有机层经水洗、饱和食盐水洗,无水硫酸钠干燥,减压蒸发溶剂,得黄色固体1.0g,收率90.9%。
[0073]
中间体:2-(2,6-二氧代哌啶-3-基)-4-(4-(哌嗪-1-基)哌啶-1-基)异吲哚啉-1,3-二酮盐酸盐(20)的制备
[0074]
将化合物18(1.0g,2.81mmol),1-叔丁氧羰基-哌嗪(2.1g,11.26mmol)溶于20ml二氯甲烷中,滴加冰乙酸2滴,冰浴下缓慢分次加入氰基硼氢化钠(0.88g,14.07mmol),室温搅拌2h。反应结束后,向反应体系中加入水、二氯甲烷(25ml
×
3)萃取,有机层经水洗、饱和食盐水洗,无水硫酸钠干燥,减压蒸发溶剂,快速柱层析(0.5%-2%甲醇/二氯甲烷),得黄色固体0.71g,收率71%。将所得黄色固体溶于15ml二氯甲烷中,冰浴下滴加1ml 4.0m氯化氢/二氧六环溶液,室温反应1h,反应结束后有固体析出。抽滤、干燥得黄色固体0.65g,收率91.5%。
[0075]
式i化合物(化合物zq-31):n1-(4-((5-(4-(1-(2-(2,6-二氧代哌啶-3-基)-1,3-二氧异吲哚啉-4-基)哌啶-4-基)哌嗪-1-基)-5-氧代戊基)氧基)苯乙基)-n3-羟基间苯二甲酰胺的制备:
[0076]
将化合物15a(100mg,0.21mmol)和20(105.1mg,0.23mmol)溶于dmf中,加入hatu(121.6mg,0.25mmol)、三乙胺(0.11ml,0.83mmol),室温搅拌4h。反应结束后,向反应液中加
入水,有沉淀析出,抽滤、干燥得黄色固体。将所得黄色固体溶于10ml二氯甲烷中,冰浴下滴加1ml 4.0m氯化氢/二氧六环溶液,室温反应1h,反应结束后减压蒸发溶剂,快速柱层析(2%-5%甲醇/二氯甲烷),得黄色固体38mg,收率18.5%。具体鉴定结果为:1h nmr(400mhz,dmso-d6)δ11.37(s,1h),11.09(s,1h),9.11(s,1h),8.75(s,1h),8.29(s,1h),8.00
–
7.84(m,2h),7.70(s,1h),7.53(s,1h),7.36(s,2h),7.15(d,j=7.1hz,2h),6.85(d,j=7.3hz,2h),5.17
–
5.02(m,1h),3.94(s,3h),3.81(s,3h),3.45(s,8h),2.99
–
2.73(m,6h),2.59(d,j=18.7hz,2h),2.41(s,2h),2.17(s,1h),2.04(s,1h),1.86(s,2h),1.68(d,j=29.3hz,5h).
13
c nmr(101mhz,dmso-d6)δ173.22,171.05,170.39,167.42,166.73,166.00,164.16,157.42,149.61,136.29,135.11,133.95,133.24,131.65,130.11,129.98,129.71,128.83,126.38,124.50,117.04,115.41,114.71,67.49,62.09,56.41,49.19,48.98,41.59,34.55,31.99,31.34,28.69,26.94,22.48,21.62.purity:96.9%by hplc(tr=9.57min).
[0077]
实施例3hdac8降解活性研究
[0078]
本发明所述化合物的hdac8降解活性采用如下方法测试所证明。这些效果表明本发明化合物可有效降解hdac8蛋白。具体测试方法如下:
[0079]
仪器试剂:hdac8一抗(购自abcam,epr10338(2));β-tubulin一抗(购自abcam,epr16778);兔抗(购自弗得生物,fdr007);鼠抗(购自弗得生物,fdm007);dmem培养基(购自gibco)。
[0080]
1.降解剂在hct-116细胞中降解hdac8活性测试
[0081]
铺板:6孔板中,每孔加入2
×
105个细胞,铺板后,向每孔中加入不同浓度的待测化合物溶液,至于37℃,5%co2孵箱中培养24h。
[0082]
准备蛋白样品:培养结束后,收集细胞加入含1%广谱蛋白酶抑制剂、磷酸酶抑制剂和pmsf的ripa裂解液,于冰上裂解15min后,13000
×
g,4℃离心10min,收集上清蛋白样品,用bca试剂盒进行蛋白定量,将稀释后的蛋白样品与1
×
loading buffer配置成浓度为1mg/ml的混合溶液,于100℃下加热变性5min,4℃下保存。
[0083]
western blot实验:
[0084]
1).配胶:配置不同浓度的sds-page凝胶。
[0085]
2).上样:将配置好的蛋白样品按10μl/孔加入sds-page凝胶上样孔中。
[0086]
3).电泳:蛋白样品在浓缩胶中电压为80v,待蛋白进入分离胶后,电压上调至120v继续电泳,待溴酚蓝达到分离胶底部时停止电泳。
[0087]
4).转膜:将电泳完毕的胶完整的放在盛有电转液的玻璃皿中,将滤纸、pvdf膜、凝胶按正极-海绵-双层滤纸-pvdf膜-凝胶-双层滤纸-海绵-负极安装在转膜夹中,冰浴下恒流300ma转膜75min。
[0088]
5).封闭:转膜完毕后,将pvdf膜取出,放入5%脱脂奶粉封闭液内,置于摇床(70转/分钟),室温封闭90min。
[0089]
6).一抗孵育:封闭结束后,将pvdf膜用tbst液洗涤5min
×
5次,加入按一定比例稀释的一抗,4℃下孵育过夜。
[0090]
7).二抗孵育:一抗孵育结束后,吸走一抗,将pvdf膜用tbst液洗涤5min
×
5次,按一抗种属(兔抗或鼠抗),加入按比例稀释的二抗,室温下孵育1h。
[0091]
8).显影:二抗孵育结束后,吸走二抗,将pvdf膜用tbst液洗涤5min
×
5次。显色时将ecl显影液均匀涂在pvdf膜上,置于成像分析系统中显影、拍照。
[0092]
数据处理:
[0093]
使用image j软件处理western blot实验所得图片,计算灰度值,通过hdac8和内参的灰度值计算hdac8的相对丰度。按下列公式计算hdac8降解率,降解率=(1-hdac8相对丰度)
×
100%。
[0094]
所测活性结果如表1所示:
[0095]
表1化合物zq-4、zq-5、zq-18、zq-23、zq-31的hdac8降解活性
[0096][0097]
上述实验结果显示,在5μm浓度下,化合物zq-4、zq-5、zq-18、zq-23、zq-31在人结肠癌细胞hct-116中均显示出有效的hdac8降解活性,效果均明显优于阳性对照品(brd73954)的降解活性。
[0098]
实施例4化合物zq-23对hdac8降解效率的时间梯度以及浓度梯度研究
[0099]
本发明所述化合物对hdac8降解效率的时间梯度以及浓度梯度采用实施例3所述测试方法证明。
[0100]
测试结果如图16所示,通过空白对照品(dmso)与化合物zq-23比较可知,化合物zq-23在给药2h后开始降解hdac8蛋白并在10h对hdac8降解达到最大(图16a)。为了测试zq-23对hdac8的降低效力,我们用不同测试浓度的化合物(0.1μm至160μm)处理hct-116细胞,hdac8水平如图16b所示。计算dc
50
和d
max
(图16c),结果表示化合物zq-23降解hdac8的dc
50
为147.6nm,d
max
为93.72%。在较高的浓度下,由于所谓的“hook效应”,靶蛋白降解通常削弱,我们发现化合物zq-23在≥40μm的浓度下观察到此效应(图16b)。
[0101]
实施例5化合物zq-23对hdac1、hdac3、hdac6、ac-α-tubulin、ac-smc3降解活性研究
[0102]
本发明所述化合物对hdac1、hdac3、hdac6、ac-α-tubulin、ac-smc3降解活性采用实施例3所述测试方法证明。hdac1一抗(购自abcam,ab19845);hdac3一抗(购自abcam,ab32369);hdac6一抗(购自abcam,ab133493)。
[0103]
测试结果如图17所示,通过空白对照品(dmso)与化合物zq-23比较可知,化合物zq-23在较高浓度下对hdac6有微弱的降解效果(图17a),其dc
50
为4.95μm,但是化合物zq-23在测试浓度下没有表现出对hdac1、hdac3的降解活性,此外化合物zq-23能够以剂量依赖方式增加ac-α-tubulin、ac-smc3水平(图17b)。
[0104]
实施例6化合物zq-23对hdac8蛋白降解的机制研究
[0105]
本发明所述化合物对hdac8蛋白降解的机制研究采用实施例3所述测试方法证明。具体实施方法如下:zq-37和zq-36、hdac6/8抑制剂brd73954、e3连接酶配体泊马度胺(图18a)或蛋白酶体抑制剂mg132、溶酶体酶抑制剂巴佛洛霉素a1或e3连接酶抑制剂(图18b)或dmso预处理hct-116细胞4小时,然后用5μm zq-23或dmso预处理10小时后测试对hdac8蛋白表达水平的影响。其中所述zq-36、zq-37均由zq-23改造获得,zq-36在结合crbn方面存在缺陷,而zq-37用thp基团取代异羟肟酸。
[0106]
测试结果如图18所示,正如预期的那样,zq-36和zq-37没有引起hdac8的降解,可能原因为zq-36泊玛度胺(poma)的n-甲基化而丧失结合crbn的能力,zq-37的异羟肟酸部分用thp保护,从而阻碍了异羟肟酸和hdac之间的相互作用。这一结果表明zq-23引起降解需要同时结合hdac8和crbn(图18a)。此外,单独用brd73954、poma(pomalidomide/泊玛度胺)或者用brd73954、poma与zq-23进行共处理也不能导致hct-116细胞中hdac8蛋白的降解(图18a),进一步表明poi-protac-e3三元复合物的形成对靶蛋白的降解起关键作用。最后,当zq-23与蛋白酶体抑制剂mg132或e3连接酶抑制剂组合使用时,zq-23丧失了降解hdac8的能力,而当zq-23与溶酶体抑制剂巴佛洛霉素a1一起使用时,保持降解活性(图18b),表明zq-23通过蛋白酶体途径介导hdac8降解而不是通过溶酶体途径介导。
[0107]
上面结合附图对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1