一种提高虫草素产量的蛹虫草液体发酵方法
1.本发明涉及一种提高虫草素产量的蛹虫草液体发酵方法,属于生物发酵技术领域。
背景技术:
2.蛹虫草(cordyceps militaris)为子囊菌门,肉座目,麦角菌科、虫草属的模式种,又叫北冬虫夏草,北虫草,是一种虫类重要药用真菌。中医认为,蛹虫草既能补肺阴,又能补肾阳,是一种能同时平衡、调节阴阳的中药。相较于冬虫夏草,蛹虫草具有以下两方面优点:一方面,人工条件下蛹虫草的子实体育成技术相对冬虫夏草更为成熟;另一方面,蛹虫草中的虫草素(cordycepin)生物合成相关基因的解析相对明了,cmcns1和cmcns2这两个直接参与虫草素合成代谢的基因于2017年在蛹虫草中被发现。虫草素又名蛹虫草菌素,化学名为3
’‑
脱氧腺苷(3
’‑
deoxyadenosine),是一种从蛹虫草中分离出来的核苷类抗生素。近二十多年来,人们在虫草素的各类抗肿瘤活性试验、虫草素对氧化应激引起的衰老改善、机体免疫功能的增强调节、抑制脂肪细胞分化预防肥胖发生、炎症抑制、人体外周血单核细胞生产il-10的作用、抗白血病活性和作用机理等领域的应用研究方面都取得了开创性的成果。虫草素多样的药理作用已经得到了公认,且目前高纯度的虫草素在国内市场的售价也已超过6000元/克,故拥有巨大的开发价值和广阔的市场前景。
3.常见的虫草素获取途径有三种:一是从天然蛹虫草子实体中提取;二是人工育成蛹虫草子实体后再提取;三是运用现代生物技术对蛹虫草菌丝体进行发酵后,从发酵获得的菌丝体或培养液中提取。不论天然蛹虫草子实体还是人工育成的蛹虫草子实体,其子实体产量级虫草素含量均相对较低,且工艺复杂、生产成本高,无法满足市场需要。而具有生产周期短、成本低等优势的液体深层发酵技术所生产的虫草素,其生物活性与野生蛹虫草中获得的虫草素基本一致,已成为获取虫草素的最经济的方法。虽然近几年液体深层发酵蛹虫草生产虫草素的技术取得了一定的进展,但该技术生产的虫草素仍不能满足日益倍增的虫草素产能需求。因此,如何通过优化生产工艺来降低生产成本或进一步提升虫草素产量最终提升经济效益,已成为虫草制品行业内一个亟待解决的技术难题。
4.除优化虫草素提取工艺及选育高产虫草素的蛹虫草菌株之外,业内普遍将关注点聚焦在通过控制温度、光照、ph、盐离子、营养物质、前体物及激素等方法来优化发酵条件,进而影响虫草素代谢并最终提高虫草素产量。而这些优化发酵条件所基于的发酵方法,仍是传统的液体发酵方法,如:
5.文献:夏永亮.虫草素生物合成机理研究.博士学位论文,中国科学院大学,2014.报道了虫草素的合成基因簇,并揭示一种能够实现高效的虫草素生物合成的方法。该方法是将蛹虫草中虫草素的合成基因簇异源表达至包含或能自体生成3'-amp的真菌,使之能够生产虫草素。但缺点是没有给出虫草素的具体产量或提升倍数。
6.文献:汤佳鹏,汪建雄.植物生长调节剂促进蛹虫草液体表面培养生产虫草素.报道了添加不同浓度的植物生长调节来提升虫草素产量的技术,但生产周期较长。
7.中国专利:陈萍等,申请号202110338257.8提供了一种过表达虫草素的重组蛹虫草,并从该菌株发酵液中分离提取虫草素的方法。该方法是对腺苷琥珀酸合酶基因、腺苷琥珀酸裂合酶基因或5'-核苷酸酶基因在蛹虫草中进行过表达重组。然后对转化子菌株的发酵培养液进行分离、纯化获取虫草素。但缺点是过表达重组的基因改造技术复杂操作难度较大,且发酵液中虫草素的产量较低。
技术实现要素:
8.本发明的目的在于针对现有虫草素发酵技术存在的种种不足,提供一种能显著提高蛹虫草发酵液中虫草素产量、且无需基因改造、无需添加虫草素前体、生产工艺简单、发酵时间相对较短的虫草素生产方法。
9.本发明提供了鱼藤酮在促进蛹虫草(cordyceps militaris)虫草素产量方面的应用。
10.在一种实施方式中,所述应用是在蛹虫草发酵过程中使用鱼藤酮促进虫草素的生产。
11.在一种实施方式中,所述鱼藤酮以1-10mg/l的终浓度添加至蛹虫草的发酵培养基中。
12.在一种实施方式中,所述鱼藤酮以二甲基亚砜为溶剂加入至发酵培养基中。
13.在一种实施方式中,所述蛹虫草购自中国普通微生物菌种保藏管理中心,保藏编号为ccgmc 3.14242。
14.本发明还提供一种提高虫草素产量的蛹虫草发酵方法,是将蛹虫草(cordyceps militaris)菌种,菌株保藏号为ccgmc 3.14242,在含鱼藤酮的发酵培养基中发酵。
15.在一种实施方式中,所述发酵培养基含有葡萄糖20g/l,动物组织胃蛋白酶水解物和胰酪胨等量混合物10g/l,ph=5.6
±
0.1。
16.在一种实施方式中,所述鱼藤酮的终浓度为1~10mg/l。
17.在一种实施方式中,所述发酵是在20~28℃,150~250r/min发酵至少5天。
18.在一种实施方式中,所述发酵是先在发酵培养基中发酵1~5天,再向培养基中补加终浓度为1~10mg/l的鱼藤酮,继续发酵。
19.在一种实施方式中,所述方法通过如下步骤进行:
20.1)将蛹虫草菌种接种到含葡萄糖、马铃薯浸出粉的种子培养基中,在25-28℃、转速为180-220r/min的摇瓶中发酵3-5天,获得蛹虫草的种子液;
21.2)将步骤1)制备的蛹虫草种子液用悬臂式电动搅拌机打匀后,取粒径小于0.1mm的菌体制备成浓度为1.0-2.0g/l(以菌体湿重计)的菌丝体悬浮液作为种子液;按体积比0.5-1.0%的比例将种子液转移接种到液体发酵培养基中,在25-28℃、转速为180-220r/min发酵1-5天;
22.3)补加终浓度为1-10mg/l的鱼藤酮后,在25-28℃、转速为180-220r/min的条件下继续发酵10-15天。
23.在一种实施方式中,所述种子培养基含有:葡萄糖20g/l,马铃薯浸出粉6g/l,ph=5.6
±
0.2。
24.本发明还提供所述方法在生产含虫草素的产品中的应用。
25.有益效果:
26.1)本发明通过在蛹虫草发酵一段时间后补加适量的鱼藤酮,可显著提高蛹虫草发酵液中虫草素的产量。相较于未添加鱼藤酮的传统发酵的产量189.66mg/l,鱼藤酮添加后产量高达804.69mg/l,虫草素总产量提高了324.28%。
27.2)本发明通过提升胞内3-磷酸甘油醛脱氢酶的酶活、增加[nadh/nad
+
]水平、增加虫草素生物合成基因cmcns1-3的转录水平以及增加腺嘌呤(腺苷酸)在核苷酸代谢中的占比,从这三个维度综合提升虫草素合成代谢。
[0028]
3)本发明的发酵工艺简单,无需通过基因改造等手段提升酶活;生产成本低,无需源源不断的补料腺嘌呤等虫草素合成所需底物,且本发明的方法发酵时间较短,工艺简单,生产效率相比现有方法明显提高,适合工业化生产。
附图说明
[0029]
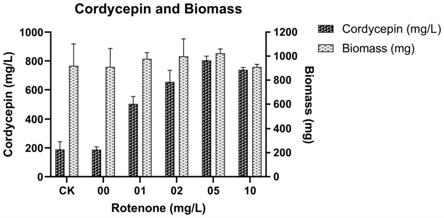
图1是在实施例1~3的方式下不同浓度鱼藤酮对虫草素产量及生物量影响的结果图;其中,00表示实施例2添加不含鱼藤酮的dmso组;01、02、05、10依次表示添加以dmso为溶剂的终浓度分别为1mg/l、2mg/l、5mg/l以及10mg/l鱼藤酮的实验组。
[0030]
图2是鱼藤酮对虫草素发酵曲线及糖耗曲线影响的结果图。
[0031]
图3是在实施例4的实施方式下鱼藤酮对蛹虫草胞内[nadh/nad
+
]水平及3-磷酸甘油醛脱氢酶活影响的结果图。
[0032]
图4是基于荧光定量pcr验证获得的鱼藤酮对蛹虫草胞内虫草素合成基因cmcns1-3转录水平影响的结果图。
[0033]
图5是基于转录组分析获得的鱼藤酮对蛹虫草中核苷酸代谢相关基因影响的结果图。
[0034]
图6是基于转录组分析获得的鱼藤酮对蛹虫草中糖酵解、糖异生及无氧呼吸相关基因影响的结果图。
[0035]
图7是基于转录组分析获得的鱼藤酮对蛹虫草中三羧酸循环相关基因影响的结果图。
[0036]
图8是在实施例5的方法下转录组质量控制的结果图。
具体实施方式
[0037]
鱼藤酮母液的制备及补加方法为:在干燥环境下分别称取不同重量的鱼藤酮粉末,随后使用二甲基亚砜充分溶解鱼藤酮粉末并定容,使鱼藤酮浓度分别精确至2g/l、4g/l、10g/l以及20g/l(误差≤1%);使用0.22μm尼龙微孔过滤器过滤后即获得鱼藤酮母液;补加鱼藤酮至发酵培养基时,需在轻摇或搅拌培养基的同时缓慢加入鱼藤酮母液。
[0038]
检测方法:
[0039]
使用三层无纺布过滤全部发酵物,滤液即为发酵液粗样品,滤渣即为菌丝体粗样品;高速离心发酵液粗样品后取上清液,经0.22μm聚醚砜微孔过滤器过滤即获得发酵液待测试样。
[0040]
生物量的检测:将菌丝体粗样品用单蒸水洗涤三次后置于60℃鼓风干燥箱烘干,烘至恒重时的重量即为菌丝体的生物量。
[0041]
虫草素含量检测:使用高效液相色谱法(ny/t 2116-2012)定量发酵液待测试样中的虫草素含量,上清经液0.22μm聚醚砜微孔过滤器过滤后即获得待测试样;其中流动相在脱气或使用前需用磷酸调ph=4.0
±
0.1,色谱柱为日本岛津公司的shim-pack gist c18色谱柱(型号:227-30017-07);使用苏州科铭生物技术有限公司的还原糖含量测试盒(货号:hyt-1-y)定量发酵液待测试样中的还原糖含量,其中检测仪器为美谷分子仪器(上海)有限公司的spectramax abs plus。
[0042]
实施例1
[0043]
采用中国普通微生物菌种保藏管理中心保藏的蛹虫草(cordyceps militaris)菌种进行发酵,菌株保藏号为ccgmc 3.14242。
[0044]
种子培养基采用青岛海博生物公司生产的马铃薯葡萄糖水(货号:hb0233-4),主要成分为:葡萄糖20g/l,马铃薯浸出粉6g/l;
[0045]
液体发酵培养基采用青岛海博生物公司生产的沙氏葡萄糖液体培养基(货号:hb0253-71),培养基主要成分为:葡萄糖20g/l,动物组织胃蛋白酶水解物和胰酪胨等量混合物10g/l,ph=5.6
±
0.2。
[0046]
将蛹虫草菌丝块接种于含100ml种子培养基的250ml摇瓶中,在发酵温度为25℃、转速为200r/min的回转式摇瓶柜中发酵4天,获得蛹虫草菌株的种子菌丝培养物。用搅拌机将培养物打匀后,取粒径小于0.1mm的菌丝体以无菌水调成浓度为1.0g/l(以菌体湿重计)的菌丝体悬浮液,然后接种1ml菌丝体悬浮液于含100ml发酵培养基的250ml摇瓶中。发酵温度为25℃,转速为200r/min。发酵15天,期间每天收集0.5-1.0ml发酵液用于检测。待结束发酵后,收获剩余发酵物用于检测。
[0047]
结果如图1、图2中ck组所示,其中发酵结束后的生物量为919.90
±
181.767mg,虫草素产量为189.66
±
53.48mg/l。
[0048]
实施例2
[0049]
菌株、种子培养基和液体发酵培养基以及接种方法同实施例1,区别在于,控制发酵温度为25℃,转速为200r/min,先发酵1天,然后一次性补加50μl的二甲基亚砜于发酵液中,相同条件下继续发酵14天,期间每天收集0.5-1.0ml发酵液用于检测。待结束发酵后,收获剩余发酵物用于检测。
[0050]
结果如图1、图2中0mg/l组所示,其中生物量为910.67
±
153.47mg,虫草素产量为188.21
±
20.38mg/l,可见0.5
‰
的二甲基亚砜添加量不会对蛹虫草的发酵产生明显影响。
[0051]
实施例3
[0052]
菌株、种子培养基和液体发酵培养基组成以及接种方法同实施例1,区别在于,控制发酵温度为25℃,转速为200r/min,先发酵1天,然后分别一次性补加50μl含不同浓度(2g/l、4g/l、10g/l以及20g/l)的鱼藤酮母液(溶剂为二甲基亚砜)于发酵液中,使鱼藤酮终浓度分别为1mg/l、2mg/l、5mg/l以及10mg/l,相同条件下继续发酵14天。待结束发酵后,分别收获剩余发酵物。
[0053]
结果如图1、图2中1mg/l、2mg/l、5mg/l以及10mg/l组所示,其中各浓度下的生物量分别为977.10
±
52.16mg、998.43
±
146.40mg、1024.27
±
35.95mg以及909.53
±
23.31mg,虫草素产量分别为501.87
±
52.44mg/l、654.64
±
81.58mg/l、804.69
±
29.45mg/l以及738.36
±
17.72mg/l。
[0054]
实施例4
[0055]
菌株、种子培养基和液体发酵培养基组成以及接种方法同实施例1,区别在于,发酵温度为25℃,转速为200r/min,先发酵5天,然后分别一次性补加超纯水和浓度为10g/l的鱼藤酮母液50μl于发酵液中(两组分别命名为ck组和rotenone组),相同条件下继续发酵6h。待结束发酵后,收获剩余发酵物。
[0056]
使用三层无纺布过滤全部发酵物,滤渣即为菌丝体粗样品;将菌丝体粗样品用单蒸水洗涤三次后用滤纸将水分尽量吸干,随后将菌丝体按照后续需求的使用量称重分装。
[0057]
分别使用上海碧云天生物技术有限公司的nad+/nadh检测试剂盒(wst-8法,货号:s0175)、nadp+/nadph检测试剂盒(wst-8法,货号:s0179)以及苏州科铭生物技术有限公司的3-磷酸甘油醛脱氢酶试剂盒(货号:gapdh-1-y)对菌丝体的nadh/nad+、nadph/nadp+以及gapdh酶活进行检测。结果如图3所示,其中rotenone组和ck组的nadh/nad+比值分别为1.452
±
0.068和0.598
±
0.082,nadph/nadp+比值分别为1.342
±
0.313和0.561
±
0.150,rotenone组和ck组的gapdh酶活分别为425.864
±
8.296nmol/min/g和675.083
±
16.366nmol/min/g——rotenone组的nadh/nad+比值、nadph/nadp+比值以及gapdh酶活相较于ck组分别提升142.809%、139.216%以及58.521%。
[0058]
实施例5
[0059]
菌株、种子培养基和液体发酵培养基组成以及接种方法同实施例1,区别在于,发酵温度为25℃,转速为200r/min,先发酵1天,然后分别一次性补加超纯水和浓度为10g/l的鱼藤酮母液50μl于发酵液中(使发酵液中鱼藤酮终浓度为5mg/l),两组分别命名为ck组和rotenone组,相同条件下继续发酵3.5天。待结束发酵后,收获剩余发酵物。
[0060]
使用三层无纺布过滤全部发酵物,滤渣即为菌丝体粗样品;将菌丝体粗样品用单蒸水洗涤三次后用滤纸将水分尽量吸干,随后将菌丝体液氮速冻。分别使用美国invitrogen公司的trizol
tm
试剂盒(货号:15596026)和superscript
tm
ii逆转录试剂盒(货号:18064014)进行rna抽题及逆转录;使用illumina公司的truseq stranded mrna library prep试剂盒(货号:rs-122-2101)和hiseq x ten测序系统进行cdna文库构建及转录组测序。
[0061]
使用湖南艾科瑞生物工程有限公司的green premix pro taq hs qpcr试剂盒(货号:ag11701)进行荧光定量pcr;cmcns1基因的定量上游引物序列为5
’‑
gcgaacccacgatctgcacaagccctaca-3’,下游引物序列为5
’‑
ccatcatggactgcgtgaggtgcggataca-3’;cmcns2基因的定量上游引物序列为5
’‑
tcgcagccctgctccatgacattgacatttctcaca-3’,下游引物序列为5
’‑
gcatctccaccagcggaaagaaacagctcttcttca-3’;cmcns3基因的定量上游引物序列为5
’‑
cacgctgcggcttgctgacgacgac-3’,下游引物序列为5
’‑
gccgtgatacgccgctagttcctgatgacc-3’;内参基因(cmactin)的定量上游引物序列为5
’‑
caacaacttcctgacgggc-3’,下游引物序列为5
’‑
tccttgggcttctgctgac-3’。
[0062]
荧光定量pcr及转录组测序结果如图4~图8所示,其中rotenone组中虫草素合成基因cmcns1-3的转录水平相较于ck组分别提升了501.35%、1379.53%以及1677.89%;同时在核苷酸代谢中rotenone组相较于ck组具有更高的腺嘌呤(腺苷酸)合成的占比,该数据表明,鱼藤酮的添加能通过上调腺苷酸合成相关基因并下调鸟苷酸、尿苷酸和胞苷酸的合成相关基因,进而使蛹虫草体内的核苷酸代谢流更偏向腺嘌呤(腺苷酸),从而无需在发酵
过程中额外添加腺嘌呤等虫草素代谢所需的特异性底物。此外较于ck组,rotenone组在三羧酸循环路径中的相关基因呈明显下调趋势,而糖酵解及无氧呼吸径中的相关基因则与此相反明显上调趋势。
[0063]
对比例1:
[0064]
参照论文《谷胱甘肽促进液体发酵体系中蛹虫草合成虫草素》中的方法,向发酵培养基中添加谷胱甘肽(glutathione,gsh),并控制发酵培养基中的gsh的终浓度分别为0.5、1.0、2.0及3.0g/l。结果显示,发酵15天的生物量和发酵20天的虫草素含量分别为14.45
±
0.63g/l和439.69
±
12.43mg/l,gsh添加3.0g/l组发酵15天的cmcns1-2转录水平与ck组相比分别提升540.67倍和25.81倍。可见,该方法不论虫草素的终产量还是虫草素合成基因cmcns2的转录水平均远低于本方法,且添加剂量及成本大,生产周期长达20天,是本发明的1.33倍。
[0065]
对比例2:
[0066]
参照论文《添加前体物对虫草素产量的影响及动力学特征》中的方法,分别向发酵培养基中添加1.5g/l的腺苷、2.5g/l的苯丙氨酸、1.5g/l的腺嘌呤、2.5g/l的甘氨酸和2.5g/l的l-谷氨酰胺。结果显示,发酵20天的虫草素产量分别为772.5mg/l、661.7mg/l、103.5mg/l、149.6mg/l和174.0mg/l,虫草素终产量低于本方法,且添加剂量及成本大、生产周期长达20天,是本发明的1.33倍。
[0067]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1