一种Baeyer-Villiger单加氧酶及其用途
一种baeyer-villiger单加氧酶及其用途
技术领域
1.本发明属于生物技术领域,具体涉及一种baeyer-villiger单加氧酶及其用途。
背景技术:
2.龙涎醚是来源于抹香鲸的名贵香料龙涎香的主要香味成分。由于龙涎香的天然来源越来越稀少,且很多国家目前已立法禁止龙涎香交易,龙涎醚已取代龙涎香作为定香剂和致香剂被应用于香水、高端日化产品、香烟等产品中,具有很高的市场价值。目前龙涎醚的主要来源是以植物提取的天然产物香紫苏醇为原料,进行化学氧化、还原、环化三步反应,先后形成香紫苏内酯和香紫苏二醇,最终产生龙涎醚,如图2所示。除了化学法以外,也可以用生物转化—化学催化结合的方式进行龙涎醚的生产:一种是利用真菌cryptococcus albidus atcc 20918以化合物(1)为原料发酵生产化合物(2)(us005212078a,1993),随后以化合物(2)为原料通过化学法生产化合物(4);另一种方式是用真菌hyphozyma roseoniger atcc 20624以化合物(1)为原料生产化合物(3)(us4798799a,1989),再以化合物(3)为原料通过化学法生产化合物(4)。
3.化学-酶法合成龙涎醚近年来也有报道,来源于酸热脂环酸杆菌(alicyclobacillus acidocaldarius)的角鲨烯藿烯环化酶(squalene hopene cyclase,shc)可催化16碳前体(3e,3e)-homofarnesol发生环化反应直接生成龙涎醚(advanced synthesis&catalysis 2018,360,2339-2351)。该方法目前主要存在两个问题:首先,(3e,3e)-homofarnesol需以橙花叔醇为原料经四步化学反应合成(us9758500b2,2017),成本较高且产率较低;其次,shc催化的反应会产生气味远远低于龙涎醚的同分异构体。因此,龙涎醚的合成方法仍有较大的改进空间。
技术实现要素:
4.本发明的目的是提供一种真菌来源的baeyer-villiger氧化酶,该酶及表达该酶的工程菌株均能够催化香紫苏醇衍生物发生baeyer-villiger氧化反应生成乙酸酯,后续可通过温和易发的酯键水解、脱水缩合反应生产龙涎醚。为龙涎醚的合成开辟了新的途径。
5.为实现上述目的,本发明首先采用的技术方案是:一种baeyer-villiger单加氧酶,该酶的氨基酸序列如seq id no.1所示。
6.进一步地,本发明还提供所述baeyer-villiger单加氧酶的编码基因,其核苷酸序列如seq id no.2所示。
7.进一步地,本发明还提供一种包含所述baeyer-villiger单加氧酶的编码基因的表达载体。
8.进一步地,本发明还提供一种表达所述baeyer-villiger单加氧酶的工程菌,所述工程菌包含所述的表达载体或所述编码基因。
9.进一步地,本发明还提供一种baeyer-villiger单加氧酶的用途,该酶在制备龙涎醚的过程中,用于催化香紫苏醇衍生物发生baeyer-villiger氧化反应。
10.进一步地,本发明还提供一种化学-酶法生产龙涎醚的方法,该方法包括:利用所述的baeyer-villiger单加氧酶催化香紫苏醇衍生物发生baeyer-villiger氧化反应生成乙酸酯,后续通过酯键水解、脱水缩合反应生产龙涎醚;其中,反应体系中,酶与底物的摩尔比为1:4~1:50。
11.与现有技术相比,本发明具有的有益效果在于:
12.1.提供一种新型的baeyer-villiger单加氧酶及表达该酶的工程菌;
13.2.baeyer-villiger单加氧酶能够催化香紫苏醇衍生物发生baeyer-villiger氧化反应,为龙涎醚的生产提供了新途径;
14.3.提供一种新的化学-酶法生产龙涎醚的方法,该方法条件温和,成本低廉。
附图说明
15.图1为本发明提供的化学-酶法生产龙涎醚过程中化合物(5)在hrbvmo催化下发生的bayer-villiger氧化反应;
16.图2为现有龙涎醚的化学合成及本发明提供的化学-酶法合成路径;其中a,b,c,d,e,g均为已知反应,f为本发明提供的hrbvmo催化的bayer-villiger氧化反应;
17.图3为hrbvmo的表达质粒图谱;
18.图4为纯化后的hrbvmo的sds-page分析,图中:m.蛋白marker;1.hrbvmo蛋白,理论分子量大小为81kda。
19.图5为化合物(5)和化合物(6)标准品的高分辨质谱检测;图中,a:化合物(5);b:化合物(6);
20.图6为化合物(5)和化合物(6)的1h核磁共振图谱;图中,a:化合物(5);b:化合物(6);
21.图7为化合物(5)在hrbvmo催化下反应产物的gc-ms/ms鉴定;a.化合物(6)标准品的离子色谱图;b.化合物(6)标准品离子碎片谱;c.化合物(5)在hrbvmo催化下反应产物的离子色谱图;d.化合物(5)在hrbvmo催化下反应产物离子碎片谱;
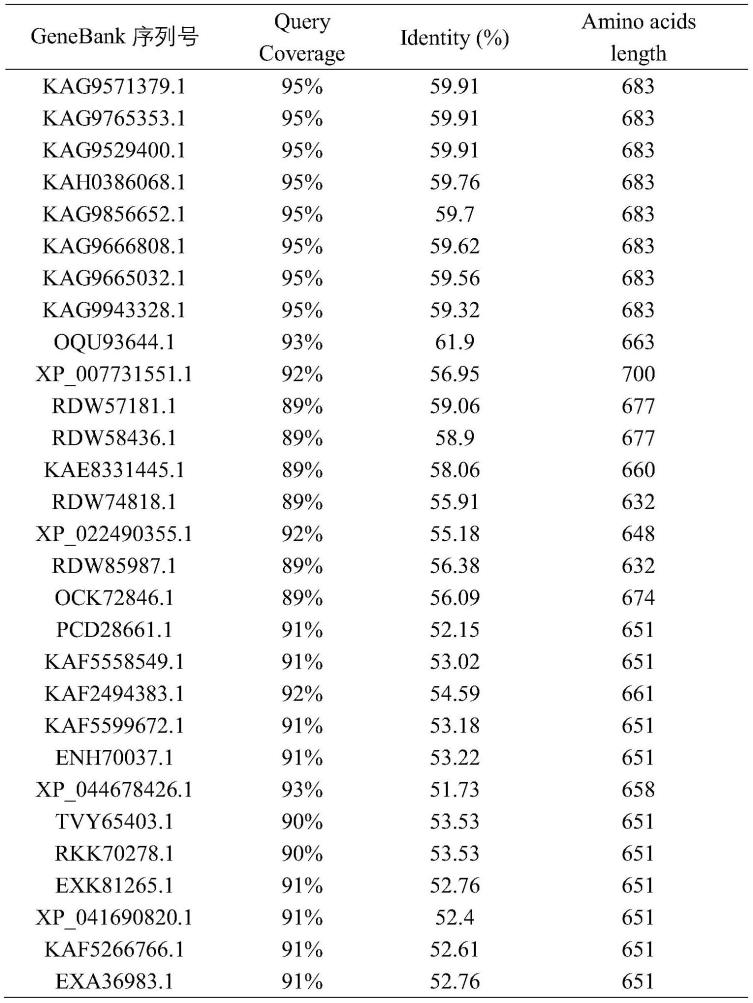
22.图8为化合物(5)在hrbvmo催化下反应产物的高分辨lc-ms检测;a.反应产物中提取离子流色谱图;b.a图中提取到的离子峰处的质谱检测到与化合物(6)理论分子量一致的离子峰。
具体实施方式
23.为了便于理解本发明,下面结合附图和具体实施例,对本发明进行更详细的说明。附图中给出了本发明的较佳的实施例。但是,本发明可以以许多不同的形式来实现,并不限于本说明书所描述的实施例。相反地,提供这些实施例的目的是使对本发明公开内容的理解更加透彻全面。
24.实施例1 baeyer-villiger单加氧酶hrbvmo的基因与氨基酸序列分析
25.通过对真菌hyphozyma roseonigra atcc 20624(购自american type culture collection)基因组测序及数据挖掘获得一个长度为2124个碱基的编码基因,该基因编码一个长度为707个氨基酸的蛋白,命名为hrbvmo。该编码基因序列如seq id no.2所示,蛋白的氨基酸序列如seq id no.1所示。
26.通过对该蛋白hrbvmo进行pfam分析(在线工具地址http://pfam.xfam.org/)发现,该蛋白属于flavin-containing monooxygenase(fmo)蛋白家族,因此其催化反应时需要黄素腺嘌呤二核苷酸(fad)作为辅因子。随后,在uniprot数据库(www.uniprot.org)中对该蛋白进行功能预测,与其一致性最高且有功能研究报道的蛋白为4-羟基苯乙酮单加氧酶(序列号:q93tj5),该酶能够催化4-羟基苯乙酮发生bayer-villiger氧化反应生成4-乙酰氧基苯酚,hrbvmo与该酶的序列一致性为36%。
27.为了确定hrbvmo氨基酸序列的新颖性,本发明课题组通过在线blast(https://blast.ncbi.nlm.nih.gov/blast.cgi)在genbank中搜索它的同源蛋白并按序列相似性排列,表1中所列的为genebank数据库中与hrbvmo一致性最高的30个序列,其中只有一个蛋白的基因序列与hrbvmo一致性大于60%,其余29个蛋白均低于60%。该分析结果说明hrbvmo蛋白为从未公开过的蛋白序列。
28.表1.genebank中与hrbvmo编码基因一致性最高的前30个蛋白的基因序列
29.30.实施例2 hrbvmo的克隆
31.以hyphozyma roseonigra atcc 20624(购自american type culture collection)菌落为模板,以bv-f及bv-r为引物对hrbvmo的编码基因片段进行扩增。采用takara公司的primestar max dna polymerase,按照试剂盒说明书配置反应体系。
32.扩增程序为:
[0033][0034]
以pet28a为模板,28a-f及28a-r为引物对pet28a进行线性化扩增。
[0035]
扩增程序为:
[0036][0037]
以上扩增引物序列如表2所示。
[0038]
表2.hrbvmo编码基因克隆至pet28a的引物及其序列
[0039][0040]
将获得的hrbvmo编码基因片段与线性化的pet28a载体片段利用无缝克隆试剂盒进行连接形成表达载体pet28a-hrbvmo,图谱如图3所示。将上述表达载体转化至大肠杆菌表达菌株escherichia coli rosseta-gami 2(de3),获得表达菌株rg2-hrbvmo。菌株rg2-hrbvmo表达c端带有组氨酸纯化标签的hrbvmo蛋白,可通过ni-nta亲和层析柱进行蛋白纯化。
[0041]
实施例3 hrbvmo蛋白的表达与纯化
[0042]
挑取rg2-hrbvmo单克隆接到培养基中(含有50μg/ml卡那霉素和10μg/ml氯霉素双抗性)进行种子液培养,37℃、220rpm摇床培养8-12h;扩大培养的比例为1:500~1:100,37℃、220rpm摇床培养约4h,当od
600
达到0.6~0.8时加入iptg开始诱导,iptg终浓度可以为0.2~1mm。诱导条件为18~30℃诱导18-24h。将诱导结束的菌液在4℃、3000~6000g条件下离心10min,收集菌体。
[0043]
收集的菌体用50ml预冷的lysis buffer重悬,在冰浴中利用超声破碎仪对菌体进
行破碎,破碎程序为功率为290w,超声破碎4s,停止8s,超声总时长为15min。在4℃13000g 60min条件下离心取上清,上清液与3ml ni-nta树脂在4℃的下孵育1小时使目标蛋白与树脂充分结合,先后用15ml lysis buffer和15ml wash buffer冲洗,用5ml elution buffer洗脱收集目标蛋白,用ultracel-30k的超滤管对洗脱液浓缩至2.5ml。将脱盐柱pd-10用25ml desalting buffer平衡,将2.5ml浓缩蛋白液加入到脱盐柱pd-10中,加入3.5ml的desalting buffer收集蛋白,用分光光度计测定纯化蛋白质的浓度为2mg/ml,取10μl蛋白用于sds-page检测,检测结果如图4所示。剩余蛋白用液氮速冻并保存于-80℃。
[0044]
上述蛋白纯化各缓冲液配方:
[0045]
lysis buffer(1l):6g nah2po4、17.5g nacl、100g甘油,0.68g咪唑,ph 8.0。
[0046]
wash buffer(1l):6g nah2po4、17.5g nacl、100g甘油,1.36g咪唑溶,ph 8.0。
[0047]
elution buffer(1l):6g nah2po4、17.5g nacl、100g甘油,17.02g咪唑,ph 8.0。
[0048]
desalting buffer(1l):6g nah2po4、100g甘油,ph 7.4。
[0049]
实施例4 hrbvmo蛋白的功能鉴定
[0050]
(1)hrbvmo蛋白的底物与产物标准品的制备
[0051]
作为验证hrbvmo蛋白功能的底物与产物,化合物(5)(香紫苏酮)和化合物(6)(香紫苏二醇乙酸酯)均通过化学法合成。其中化合物(5)的合成条件依据参考文献synthetic communications 2004,34,3631
–
3643,化合物(6)的合成条件依据参考文献chemistry of natural compounds 2011,47,574
–
578,合成并纯化后的化合物(5)和化合物(6)经高分辨质谱(如图5所示)及核磁共振1h谱(如图6所示)鉴定,确认与参考文献吻合,具体数据如下:
[0052]
化合物(5):高分辨质谱分子量303.2295([m+na]
+
,理论值303.2295)。
[0053]1h nmr(600mhz,cdcl3,δ,ppm,j/hz):0.79(6h,s),0.86(3h,s),1.15(3h,s),1.08
–
1.88(2h,m),2.13(3h,s),2.59(1h,ddd,j=5.7,7.8,17.8),2.65(1h,dd,j=7.8,17.8).
[0054]
化合物(6):高分辨质谱分子量319.2248([m+na]
+
,理论值319.2244)。
[0055]1h nmr(600mhz,cdcl3,δ,ppm,j/hz):0.79(6h,s),0.86(3h,s),1.15(3h,s),1.08
–
1.88(2h,m),2.13(3h,s),2.59(1h,ddd,j=5.7,7.8,17.8),2.65(1h,dd,j=7.8,17.8).
[0056]
以上核磁数据与参考文献一致。
[0057]
(2)hrbvmo蛋白催化香紫苏醇衍生物发生bayer-villiger氧化反应的产物鉴定
[0058]
hrbvmo蛋白催化的反应如图1所示,具体过程如下:
[0059]
2.8mg化合物(5)溶于二甲基亚砜(dmso)制成10mm底物母液,50mm nah2po
4-nah2po
4 ph 7.5作为反应缓冲液。
[0060]
反应体系:fad 30μm,nadph 1mm,gdh 1μm,葡萄糖10mm,化合物(5)100μm,hrbvmo 10μm(终浓度),总体积200μl。反应5小时后用200μl乙酸乙酯萃取,产物用于后续检测。对照样品与以上反应样品相同处理,唯一不同点在于所用酶为100℃处理10min失活后的hrbvmo。
[0061]
反应产物首先在气相色谱(gc-ms/ms)上进行检测,所用仪器型号为thermo q exactive
tm gc orbitrap
tm gc-ms/ms。检测结果如图7所示,化合物(5)在hrbvmo催化下反应生成出峰时间(28.04min)及离子碎片(图7中c、d所示)与化合物(6)(如图7中a、b所示)相同的物质,证明其产物为化合物(6)。随后,将样品与对照的样品用氮吹仪吹干后用40%甲醇溶解,进行高分辨lc-ms分析,如图8所示,从反应样品中可提取到化合物(6)的离子峰。由
gc-ms/ms和lc-ms结果可以确定,hrbvmo能够催化香紫苏酮发生bayer-villiger反应生成香紫苏二醇乙酸酯。该结果为hrbvmo应用于龙涎醚的合成提供了有力的证据。
[0062]
本发明提供的化学-酶法生产龙涎醚的方法中,化合物(5)的生产可通过起始原料香紫苏醇进行一步氧化生产,其报道的最高产率为90%(tetrahedron 1993,49,10405
–
10412;tetrahedron 2011,67,1142
–
1144;chemistry of natural compounds 2021,57,101
–
110.),而后续的酯键水解及环化均为环境友好、成本低廉的反应,因此本发明对于龙涎醚合成方法的改进具有重要意义,能够带来显著的经济效益。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1