一种食管上皮细胞癌前病变细胞模型的构建方法
1.本发明涉及细胞模型构建方法领域,尤其是一种食管上皮细胞癌前病变细胞模型的构建方法。
背景技术:
2.国际癌症研究机构报告显示,全球食管癌发病率在所有癌症中排名第七,总死亡率在所有癌症中排名第六,环境、饮食习惯、生活方式在食管癌的发生过程中起着重要作用,其中,霉菌毒素感染被认为是中国食管癌高发区居民食管癌发生的重要危险因素之一。黄曲霉毒素b1是食物中最常见的也是毒性最大的霉菌毒素,且在1993年af b1被iarc定义为i类致癌物。一项病例对照研究表明,黄曲霉毒素b1的高暴露可能是中国淮安(食管癌高发区)食管癌前病变的重要危险因素。近年来,有关食管癌前病变细胞模型的建立方法极少见到,大多使用甲基苄基亚硝胺诱导建立食管癌前病变动物模型,为此,本发明提出了一种食管上皮细胞癌前病变细胞模型的构建方法。
技术实现要素:
3.为解决现有技术中的问题,本发明提出了一种食管上皮细胞癌前病变细胞模型的构建方法。
4.为了实现上述目的,本发明采用了如下技术方案:
5.一种食管上皮细胞癌前病变细胞模型的构建方法,包括如下步骤:
6.步骤一,培养heec;
7.步骤二,染毒处理:将afb1粉末溶于dmso中得到10mmol/l的混合液,再加入完全培养液稀释混合液得到1μmol/lafb1染毒液;
8.将所述heec以40%密度接种25cm2培养瓶中,培养过夜,待heec贴壁恢复形态后进行afb1处理,传代,此为afb1处理第一代细胞,待细胞恢复形态贴壁过夜后,重复进行afb1处理,重复培养30代,其中每处理5代,对相应细胞进行液氮冻存,所述afb1处理为在heec中加入1μmol/lafb1染毒液培养48-72小时。
9.进一步地,所述培养heec的步骤为:将heec置于完全培养液中并置于5%co2、37℃的培养箱中,所述完全培养液包括高糖dmem培养液、fbs和双抗,高糖dmem培养液:fbs:双抗的体积比为10:1:0.1,双抗为100u/ml的链霉素和100u/ml的青霉素。
10.进一步地,所述构建方法包括采用cck8法检测染毒处理后的heec活力。
11.进一步地,检测染毒处理后的heec活力的步骤包括如下:将heec以6
×
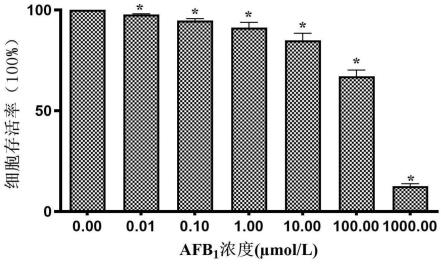
103个/孔密度接种于96孔板中,每孔体积100μl,置于37℃、5%co2培养箱内培养;24h后,板内分别加入100μl含0、0.01、0.1、1、10、100、1000μmol/l的afb1培养液,每组5个复孔,并设置空白孔染毒24h;后弃去培养液,换成100μl完全培养液,随即每干预孔贴壁加入10μl cck8溶液,培养箱内孵育1.5h,置于酶标仪cck8模式下测定各孔od值,记录结果取平均值。
12.进一步地,检测染毒处理后的heec活力的步骤包括检测afb1干预后每隔5代细胞
活力:将含afb1培养液染毒的第5、10、15、20、25、30代的细胞以6
×
103个/孔密度接种于96孔板中,每孔体积100μl,置于37℃、5%co2培养箱内培养48h后,弃去培养液,换成100μl完全培养液,随即每干预孔贴壁加入10μl cck8溶液,小心避免产生气泡,培养箱内孵育1.5h,置于酶标仪cck8模式下测定各孔od值,记录结果取平均值。
13.进一步地,所述构建方法包括计算细胞存活率:细胞存活率=(试验组od-空白组od)/(对照组od-空白组od)
×
100%。
14.进一步地,所述构建方法包括采用流式细胞术检测细胞周期。
15.进一步地,所述构建方法包括采用流式细胞仪检测细胞凋亡、采用transwell法检测细胞的迁移能力、采用transwell法检测细胞的侵袭能力。
16.进一步地,采用transwell法检测细胞的侵袭能力包括:用无fbs的培养液稀释matrigel胶,稀释比例为1:8;小室每孔加50μl稀释液,4℃冷藏静置,至第二天实验使用;将未染毒的heec、afb1染毒30代的细胞用胰酶消化后离心,用不含fbs的培养液调整各组细胞密度为3
×
105个/孔,在铺好胶的上室加入200μl细胞悬液,下室加入600μl含50%fbs的培养液。
17.本发明的有益效果:
18.本发明公开了一种食管正常上皮细胞(heec)经黄曲霉毒素b1(afb1)长期干预为食管癌前病变细胞模型的方法,建立方法为:使用1μmol/lafb1溶液长期连续干预heec至第30代,采用cck8法来检测afb1染毒不同代数的heec活力的影响,采用流式细胞仪检测不同代数细胞的细胞凋亡、细胞周期,采用transwell法检测染毒30代细胞的侵袭、迁移能力,采用western blot法检测emt相关蛋白(e-cadherin、n-cadherin)、细胞周期相关蛋白(cyclin a2、cyclin d1及cdk2)的表达。本发明进一步探索afb1在食管癌发生过程的相关分子机制,为食管癌的病因学研究奠定基础,为防止食品中afb1对食管的毒性提供一定的理论依据。
附图说明
19.图1是本发明采用cck8法检测heec的活力情况的关系示意图;
20.图2是本发明采用cck8法检测heec的增殖情况的关系示意图;
21.图3是本发明采用流式细胞术检测heec的细胞周期情况的关系示意图;
22.图4是本发明采用流式细胞术检测heec的细胞凋亡情况的关系示意图;
23.图5是本发明采用transwell法检测heec迁移能力的关系示意图;
24.图6是本发明采用transwell法检测heec侵袭能力的关系示意图;
25.图7是本发明整体流程示意图。
具体实施方式
26.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
27.本发明中各缩写指代的含义为:heec:食管正常上皮细胞,afb1:黄曲霉毒素b1,pbs:磷酸盐缓冲溶液,dmso:二甲基亚砜,dmem:dulbecco's modified eagle medium;
28.一种食管上皮细胞癌前病变细胞模型的构建方法,如图7所示,用afb1长期连续干
预heec,具体方法:
29.(1)细胞培养
30.用高糖dmem培养液、fbs(胎牛血清)、双抗(100u/ml链霉素、100u/ml青霉素)配制细胞培养液,三者比例为10:1:0.1,置于5%co2、37℃培养箱中,用配好的完全培养液培养heec,待细胞密度达80-90%,即可进行传代、实验或冻存等操作。
31.(2)染毒处理
32.①
配置afb1染毒液母液:将afb1粉末溶于dmso,浓度为10mmol/l,若长期使用,可放置于4℃冰箱内。
33.②
长期afb1染毒处理:根据前期cck8细胞增殖实验结果,确定afb1染毒浓度为1μmol/l,诱导细胞恶性转化。用完全培养液将其稀释成1μmol/l,现配现用。细胞以约40%密度接种25cm2培养瓶,培养过夜,待细胞贴壁恢复形态后,用含1μmol/l afb1的dmem培养液培养48-72小时后传代,此为afb1处理第一代细胞,待细胞恢复形态贴壁过夜后,重复进行相同的afb1处理,如此重复培养30代。其中每处理5代,对相应细胞进行液氮冻存。
34.可用cck8法检测该细胞的活力及增殖情况。
35.(1)测afb1干预后heec活力
36.将heec以6
×
103个/孔密度接种于96孔板中,每孔体积100μl,置于37℃、5%co2培养箱内培养。24h后,板内分别加入100μl含0、0.01、0.1、1、10、100、1000μmol/l的afb1培养液,每组5个复孔,并设置空白孔(不含细胞,只含培养液,为去除背景值)染毒24h;后弃去培养液,换成100μl完全培养液,随即每干预孔贴壁加入10μl cck8溶液,小心避免产生气泡,培养箱内孵育1.5h,置于酶标仪cck8模式下测定各孔od值,记录结果取平均值。
37.按上述操作步骤重复进行3次实验。计算细胞存活率:细胞存活率=(试验组od-空白组od)/(对照组od-空白组od)
×
100%。
38.(2)测afb1干预后每隔5代细胞活力
39.将含afb1培养液染毒的第5、10、15、20、25、30代的细胞以6
×
103个/孔密度接种于96孔板中,每孔体积100μl,置于37℃、5%co2培养箱内培养48h后,弃去培养液,换成100μl完全培养液,随即每干预孔贴壁加入10μl cck8溶液,小心避免产生气泡,培养箱内孵育1.5h,置于酶标仪cck8模式下测定各孔od值,记录结果取平均值。
40.按上述操作步骤重复进行3次实验。计算细胞增殖率:细胞增殖率=(试验组od-空白组od)-(对照组od-空白组od)/(对照组od-空白组od)
×
100%。
41.采用流式细胞术检测细胞周期;
42.每组细胞设置三个平行样,将含afb1培养液染毒0、5、10、15、20、25、30代的细胞种于25cm2培养瓶中,内含3ml培养液,置于37℃、5%co2饱和湿度培养箱内培养。待细胞贴壁生长48h后,收集各组细胞进行流式检测。用pbs清洗2次,随即加入1ml含0.25%的edta胰酶消化细胞,待细胞全部皱缩变圆并有少量飘起后终止消化,转移至15ml离心管,1000rpm离心5min,再用pbs洗两遍后,1000rpm离心5min,调整细胞密度至1
×
106个,并转移至1.5ml ep管,逐滴加入500μl的70%冰乙醇(提前配制并置于冰箱4℃预冷)。将各组ep管置于冰箱4℃过夜,第二天离心弃去冰乙醇,用pbs洗涤1次离心弃去,随即放入500μl提前配置好的染液(rnase酶:pi=1:9),轻柔吹打混匀,避光放置30min后,吸取单细胞悬液,过300目筛后,上流式细胞仪检测。
43.采用流式细胞仪检测细胞凋亡;
44.每组细胞设置五个平行样,将含afb1培养液染毒第0、5、10、15、20、25、30代的细胞种于25cm2培养瓶中,内含3ml培养液,置于37℃、5%co2饱和湿度培养箱内培养。待细胞贴壁,生长48h后,收集各组细胞进行流式检测。收集各组培养液,用pbs洗涤细胞并收集,加入1ml无edta的胰酶消化细胞,待细胞全部皱缩变圆并有少量飘起后终止消化,1200rpm离心5min后,再用pbs清洗两遍后离心,随后弃掉上清液,加入适量体积的binding buffer,保证细胞密度为5
×
105个,轻柔吹打。后取100-200μl单细胞悬液加5μlannexinv-fitc和5μlpi,避光孵育20min后,上流式细胞仪检测。
45.采用transwell法检测细胞的迁移能力;
46.消化离心并收集未染毒的heec、afb1染毒30代的细胞。采用pbs重悬细胞,再次离心后加入无fbs培养液制成单细胞悬液,调整各组细胞密度为5
×
104个/孔,上室加入200μl细胞悬液,下室加入含20%fbs的600μl培养液,培养24h。培养结束后,用棉签轻柔擦拭处理小室内残余细胞,下室加入600μl甲醇用于固定小室,15min后吸去固定液,加入600μl结晶紫染色液染色15min,随后pbs清洗1-2次,避光风干,在倒置显微镜下观察,每个样本随机选取5个视野拍照,对迁移个数进行计数。
47.采用transwell法检测细胞的侵袭能力;
48.用无fbs的培养液稀释matrigel胶,稀释比例为1:8。小室每孔加50μl稀释液,4℃冷藏静置,至第二天实验使用。将未染毒的heec、afb1染毒30代的细胞用胰酶消化后离心,用不含fbs的培养液调整各组细胞密度为3
×
105个/孔,在铺好胶的上室加入200μl细胞悬液,下室加入600μl含50%fbs的培养液。培养24h后,后续步骤同5。
49.实施例1:使用1mol/lafb1溶液长期连续干预heec至第20代,采用cck8法来检测heec的增殖率为14.31
±
6.20%,采用流式细胞仪检测heec的细胞周期中g0/g1期占比56.78
±
0.89%,s期占比33.60
±
0.93%,采用流式细胞仪检测heec的细胞凋亡率为18.63
±
0.36%。
50.实施例2:使用1mol/lafb1溶液长期连续干预heec至第30代,采用cck8法来检测heec的增殖率为45.79
±
1.12%,采用流式细胞仪检测heec的细胞周期中g0/g1期占比47.44
±
0.92,s期占比43.69
±
0.58%,采用流式细胞仪检测heec的细胞凋亡率为9.17
±
0.60%。
51.结果发现,使用1mol/lafb1溶液长期连续干预heec至第30代,细胞的增殖能力升高,细胞周期从g0/g1期向s期转化,细胞凋亡减少。
52.以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1