一种逆向调控水稻对稻瘟病菌抗性的遗传位点及其应用
1.本发明涉及植物基因工程技术领域,更具体地,涉及一种逆向调控水稻对稻瘟病菌抗性的遗传位点及其应用。
背景技术:
2.中国是拥有悠久农耕文明的农业大国,用占世界7%的土地养活了近22%的世界人口。我国粮食作物以水稻、小麦、玉米为主,但许多病原真菌严重危害粮食作物的产量和品质,如有着“水稻癌症”之称的稻瘟病每年都给我国乃至世界水稻安全带来巨大威胁。稻瘟病在全世界范围内造成重大的经济损失。其病原菌可以侵染水稻的不同部位,其中以叶瘟和穗颈瘟引起的水稻产量损失最为严重。据统计,稻瘟病可使水稻减产10-30%(talbot,2003)。水稻是全世界一半以上的人口赖以生存的粮食作物,据国际粮食政策研究所分析显示,到2030年,人类要在更少的种植面积上生产出目前水稻产量的1.38倍才能满足人口增长的需求(wilson and talbot,2009)。面对这一严峻形势,我们需要深入了解水稻的抗病性,尽可能减少稻瘟病菌引起的水稻产量和品质上的损失。
3.作物免疫是最经济、可持续和生态相关的病害管理策略之一。植物与病原菌在长期互作中进化出了两层天然免疫系统,病原相关分子模式触发的免疫(pti,pattern-triggered immunity)和效应子触发免疫(eti)。抗病基因主要是基于eti反应发现,符合基因对基因学说,即稻瘟病菌的致病基因与水稻的抗病基因一一对应,然而单个基因触发的抗病性往往由于病原菌的快速变异而在作物种植2-3年后失去其抗性作用。目前缺少广谱、持久抗病作物品种。pti是植物阻止病原菌侵染的第一道防线,产生一系列快速响应机制,包括活性氧及胼胝质的积累等,加强pti组成可能作为一项新战略广泛提高eti对作物中多种病害的有效性(yuan et al.,2021;nagou et al.,2022),有望培育出广谱、持久的抗病品种。因此,发明人对水稻材料中的组成型遗传位点进行研究,通过差异表达遗传位点的基因网络分析,发现与xloc_047603在抗、感病水稻遗传基础上具有显著的差异,抑制了几丁质酶合成相关基因的表达,抑制了水稻对稻瘟病菌侵染的pti反应。该遗传位点目前还没有文献报道过。本发明鉴定到了一种逆向调控水稻对稻瘟病菌抗性的遗传位点,为调节水稻和稻瘟病相互作用提供有价值的信息。
技术实现要素:
4.本发明的目的在于克服现有技术中存在的上述缺陷和不足,提供一种逆向调控水稻对稻瘟病菌抗性的遗传位点及其应用。
5.本发明的上述目的是通过以下技术方案给予实现的:
6.一种逆向调控水稻对稻瘟病菌抗性的遗传位点,所述遗传位点的核苷酸序列如seq id no:1所示。已证实该基因位于水稻第11号染色体上,全长815bp。本发明对水稻等重要粮食作物抗病品种的分子遗传育种具有重要的应用价值。
7.本发明还保护含有所述的逆向调控稻瘟病抗性的遗传位点的敲减表达载体以及
所述植物敲减表达载体的重组菌。
8.本发明还保护所述的逆向调控稻瘟病抗性的遗传位点、植物敲减表达载体或重组菌在提高水稻对稻瘟病抗性中的应用。
9.提高水稻对稻瘟病抗性中的应用步骤包括:将所述的含有逆向调控稻瘟病抗性的遗传位点的植物敲减表达载体转化至农杆菌中,制备农杆菌悬浮液,将农杆菌悬浮液或将所述的重组菌转化至感病水稻中,获得稻瘟病抗性水稻植株,使所述的逆向调控稻瘟病抗性的遗传位点不表达或低表达,从而提高水稻植株对稻瘟病的抗性。
10.本发明的第二个目的在于提供所述逆向调控稻瘟病抗性的遗传位点在水稻稻瘟病抗性的鉴定中的应用。
11.利用所述的逆向调控稻瘟病抗性的遗传位点在水稻对稻瘟病抗性的鉴定步骤为:
12.1)提取待检水稻总rna;
13.2)反转录制备cdna;
14.3)以cdna为模板,利用如seq id no:14和seq id no:15所示的引物序列进行qrt-pcr,所述的逆向调控水稻对稻瘟病菌抗性的遗传位点高表达的水稻品种为感病品种,所述的逆向调控水稻对稻瘟病菌抗性的遗传位点低表达或不表达的水稻品种为抗病品种。
15.与现有技术相比,本发明具有以下有益效果:
16.1.本发明提供了一种逆向调控稻瘟病抗性的遗传位点xloc_047603及其在鉴定水稻对稻瘟病抗性中的应用以及提高水稻稻瘟病抗性中的应用。本发明筛选得到的与pti相关性强的遗传位点,其核苷酸序列如seq id no:1所示。
17.2.利用该遗传位点可鉴定水稻对稻瘟病抗性,也就是说该遗传位点可作为分子标记来鉴定水稻品种对稻瘟病的抗性。
18.3.本发明构建了含有该遗传位点的表达载体和菌株。过表达本发明得到的遗传位点后,获得的过表达转化苗接种稻瘟病菌株,通过病害调查说明抗病品种中高表达该转录本,对稻瘟病菌侵染表现为感病;敲减载体转化苗接种稻瘟病菌株,通过病害调查结果说明感病品种中抑制该转录本的表达,可以提高水稻对稻瘟病菌侵染的抗病性,证明该遗传位点(xloc_047603)逆向调控水稻对稻瘟病菌的抗性。
19.4.实验证明该遗传位点xloc_047603在水稻不同过表达株系对稻瘟病菌的防卫响应中发挥着负调控作用。本发明为培育水稻抗病新品种,尤其是水稻抗稻瘟病新品种提供了一种新的策略和遗传资源,具有十分重要的理论意义和应用价值。
附图说明
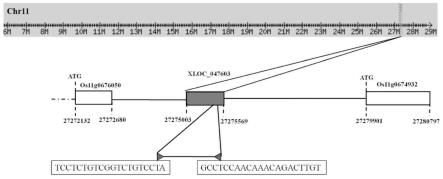
20.图1为遗传位点xloc_047603序列位置图;
21.图2为xloc_047603的过表达载体酶切图及图谱,注:ecorv酶切获得4个条带:1134bp;1168bp;2691bp;5324bp。marker条带大小为:5000bp;3000bp;2000bp;1000bp;750bp;500bp;250bp;100bp;
22.图3为过表达xloc_047603水稻转化苗的基因检测结果,注:从左到右样本顺序为:marker;阴性对照;oe86-1;oe86-2;oe86-3;oe86-12;oe86-13;oe86-16;oe86-19;
23.图4为xloc_047603过表达株系病情指数变化;
24.图5为xloc_047603过表达株系表型症状图;
25.图6为xloc_047603的敲减载体酶切图及图谱;
26.图7为敲减(xloc_047603)水稻转化苗的基因检测结果,注:从左到右样本顺序为:阳性对照;marker;阴性对照;d86-1;d86-2;d86-3;d86-4;d86-5;d86-6;d86-7;d86-8;d86-9;d86-10;d86-13;
27.图8为xloc_047603敲减突变株系病情指数变化图;
28.图9为xloc_047603敲减株系表型症状图;
29.图10为利用设计引物扩增xloc_047603在不同水稻中的表达量图。
具体实施方式
30.以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
31.除非特别说明,以下实施例所用试剂和材料均为市购。所用引物序列均由武汉伯远生物技术有限公司合成。
32.实施例1:遗传位点xloc_047603的筛选
33.1.1材料
34.寄主材料:水稻感病品种lth和一个携带抗性基因pish的近等系水稻品种irblsh-s。
35.稻瘟病菌菌株:y92-66b。
36.1.2实验方法
37.1.2.1样品收集
38.三叶一心期水稻幼苗喷雾接种(孢子浓度为:1
×
105个/ml)后保湿98%以上、黑暗、保温28℃,24h后进行样品采集,每个样本采集完全展开的水稻叶片(第2叶和第3叶),放入液氮速冻后于超低温冰箱中储存。每个样本进行3次生物学重复。剩余幼苗转移至温室继续培养,第7d进行病害调查。其中lth病斑0-2级定为抗病(r),3-5级定为感病(s)(li et al.,2014);病情指数=σ(各级病株数
×
相应级数值)/(调查总株数
×
最高级数值)
×
100,t检验进行差异显著性分析。
39.1.2.2转录组建库、测序
40.提取的水稻叶片总rna,1.0%琼脂糖凝胶电泳检测rna质量、分光光度计检测rna纯度、qubie检测rna浓度和agilent 2100检测rna完整性。检测合格的rna构建文库,测序。基本步骤为:(1)去除rrna,然后用乙醇沉淀法去除rrna残基。(2)用试剂盒(ultra
tm
directional rna library prep kit,neb,美国)构建文库。(3)纯化产物。(4)agilent 2100检测文库质量。委托北京诺禾致源生物信息科技有限公司使用illuminahiseq 2000测序平台对检测合格的文库测序,获得约125bp长度的reads。
41.1.2.3差异表达遗传位点分析,筛选xloc_047603
42.edger软件包(robinson et al.,2010)用于鉴定差异表达遗传位点。抗病水稻品种irblsh-s或感病品种lth在接种菌株处理后与相应的mock比较,表达量差异显著的遗传位点p-value《0.05且lg fc≥1或≤-1作为候选遗传位点进行研究。
43.1.3实验结果
44.(1)差异表达的遗传位点分析
45.对不同抗、感病水稻材料的遗传背景进行分析,结果发现抗病品种中几丁质酶催化过程,几丁质酶活性相关的基因表达在抗、感病品种之间有显著差别。利用基因网络分析和r脚本分析发现pti组成几丁质酶相关基因与遗传位点xloc_047603显著负相关(r2》0.9和fdr《0.05),表明xloc_047603与pti组成几丁质酶相关基因具有显著的负调控作用。
46.(2)筛选到具有差异表达的遗传位点xloc_047603
47.共表达结果表明强相关的遗传位点中,xloc_047603与pti组成几丁质酶相关基因紧密相关,可能逆向调控着水稻对稻瘟病菌的抗性。xloc_047603,全长567bp,位于水稻11号染色体,序列位置图如图1所示和序列如seq id no:1所示。该遗传位点为新发现的转录本。
48.实施例2遗传位点xloc_047603的过表达载体构建和遗传转化
49.为了验证该遗传位点逆向调控水稻对稻瘟病菌的抗病性,我们构建了含有xloc_047603遗传位点全序列的过表达载体,转化农杆菌后转化至水稻抗病品种中,验证其逆向调控抗病性的功能。
50.2.1材料
51.转化水稻野生型:抗病品种irblsh-s。
52.接种菌株:y92-66b和guy11。
53.2.2实验方法
54.2.2.1过表达载体构建
55.(1)水稻叶片基因组dna提取
56.使用基因组dna纯化试剂盒(promega,a1120),根据操作说明,提取水稻幼苗dna并纯化。1.5%琼脂糖凝胶电泳检测dna的完整性,最后所得基因组dna条带单一,无拖带,代表基因组dna完整性良好,用于后续实验。
57.(2)设计、合成过表达载体所需引物:
58.xloc_047603-o(+):cagtcgtctcacaactgtcatcttaaggcgtaact
59.xloc_047603-o(-):cagtcgtctcatacaggtttttgccaattccattt
60.序列如seq id no:2-3所示产物片段大小为567bp。
61.(3)pcr反应
62.进行50μl的pcr反应,包括dna模板:1μl;buffer:5μl;mg
2+
:4μl;dntp:2μl;p+:2μl;p-:2μl;h2o:34μl;taq酶:2u。pcr反应程序为:94℃预变性5min;94℃变性30s;50℃退火延伸45s;72℃延伸12s;循环30次,72℃延伸10min。
63.(4)琼脂糖胶电泳及产物回收
64.1.5%琼脂糖电泳检测pcr产物大小分别为567bp;切下电泳片段,进行溶胶回收,回收程序按试剂盒说明说进行,用总体积30μl的水溶解回收dna(标记为idnax2),检测无误后用于载体连接。
65.(5)载体和idnax2酶切、纯化
66.载体和idnax2进行酶切,酶切体系为20μl(buffer:13μl;h2o:13μl;basi/eco3ii:1μl;pbwa(v)hs-ccdb或idnax2:4μl)。37℃酶切1h。将载体酶切物和回收片段酶切产物合并,用pcr纯化试剂盒纯化(标记为pbwa-idnax2)用于连接反应。
67.(6)连接反应及产物转化感受态和菌斑pcr鉴定
68.连接反应体系10μl(buffer:1μl;h2o:5.5μl;t4连接酶:1μl;pbwa-idnax2:2.5μl)。20℃连接1h,获得连接产物。将5-10μl连接产物转化到大肠杆菌感受态,转化涂(卡那霉素)抗性平皿,37℃培养12h,进行菌斑pcr鉴定。挑取10个菌斑进行1.5ml ep管接菌和pcr鉴定,pcr反应体系25μl(模板:1μl;buffer:2.5μl;mg
2+
:4μl;dntp:1μl;hs)35seq/35seq(g):1μl;nosseq-r/noseq(g):1μl;h2o:16.5μl;taq酶:10u)。pcr反应程序为:94℃预变性5min;94℃变性30s;50℃退火延伸45s;72℃延伸12s;循环30次,72℃延伸10min。
69.2.0%琼脂糖电泳检测目标条带为157bp左右的片段。取1-3个阳性条带对应的菌液,取100μl送样测序,其余400μl菌液接种到含有5-10ml(卡那霉素)的抗性lb中,试管摇菌,待测序结果出来后,对应正确的取一管菌液提取质粒(命名为pbwa(v)hs-oe-lln-47603)。
70.2.2.2载体转化农杆菌
71.将鉴定正确的过表达载体质粒pbwa(v)hs-oe-lln-47603转化至农杆菌eha105,挑取农杆菌单菌落,置于培养液中震荡培养。取培养好的菌液置于离心管,离心取上清,制备农杆菌悬浮液用于水稻转化。
72.2.2.3水稻抗病品种irblsh-s转化
73.(1)取成熟野生型抗病水稻品种irblsh-s种子,挑选无菌斑、饱满优质种子,机械脱壳,消毒后接种到愈伤组织诱导培养基中,培养基配方为:ms+2,4-d 2.0mg/l+糖20g/l。
74.(2)挑出大小为0.2cm
×
0.2cm的愈伤组织,置于农杆菌悬浮液侵染5min;然后将愈伤组织置于共培养基上培养,共培养基配方为:ms+naa 0.2mg/l+6-ba 1.0mg/l。
75.(3)抗性愈伤组织培养:将愈伤组织取出,晾干,转入筛选培养基上进行第一次筛选;将长有抗性愈伤的初始愈伤转导到新培养基上进行第二次筛选。一筛培养基配方为:ms+2,4-d 0.2~0.5mg/l+50mg/l潮霉素;二筛培养基为:ms+2,4-d 0.2~0.5mg/l+80mg/l潮霉素。
76.(4)挑选抗性愈伤组织进行芽培养:将挑选的愈伤组织移入装有芽分化培养基中,放入恒温培养室中等待分化成苗;生长至1cm左右,移至生根培养基壮苗。分化培养基配方为:ms+naa 0.2~0.5mg/l+6-ba 1.0mg/l;生根培养基配方为:ms+naa 0.2~0.4mg/l。
77.(5)生根苗利用潮霉素基因扩增的前引物为hyg(280)+:5'-acggtgtcgtccatcacagtt tgcc-3',后引物为hyg(280)-:5'-ttccggaagtgcttgacattgggga-3',序列如seq id no:4-5所示进行pcr扩增,退火温度为56℃。扩增后得到的pcr产物,用1.5%琼脂糖凝胶电泳检测,凝胶成像系统检测产物带型并进行分析,确认转化成功。生根苗温室内炼苗、培养至收获t1代种子。
78.2.2.4xloc_047603过表达转化苗的抗病性鉴定
79.(1)转化苗培养
80.育苗采用育秧盘法。播种前将水稻土、腐殖土和草木灰按照1:1:1混合均匀,阳光暴晒消毒。挑选饱满的水稻种子消毒(1.5%naclo消毒浸泡5min,清水冲洗直至没有次氯酸钠的气味为止)。将消毒好的过表达转化苗t1代种子和野生型lth的种子分别放入灭菌的培养皿里,清水持续浸泡。在28℃恒温培养箱中催芽到露白,然后将其播种到育秧盘中。水稻生长到三叶一心期(约21d)用于接种稻瘟病菌孢子(1
×
105个/ml)试验。
81.(2)病害调查及取样
82.喷雾接种后黑暗培养24h的水稻幼苗转移至温室,第7d进行发病程度调查,病斑0-2级定为抗病(r),3-5级定为感病(s),计算病情指数。病情指数=σ(各级病叶数
×
各级代表值)/(调查总叶数
×
最高级代表值)
×
100,以抗病水稻品种irblsh-s为对照。
83.2.3实验结果
84.(1)成功构建水稻遗传位点xloc_047603过表达载体
85.利用候选水稻xloc_047603的核苷酸序列,成功构建了xloc_047603的过表达载体,载体酶切图和载体图谱见图2。
86.(2)基因检测xloc_047603过表达成功的转化苗
87.根据xloc_047603序列构建过表达载体,转化到irblsh-s中,形成xloc_047603的过表达株系(oe86)。irblsh-s对y92-66b侵染,表现为抗病。经基因检测,不同过表达株系(oe86-1;oe86-2;oe86-3;oe86-12;oe86-13;oe86-16;oe86-19;oe86-24)均为阳性株(图3)。所有阳性转化株用于后续抗病性鉴定。
88.(3)水稻xloc_047603过表达株系对菌株侵染的响应变化
89.实验结果表明:过表达株系(oe86-1;oe86-2;oe86-3;oe86-12;oe86-13;oe86-16;oe86-19;oe86-24)对y92-66b的侵染表现出不同程度的感病(图4,图5),病情指数分别达到24.4;25.2;45.0;16.7;40.5;36.3;44.0;28.0,显著高于抗病对照irblsh-s的病情指数7.03。结果进一步证明:xloc_047603逆向调控了水稻对稻瘟病菌的抗性。
90.实施例3:遗传位点xloc_047603的敲减表达载体构建和遗传转化
91.为了应用逆向调控水稻对稻瘟病菌抗性的遗传位点,我们构建了敲减载体,获得了具有抗病性的水稻转化苗。
92.3.1材料
93.转化水稻野生型感病品种:lth。
94.接种稻瘟病菌菌株:y92-66b和guy11。
95.3.2实验方法
96.3.2.1载体构建
97.(1)水稻叶片基因组dna提取
98.使用基因组dna纯化试剂盒(promega,a1120),根据操作说明,提取水稻幼苗dna并纯化。1.5%琼脂糖凝胶电泳检测dna的完整性,最后所得基因组dna条带单一,无拖带,代表基因组dna完整性良好,用于后续实验。
99.(2)合成以下三对引物
100.xloc_047603-f引物:
101.xloc_047603-f(+):cagtcgtctcacaacgaacacatgcatcagttcattct
102.xloc_047603-f(-):cgatcgtctcacagggttctgaacctaaatagcgtgat
103.loop引物:
104.loop(+):cgatggtctcacctgcaggtctagtttttctcct
105.loop(-):cgatggtctcagcccgggctctgtaactatcatc
106.xloc_047603-r引物:
107.xloc_047603(+):cagtcgtctcagggcgcttctgaacctaaatagcgtgat
108.xloc_047603-r(-):cgatcgtctcatacagaacacatgcatcagttcattct
109.其序列如seq id no:6-11所示。
110.(3)pcr反应
111.3对引物分别进行50μl体系的pcr反应,dna模板:1μl;buffer:5μl;mg
2+
:4μl;dntp:2μl;p+:2μl;p-:2μl;h2o:34μl;taq酶:2u。pcr程序为:94℃预变性5min;94℃变性30s;50℃退火延伸45s;72℃延伸12s;循环数为30次,72℃延伸10min。
112.(4)琼脂糖胶电泳及产物回收
113.1.5%琼脂糖电泳检测3对引物pcr产物大小分别为202bp、200bp、202bp;切下电泳片段,放在同一个体系中进行溶胶回收,回收程序按试剂盒说明说进行,用总体积30μl的水溶解回收dna(标记为ldnax2),检测无误后用于载体连接。
114.(5)载体和ldnax2酶切、纯化
115.载体和ldnax2分别进行20μl体系d酶切,buffer:13μl;h2o:13μl;basi/eco3ii:1μl;pbwa(v)hs-ccdb或ldnax2:4μl。37℃酶切1h。将载体酶切物和回收片段酶切产物合并,用pcr纯化试剂盒纯化(标记为pbwa-ldnax2)用于连接反应。
116.(6)连接反应及产物转化感受态和菌斑pcr鉴定
117.连接反应体系10μl(buffer:1μl;h2o:5.5μl;t4连接酶:1μl;pbwa-ldnax2:2.5μl)。20℃连接1h,获得连接产物。将5-10μl连接产物转化到大肠杆菌感受态,转化涂(卡那霉素)抗性平皿,37℃培养12h,用于菌斑pcr鉴定。挑取10个菌斑同时进行1.5ml ep管接菌和pcr鉴定。pcr反应体系25μl(模板:1μl;buffer:2.5μl;mg
2+
:4μl;dntp:1μl;hs)35seq/35seq(g):1μl;nosseq-r/noseq(g):1μl;h2o:16.5μl;taq酶:10u)。pcr反应程序为:94℃预变性5min;94℃变性30s;50℃退火延伸45s;72℃延伸12s;循环数为30次,72℃延伸10min。
118.1.5%琼脂糖电泳检测目标条带为194bp左右的片段。取1-3个阳性条带对应的菌液,取100μl送样测序,其余400μl菌液接种到含有5-10ml(卡那霉素)的抗性lb中,试管摇菌,待测序结果出来后,对应正确的取一管菌液提取质粒(命名为pbwa(v)hs-rnai-lln-2018-3)。
119.3.2.2载体转化农杆菌
120.将鉴定正确的敲减载体质粒pbwa(v)hs-rnai-lln-2018-3转化至农杆菌eha105,挑取农杆菌单菌落,置于培养液中震荡培养。取培养好的菌液置于离心管,离心取上清,制备农杆菌悬浮液用于水稻转化。
121.3.2.3水稻感病品种lth转化
122.(1)取成熟野生型水稻lth种子,挑选无菌斑、饱满优质种子,机械脱壳,消毒后接种到愈伤组织诱导培养基中,培养基配方为:ms+2,4-d 2.0mg/l+糖20g/l。
123.(2)挑出大小为0.2cm
×
0.2cm的愈伤组织,置于农杆菌悬浮液侵染5min;然后将愈伤组织置于共培养基上培养,共培养基配方为:ms+naa 0.2mg/l+6-ba 1.0mg/l。
124.(3)抗性愈伤组织培养:将愈伤组织取出,晾干,转入筛选培养基上进行第一次筛选;将长有抗性愈伤的初始愈伤转导到新培养基上进行第二次筛选。一筛培养基配方为:ms+2,4-d 0.2~0.5mg/l+50mg/l潮霉素;二筛培养基为:ms+2,4-d 0.2~0.5mg/l+80mg/l潮霉素。
125.(4)挑选抗性愈伤组织进行芽培养:将挑选的愈伤组织移入装有芽分化培养基中,
放入恒温培养室中等待分化成苗;生长至1cm左右,移至生根培养基壮苗。分化培养基配方为:ms+naa 0.2~0.5mg/l+6-ba 1.0mg/l;生根培养基配方为:ms+naa 0.2~0.4mg/l。
126.(5)生根苗利用潮霉素基因扩增的前引物为hyg(280)+:5'-acggtgtcgtccatcacagtt tgcc-3',后引物为hyg(280)-:5'-ttccggaagtgcttgacattgggga-3'序列如seq id no:12-13所示进行pcr扩增,退火温度为56℃。扩增后得到的pcr产物,用1.5%琼脂糖凝胶电泳检测,凝胶成像系统检测产物带型并进行分析,确认转化成功。生根苗温室内炼苗、培养至收获t1代种子。
127.3.2.4xloc047603敲减转化苗的抗病性鉴定
128.(1)转化苗培养
129.育苗采用育秧盘法。播种前将水稻土、腐殖土和草木灰按照1:1:1混合均匀,阳光暴晒消毒。挑选饱满的水稻种子消毒(1.5%naclo消毒浸泡5min,清水冲洗直至没有次氯酸钠的气味为止)。将消毒好的敲减转化苗t1代种子和野生型lth的种子分别放入灭菌的培养皿里,清水持续浸泡。在28℃恒温培养箱中催芽到露白,然后将其播种到育秧盘中。水稻生长到三叶一心期(约21d)用于接种试验。
130.(2)病害调查及取样
131.喷雾接种后黑暗培养24h的水稻幼苗转移至温室,接种第7d调查发病程度,病斑0-2级定为抗病(r),3-5级定为感病(s),计算病情指数,病情指数=σ(各级病叶数
×
各级代表值)/(调查总叶数
×
最高级代表值)
×
100。以lth为感病对照品种。
132.3.3实验结果
133.(1)成功构建水稻xloc_047603敲减载体
134.利用候选水稻xloc_047603的核苷酸序列,成功构建了xloc_047603的敲减载体,载体酶切图和载体图谱见图6。
135.(2)基因检测xloc_047603敲减成功的转化苗
136.根据xloc_047603序列构建敲减载体,转化到lth野生型中,获得xloc_047603敲减转化苗(d86)。经基因检测,不同敲减株系(d86-1;d86-2;d86-3;d86-4;d86-5;d86-6;d86-7;d86-8;d86-9;d86-10;d86-13;d86-14;d86-15;d86-16)为阳性株(图7),可用于后续抗病性鉴定。
137.(3)水稻xloc_047603敲减株系对菌株侵染的响应变化
138.数据表明:与野生型对照相比,敲减株系(d86-1;d86-2;d86-3;d86-5;d86-6;d86-7;d86-9;d86-10;d86-14;d86-15;d86-16)对y92-66b的侵染表现出不同程度的抗性(图8,图9),病情指数分别达到37.0;41.7;36.4;36.8;35.4;23.6;31.0;34.8;33.6;47.9;46.1,显著低于感病对照lth的病情指数71.6。结果证明:xloc_047603水稻敲减株系提高了其对稻瘟病菌的抗性反应。
139.实施例4:荧光定量pcr检测水稻xloc_047603的表达量,鉴定不同水稻品种抗病性
140.4.1材料
141.水稻品种:感病品种lth和抗病品种irblsh-s。
142.稻瘟病菌菌株:菌株y92-66b;菌株guy11。
143.4.2实验方法
144.4.2.1水稻叶片rna的提取
145.水稻叶片总rna提取使用rna提取试剂盒(super总rna提取试剂盒ls1040),根据操作说明执行,略作修改。
146.4.2.2rna逆转录
147.利用反转录试剂盒(goscripttm reverse transcription system,a5001)对检测合格的rna进行反转录,按操作说明执行。
148.4.2.3荧光定量验证候选遗传位点表达量
149.为了确定开发检测xloc_047603遗传位点表达量的快速方法,我们设计了荧光定量pcr特异性引物用于检测该遗传位点的表达,提取各样本的总rna,反转录后进行qrt-pcr验证。qrt-pcr反应体系(在黑暗条件下及冰上进行):cdna 2.0μl;sybr premix ex taq ii 10.0μl;前引物0.4μl;后引物0.4μl;加rna-free water至总体积为20μl。所用引物为xloc_047603pf:tcctctgtcggtctgtccta;xloc_047603pr:gcctccaacaaacagacttgt,序列如seq id no:14-15所示。产物大小为106bp。
150.反应体系配制完成后充分混匀,加封膜后上样。使用荧光定量pcr仪(bio-rad thermal cycler,美国)进行ct值检测。反应程序为:95℃预变性3min;95℃变性20s;58℃退火延伸20s;65℃采集荧光信号;循环数为45次。溶解曲线参数:从60℃开始升温,温度每升高0.5℃为一个循环采集荧光信号,共80个循环。每个样品设置3个生物学重复,3个技术重复,记录ct值,计算相对表达水平。
151.4.3实验结果
152.lth和irblsh-s及接种菌株y92-66b,或guy11后的寄主水稻中xloc_047603的表达量情况见图10,qrt-pcr检测结果与测序结果一致。实验结果表明,采用我们开发的分子标记xloc_047603在水稻感病品种lth与抗病品种irblsh-s中的表达水平存在显著差异,产物大小为106bp,产物序列如seq id no:16所示:具体如下:
153.tcctctgtcggtctgtcctacatccttcagttatcagtgccagatcaatgatcacaagagttgatattttggagaccacaaatgcacaagtctgtttgttggaggc。
154.该引物和产物能精确反应xloc_047603的表达量变化。因此,该qrt-pcr检测所用分子标记(即引物)和产物可用于该xloc_047603的表达量检测;可用于不同水稻品种的抗病性鉴定,即表达量高的水稻品种为含有该逆向遗传位点的感稻瘟病品种,低表达或不表达的水稻品种为不含该逆向遗传位点的抗稻瘟病品种。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1