一种保持细胞结构完整性的益生菌灭活方法及其应用与流程
1.本发明属于微生物技术领域,涉及一种保持细胞结构完整性的益生菌灭活方法及其应用。
背景技术:
2.益生菌主要包含乳酸杆菌、双歧杆菌、芽孢杆菌及酵母等,由益生菌菌种经发酵、浓缩或离心、干燥等方式所制备的原料菌剂可称作益生菌菌剂,其中包括活菌体、死菌体、菌体成分及代谢产物。益生菌主要涉及功能性食品、膳食补充剂、发酵食品、日化护理、农用饲料、生态环保及预防医学等领域的应用产品开发,摄入足够数量的益生菌,对宿主起有益健康的作用。
3.益生菌细胞壁组分中的肽聚糖、多糖和磷壁酸,以及其代谢产物(维生素和游离氨基酸等)都能够增强免疫反应。这些成分在菌体失去活性后依然能够发挥作用,它们能诱导b淋巴细胞分泌多种抗体,还能够激活巨噬细胞,使之吞噬功能增强,并分泌多种具有抗击肿瘤功能的效应分子,如tnf-α、il-6、il-12等,以此来增强机体免疫。
4.灭活菌是一种通过特殊的灭活技术,保留有益菌原有结构及特性,但不再具备生长繁殖能力的有益菌。“灭活”,就是采用物理或化学的方法将微生物的活细胞、或者活体(如病毒)杀死,使其不再具有生长与繁殖能力,但仍然保持细胞的形态。灭活的益生菌菌体抗病源微生物的能力主要源于两方面:一是有效增强机体的免疫力;二是靠灭活后细胞表面暴露更多的吸附位点,可以吸附在机体粘膜表面实现对病原菌的竞争性排斥。
5.目前,在灭活益生菌产品的实际应用场景中,由于其无活性指征,更多的在家庭日化、口腔护理、外用栓剂得到法规允许及行业青睐,但上述情况由于绝大多数情况下并非直接服用或长期接触吸收,而只是短暂接触后进行清洗去除,导致在实际益生菌功效发挥方面遭遇阻碍,特别的,在益生菌菌剂自身还未完全崩解溶出时无法有效进行位点吸附,导致最终只具备概念性,而无实质作用。
6.总体来看,现有技术在灭活型益生菌菌种制剂方面存在以下问题:(1)菌剂崩解释放缓慢:短暂条件接触下益生菌无法完全释放并进行位点结合;(2)无完整细胞结构:常规灭活工艺通常会导致细胞壁破裂,结构损伤明显,丧失基本菌种功能,显著影响益生菌功效发挥基础;(3)单位细胞含量较低:作为产品核心质量指标,需要满足其灭活型益生菌菌剂中关键单位细胞含量达到有效摄入量。
7.因此,对于本领域而言,需要优化益生菌灭活工艺,提供一种具备快速释放溶出、安全可靠、高菌量的灭活益生菌菌剂来满足在实际应用场景中的需求。
技术实现要素:
8.针对现有技术的不足,本发明的目的在于提供一种保持细胞结构完整性的益生菌灭活方法及其应用。
9.为达到此发明目的,本发明采用以下技术方案:
第一方面,本发明提供一种保持细胞结构完整性的益生菌灭活方法,所述保持细胞结构完整性的益生菌灭活方法包括如下步骤:调节培养液温度至5-25℃,调节培养液的ph至6.5-7.0,离心,收集菌泥,与热激保护剂混合2-3 h后,采用瞬时高温杀菌的方式进行灭活;所述热激保护剂包括胶体和甘氨酸盐;所述胶体包括明胶、卡拉胶或阿拉伯胶中的任意一种或至少两种的组合,所述至少两种的组合例如明胶和卡拉胶的组合、卡拉胶和阿拉伯胶的组合、卡拉胶和阿拉伯胶的组合,其他任意的组合方式均可。
10.优选地,所述混合的温度为5-25℃。
11.上述5-25℃中的具体数值例5℃、6℃、7℃、8℃、9℃、10℃、11℃、12℃、13℃、14℃、15℃、17℃、20℃、22℃、25℃等。
12.上述6.5-7.0中的具体数值例如6.5、6.6、6.7、6.8、6.9、7等。
13.上述2-3 h中的具体数值例如2 h、2.1 h、2.2 h、2.3 h、2.4 h、2.5 h、2.6 h、2.7 h、2.8 h、2.9 h、3 h等。
14.优选地,所述益生菌包括乳杆菌属益生菌、双歧杆菌属益生菌、链球菌属益生菌、肠球菌属益生菌、乳球菌属益生菌、片球菌属益生菌、葡萄球菌属、明串珠菌属益生菌或酵母益生菌中的任意一种或至少两种的组合,所述至少两种的组合例如乳杆菌属益生菌与双歧杆菌属益生菌的组合、乳球菌属益生菌与片球菌属益生菌的组合、双歧杆菌属益生菌与链球菌属益生菌的组合等,其他任意的组合方式均可。
15.优选地,所述乳杆菌属益生菌包括植物乳杆菌、鼠李糖乳杆菌、干酪乳杆菌、副干酪乳杆菌、罗伊氏乳杆菌、嗜酸乳杆菌、德式乳杆菌(包括德式乳杆菌保加利亚亚种)、唾液乳杆菌、发酵乳杆菌、格氏乳杆菌、约氏乳杆菌、詹氏乳杆菌、清酒乳杆菌、卷曲乳杆菌或费氏丙酸杆菌(包括费氏丙酸杆菌谢氏亚种)中的任意一种或至少两种的组合,所述至少两种的组合例如植物乳杆菌和鼠李糖乳杆菌的组合、发酵乳杆菌和格氏乳杆菌的组合、詹氏乳杆菌和清酒乳杆菌的组合等,其他任意的组合方式均可。
16.所述双歧杆菌属益生菌包括动物双歧杆菌(包括动物双歧杆菌乳亚种)、长双歧杆菌、短双歧杆菌、青春双歧杆菌、婴儿双歧杆菌或两歧双歧杆菌中的任意一种或至少两种的组合,所述至少两种的组合例如长双歧杆菌和短双歧杆菌的组合、婴儿双歧杆菌和两歧双歧杆菌的组合、动物双歧杆菌和婴儿双歧杆菌的组合,其他任意的组合方式均可。
17.所述链球菌属益生菌包括嗜热链球菌。
18.所述肠球菌属益生菌包括粪肠球菌和/或屎肠球菌。
19.所述乳球菌属益生菌包括乳酸乳球菌。
20.所述乳酸乳球菌包括乳酸乳球菌乳酸亚种、乳酸乳球菌乳脂亚种或乳酸乳球菌双乙酰亚种中的任意一种或至少两种的组合。
21.所述片球菌属益生菌包括乳酸片球菌和/或戊糖片球菌。
22.所述葡萄球菌属益生菌包括小牛葡萄球菌、木糖葡萄球菌或肉葡萄球菌中的任意一种或至少两种的组合,所述至少两种的组合例如小牛葡萄球菌和木糖葡萄球菌的组合、木糖葡萄球菌和肉葡萄球菌的组合、小牛葡萄球菌和肉葡萄球菌的组合等,其他任意的组合方式均可。
23.所述明串珠菌属益生菌包括肠膜明串珠菌。
24.所述酵母益生菌包括布拉迪酵母和/或马克斯克鲁维酵母。
25.优选地,所述热激保护剂包括明胶和甘氨酸亚铁。
26.优选地,以菌泥的重量为1份,胶体的加入量为0.8-1.8份,甘氨酸盐的加入量为0.03-0.1份。
27.上述0.8-1.8份中的具体数值例如0.8份、0.9份、1份、1.1份、1.2份、1.3份、1.4份、1.5份、1.6份、1.7份、1.8份等。
28.上述0.03-0.1份中的具体数值例如0.03份、0.04份、0.05份、0.06份、0.07份、0.08份、0.09份、0.1份等。
29.优选地,所述灭活的温度为126-132℃,灭活的时间为3-8 min。
30.上述126-132℃中的具体数值例如126℃、127℃、128℃、129℃、130℃、131℃、132℃等。
31.上述3-8 min中的具体数值例如3 min、4 min、5 min、6 min、7 min、8 min等。
32.优选地,所述益生菌培养液的制备方法包括将益生菌接种到mrs培养基或l-mrs培养基中进行培养。
33.优选地,所述接种的接种量为1%-5%,例如1%、2%、3%、4%、5%等。
34.优选地,所述培养的温度为30-42℃,例如30℃、31℃、32℃、33℃、34℃、35℃、36℃、37℃、38℃、39℃、40℃、41℃、42℃等。
35.优选地,所述培养的时间为12-24 h,例如12 h、14 h、16 h、18 h、20 h、22 h、24 h等。
36.需要说明的是本发明的灭活方法不适用于芽孢类益生菌,由于其芽孢特殊的保护机制,本发明所述灭活强度不满足其完全丧失活性的技术条件。
37.第二方面,本发明提供一种灭活益生菌颗粒制剂的制备方法,所述制备方法包括:采用如第一方面所述的保持细胞结构完整性的益生菌灭活方法制得灭活益生菌,喷雾干燥后,采用流化床造粒工艺进行造粒。
38.优选地,所述流化床造粒工艺包括如下步骤:(1)将粘合剂、润滑剂与水混合,得浆料;将填充剂、崩解剂与灭活益生菌混合,得底料;(2)将底料投入流化床中,进风,喷入浆料,进行雾化并粘合底料,完成制粒。
39.本发明中,粘合剂主要用于灭活型益生菌颗粒制剂制备过程中进行粘合,同时对灭活益生菌的细胞结构起到一定的保护作用,避免由于气流热量引起细胞内部膨胀破裂。
40.优选地,所述粘合剂包括海藻糖、阿拉伯树胶或卡拉胶中的任意一种或至少两种的组合,所述至少两种的组合例如海藻糖和阿拉伯树胶的组合、阿拉伯树胶和卡拉胶的组合、海藻糖和卡拉胶的组合等,其他任意的组合方式均可,优选海藻糖和卡拉胶的组合。
41.在其他条件均一致的前提下,当粘合剂使用cmc(羧甲基纤维素)时,得到的灭活益生菌颗粒制剂的溶解释放效果不佳,表现为胶粘结团,颗粒不均匀。当粘合剂使用白砂糖时,不能对灭活益生菌的细胞结构起到很好的保护作用。
42.所述海藻糖与卡拉胶的质量比为(10-20):1。
43.上述(10-20)中的具体数值例如10、11、12、13、14、15、16、17、18、19、20等。
44.崩解剂的选择对产品的溶解释放效果具有重要的影响。
45.优选地,所述崩解剂包括羧甲基淀粉钠(cms-na)、低取代纤维素(l-hpc)、预胶化淀粉、甘露醇或微晶纤维素中的任意一种、至少两种的组合或由其中至少两种组分制得的交联物,所述至少两种的组合例如羧甲基淀粉钠和低取代纤维素的组合、预胶化淀粉和甘露醇的组合、甘露醇和微晶纤维素的组合等,其他任意的组合方式均可,优选甘露醇-预胶化淀粉交联物。
46.在其他条件均一致的前提下,当崩解剂使用干淀粉或cms-na时,得到的灭活益生菌颗粒制剂的溶解释放效果不佳,表现为胶粘结团,颗粒不均匀。
47.填充剂可在高温制备过程中对益生菌基本细胞结构进行保护,同时具备快速溶解特性,有助于提高产品的溶解释放速度。
48.优选地,所述填充剂包括乳糖、葡萄糖、蔗糖、麦芽糖、d-甘露糖醇、山梨糖醇或甘氨酸中的任意一种或至少两种的组合,所述至少两种的组合例如乳糖和葡萄糖的组合、蔗糖和麦芽糖的组合、山梨糖醇和甘氨酸的组合等,其他任意的组合方式均可,优选蔗糖与甘氨酸的组合。
49.所述蔗糖与甘氨酸的质量比为(1-3):1。
50.上述(1-3)中的具体数值例如1、1.2、1.5、1.7、2、2.2、2.5、2.7、3等。
51.润滑剂可用于促进菌剂快速溶解释放以及增加剂型流动性。
52.优选地,所述润滑剂包括丙三醇、硬脂酸钙、硬脂酸丁酯或硬脂酸钾中的任意一种或至少两种的组合,所述至少两种的组合例如丙三醇和硬脂酸钙的组合、硬脂酸钙和硬脂酸丁酯的组合、硬脂酸丁酯和硬脂酸钾的组合等,其他任意的组合方式均可。
53.优选地,所述流化床造粒工艺中所用原料以重量份数计包括:填充剂10-30份、粘合剂3-8份、润滑剂0.5-4份、崩解剂15-25份和灭活益生菌30-72份。
54.上述10-30份中的具体数值例如10份、12份、15份、17份、20份、22份、25份、27份、30份等。
55.上述3-8份中的具体数值例如3份、4份、5份、6份、7份、8份等。
56.上述0.5-4份中的具体数值例如0.5份、1份、1.5份、2份、2.5份、3份、3.5份、4份等。
57.上述15-25份中的具体数值例如15份、16份、17份、18份、19份、20份、21份、22份、23份、24份、25份等。
58.上述30-72份中的具体数值例如30份、35份、40份、45份、47份、50份、52份、55份、57份、60份、65份、70份、72份等。
59.优选地,步骤(1)浆料的制备中,所述混合在60-70℃下进行,例如60℃、61℃、62℃、63℃、64℃、65℃、66℃、67℃、68℃、69℃、70℃等,所述混合的时间为10-30 min,例如10 min、15 min、20 min、25 min、30 min。
60.优选地,步骤(1)底料的制备中,所述混合在常温(15-40℃,例如15℃、20℃、25℃、30℃、35℃、40℃等)下进行即可,混合的时间为20-40 min,例如20 min、25 min、30 min、35 min、40 min等。
61.优选地,步骤(2)所述进风中,进风温度为85-95℃,例如85℃、86℃、87℃、88℃、89℃、90℃、91℃、92℃、93℃、94℃、95℃等。
62.优选地,步骤(2)所述进风中,进风量为30-40 m3/min,例如30 m3/min、32 m3/min、
34 m3/min、36 m3/min、38 m3/min、40 m3/min等。
63.优选地,步骤(2)所述雾化中,雾化压力为120-135 kpa,例如120 kpa、125 kpa、130 kpa、135 kpa等。
64.第三方面,本发明提供如第一方面所述的保持细胞结构完整性的益生菌灭活方法或如第二方面所述的灭活益生菌颗粒制剂的制备方法在制备食品、药品、保健品或化妆品中的应用。
65.本发明所述的数值范围不仅包括上述列举的点值,还包括没有列举出的上述数值范围之间的任意的点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
66.在本发明中,术语“热激保护剂”指能够改善在热致死过程中细胞结构完全破裂或蛋白显著变性凝聚等不利情况的试剂。
67.在本发明中,术语“流化床”指将大量固体颗粒悬浮于运动的流体之中,从而使颗粒具有流体的某些表观特征。这种流固接触状态称为固体流态化,即流化床。
68.与现有技术相比,本发明具有如下有益效果:(1)本发明创造性地提出了一种新型的益生菌灭活工艺。
69.与目前本领域常规的直接热灭活方法相比,本发明的灭活工艺的优势在于最大限度保持了细胞完整结构,提高了灭活后产品中的具备完整结构的总细胞数,改善了产品的水分含量、水活度及外观性状,提高了产品质量。
70.具体地,a. 在发酵结束后立即进行降温来停止细胞代谢,防止细胞发生代谢反馈抑制,产生自溶情况;b.在灭活前控制ph以保持其中性体系,避免发酵液中有效酸度过高而导致细胞活性受影响,降低细胞能量传递与消耗,促进细胞蛋白保持结构稳定,防止细胞蛋白絮凝或严重变性;c 添加热激保护剂的目的在于调节细胞内外部渗透压,降低在水分蒸发过程中细胞质溢散,保持细胞结构的完整性,在本发明中,胶体与甘氨酸盐相互配合,显著提升了产品的完整细胞数、改善了产品水活度及外观性状;d. 灭活工艺采用瞬时高温杀菌,相较于原位高压蒸汽灭菌方式,能够极大保持原有氨基酸、维生素等功能性成分结构,降低或避免了美拉德反应产生的不利外观或类黑素物质成分,赋予产品良好的外观性状;f 热激保护剂的选择对灭活产品的具备完整结构的总细胞数、水活度、水分及产品外观性状有一定的影响,其中,明胶与甘氨酸亚铁这种特定组合在提升产品的完整细胞数、改善水活度及外观性状方面,取得了意料不到的协同增效的作用,优于其他热激保护剂选择。
71.(2)本发明创造性地将流化床造粒方法应用于益生菌剂的制备中。
72.在固体益生菌剂的制备中,现有技术一般将常规喷雾干燥得到的菌剂直接应用于下游产品,这种喷雾干燥得到的菌剂往往崩解效果不佳,在水相中溶解时会出现悬浮或结团的现象。而本发明在喷雾干燥后,增加了流化床造粒工艺,对各组分进行均匀混合,可收集到满足特定粒径范围的产品,并提高了产品崩解溶出指标,对最终产品实现标准化制备提供技术支撑。
73.在所述流化床造粒工艺中,本发明所用试剂均符合法规要求,无毒无害,不产生生化污染,安全可靠。而且,本发明基于益生菌剂的特殊性质,对使用的崩解剂、粘合剂等进行特定选择,进一步提高了产品的崩解溶出指标。
74.采用本发明所述的工艺得到的产品中总细胞数不低于1
×
10
11
cells/g,水分不高
于5.0%,水活度不高于0.1aw;产品性状为乳白色至淡黄色微颗粒,粒径0.15-0.18 mm,速释效果可满足在水中溶解5-10秒内完全崩解释放,无悬浮或结团现象,与现有技术相比取得了显著的进步。
具体实施方式
75.为更进一步阐述本发明所采取的技术手段及其效果,以下结合本发明的优选实施例来进一步说明本发明的技术方案,但本发明并非局限在实施例范围内。
76.以下实施例中,若无特殊说明,所以的试剂及耗材均购自本领域常规试剂厂商;若无特殊说明,所用的实验方法和技术手段均为本领域常规的方法和手段。
77.下述实施例、对比例、应用例和对比应用例所涉及的原料信息如下:蔗糖购自南宁糖业,甘氨酸购自河北华恒,丙三醇(纯度98%)购自美国陶氏,海藻糖(纯度99%)购自日本林原,卡拉胶购自法国罗塞洛,明胶购自美国嘉吉,甘氨酸亚铁购自德国默克,甘氨酸锌购自德国默克,甘露醇-预胶化淀粉交联物购自美国嘉吉。
78.实施例1(配方1)本实施例提供一种灭活方法,灭活对象为唾液乳杆菌ls97(保藏编号cgmcc no.16922),具体步骤如下:(1)高活性唾液乳杆菌ls97发酵液的制备:取冻干管保藏的唾液乳杆菌ls97接种于常规mrs液体培养基中,接种量15.0%,于35℃培养,培养过程中监测其发酵生长状态,当生长速率显著下降时停止发酵(培养时间12-14 h),同时利用在线活细胞检测设备进行检测,要求培养得到的发酵液中活菌数水平不低于1
×
10
9 cfu/ml。
79.(2)唾液乳杆菌ls97灭活前预处理:对步骤(1)所得的发酵液立即进行降温处理,降温至15℃后,利用氢氧化钠调控发酵液ph至7.0,8000 rpm离心5 min,弃上清,收集离心沉淀物(菌泥),称量,记作“菌泥湿重”,并添加热激保护剂(以菌泥湿重为1重量份,添加明胶1.2重量份和甘氨酸亚铁0.05重量份),15℃下持续搅拌平衡2.5 h;(3)唾液乳杆菌ls97灭活处理:将步骤(2)得到的混合物预热至75℃,后采用瞬时高温杀菌方式,经蒸汽装置瞬时升温至130℃,维持6 min完成灭活,得到灭活益生菌发酵物。
80.实施例2本实施例提供一种灭活方法,灭活对象为长双歧杆菌bl21(保藏编号为cgmcc:10452),具体步骤如下:(1)高活性长双歧杆菌bl21发酵液的制备:取冻干管保藏的长双歧杆菌bl21接种于l-mrs培养基中,接种量4.0%,于37℃培养,培养过程中监测其发酵生长状态,当生长速率显著下降时停止发酵,同时利用在线活细胞检测设备进行检测,要求培养得到的发酵液中活菌数水平不低于1
×
10
9 cfu/ml。
81.(2)灭活前预处理:对步骤(1)所得的发酵液立即进行降温处理,降温至5℃后,利用氢氧化钠调控发酵液ph至6.5,7000 rpm离心8 min,弃上清,收集离心沉淀物(菌泥),称量,记作“菌泥湿重”,并添加热激保护剂(以菌泥湿重为1重量份,添加明胶1.6重量份和甘氨酸亚铁0.03重量份),5℃下持续搅拌平衡3 h;(3)灭活处理:将步骤(2)得到的混合物预热至60℃,后采用瞬时高温杀菌方式,经
蒸汽装置瞬时升温至126℃,维持7 min完成灭活,得到灭活益生菌发酵物。
82.实施例3本实施例提供一种灭活方法,灭活对象为乳酸片球菌ccfm7902(保藏编号为cgmcc:20550),具体步骤如下:(1)高活性乳酸片球菌发酵液的制备:取冻干管保藏的乳酸片球菌接种于mrs培养基中,接种量2.0%,于32℃培养,培养过程中监测其发酵生长状态,当生长速率显著下降时停止发酵,同时利用在线活细胞检测设备进行检测,要求培养得到的发酵液中活菌数水平不低于1
×
10
9 cfu/ml。
83.(2)灭活前预处理:对步骤(1)所得的发酵液立即进行降温处理,降温至20℃后,利用氢氧化钠调控发酵液ph至6.7,8000 rpm离心5 min,弃上清,收集离心沉淀物(菌泥),称量,记作“菌泥湿重”,并添加热激保护剂(以菌泥湿重为1重量份,添加明胶0.9重量份和甘氨酸亚铁0.07重量份),20℃下持续搅拌平衡2 h;(3)灭活处理:将步骤(2)得到的混合物预热至70℃,后采用瞬时高温杀菌方式,经蒸汽装置瞬时升温至132℃,维持4 min完成灭活,得到灭活益生菌发酵物。
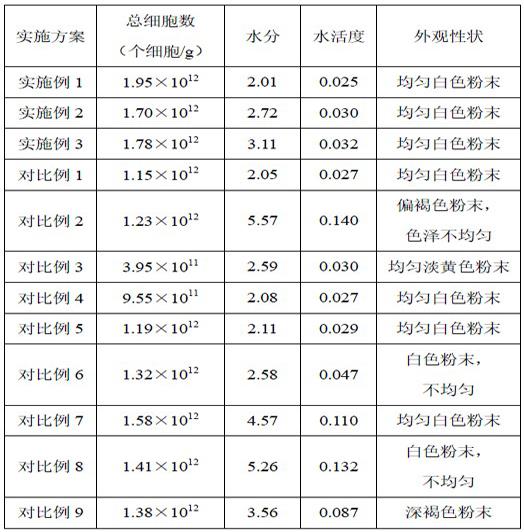
84.实施例4(配方2)本实施例提供一种灭活方法,其与实施例1的区别仅在于调整步骤(2)中热激保护剂的配方,将“明胶1.2重量份”替换为“卡拉胶1.2重量份”,其他参照实施例1。
85.实施例5(配方3)本实施例提供一种灭活方法,其与实施例1的区别仅在于调整步骤(2)中热激保护剂的配方,将“甘氨酸亚铁0.05重量份”替换为“甘氨酸锌0.05重量份”,其他参照实施例1。
86.实施例6(配方4)本实施例提供一种灭活方法,其与实施例1的区别仅在于调整步骤(2)中热激保护剂的配方,将“明胶1.2重量份”替换为“明胶2.4重量份”,其他参照实施例1。
87.实施例7(配方5)本实施例提供一种灭活方法,其与实施例1的区别仅在于调整步骤(2)中热激保护剂的配方,将“明胶1.2重量份”替换为“明胶0.6重量份”,其他参照实施例1。
88.实施例8(配方6)本实施例提供一种灭活方法,其与实施例1的区别仅在于调整步骤(2)中热激保护剂的配方,将“明胶1.2重量份和甘氨酸亚铁0.05重量份”替换为“明胶2重量份和甘氨酸亚铁0.11重量份”,其他参照实施例1。
89.实施例9(配方7)本实施例提供一种灭活方法,其与实施例1的区别仅在于调整步骤(2)中热激保护剂的配方,将“明胶1.2重量份和甘氨酸亚铁0.05重量份”替换为“明胶2重量份和甘氨酸亚铁0.025重量份”,其他参照实施例1。
90.对比例1本对比例提供一种灭活方法,其与实施例1的区别在于,步骤(2)中不对发酵液进行降温处理,而是维持35℃培养温度,其他参照实施例1。
91.对比例2本对比例提供一种灭活方法,其与实施例1的区别仅在于步骤(2)中,降温至15℃
后,对其发酵液ph不进行干预,此时发酵液中ph约为4.0-5.0,其他操作参照实施例1。
92.对比例3本对比例提供一种灭活方法,其与实施例1的区别仅在于步骤(2)中,不添加热激保护剂,其他操作参照实施例1。
93.对比例4本对比例提供一种灭活方法,其与实施例1的区别仅在于步骤(2)中,将“平衡2.5 h”改为“平衡1 h”,其他操作参照实施例1。
94.对比例5本对比例提供一种灭活方法,其与实施例1的区别仅在于步骤(2)中,将“平衡2.5 h”改为“平衡4 h”,其他操作参照实施例1。
95.对比例6本对比例提供一种灭活方法,其与实施例1的区别仅在于步骤(2)的热激保护剂中缺少甘氨酸亚铁,即,将“明胶1.2重量份和甘氨酸亚铁0.05重量份”替换为“明胶1.25重量份”,其他参照实施例1。
96.对比例7本对比例提供一种灭活方法,其与实施例1的区别仅在于步骤(2)的热激保护剂中缺少明胶,即,将“明胶1.2重量份和甘氨酸亚铁0.05重量份”替换为“甘氨酸亚铁0.05重量份”,其他参照实施例1。
97.对比例8本对比例提供一种灭活方法,其与实施例1的区别仅在于将步骤(2)的热激保护剂中的“甘氨酸亚铁”替换为等量的“甘氨酸”,其他参照实施例1。
98.对比例9本对比例提供一种灭活方法,其与实施例1的区别仅在于将步骤(3)的灭活方式“瞬时高温连续灭菌方式”改为“原位高压蒸汽灭菌的方式”(灭菌温度121℃,时间20 min),其他参照实施例1。
99.测试例1采用常规工艺将上述实施例、对比例制得的灭活益生菌发酵物进行连续性高温喷雾干燥,喷雾干燥塔进风温度168℃,出风温度为75℃,真空度-0.022 mpa,冷却,得到灭活益生菌固体。
100.对各组得到的灭活益生菌固体进行测试,包括考察其具备完整结构的总细胞数、包含理化指标(水分、水活度)、产品性状(外观性状、色泽均一性)。
101.具体测试方法为如下:乳酸菌活菌数计数:gb 4789.35其具备完整结构的总细胞数:血球计数板法。
102.水分(%,质量百分含量):gb 5009.3。
103.水活度(aw):gb 5009.238。
104.结果见表1和表2:表1
从表1数据中不难看出,与实施例1相比,在变更相应条件之后,产品质量在不同层面均受到影响,其中(1)在发酵结束后不进行降温将导致细胞代谢生产维持,发生代谢反馈抑制,产生自溶情况,表现为其具备完整结构的总细胞数降低;(2)如果不调节ph将导致发酵液中有效酸度持续上升,酸性物质浓度上升对细胞活性造成显著影响,表现为其具备完整结构的总细胞数降低,而且水分、水活度升高,且严重影响产品外观;(3)不添加热激保护剂会对细胞在后续加工过程中的完整性造成明显影响,导致其具备完整结构的总细胞数的显著降低;(4)同时热激保护剂的平衡时间周期也与其有关联性,不宜过短或过长;(5)保护剂成分也对喷雾干燥效果具有影响,仅添加胶体成分容易导致水分难以挥发,而仅含氨基酸盐则容易导致体系破坏,促进蛋白变性等不利反应,若将氨基酸盐替换成氨基酸,少了盐离子,则同样达不到预期效果,胶体与甘氨酸盐相互配合,显著提升了产品的完整细胞数、改善了产品水活度及外观性状;(6)灭活工艺采用瞬时高温杀菌,相较于原位高压蒸汽灭菌方式,能够极大保持原有氨基酸、维生素等功能性成分结构,降低或避免了美拉德反应产生的不利外观或类黑素物质成分,赋予产品良好的外观性状。
105.表2
由表2数据可知,热激保护剂的配方中胶体、甘氨酸盐的选择以及二者的加入量对产品中完整的细胞存留量具有显著影响,同时对冻干效果的影响也较大,影响产品的水分、水活度,进而导致了产品呈现不同外观性状。其中,明胶与甘氨酸亚铁这种特定组合在提升产品的完整细胞数、改善水活度及外观性状方面,取得了意料不到的协同增效的作用,优于其他热激保护剂选择。此外,胶体与甘氨酸盐的最优加入量为:以菌泥的重量为1份,胶体的加入量为0.8-1.8份,甘氨酸盐的加入量为0.03-0.1份,采用此最优配比方案在提升产品的完整细胞数、改善水活度及外观性状方面取得了最佳的效果。
106.应用例1本应用例提供一种灭活益生菌颗粒制剂的制备方法,具体如下:(1)采用常规工艺将实施例1制得的灭活发酵物进行连续性高温喷雾干燥,喷雾干燥塔进风温度168℃,出风温度为75℃,真空度-0.022 mpa,冷却,得灭活益生菌固体;(2)将灭活益生菌固体进行流化床造粒:表3 配方表(流化床)
具体操作如下:1、将粘合剂、润滑剂(121℃,30分钟高压蒸汽灭菌后)溶于65℃的无菌纯水中搅拌20 min,搅拌速度为100 rpm,得浆料;2、将配方表中的剩余组分混合30 min(常温混合即可),过80目筛,得底料;3、流化床造粒:将底料投入流化床中,进风,使用蠕动泵将浆料通过喷浆通道进行雾化并粘合底料,喷浆过程中要求保持浆料温度不低于40℃,具体参数设置如下:3.1造粒阶段(喷枪杆置设备顶部):表43.2.干燥阶段:表5
3.3.冷却:停止加热,保持进风风量,降温20 min;3.4.出仓:停引风机,关进风管阀门,自动清灰5 min后出仓;4、粉碎过筛:机械粉碎,过50目筛,收集粒径范围为0.15-0.18 mm的颗粒作为最终产品(即灭活益生菌颗粒制剂),其余颗粒可进行二次粉碎或重新回掺造粒。
107.最终产品中完整细胞数不低于1
×
10
12
cells/g,水分不高于3.0%,水活度不高于0.1aw;产品性状为乳白色至淡黄色微颗粒,粒径0.15-0.18 mm,速释效果可满足在水中溶解5-10秒内完全崩解释放,无悬浮或结团现象。
108.为凸显本发明将流化床造粒工艺应用于灭活益生菌制剂中的优势,将步骤(1)经喷雾干燥得到的益生菌固体直接置于水中,作为对比(现有技术一般直接将喷雾干燥得到的益生菌固体用于下游产品),观察其溶解释放效果,结果显示:直接喷雾干燥所得益生菌固体有部分悬浮或结团,结团后快速沉淀至容器底部,崩解释放速率显著与现有技术崩解效果相比差异显著。
109.申请人声明,本发明通过上述实施例、应用例来说明本发明的一种保持细胞结构完整性的益生菌灭活方法及其应用,但本发明并不局限于上述实施例、应用例,即不意味着本发明必须依赖上述实施例、应用例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
110.以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
111.另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1