5,6-二氢苯并咪唑并异喹啉类螺环内酯化合物及其合成方法和应用
1.本发明涉及有机合成领域,具体涉及一种5,6-二氢苯并咪唑并异喹啉类螺环内酯化合物及其合成方法和应用。
背景技术:
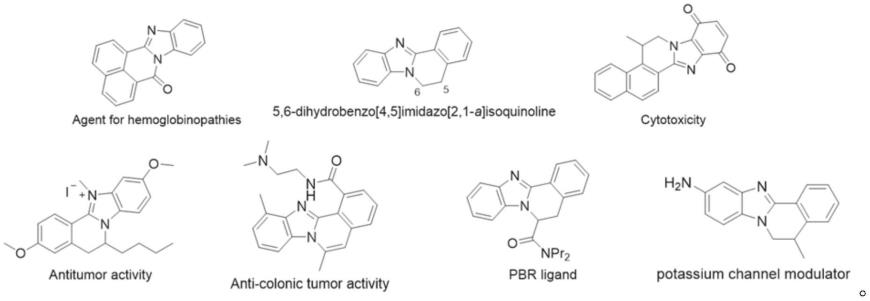
2.稠合苯并咪唑衍生物是普遍存在的结构基序,可以在很多天然和药学上感兴趣的化合物中找到,已被广泛应用于医药、化学等领域。。特别是苯并[4,5]咪唑并[2,1-a]异喹啉骨架,是苯并咪唑家族是许多药物活性化合物和功能材料的核心结构,越来越受到合成化学家和药物化学家的关注。含有苯并[4,5]咪唑并[2,1-a]异喹啉骨架的代表性化合物如下结构所示:
[0003][0004]
由于苯并[4,5]咪唑并[2,1-a]异喹啉及其衍生物的重要性,人们在合成制备这种特殊类型的杂环骨架方面付出了巨大的努力。例如,在文献(the journal of organic chemistry,2014,79:4727-4734)及文献(green chemistry,2019,21:5517-5520)中报道了以下路线的合成策略:
[0005][0006]
此外,大多数关于苯并[4,5]咪唑并[2,1-a]异喹啉骨架集中在苯并[d]咪唑-1-基)丙-2-烯-1-酮部分,该部分在第6位含有羰基。例如:2019年,yu课题组通过银催化脱羧自由基串联环化反应,实现了苯并咪唑并[[2,1-a]异喹啉-6(5h)-酮的构建(chemistry communication,2019,55:2861-2864)。reddy团队使用n-甲基丙烯酰基-2-苯基苯并咪唑与
芳醛进行无金属氧化酸化/环化反应,生成苯并咪唑并[[2,1-a]异喹啉-6(5h)-酮及其衍生物(organic biomolecular chemistry,2019,17:9627-9630)。雷爱文课题组致力于开发锰催化的电化学自由基串联环化反应,以制备苯并咪唑并[[2,1-a]异喹啉-6(5h)-酮(acs cata1yst,2020,10:6676-6681.)。中国专利申请cn113480535a公开了以n-甲基丙烯酰基-2-苯基苯并咪唑与a-羰基烷基溴化合物在可见光照射下以串联自由基环化反应,获得苯并咪唑并[[2,1-a]异喹啉-6(5h)-酮类化合物。中国专利申请cn 114181214 a公开了2-芳基苯并咪唑类化合物与环烷烃类或甲苯类化合物环化制备苯并咪唑并异喹啉酮类化合物的方法。以上现有制备方法可以总结为以下反应式:
[0007][0008]
上述已经报道的制备苯并[4,5]咪唑并[2,1-a]异喹啉的合成方法,大多数都经多步反应转化,并且需要昂贵的催化剂、底物和/或试剂,这大大限制了该类化合物在工业中的进一步应用。
[0009]
并且,目前并没有关于5,6-二氢苯并[4,5]咪唑并[2,1-a]异喹啉类化合物的相关报道,使在产物的第6位为亚甲基(-ch2-);尤其是,5位螺环内酯的化合物更未见报道。为了扩大这种独特骨架在有机和药物化学中的应用,有必要开发一种高效、快速的方法来制备该类5,6-二氢苯并[4,5]咪唑并[2,1-a]异喹啉类螺环内酯化合物。
技术实现要素:
[0010]
针对现有技术的不足,本发明的目的在于提供了一类5,6-二氢苯并[4,5]咪唑并[2,1-a]异喹啉类螺环内酯化合物(即5,6-二氢苯并咪唑并异喹啉类螺环内酯化合物)及其制备方法和应用。
[0011]
一种新的5,6-二氢苯并[4,5]咪唑并[2,1-a]异喹啉类螺环内酯化合物的合成方法,包含以下步骤:
[0012]
取代2-((2-苯基-1h-苯并[d]咪唑-1-基)甲基)丙烯酸酯(1)与醇类化合物在氧化剂存在下,升温进行化学反应,无须金属催化剂,可直接获得5,6-二氢苯并[4,5]咪唑并[2,1-a]异喹啉类螺环内酯化合物。其化学反应式可表述为(式i):
[0013][0014]
其中,
[0015]
r1、r2为所在苯环上的取代基,可以为单取代,也可以为多取代,独立地选自h、甲基、乙基、丙基、叔丁基、卤素;
[0016]
r3为甲基、乙基、丙基、叔丁基;
[0017]
所述的氧化剂为过氧化二苯甲酰(bpo),或者为bpo与其它氧化剂比如过硫酸钾(k2s2o8)、二叔丁基过氧化物(dtbp)、叔丁基过氧化物(tbhp)、过氧苯甲酸叔丁酯(tbpb)中的任意一种或几种的混合物;
[0018]
所述的升温条件为反应温度为50~120℃,反应时间为2-8小时。
[0019]
进一步地,本发明提供的5,6-二氢苯并[4,5]咪唑并[2,1-a]异喹啉类螺环内酯化合物的合成方法,如式i所示,其中,
[0020]
r1、r2为所在苯环上的取代基,可以为单取代,也可以为多取代,独立地为h、甲基、卤素;
[0021]
氧化剂为过氧化二苯甲酰(bpo);
[0022]
所述的升温条件为反应温度为80℃;
[0023]
反应时间为4小时。
[0024]
进一步地,根据上述本发明提供的一种5,6-二氢苯并[4,5]咪唑并[2,1-a]异喹啉类螺环内酯化合物的合成方法,所述氧化剂与原料(1)的比例为1~6:1。
[0025]
更进一步地,所述氧化剂与原料(1)的比例为3:1。
[0026]
本发明还提供所述方法制备所得的5,6-二氢苯并[4,5]咪唑并[2,1-a]异喹啉类螺环内酯化合物,包含以下结构:
[0027][0028]
本发明所述方法制备所得的5,6-二氢苯并[4,5]咪唑并[2,1-a]异喹啉类螺环内酯化合物可以单独使用,也可以用常规的方法制备成药学上可接受的盐使用,所述药学上可接受的盐为盐酸盐、氢溴酸盐、氢碘酸盐、硫酸盐、硫酸氢盐、磷酸盐、乙酸盐、丙酸盐、丁酸盐、草酸盐、酒石酸盐、甲磺酸盐、对甲苯磺酸盐、富马酸盐、牛磺酸盐、柠檬酸盐、琥珀酸盐,或其混合盐。
[0029]
本发明还提供所述方法制备所得的5,6-二氢苯并[4,5]咪唑并[2,1-a]异喹啉类螺环内酯化合物及其在药学上可接受的盐在制备治疗、预防及缓解癌症的药物中的应用,
所述癌症包括但不限于肝癌、脑瘤、肺癌、肾癌。
[0030]
与现有技术相比,本发明具有如下优点:
[0031]
本发明提供的5,6-二氢苯并[4,5]咪唑并[2,1-a]异喹啉类螺环内酯化合物的合成方法原料廉价易得、不需要金属催化剂、反应条件温和、速度快、操作简便、区域选择性高、产率高、有利于工业化生产。同时,由本发明所述的方法获得的5,6-二氢苯并[4,5]咪唑并[2,1-a]异喹啉类螺环内酯化合物具有较好的对肿瘤细胞的增殖抑制活性,并对不同的细胞株表现出一定的选择性,因而,可以在制备治疗、预防及缓解癌症的药物中有所应用,或者作为先导化合物用于设计活性更高的候选分子。
具体实施方式
[0032]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0033]
实施例1.合成条件摸索
[0034]
以2-((2-苯基-1h-苯并[d]咪唑-1-基)甲基)丙烯酸甲酯与乙醇为反应底物,在不同氧化剂、催化剂、反应温度等条件下反应,检测反应收率。反应式如下:
[0035]
[0036][0037]a反应条件:1(0.1mmol),乙醇(2ml),催化剂(10%mol),氧化剂(3.0equiv.),110℃,4hours;
b n.d.:no detect;
c tbhp:5.0
–
6.0mol/l in decane;
[0038]
d n.r.:no reaction;
e the reaction time was prolonged to 8h;
f the amount of bpo was decreased to 2.0equiv.;
g bpo(3.0equiv.),acn(2ml);
[0039]
可见,底物(0.1mmol)与醇类(3.0ml)在氧化剂bpo、无金属催化剂、80℃升温条件下反应4-8h,可以获得比较好的效果。
[0040]
实施例2.合成实验
[0041]
取代2-((2-苯基-1h-苯并[d]咪唑-1-基)甲基)丙烯酸酯(0.1mmol)与醇类(3.0ml)在氧化剂bpo、无金属催化剂、80℃升温条件下反应4h,获得多个5,6-二氢苯并[4,5]咪唑并[2,1-a]异喹啉类螺环内酯化合物。反应方程式如下:
[0042][0043]
产物如下:
d)δ176.17,148.23,143.96,137.78,134.79,131.04,129.03,126.55,125.69,125.54,123.34,123.05,120.20,108.84,83.22,51.83,50.05,48.93,30.75,29.73.
[0050][0051]
3,5',5'-trimethyl-4',5'-dihydro-2'h,6h-spiro[benzo[4,5]imidazo[2,1-a]isoquinoline-5,3'-furan]-2'-one(3d).colorless oil(78%).1h nmr(400 mhz,chloroform-d)δ8.21(d,j=7.9 hz,1h),7.87
–
7.80(m,1h),7.41
–
7.29(m,4h),7.10(s,1h),4.52(d,j=12.4 hz,1h),4.40(d,j=12.4 hz,1h),2.42(d,j=10.1 hz,4h),2.20(d,j=13.9 hz,1h),1.56(s,3h),1.48(s,3h).
13
c nmr(101 mhz,chloroform-d)δ176.37,148.53,144.00,141.68,137.81,134.76,129.84,126.48,126.19,123.10,122.93,122.80,120.05,108.72,83.23,51.84,50.03,48.88,30.75,29.80,21.82.
[0052][0053]
3-fluoro-5'-methyl-4',5'-dihydro-2'h,6h-spiro[benzo[4,5]imidazo[2,1-a]isoquinoline-5,3'-furan]-2'-one(3e).colorless oil(66%).d.r.=1/1.1h nmr(400 mhz,chloroform-d)δ8.40
–
8.32(m,2h),7.87
–
7.79(m,2h),7.41
–
7.31(m,7h),7.28
–
7.16(m,1h),7.05(dd,j=9.2,2.5 hz,1h),6.98
–
6.94(m,1h),4.85(dp,j=9.6,6.2 hz,1h),4.73(dt,j=10.3,5.8 hz,1h),4.61(d,j=12.7 hz,2h),4.47(d,j=12.5 hz,1h),4.41
–
4.32(m,2h),2.71(dd,j=13.7,6.1 hz,1h),2.42(dd,j=13.1,5.4 hz,1h),2.09(dd,j=13.1,10.3 hz,1h),1.92(ddd,j=13.8,9.5,1.4 hz,1h),1.50(dd,j=6.2,3.4 hz,6h).
13
c nmr(101 mhz,cdcl3)δ175.73,175.44,165.53,165.09,163.02,162.57,147.45,147.15,143.99,143.89,138.59,138.51,137.17,137.10,134.69,134.65,129.30,129.21,128.51,128.42,123.39,123.34,123.17,123.12,122.37,121.89,121.86,120.19,120.13,116.67,116.46,113.70,113.46,112.76,112.52,108.98,108.79,74.49,74.45,51.22,50.97,48.97,45.83,45.79,43.16,21.17,20.47.
[0054][0055]
3-bromo-5'-methyl-4',5'-dihydro-2'h,6h-spiro[benzo[4,5]imidazo[2,1-a]isoquinoline-5,3'-furan]-2'-one(3f).d.r.:1:1.1h nmr(400 mhz,chloroform-d)δ8.23(dd,j=19.2,8.3 hz,2h),7.88
–
7.82(m,2h),7.67(ddd,j=11.8,8.3,1.8 hz,2h),7.49(d,j=1.8 hz,1h),7.36(t,j=7.6 hz,7h),4.86(dt,j=9.7,6.1 hz,1h),4.75(dt,j=10.9,5.7 hz,1h),4.62(d,j=12.7 hz,1h),4.47(d,j=12.5hz,1h),4.41
–
4.33(m,2h),
2.71(dd,j=13.7,6.0 hz,1h),2.42(dd,j=13.1,5.3 hz,1h),2.09(dd,j=13.0,10.4 hz,1h),1.94(dd,j=13.7,9.5 hz,1h),1.51(t,j=6.2 hz,6h).
13
c nmr(101 mhz,chloroform-d)δ175.73,175.47,147.01,137.78,136.49,134.67,134.64,132.64,132.45,129.37,128.40,128.08,127.55,125.57,124.88,124.35,123.70,123.65,123.37,123.32,120.30,120.23,109.10,108.90,74.55,74.52,51.06,50.79,49.05,45.86,45.81,43.19,21.16,20.45.
[0056][0057]
3-bromo-5',9,10-trimethyl-4',5'-dihydro-2'h,6h-spiro[benzo[4,5]imidazo[2,1-a]isoquinoline-5,3'-furan]-2'-one(3g).colorless oil(69%).d.r.=1/1.1h nmr(400mhz,chloroform-d)δ8.18(dd,j=19.1,8.3 hz,2h),7.68
–
7.56(m,4h),7.46(d,j=1.9 hz,1h),7.35(d,j=1.9 hz,1h),7.14(d,j=9.3 hz,2h),4.85(dt,j=9.7,6.0 hz,1h),4.73(dp,j=11.7,6.0 hz,1h),4.56(d,j=12.6 hz,1h),4.41(d,j=12.5 hz,1h),4.30(d,j=12.5 hz,2h),2.67(dd,j=13.7,6.0 hz,1h),2.40(d,j=5.5 hz,13h),2.06(dd,j=13.0,10.3 hz,1h),1.90(dd,j=13.7,9.5 hz,1h),1.50(t,j=6.2 hz,6h).
13
c nmr(101 mhz,cdcl3)δ175.86,175.60,146.51,146.23,142.56,142.48,137.53,136.24,133.23,133.13,133.06,132.50,132.31,129.29,128.11,127.98,127.28,125.22,125.00,124.71,124.47,120.26,120.17,109.28,109.10,74.52,74.49,51.12,50.85,49.03,45.85,45.74,43.21,21.14,20.71,20.46.
[0058][0059]
9,10-difluoro-5'-methyl-4',5'-dihydro-2'h,6h-spiro[benzo[4,5]imidazo[2,1-a]isoquinoline-5,3'-furan]-2'-one(3h).colorless oil(65%).d.r.=1/1.1h nmr(400mhz,chloroform-d)δ8.30(ddd,j=19.2,6.8,2.0 hz,2h),7.61(dd,j=10.4,7.2 hz,2h),7.52(ddt,j=13.3,7.5,4.5 hz,4h),7.33(dd,j=7.2,1.8 hz,1h),7.24(dd,j=7.4,1.4 hz,1h),7.17(dt,j=9.5,6.4 hz,2h),4.86(dp,j=9.2,6.3hz,1h),4.72(dp,j=11.7,6.0 hz,1h),4.61(d,j=12.6 hz,1h),4.37(d,j=2.3 hz,2h),4.26(d,j=12.6 hz,1h),2.70(dd,j=13.7,6.3 hz,1h),2.42(dd,j=12.8,5.4 hz,1h),2.07(dd,j=12.9,10.4 hz,1h),1.96(dd,j=13.7,9.1 hz,1h),1.50(dd,j=6.2,4.9 hz,6h).
13
c nmr(101 mhz,chloroform-d)δ176.13,175.82,136.02,134.42,131.69,131.08,129.42,129.18,126.87,126.19,125.98,125.44,124.99,107.71,107.61,107.51,97.14,97.00,74.47,74.42,50.98,50.81,49.41,46.52,46.03,43.34,29.73,21.29,20.41.
[0060][0061]
9,10-dichloro-5'-methyl-4',5'-dihydro-2'h,6h-spiro[benzo[4,5]imidazo[2,1-a]isoquinoline-5,3'-furan]-2'-one(3i).colorless oil(63%).d.r.》25/1.1h nmr(500mhz,chloroform-d)δ8.30
–
8.26(m,1h),7.84(s,1h),7.48
–
7.41(m,3h),7.19
–
7.15(m,1h),4.68
–
4.59(m,1h),4.54(d,j=12.6 hz,1h),4.22(d,j=12.6 hz,1h),2.34(dd,j=12.9,5.3 hz,1h),2.00(dd,j=13.0,10.3 hz,1h),1.42(d,j=6.2 hz,3h).
13
c nmr(126 mhz,chloroform-d)δ175.64,149.66,143.28,134.82,133.97,131.41,129.43,127.36,127.26,127.11,125.02,124.78,121.25,110.43,74.42,50.75,49.34,45.96,20.42.
[0062][0063]
9,10-dichloro-3-fluoro-5',5'-dimethyl-4',5'-dihydro-2'h,6h-spiro[benzo[4,5]imidazo[2,1-a]isoquinoline-5,3'-furan]-2'-one(3j).colorless oil(57%).1h nmr(500 mhz,chloroform-d)δ8.30(dd,j=8.7,5.6 hz,1h),7.90(s,1h),7.47(s,1h),7.23(td,j=8.4,2.5 hz,1h),7.04(dd,j=9.0,2.4 hz,1h),4.52(d,j=12.4 hz,1h),4.33(d,j=12.5 hz,1h),2.42(d,j=14.0 hz,1h),2.24(d,j=14.2 hz,1h),1.60(s,3h),1.51(s,3h).
13
c nmr(126 mhz,chloroform-d)δ175.04,165.35,163.33,149.34,143.22,140.04,133.95,129.24,129.17,127.43,127.24,121.32,121.27,116.78,116.61,113.49,113.30,110.27,83.36,51.68,50.02,48.58,30.74,29.91,29.72.
[0064]
可见,当使用乙醇、正丙醇和异丙醇为反应物时,级联环化反应顺利进行,得到新的含内酯衍生物7a、7b和7c,产率分别为83%、79%和72%。令人欣慰的是,不同的单取代化合物1也可以反应生成不同产率的相应产物,如7d(78%)、7e(66%)和7f(64%)。此外,对于多取代起始材料1也观察到类似的结果,以不同的产率得到产物7g-7j,这表明给电子基团在反应过程中优于吸电子基团。
[0065]
实施例3.2-((n-苯基乙酰氨基)甲基)丙烯酸甲酯与乙醇的反应
[0066]
用实施例2同样的方法,更换原料为2-((n-苯基乙酰氨基)甲基)丙烯酸甲酯(0.1mmol),与乙醇(3ml)在bpo(0.3mmol)存在下于80℃升温条件下反应4h,得到产物3k.
[0067][0068]
1'-乙酰基-5-甲基-4,5-二氢-2h-螺[呋喃-3,3'-二氢吲哚]-2-酮(3k)。无色油状物,收率51%,两种构型比值d/r》25/1.1h nmr(400mhz,cdcl3)δ:8.25(d,j=8.2hz,1h),
7.31(t,j=7.8hz,1h),7.18(t,j=8.8hz,1h),7.06(t,j=7.5hz,1h),4.95(dp,j=11.8,6.0hz,1h),4.59(d,j=10.6hz,1h),3.95(d,j=10.7hz,1h),2.75(dd,j=12.9,5.9hz,1h),2.25(s,3h),2.08(dd,j=12.9,9.8hz,1h),1.53(d,j=6.1hz,3h).
13
c nmr(101mhz,cdcl3)δ:168.31,132.13,129.85,127.92,124.28,122.24,117.59,74.38,58.60,52.84,45.90,24.20,21.33.
[0069]
可见,2-((n-苯基乙酰氨基)甲基)丙烯酸甲酯与乙醇反应也得到了类似的螺环结构的产物3k(51%),证明了优化的反应条件具有广泛的适用性。
[0070]
实施例4.盐酸盐的制备(以化合物3a为例)
[0071]
取化合物3a(100mg),溶于乙酸乙酯5ml中。室温下通入hcl气体至过饱和。降温至0度左右,慢慢析出晶体,为化合物3a的盐酸盐。
[0072]
实施例5.肿瘤细胞的增殖抑制活性—mtt法
[0073]
mtt法又称为mtt比色法,是一种检测细胞存活和生长的方法。其检测原理为活细胞线粒体中的琥珀酸脱氢酶能使得外源性mtt还原为水不溶性的蓝紫色结晶的甲瓒(formazan),并且能够沉积在细胞内,而死细胞却无此功能。二甲基亚砜(dmso)能够溶解细胞中的甲瓒,用酶联免疫检测仪在540nm或720nm波长测定其光吸收值,可间接反映活细胞数量。在一定细胞数范围内,mtt结晶形成的量与细胞数成正比。该方法已广泛应用于一些生物活性因子的活性检测、大规模的抗肿瘤药物的筛选、细胞毒性试验以及肿瘤放射敏感性测定等。它的特点是灵敏度高、经济。
[0074]
实验方法:取对数生长期的肿瘤细胞株(hepg2肝癌、u-87mg脑星形胶质母细胞瘤、h1299人肺癌细胞、786-o人肾透明细胞癌细胞),按4000细胞/孔接种于96孔培养液,设置对照组(dmso)及化合物处理组。化合物浓度最高为50μg/ml,5倍梯度稀释,总共5个浓度,每个浓度三个复孔。化合物作用细胞72小时后,弃去培养液,每孔加入预冷的10%三氯醋酸(tca)溶液100微升固定细胞,4℃冰箱放置1小时,培养液各孔用去离子水洗涤五遍,去除三氯醋酸溶液,在空气中干燥后,每孔加入1%乙酸配制的srb溶液(4mg/ml)50微升,室温下放置20分钟,弃去各孔内液体后用1%乙酸洗涤五遍,洗干净未结合的srb染料后空气干燥,每孔加入ph=10.5的10mm的tris-base(三羟甲基胺基甲烷)溶液100微升溶解,在平板振荡5分钟,酶标仪515nm波长下测定吸光度od值。
[0075]
测得化合物得ic
50
值如下表所示:
[0076]
表1.化合物ic
50
(μm)值
[0077][0078][0079]
可见,对不同的细胞株(hepg2肝癌、u-87mg脑星形胶质母细胞瘤、h1299人肺癌细胞、786-o人肾透明细胞癌细胞),本发明提供的5,6-二氢苯并[4,5]咪唑并[2,1-a]异喹啉类螺环内酯化合物均具有较好的对肿瘤细胞的增殖抑制活性,因而,可以在制备治疗、预防及缓解癌症的药物中有所应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1