一种促进杜鹃兰属植物种子萌发的菌株及其应用的制作方法
1.本发明涉及生物技术领域,尤其涉及一种促进杜鹃兰属植物种子萌发的菌株及其应用。
背景技术:
2.杜鹃兰(学名:cremastra appendiculata(d.don)makino),假鳞茎卵球形或近球形,密接,有关节,外被撕裂成纤维状的残存鞘。叶通常1枚,生于假鳞茎顶端,狭椭圆形、近椭圆形或倒披针状狭椭圆形。花葶从假鳞茎上部节上发出,近直立;总状花序长10-25厘米,具5-22朵花;花瓣倒披针形或狭披针形,向基部收狭成狭线形,先端渐尖;唇瓣与花瓣近等长,线形。蒴果近椭圆形,下垂。花期5-6月,果期9-12月。生于林下湿地或沟边湿地上,海拔1000-2900 米。
3.杜鹃兰具有清热解毒、化痰散结的功效,现代临床上配伍应用于抗肿瘤、抗菌、降压、抗痛风、致突变性、抗血管生成活性、毒覃碱m 3受体阻断作用、抗血管生成的活性,在市场上具有很大的开发潜力。杜鹃兰巨大的药用价值和园艺价值,市场需求量大。但是由于长期遭受掠夺式采挖,且自身生殖机制的限制,使得杜鹃兰的栽培成活率低、繁殖周期长,进而造成杜鹃兰资源濒临枯竭。
4.杜鹃兰种子细小,没有胚乳,自然生长过程中很难直接萌发,萌发率极低,一般只有0-0.01%。目前杜鹃兰主要靠假鳞茎的无性繁殖、蒴果种子的组织培养、蒴果种子的直播方式进行繁育,这几种方法的繁殖率都较低,因此一直限制了杜鹃兰的扩大栽培。
5.由此可见,如何提高其种子萌发率是解决育苗成功率和稳定率的关键。
技术实现要素:
6.有鉴于此,本发明的目的之一是提供一株促进杜鹃兰属植物种子萌发的菌种 tcm-1,以解决杜鹃兰属植物种子萌发率低的问题。
7.本发明通过以下技术手段解决上述技术问题:
8.一株促进杜鹃兰属植物种子萌发的菌种天乐萌发菌1号(tcm-1),所述菌株tcm-1为镰孢菌属真菌,分类学名称为fusarium sp.,该菌株于2021年8月 23日保藏于广东省微生物菌种保藏中心,菌种保藏编号为gdmcc no:61880,保藏地址为广东省广州市先烈中路100号大院59号楼5楼。
9.进一步,所述伴生菌株的its序列如seq id no.1所示,具体为:
[0010]5’‑
tcacttcagaagagttgggtgttttacggcgtggccgcgccgctctccagtcgcgaggtgttagc tactacgcgatggaagctgcggcgggaccgccactgtatttgggggacggcgtgtgcccacggggggct ccgccgatccccaacgccaggcccgggggcctgagggttgtaatgacgctcgaacaggcatgcccgcca gaatactggcgggcgcaatgtgcgttcaaagattcgatgattcactgaattctgcaattcacattactt atcgcatttcgctgcgttcttcatcgatgccagagccaagagatccgttgttgaaagttttaatttatt tgcttgttttactcagaagaaacattatagaaacagagttaggggtcctctggcgggggcggcccgttt cacggggccgtctattcccgccgaagcaac
gtttaggtatgttcac-3’[0011]
进一步,本发明的目的之二是提供所述菌株的具体分离纯化方法。
[0012]
所述菌株从野生的杜鹃兰小苗块茎分离得到,经过纯化、伴种试验筛选所得。所述菌株的具体分离纯化方法为:
[0013]
于贵州省毕节市大方县普底乡红丰村地方采集野生杜鹃兰小苗的假鳞状块茎,将采集的块茎在清水中洗净泥土和杂质,沥干水分,在超净工作台下先在 75%乙醇中浸泡15s,无菌水漂洗3-5次,再在0.1%升汞中浸泡1-2s,无菌水漂洗3-5次。用解剖刀将块茎切成5mm
×
5mm
×
5mm的小块,用无菌滤纸吸干水滴,每个平板放入5块,置于分离培养基中培养,共培养50块块茎。将平板置于25℃培养箱、中黑暗培养14-28天。待菌落从块茎中长出,用接种针挑取菌丝置pda 培养基上,培养7d后观察菌落形态的一致性和均匀性,若菌落形态有差异,进行第二次分离,如此反复直至纯化获得纯培养菌落。分离培养基为马丁-孟加拉红培养基制备方法为:葡萄10g、胰蛋白胨5g、k2hp041 g、mgso4·
7h200.5 g、孟加拉红0.033g、琼脂20g,蒸馏水定容至1000ml,ph 5.0;马铃薯葡萄糖琼脂培养基(pda)制备方法:马铃薯200g,切碎加水煮沸20min后过滤,在马铃薯汁中加入琼脂15g充分溶解,再加入葡萄糖20g,蒸馏水定容至1000 ml。所用试剂均为市售试剂。
[0014]
所述菌株的鉴定方法为:
[0015]
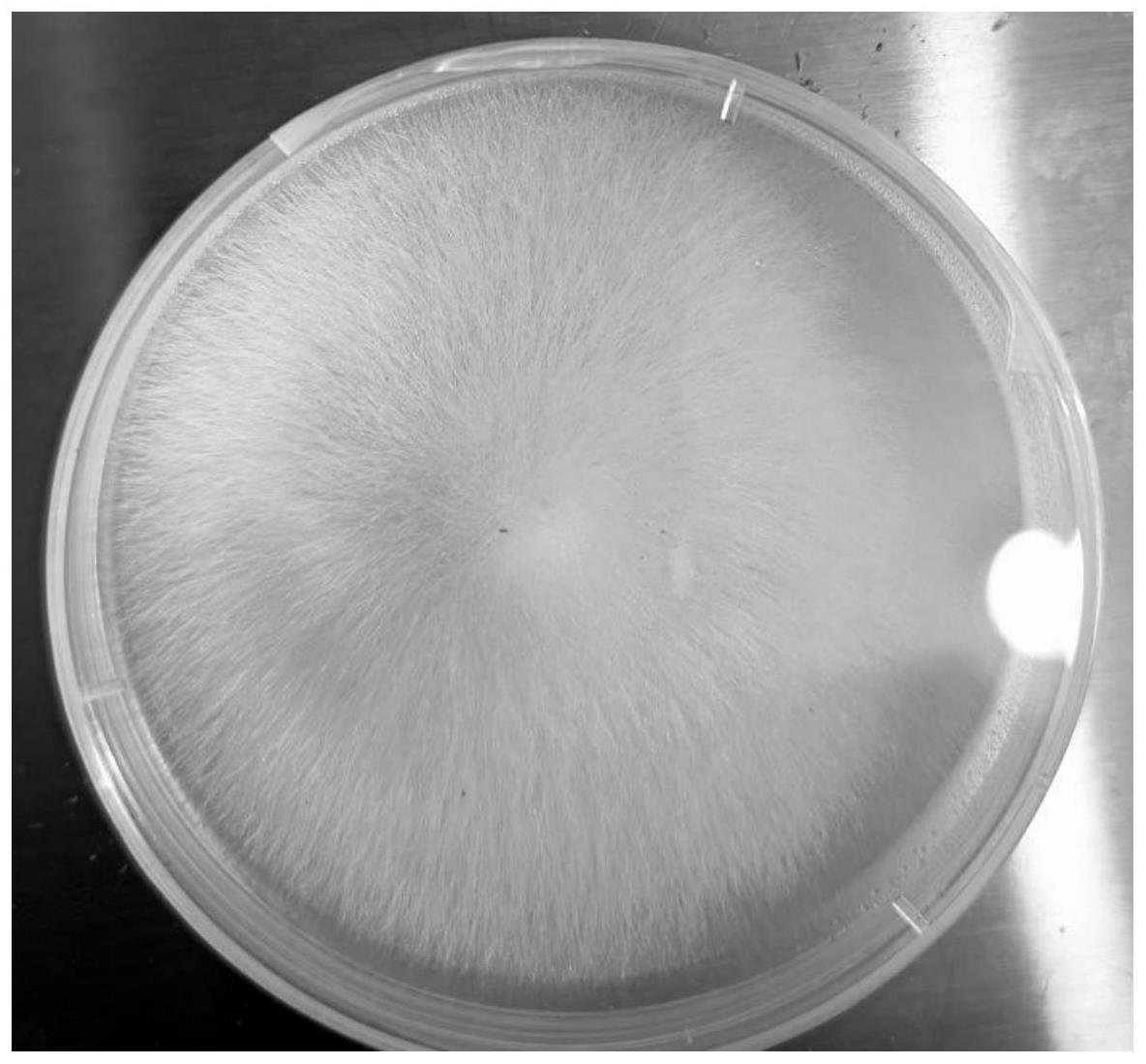
形态观察,所述伴生菌株的菌落形态为:平皿中菌丝白色,呈绒毛状;液体培养菌丝球不规则球形或椭圆形,直径0.4-0.5mm;原种和栽培种菌丝为白色,菌丝稀疏,绒毛状。(见图1-4)
[0016]
分子鉴定,(1)真菌基因组dna提取
[0017]
用生工生物工程(上海)股份有限公司生产的基因组dna抽提试剂盒提取菌株的基因组dna,用1.0%琼脂糖凝胶电泳检测dna的浓度、纯度与完整性。
[0018]
(2)pcr反应体系
[0019]
核糖体dna的its区域通用引物由生工生物工程(上海)股份有限公司合成,引物系列为:its1 5
′‑
tccgtaggtgaacctgcgg-3
′
, its4 5
′‑
tcctccgcttattgatatgc-3
′
。
[0020]
pcr反应体系:template(基因组dna20-50ng/μl)0.5μl、10
×
buffer(with mg
2+
)2.5μl、dntp(各2.5mm)1μl、酶0.2μl、引物f(10um)0.5μl、引物r(10 um)0.5μl、加双蒸h2o至25μl。
[0021]
pcr循环条件为:94℃预变性4min,(94℃45sec,55℃45sec,72℃1min)30 个循环,72℃修复延伸10min,4℃终止反应。
[0022]
凝胶电泳:用1.0%的琼脂糖凝胶电泳检测反应产物浓度及pcr扩增片段大小,150v、100ma20min。凝胶电泳图见附图11。
[0023]
纯化回收:pcr产物电泳条带切割所需dna目的条带,用生工生物工程(上海)股份有限公司的dna产物回收试剂盒进行pcr产物的回收。
[0024]
(3)分子测序与菌种鉴定回收后的pcr产物送生工生物工程(上海)股份有限公司进行测序。所得的its核苷酸序列在ncbi上进行同源性比较,以相似性99%及以上为标准,进行菌种的分子鉴定,鉴定为fusarium(镰孢菌属),具体为fusarium solani(腐皮镰孢菌)。
[0025]
本发明的目的之三是提供菌株在促进杜鹃兰属植物种子萌发上的应用。尤其涉及
菌株在促进杜鹃兰属植物种子萌发和幼苗形成中的应用,所述幼苗是指种子萌发形成至少一个叶片。
[0026]
进一步,所述应用包括以下步骤,
[0027]
s1:制备固定菌床,于9-10月份,在郁闭度0.2-0.5的树林下制备固定菌床,挖育苗坑,先在坑底均匀撒拨保藏编号为gdmcc no:61880的菌种,再将直径3-5cm的木材,平铺在菌种上面,撒上一层树叶,然后撒覆土培养,待30天后菌种萌发;
[0028]
s2:播种,10月-11月初进行杜鹃兰蒴果播种,选择野生或人工授粉获得的成熟但尚未开裂的杜鹃兰蒴果,将其中的种子撒播于提前制作好的菌床之上,然后覆上腐疏松腐殖土,再覆盖枯松针;
[0029]
s3:林间管理,播种好后离地2米搭遮阳棚,遮阳网密度为6针;
[0030]
s4:生长期管理,一般30天种子萌发,90天出土,观察种子出土后,揭去松针,让幼苗顺利出土,期间控制中午光照控制在1000-1500lx,温度15-25℃,土壤湿度50%-70%,空气湿度70%-90%;
[0031]
s5:移栽,待杜鹃兰幼苗生长至叶片10cm时,进行移栽。
[0032]
进一步,步骤s1所述的保藏编号为gdmcc no:61880的菌种的用量为 1-1.5kg/
㎡
。
[0033]
进一步,步骤s1所述的木材为阔叶树木,可优选青杠、化槁、毛栗中的一种或多种,所述木材的用量为10-12kg/
㎡
,所述树叶为阔叶树树叶,可优选青杠树叶、毛栗树叶中的一种或多种,所述树叶的用量为1-1.5kg/
㎡
。
[0034]
进一步,步骤s2所述的杜鹃兰蒴果的播种用量为3-5个/
㎡
。所用覆土为 2-4cm,并且是树林中表土层树木的枯枝残叶,经过较长时间腐烂发酵后所形成的腐殖土;所覆盖枯松针为1-2cm,同时为自然掉落后风干后的马尾松松叶。
[0035]
本发明的有益效果:本发明以杜鹃兰属植物蒴果为育苗材料,通过伴生菌种筛选出保藏编号为gdmcc no:61880的镰孢菌属真菌菌株,将此菌株制作成栽培种,然后制作固定菌床,进行伴生播种,使杜鹃兰属植物种子播种萌发率由0.01%提高至20%,育苗成功率100%。本发明解决了杜鹃兰属植物种子自然萌发率低的问题,提高了育种的可靠性和稳定性,该方法操作简单、成本低、无污染,对杜鹃兰属植物的育苗和规模化生产具有突破性的意义,同时也对其他兰科植物的育苗提供了可供参考的经验。
附图说明
[0036][0037]
图1是镰孢菌属真菌fusarium sp.菌株(保藏编号为gdmcc no:61880)在 pda平板上培养形成的菌落,可见菌丝形态特征。
[0038]
图2是镰孢菌属真菌fusarium sp.菌株(保藏编号为gdmcc no:61880)液体菌种菌丝形态特征图;
[0039]
图3是本发明原种菌丝形态特征图;
[0040]
图4是栽培种菌丝形态特征图;
[0041]
图5是实施例1中林下播种图;
[0042]
图6是实施例2中林下播种图;
[0043]
图7是实施例1中杜鹃兰种子萌发及幼苗生长图;
[0044]
图8是实施例1中杜鹃兰幼苗成苗图;
[0045]
图9是实施例2中国杜鹃兰种子萌发图
[0046]
图10是实施例2中杜鹃兰幼苗成苗图;
[0047]
图11分子鉴定过程的pcr凝胶电泳图。
具体实施方式
[0048]
以下将结合实施例对本发明进行详细说明,但并不作为对本发明限制的依据。
[0049]
实施例1:菌株的分离、纯化、鉴定
[0050]
菌株的分离、纯化:于贵州省毕节市大方县普底乡红丰村地方采集野生杜鹃兰小苗的假鳞状块茎,将采集的块茎在清水中洗净泥土和杂质,沥干水分,在超净工作台下先在75%乙醇中浸泡15s,无菌水漂洗3次,再在0.1%升汞中浸泡2s,无菌水漂洗5次。用解剖刀将块茎切成5mm
×
5mm
×
5mm的小块,用无菌滤纸吸干水滴,每个平板放入5块,置于分离培养基中培养,共培养50块块茎。将平板置于25℃培养箱、中黑暗培养20天。待菌落从块茎中长出,用接种针挑取菌丝置 pda培养基上,培养7d后观察菌落形态的一致性和均匀性,若菌落形态有差异,进行第二次分离,如此反复直至纯化获得纯培养菌落。分离培养基为马丁-孟加拉红培养基制备方法为:葡萄10g、胰蛋白胨5g、k2hp041 g、mgso4·
7h20 0.5 g、孟加拉红0.033g、琼脂20g,蒸馏水定容至1000ml,ph 5.0;马铃薯葡萄糖琼脂培养基(pda)制备方法:马铃薯200g,切碎加水煮沸20min后过滤,在马铃薯汁中加入琼脂15g充分溶解,再加入葡萄糖20g,蒸馏水定容至1000 ml。所用试剂均为市售试剂。
[0051]
菌株的鉴定方法为:
[0052]
形态观察,所述伴生菌株的菌落形态为:平皿中菌丝白色,呈绒毛状;液体培养菌丝球不规则球形或椭圆形,直径0.4-0.5mm;原种和栽培种菌丝为白色,菌丝稀疏,绒毛状。(见图1-4)
[0053]
分子鉴定,(1)真菌基因组dna提取
[0054]
用生工生物工程(上海)股份有限公司生产的基因组dna抽提试剂盒提取菌株的基因组dna,用1.0%琼脂糖凝胶电泳检测dna的浓度、纯度与完整性。
[0055]
(2)pcr反应体系
[0056]
核糖体dna的its区域通用引物由生工生物工程(上海)股份有限公司合成,引物系列为:its1 5
′‑
tccgtaggtgaacctgcgg-3
′
, its4 5
′‑
tcctccgcttattgatatgc-3
′
。
[0057]
pcr反应体系:
[0058]
[0059]
pcr循环条件为:
[0060][0061]
凝胶电泳:用1.0%的琼脂糖凝胶电泳检测反应产物浓度及pcr扩增片段大小,150v、100ma20min。凝胶电泳图见附图11。
[0062]
纯化回收:pcr产物电泳条带切割所需dna目的条带,用生工生物工程(上海)股份有限公司的dna产物回收试剂盒进行pcr产物的回收。
[0063]
(3)分子测序与菌种鉴定回收后的pcr产物送生工生物工程(上海)股份有限公司进行测序。所得的its核苷酸序列在ncbi上进行同源性比较,以相似性99%及以上为标准,进行菌种的分子鉴定,鉴定为fusarium(镰孢菌属),具体为fusarium solani(腐皮镰孢菌)。
[0064]
本实施例分离出的天乐萌发菌1号(tcm-1),于2021年8月23日保藏于广东省微生物菌种保藏中心,菌种保藏编号为gdmcc no:61880,保藏地址为广东省广州市先烈中路100号大院59号楼5楼。
[0065]
实施例2:杜鹃兰属植物菌种伴生育苗的方法一
[0066]
本实施例在贵州省毕节市大方县普底基地进行,具体在郁闭度为0.4的青杠杂木林下作为育苗基地进行育苗,育苗基地海拔高度1820米,林地土壤疏松透气,土层厚,有6cm以上的腐殖质层。本实施例中播撒菌种育苗实验面积为4亩,未播撒菌种的对照实验为1亩。
[0067]
制备固定菌床:于2019年9月14日到22日,在烂泥沟普底基地青杠杂木林林下挖长100cm
×
宽80cm
×
深10cm的育苗坑,相邻育苗坑间距20cm,行间距为 20cm,在坑底均匀播撒本发明实施例1分离纯化的保藏编号为gdmcc no:61880 的菌种,菌种用量为1kg/
㎡
,再将直径3-5cm的青杠木材按照10kg/
㎡
的用量平铺在菌种上面,然后青杠木材上撒上一层青杠树叶,再覆土2-3cm后培养。
[0068]
播种:固定菌床制作完毕,于2019年10月15日到20日,开始进行蒴果播种。准备3000粒人工授粉获得的成熟但尚未开裂的杜鹃兰蒴果,将种子撒播于上述提前制作好的固定菌床之上,以行株距20cm
×
20cm的距离打窝,每窝播种 3个蒴果,然后覆上当地树林中收集的腐疏松腐殖土3-5cm,再覆盖自然掉落后风干后的马尾松松叶枯松针2-3cm。
[0069]
林间管理:播种好后离地2米搭遮阳棚,遮阳网密度为6针。
[0070]
生长期管理:在播种后每间隔10天进行一次观察,发现30天种子开始萌发, 98天后观察到种子开始出土记录发芽率,此时揭去松针,让幼苗顺利出土。当种子萌发出土后形成第一个叶片时,记录幼苗成活率。
[0071]
需要注意的是,管理期间需要做好整个过程的光照、温度、湿度管理,中午控制光照在1000-1500lx、温度15-25℃、土壤湿度50%-70%、空气湿度70%-90%。
[0072]
2020年6月,在杜鹃兰幼苗生长至叶片10cm时,进行移栽。
[0073]
对照实验:对照实验于相同基地内进行,土质、生境情况相同,实验面积为 1亩,与实验组的操作仅在制备固定菌床步骤中不同,其余步骤相同。对照实验的固定菌床步骤具体操作如下:
[0074]
于2019年9月14日到22日,在烂泥沟普底基地青杠杂木林林下挖长100cm
×
宽80cm
×
深10cm的育苗坑,相邻育苗坑间距20cm,行间距为20cm,将直径3-5cm 的青杠木材按照10kg/
㎡
的用量平铺在育苗坑底,然后青杠木材上撒上一层青杠树叶,再覆土2-3cm后培养。
[0075]
实施例3:杜鹃兰属植物菌种伴生育苗的方法二
[0076]
本实施例在贵州省毕节市大方县九层崖基地进行,具体在郁闭度0.3-0.4的青杠杂木林下作为育苗基地进行育苗,育苗基地海拔高度1620米,林地土壤疏松透气,土层厚,有5cm以上的腐殖质层。本实施例中播撒菌种育苗实验面积为2亩,未播撒菌种的对照实验为1亩。
[0077]
制备固定菌床:于2020年9月22日到29日,在九层崖普底基地青杠杂木林林下挖长80cm
×
宽度80cm
×
深10cm的育苗坑,相邻育苗坑间距20cm,行间距为20cm,在坑底均匀播撒本发明实施例1分离纯化的保藏编号为gdmcc no:61880 的菌种,菌种用量为1kg/
㎡
,再将直径3-5cm的青杠木材按照10kg/
㎡
的用量平铺在菌种上面,然后青杠木材上撒上一层青杠树叶,再覆土2-3cm后培养。
[0078]
播种:固定菌床制作完毕,于2020年10月24日到28日,开始进行蒴果播种。准备2000粒人工授粉获得的成熟但尚未开裂的杜鹃兰蒴果,将种子撒播于上述提前制作好的固定菌床之上,以行株距20cm
×
20cm的距离打窝,每窝播种 3个蒴果,然后覆上当地树林中收集的腐疏松腐殖土3-5cm,再覆盖自然掉落后风干后的马尾松松叶枯松针2-3cm。
[0079]
林间管理:播种好后离地2米搭遮阳棚,遮阳网密度为6针。
[0080]
生长期管理:在播种后每间隔10天进行一次观察,发现30天种子开始萌发, 89天后观察到种子开始出土记录发芽率,此时揭去松针,让幼苗顺利出土。当种子萌发出土后形成第一个叶片时,记录幼苗成活率。
[0081]
需要注意的是,管理期间需要做好整个过程的光照、温度、湿度管理,中午控制光照在1000-1500lx、温度15-25℃、土壤湿度50%-70%、空气湿度70%-90%。
[0082]
2021年5月,在杜鹃兰幼苗生长至叶片10cm时,进行移栽。
[0083]
对照实验:对照实验于相同基地内进行,土质、生境情况相同,实验面积为 1亩,与实验组的操作仅在制备固定菌床步骤中不同,其余步骤相同。对照实验的固定菌床步骤具体操作如下:
[0084]
制备固定菌床:于2020年9月22日到29日,在九层崖普底基地青杠杂木林林下挖长80cm
×
宽度80cm
×
深10cm的育苗坑,相邻育苗坑间距20cm,行间距为20cm,将直径3-5cm的青杠木材按照10kg/
㎡
的用量平铺在育苗坑底,然后青杠木材上撒上一层青杠树叶,再覆土2-3cm后培养。
[0085]
根据实施例1和实施例2记录的种子萌发率和幼苗成活率计算平均种子萌发率和幼苗成活率,得到的结果如表1所示。
[0086]
表1种子萌发率和幼苗成活率
[0087][0088]
数据分析:
[0089]
实施例1和实施例2中播撒本发明伴生菌种培育的杜鹃兰种子萌发率分别达到18%、21%,而实施例1和实施例2未播撒本发明的伴生菌种(对照)的杜鹃兰种子萌发率仅分别为0.01%、0.008%,应用本菌种杜鹃兰的萌发率显著高于对照处理,实施例1、实施例2中种子萌发后移栽培育的幼苗均成活,育苗成功率 100%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1