一种有机小分子NIR-II荧光染料、纳米颗粒及其制备方法与应用
一种有机小分子nir-ii荧光染料、纳米颗粒及其制备方法与应用
技术领域
1.本发明属于生物医药工程领域,更具体地,涉及一种有机小分子nir-ii荧光染料、纳米颗粒及其制备方法与应用。
背景技术:
2.癌症是最具生命威胁的疾病之一,预计在未来几十年内将成为死亡的主要原因和延长寿命的最大障碍。目前,两种常用的治疗方法,放疗和化疗,通常伴有广泛的副作用。因此,对非侵入性和选择性治疗的研究一直是医学相关领域的热门话题。光学治疗由于具有高安全性、高选择性等优点,近年来被广泛用于癌症肿瘤中。在光疗过程中,无毒的光疗剂可以在光照下被激活,从而选择性地杀死癌细胞,而不会引起严重的副作用。通过对光疗剂的精心设计和对病变部位(如肿瘤组织)光照的良好控制,可以实现光疗的双重“选择性”,从而降低传统化疗和放疗中的全身毒性。光热疗法(ptt),作为光学治疗中的一种,其依靠具有光热效应的纳米材料将光转化为热从而杀死癌细胞,可有效避免对正常细胞产生的毒副作用。
3.癌症部位的精准成像诊断对癌症的诊疗具有重要意义。与传统近红外一区荧光成像技术存在的组织穿透深度不高、空间分辨率低、成像质量有限相比,近红外二区荧光成像(nir-ii,1000-1700nm)技术因为其较长的波段范围,组织对光子的吸收、散射显著减少,此外还具有较低的组织自发荧光等特点,从而可以实现活体内更深层次更高分辨率的成像诊断。nir-ii区域可以继续分为三个子窗口:nir-iia’(1000-1300nm)、nir-iia(1300-1400nm)及nir-iib(1500-1700nm),且随着波长的增加成像质量增加。目前已经报道了系列有机小分子nir-ii荧光染料用于nir-ii荧光成像指导的光热治疗,但依然存在合成复杂、不可降解、吸光能力不足、成像波长仅仅位于nir-iia’区域、治疗效果不理想等问题,因此仍然需要设计开发新型高效有机小分子nir-ii荧光染料。
技术实现要素:
4.本发明的目的是针对以上不足,提供一种有机小分子近红外二区荧光染料,并公开了纳米颗粒及其制备方法与应用,其合成简单,具有良好水溶性、生物相容性,在激光照射下,有优异的近红外二区荧光成像能力和光热转换性能,且在肿瘤微环境中可以缓慢降解,大大降低材料的毒副作用。
5.为实现上述目的,本发明是通过以下技术方案实现的:
6.本发明提供了一种有机小分子近红外二区荧光染料,该染料为吡咯并吡咯二酮单元衍生物dpp-ss,其结构式如式1所示:
[0007][0008]
本发明还提供了上述有机小分子近红外二区荧光染料的制备方法,包括以下步骤:
[0009]
将3-(二氰基亚甲基)靛酮和5'-溴-[2,2'-联噻吩]-5-甲腈混合,再加入三氯甲烷,65℃反应8h,在真空下除去溶剂后,柱色谱提纯,得到1-(5
’‑
溴-[2,2
’‑
联噻吩]-5基)-9-羰基-3-(哌啶-1-基)-9h-茚并[2,1-c]吡啶-4-腈;
[0010]
将3,6-双(5-溴噻吩-2-基)-2,5-双(2-辛基十二烷基)-2,5-二氢吡咯并[3,4-c]吡咯-1,4-二酮和1-(5
’‑
溴-[2,2
’‑
联噻吩]-5基)-9-羰基-3-(哌啶-1-基)-9h-茚并[2,1-c]吡啶-4-腈加入无水甲苯中,在氮气氛围下加入催化剂四(三苯基膦)钯,加热搅拌,除去溶剂,柱色谱分离后,制得dpp-ss。
[0011]
其合成路线为:
[0012][0013]
优选的,上述制备方法中,所述3-(二氰基亚甲基)靛酮与5'-溴-[2,2'-联噻吩]-5-甲腈的摩尔比为1:1,所述3,6-双(5-溴噻吩-2-基)-2,5-双(2-辛基十二烷基)-2,5-二氢吡咯并[3,4-c]吡咯-1,4-二酮与1-(5
’‑
溴-[2,2
’‑
联噻吩]-5基)-9-羰基-3-(哌啶-1-基)-9h-茚并[2,1-c]吡啶-4-腈的摩尔比为1:2.2。
[0014]
本发明还提供了一种上述有机小分子近红外二区荧光染料的纳米颗粒,即dpp-ss纳米颗粒,是基于式1所述的dpp-ss,利用两亲性聚合物f127及纳米共沉淀法制备得到的。
[0015]
上述dpp-ss纳米颗粒在水溶液中,其最大吸收峰在750nm,最大荧光发射峰在1100nm,且能延伸到nir-iia(1300-1400nm)区域可用于nir-iia荧光成像。
[0016]
上述dpp-ss纳米颗粒,在近红外激光的照射下,具有优异的光热转换性能,能够有效的杀死癌细胞,可用于近红外二区荧光成像指导下的癌症光热治疗。
[0017]
本发明还提供了上述有机小分子近红外二区荧光染料的纳米颗粒,的制备方法,包括以下步骤:
[0018]
将dpp-ss溶于thf中得到dpp-ss的thf溶液;
[0019]
将f127溶于去离子水中得到f127水溶液;
[0020]
在对f127水溶液超声的同时,快速注入dpp-ss的thf溶液,再将混合溶液超声4~5分钟;
[0021]
用氮气除去溶液中含有的thf,过滤,制得dpp-ss纳米颗粒水溶液。
[0022]
优选的,上述制备方法中,所述dpp-ss与f127的质量比为1:20。
[0023]
本发明还提供了一种上述有机小分子近红外二区荧光染料在制备808nm激光照射下近红外二区荧光成像造影剂中的应用,是指将其纳米颗粒水溶液作为808nm激光激发的近红外二区荧光成像造影剂。
[0024]
本发明还提供了一种上述有机小分子近红外二区荧光染料在制备近红外二区荧光成像指导的癌症光热治疗试剂中的应用,是指使用其纳米颗粒制备近红外二区荧光成像指导的癌症光热治疗试剂。
[0025]
与现有技术相比,本发明的有益效果为:
[0026]
本发明合成了一种有机小分子近红外二区荧光染料dpp-ss,其结构明确,吸收及荧光发射光谱分别位于近红外一区及近红外二区,且其荧光发射光谱延伸至nir-iia(1300-1400nm)区域,可以用于nir-iia荧光成像此外,该小分子可在肿瘤微环境中缓慢降解,大大降低材料的毒副作用。
[0027]
本发明所述dpp-ss的纳米颗粒,具有良好的水溶性和生物相容性,在808激光照射下,该纳米颗粒具有优异的nir-iia荧光成像能力,可以实现癌症部位实时高分辨成像诊断;此外,在激光照射下,该纳米颗粒同时表现出优异的光热转换性能,可以高效杀死癌细胞。
[0028]
本发明设计的有机小分子近红外二区荧光染料为近红外二区荧光成像指导下的癌症光热治疗提供了依据并为未来的癌症临床治疗应用提供了有力支持。
附图说明
[0029]
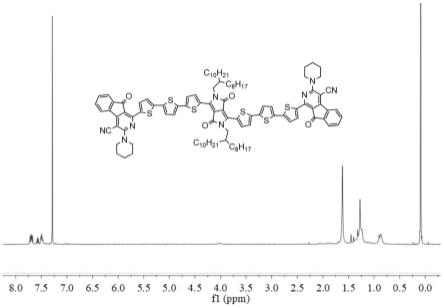
图1为本发明实施例1制备的dpp-ss的1h nmr谱图;
[0030]
图2为本发明实施例2制备的dpp-ss纳米颗粒水溶液的吸收、荧光发射谱图;
[0031]
图3为实施例所述不同浓度dpp-ss纳米颗粒水溶液近红外二窗荧光成像图;
[0032]
图4为实施例所述不同浓度dpp-ss纳米颗粒水溶液在同一光照功率密度下光热温度随时间变化图;
[0033]
图5为实施例所述相同浓度dpp-ss纳米颗粒水溶液在不同光照功率密度下光热温度随时间变化图;
[0034]
图6为实施例所述dpp-ss纳米颗粒水溶液的升/降温光热循环图;
[0035]
图7为实施例所述dpp-ss纳米颗粒在体外对癌细胞的细胞毒性图。
具体实施方式
[0036]
下面将结合附图和具体实施例更详细地描述本发明的优选实施方式。
[0037]
本发明的实施例所使用的试剂皆为市购,所使用的仪器分别为:
[0038]
近红外二窗荧光成像仪:nirvana 640-princeton instrument
[0039]
红外热成像仪:testo869
[0040]
激光器:mdl-ih-808-5w-psu-ii-led
[0041]
实施例1
[0042]
一种有机小分子近红外二区荧光染料,该染料为吡咯并吡咯二酮单元衍生物dpp-ss,其结构式如式1所示:
[0043][0044]
所述dpp-ss的合成路线为:
[0045][0046]
其具体的合成步骤如下:
[0047]
a1、将3-(二氰基亚甲基)靛酮(化合物1,100mg,0.51mmol)与5'-溴-[2,2'-联噻吩]-5-甲腈(化合物2,140mg,0.51mmol)加入反应瓶中,再加入哌啶1滴,三氯甲烷10ml,在65℃实验条件下反应8h,最后经过萃取、洗涤、旋蒸等步骤去除反应溶剂,再通过柱色谱法提纯,得到黄色固体1-(5
’‑
溴-[2,2
’‑
联噻吩]-5基)-9-羰基-3-(哌啶-1-基)-9h-茚并[2,1-c]吡啶-4-腈(化合物3,240mg,90%);
[0048]
a2、将3,6-双(5-溴噻吩-2-基)-2,5-双(2-辛基十二烷基)-2,5-二氢吡咯并[3,4-c]吡咯-1,4-二酮(化合物4,50mg,0.042mmol)与1-(5
’‑
溴-[2,2
’‑
联噻吩]-5基)-9-羰基-3-(哌啶-1-基)-9h-茚并[2,1-c]吡啶-4-腈(化合物3,45mg,0.085mmol),四(三苯基膦)钯
(5mg,0.0043mmol)加入反应管中,抽鼓氮气三次,使装置在氮气氛围里,加入甲苯10ml,在100℃实验条件下反应24h,反应液变为绿色。最后经过萃取、洗涤、旋蒸等步骤去除反应溶剂,再通过柱色谱法提纯,得到墨绿色固体化合物dpp-ss(50mg,67.5%)。其1h nmr谱图如图1所示。
[0049]
实施例2
[0050]
1.一种实施例1所述的有机小分子近红外二区荧光染料dpp-ss的纳米颗粒,其制备方法如下:
[0051]
称取dpp-ss化合物(1mg)充分溶于四氢呋喃(thf,1ml)溶液中,另外称取f127(20mg)充分溶于去离子水(10ml)中,然后,在对f127水溶液超声的同时,注射器快速注入dpp-ss的thf溶液,一边超声一边注入,将混合溶液超声4分钟。最后用氮气对混合溶液液面进行吹扫以除去溶液中含有的thf。将得到的纳米粒子溶液先滤膜过滤一遍再进行超滤,以得到定量的淡蓝色dpp-ss-nps水溶液。吸收、发射如图2所示,其荧光发射可以延伸到nir-iia区域。
[0052]
2.近红外二区荧光成像
[0053]
配制浓度分别为0.2mg/ml、0.1mg/ml、0.05mg/ml、0.025mg/ml、0.013mg/ml的上述dpp-ss纳米颗粒水溶液0.2ml,放置于小离心管中,在近红外二窗荧光成像仪下,用波长为808nm的激光激发,得到近红外二窗荧光成像,如图3所示。以ir-1061为参比,dpp-ss纳米颗粒荧光量子效率经测量为0.58%。
[0054]
3.光热性能的测试
[0055]
利用红外温敏相机研究浓度及功率密度对此纳米颗粒光热性能的影响。
[0056]
首先,在250μl离心管中分别加入200μl的去离子水、浓度分别为20、40、60、80和100μg/ml的dpp-ss纳米颗粒水溶液,并将离心管放置于激光器(808nm,1w/cm2)下照射,由红外温敏相机记录测试温度随时间变化的趋势(图4);
[0057]
然后,测试一定浓度下的dpp-ss纳米颗粒水溶液(100μg/ml)在功率密度分别为0.25、0.5、0.75和1.0w/cm2激光(808nm)照射下温度随时间变化曲线(图5);
[0058]
最后,考察了此dpp-ss纳米颗粒的光热循环稳定性(图6)。
[0059]
如图4所示,相同的激光功率照射,浓度越大温度越高。如图5所示,相同的浓度,激光功率越大温度越高。如图6所示,dpp-ss纳米粒子具有优异的光热稳定性。dpp-ss纳米粒子光热转换效率经测量为41.5%。综上表明该dpp-ss纳米粒子具有优异的光热性能。
[0060]
4.体外细胞毒性测试
[0061]
为了测量dpp-ss纳米颗粒的体外癌细胞毒性,用不同浓度dpp-ss纳米颗粒水溶液(20、40、60、80和100μg/ml)与癌细胞共孵育,然后分为两组,第一组不用激光照射,第二组用808nm(1w/cm2)激光照射,之后使用多功能酶标仪测量490nm处的吸光度,再计算出不同浓度对应的细胞存活率,如图7所示,没有激光照射下,即使在高浓度下细胞生存率依然大于80%,表明该纳米颗粒具有良好的生物相容性。当用激光照射后,细胞生存率大大降低,表明此时纳米颗粒对癌细胞具有较好的杀伤效果。
[0062]
以上已经描述了本发明的各实施例,上述说明是示例性的,并非穷尽性的,并且也不限于所披露的各实施例。在不偏离所说明的各实施例的范围和技术原理的情况下,对于本技术领域的普通技术人员来说许多修改和变更都是显而易见的,这些修改和变更也应视
为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1