一种具有CD47/SIRPα阻断效果的母体肽或衍生肽及其应用
一种具有cd47/sirp
α
阻断效果的母体肽或衍生肽及其应用
技术领域
1.本发明涉及生物医药领域,特别涉及一种具有cd47/sirpα阻断效果的母体肽或衍生肽及其应用。
背景技术:
2.先天免疫反应是机体抵抗感染和恶性肿瘤的第一道防线,而巨噬细胞作为先天免疫系统的关键组成成分之一,是通过识别暴露于目标细胞表面的“吃我”信号和“别吃我”信号来调节的吞噬作用,其中,充当“别吃我”信号的是跨膜蛋白cd47,cd47通过与受体信号调节蛋白α(sirpα)结合向循环中的巨噬细胞传递“别吃我”的信号,从而避免被吞噬细胞清除。然而,肿瘤细胞利用表面过度表达cd47来阻断吞噬作用从而逃避免疫监视进行免疫逃逸。现在越来越多的研究表明cd47表达与肿瘤患者的临床特征以及预后关系密切,例如,在ki-67》40%的高危肺神经内分泌肿瘤患者中,cd47的高表达预示着较差的无进展生存期。而且cd47的表达也与结直肠腺癌的不良临床病理特征和不良预后呈正相关。因此,cd47分子在肿瘤免疫过程中传递的关键负性免疫信号成为了研究热点。
3.sirpα胞质结构域内含有免疫受体酪氨酸基抑制基序(itims),这些基序被磷酸化后会招募含有src同源2结构域(sh2)的蛋白酪氨酸磷酸酶(shp)-1和shp-2。cd47与sirpα的结合触发了对下游磷酸酶的招募,传递负性调节信号,从而阻止了巨噬细胞的吞噬。目前,有研究表明使用cd47阻断抗体干扰cd47/sirpα相互作用可显著增强巨噬细胞在体外吞噬肿瘤细胞的能力,在治疗实体瘤或血液恶性肿瘤展现出良好的抗肿瘤疗效,这些研究结果极大促使了全人源化cd47抗体、可溶性sirpα二聚体融合蛋白、去除fc段的高亲和力sirpα单体以及羊驼来源的cd47纳米抗体在内的多种cd47/sirpα阻断剂的开发。但是,具有高分子量的抗体和蛋白类药物的组织渗透性较差,在实体瘤内发挥的阻断作用有限,而且正常的健康血细胞也表达高水平的cd47,使其成为了治疗性抗体的潜在靶标,已有一些动物和临床实验还报道了贫血和血小板的减少与cd47抗体的剂量限制性毒性有关。如何减少潜在的副作用,让cd47/sirpα阻断剂在安全性和有效性之间保持良好的平衡,成为了临床肿瘤治疗面临的迫切任务。
4.近年来,随着多肽合成技术的发展和成熟以及多肽药物的稳定性较好,加快了对多肽药物的研制以及临床应用,使得多肽药物在抗肿瘤治疗领域中越来越重要,已成为新药研发的重要方向之一。另外,全世界已有80多种多肽药物被批准上市,还有200-300种处于临床实验中,有着广阔的开发前景,而且阻断肽在抑制蛋白质相互作用方面,具有特异性强、合成方便的特点,并由于在价格、免疫原性和安全性等方面的优势,常被作为候选化合物的首选,广泛应用于肿瘤、肝炎、糖尿病、艾滋病等的预防、诊断和治疗。针对在外周循环广泛表达的cd47靶点,阻断肽相比抗体缺失igg1-fc片段的多肽,能避免触发抗体依赖的细胞介导的细胞毒作用(adcc)和补体依赖性细胞毒性(cdc),在保持优良阻断效果的同时能有效减弱红细胞的靶外清除。因此,如果能开发一种可以阻断cd47和受体信号调节蛋白α(sirpα)结合的多肽,有望在消除肿瘤免疫抑制作用的同时避免渗透性差以及cd47抗体易
产生血液毒性的问题。
技术实现要素:
5.本发明将带fmoc(笏甲氧羰基)或boc(叔丁基氧羰基)保护的氨基酸通过多肽固相合成法制备了一种多肽wsmtwwnyw,且对多肽wsmtwwnyw序列中的3,6,8位任一氨基酸突变为q,m,y,w,r或对多肽n端使用脂肪酸修饰得到一种衍生肽,在抑制肿瘤生长的同时可以解决渗透性差以及cd47抗体易产生的血液毒性问题。
6.为了实现上述目的,本发明的技术方案如下:
7.一种母体肽或衍生肽,所述母体肽序列如seq id no.1所示的多肽,所述衍生肽是由所述母体肽序列中的3,6,8位任一氨基酸突变为q,m,y,w,r或对母体肽的n端使用脂肪酸修饰得到。
8.优选地,所述母体肽氨基酸的构型独立地选自d型或l型。
9.优选地,所述衍生肽序列包括seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6、seq id no.7、seq id no.8、seq id no.9、seq id no.10所示的多肽。
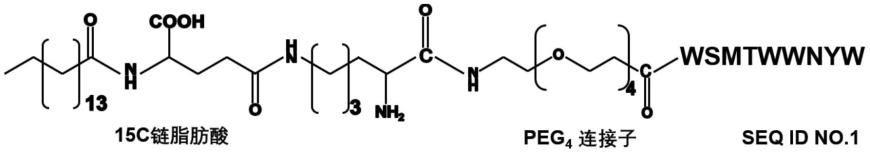
10.进一步优选地,对母体肽进行脂肪酸修饰为使用peg4在母体肽的n端连接脂肪酸fmoc-lys(pal-glu-otbu)-oh,母体肽经脂肪酸修饰后得到分子量为2101.302的衍生肽具有以下结构式:
[0011][0012]
优选地,所述母体肽或衍生肽为游离态或药学上可接受的盐。
[0013]
优选地,所述的母体肽或衍生肽在制备抗肿瘤药物中的应用。
[0014]
优选地,所述药物组合物包括注射液、口服液、粉剂、片剂、丸剂、气雾剂、软膏剂、胶囊剂。
[0015]
进一步优选地,所述抗肿瘤药物可添加一种或多种药学上可接受的辅料,所述辅料包括药学领域常规的稀释剂、填充剂、粘合剂、湿润剂、吸收促进剂、表面活性剂、润滑剂或稳定剂。
[0016]
优选地,所述肿瘤为cd47高表达相关的一系列肿瘤。
[0017]
本发明的有益效果如下:
[0018]
本发明通过固相合成法将带fmoc(笏甲氧羰基)或boc(叔丁基氧羰基)保护的氨基酸(w、s、m、t、n、y、q、r)制备了一种母体肽wsmtwwnyw(seq id no.1),在母体肽序列3,6,8位任一氨基酸突变为q,m,y,w,r或在wsmtwwnyw的n端使用peg4连接脂肪酸得到其衍生肽。本发明制备的方法简单易行、成本低廉、实用性强,制得的母体肽和衍生肽能有效阻断cd47与sirpа蛋白的结合,从而消除肿瘤的免疫抑制作用,促使巨噬细胞对肿瘤细胞的进一步吞噬,达到了抑制肿瘤生长的作用,而且制得的多肽分子量小、特异性强、完全避免cd47抗体易产生的血液毒性,具有良好生物安全性和较高的应用价值,有助于肿瘤早期诊断和免疫治疗的发展。
附图说明
[0019]
为了更清楚地说明本发明的技术方案,下面将对实施方式中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0020]
图1是本发明母体肽(seq id no.1)经脂肪酸修饰后得到的衍生肽的质谱图;
[0021]
图2是实施例2中母体肽和衍生肽浓度为25μm时阻断人源及鼠源cd47/sirpα蛋白相互作用的实验结果图;
[0022]
图3是实施例2中衍生肽浓度为100μm时阻断人源及鼠源cd47/sirpα蛋白相互作用的实验结果图;
[0023]
图4是实施例3中母体肽(seq id no.1)及衍生肽对原代巨噬细胞体外吞噬效果的影响图,图中:衍生肽为经脂肪酸修饰母体肽(seq id no.1)后得到的衍生肽;
[0024]
图5为实施例4中衍生肽对mc38移植瘤模型c57bl/6小鼠的肿瘤体积影响图,图中:衍生肽为经脂肪酸修饰母体肽(seq id no.1)后得到的衍生肽;
[0025]
图6为实施例4中mc38移植瘤模型c57bl/6小鼠给药组和对照组的血常规参数柱状图,图中:衍生肽为经脂肪酸修饰母体肽(seq id no.1)后得到的衍生肽。
具体实施方式
[0026]
下面对本发明实施方式中的技术方案进行清楚、完整地描述。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。下述实施例中的实验方法,如无特殊说明,均为常规说法。
[0027]
实施例1:合成及纯化具有cd47/sirpα阻断效果的母体肽或衍生肽
[0028]
母体肽:wsmtwwnyw(seq id no.1);
[0029]
衍生肽:wsqtwsnyw(seq id no.2)、wsmtwsnyw(seq id no.3)、wsyt wsnyw(seq id no.4)、wswtwsnyw(seq id no.5)、wsrtwsnyw(seq id no.6)、wsatwwnyw(seq id no.7)、wsatwsnww(seq id no.8)、wsatwsnrw(seq id no.9)、wsatwsnmw(seq id no.10)、脂肪酸修饰的衍生肽,所述脂肪酸修饰的衍生肽的质谱信息如图1所示,结构式如下所示:
[0030][0031]
上述母体肽或衍生肽的合成及纯化方法包括以下步骤:
[0032]
(1)将rink树脂作为载体,合成方向为序列的c端至n端,然后使用带fmoc(笏甲氧羰基)或boc(叔丁基氧羰基)保护的氨基酸(w、s、m、t、n、y、q、r)、peg4(cas:557756-85-1)以及脂肪酸fmoc-lys(pal-glu-otbu)-oh(cas:1491158-62-3)为原料(加入的量为树脂的3倍当量),分别加入rink树脂3倍当量的缩合剂6-氯苯并三氮唑-1,1,3,3-四甲基脲六氟磷酸酯(hctu)和缩合剂n,n-二异丙基乙胺(diea)偶联45分钟,再用n,n-二甲基甲酰胺(dmf)和二氯甲烷(dcm)轮流洗涤,待茚三酮茚检rink树脂不变蓝时,用比例为1:1的dmf和哌啶来脱
除fmoc保护基,再重复操作“洗涤-偶联-茚检-脱保护”的步骤,直至最后一个氨基酸偶联结束。
[0033]
(2)使用切肽试剂【三氟乙酸(tfa)、苯甲硫醚、苯酚、乙二硫醇和双蒸水按照7:9:6:6:3的比例配制而成】切割4小时将步骤(1)的多肽从载体rink树脂上切割下来,加入4℃预冷的乙醚使得多肽沉淀,再离心收集沉淀物并用乙醚洗涤3遍,最后通风橱晾干得到多肽粗品;
[0034]
(3)将步骤(2)制得的多肽粗品使用制备型反相液相色谱(rp-hplc)法来纯化,用hplc和ms分析鉴定。流动相a为0.1%三氟乙酸(tfa)/水,流动相b为乙腈;线性洗脱梯度为20%a-95%a;流速为10ml/min,检测波长为220nm;最后经冷冻干燥后得到纯化的多肽。
[0035]
(4)将步骤(3)制得的纯化多肽【母体肽wsmtwwnyw(seq id no.1)】的3,6,8位任一氨基酸突变为q,m,y,w,r,或在wsmtwwnyw序列的n端使用peg4(cas:557756-85-1)连接脂肪酸fmoc-lys(pal-glu-otbu)-oh(cas:1491158-62-3)来延长多肽链从而得到衍生肽,再使用三重四级杆液质联用仪(lcms-8060,shimadzu)来分析。
[0036]
实施例2:母体肽及衍生肽阻断人源及鼠源cd47/sirpα蛋白的相互作用
[0037]
1、采用慢病毒表达系统构建过表达稳转细胞系稳定转染细胞系cho-k1-hsirpα或cho-k1-msirpα,具体包括以下步骤:
[0038]
(1)根据human sirpα(hsirpα)基因序列(基因库序列号:bc033092.1)、mouse sirpα(msirpα)基因序列(基因库序列号:nm_001177647.2)及慢病毒表达载体plvx-puro(clontech),选择酶切位点ecor i和bamh i并由金唯智生物科技公司设计上下游引物序列。human sirpα引物序列和mouse sirpα引物序列如下表1和表2所示:
[0039]
表1 human sirpα引物序列表
[0040]
序列名称序列(5
’‑3’
)序列编号plvx-hsp-f(ecor i)cggaattcaccatggagcccgccggcccggseq id no.11plvx-hsp-r(bamh i)cgggatcctcacttcctcgggacctggacgctgseq id no.12
[0041]
表2 mouse sirpα引物序列表
[0042]
序列名称序列(5
’‑3’
)序列编号plvx-msp-f(ecor i)cggaattcaccatggagcccgccggcccggseq id no.13plvx-msp-r(bamh i)cgggatcctcacttcctctggacctggacacseq id no.14
[0043]
(2)抽取健康志愿者的外周血,通过商品化的淋巴细胞分离液(购自天津灏洋)离心获得人源外周血来源单个核细胞(pbmc),将小鼠骨髓细胞裂解红细胞后,加入20ng/ml粒细胞-巨噬细胞集落刺激因子(gm-csf)刺激分化7天得到小鼠骨髓来源的巨噬细胞。分别提取人源外周血来源单个核细胞(pbmc)或鼠源骨髓来源巨噬细胞的rna,经反转录后得到cdna,再通过pcr(pcr反应体系为20μl,包含10μl的2
×
mix预混液、1μl的10μm引物f、1μl的10μm引物r、1μl的cdna模板、7μl无菌水)获得人源或鼠源sirpα基因片段,经琼脂糖凝胶电泳分离纯化后得到所需的sirpα基因,最后用ecor i酶和bam h i酶分别对sirpα基因及plvx-puro载体进行酶切,并回收。
[0044]
(3)依次加入9μl双蒸水(ddh2o)、3μl步骤(2)酶切后的sirpα基因、5μl步骤(2)酶切后的plvx-puro载体dna、2μl的10
×
buffer以及1μl的t4连接酶混匀后在16℃水浴锅中连接过夜。
[0045]
(4)在100μl商品化的感受态细胞dh5α(购自北京全式金)中加入5μl步骤(3)的连接产物混合均匀,冰浴30min,再于42℃热激90s后放置在冰上,并加入600μl新鲜lb培养基,摇床震荡培养1h。
[0046]
(5)将步骤(4)震荡后的菌液涂布在带有氨苄抗性的lb平板上,挑选单独的白色菌落进行划线培养,再用接种环挑取平板上单独的白色菌落在lb液体培养基中进行培养,培养后经基因测序且测序正确的即为含有目的基因序列的慢病毒表达载体plvx-hsirpα或plvx-msirpα。
[0047]
(6)在dmem培养基(含10%fbs,100u/ml青霉素和100μg/ml链霉素)中培养hek-293t细胞,并收集对数生长的细胞并计数,以1
×
106cells/well接种于6孔或10mm细胞培养板中,放置于细胞培养箱中37℃、5%co2条件下培养。
[0048]
(7)设置a管和b管,待步骤(6)中培养的hek-293t细胞密度达到80~90%汇合度时,将a管转染试剂均匀加入b管中,轻摇震荡混匀,室温静置孵育20min,在孵育过程中,将汇合度达到90%的hek-293t细胞更换到新鲜dmem完全培养基(置换过程中需沿孔板侧壁缓慢加入,避免将细胞悬起),待孵育结束后再将a、b管混合溶液滴入含hek-293t细胞的dmem培养基中,培养6h后将hek-293t细胞再次更换到新鲜dmem完全培养基中生产病毒,转染48~72h后吸取含有病毒颗粒的培养液,离心除去细胞碎片后经0.45μm孔径滤膜过滤得到病毒上清液。其中a管和b管的配制如下所示:
[0049]
a管:吸取7μl lipofectamine 3000转染试剂滴加于250μl opti-mem无血清培养基中并混匀;
[0050]
b管:将慢病毒质粒及辅助质粒按照plvx-hsirpα/plvx-msirpα:pspax2:pmd2.g=4:3:1的比例分别加入8μg、6μg、2μg混合于250μl opti-mem无血清培养基中,并加入32μl的lipofectamine 3000转染试剂混匀。
[0051]
(8)在rpmi1640培养基中培养cho-k1细胞,并以2
×
105cells/well接种于细胞培养板中培养,cho-k1细胞密度达到20~30%时,向步骤(7)过滤后的病毒上清液中加入终浓度为8μg/ml的聚凝胺(polybrene),再将其加入含cho-k1细胞的细胞培养板中,1500
×
g室温离心30min后放于培养箱中,培养过夜后更换为新鲜含血清培养基,培养48h后向培养基中加入终浓度为2μg/ml的嘌呤霉素筛选得到稳定转染的cho-k1-hsirpα或cho-k1-msi rpα细胞,培养72h后可通过流式细胞仪检测转染效率,必要时可做细胞有限稀释,挑取单克隆细胞。
[0052]
2、分析母体肽及衍生肽的阻断效果
[0053]
(1)设置样品管、阴性对照管和阳性对照管,将上述筛选的cho-k1-hsirpα或cho-k1-msirpα细胞在rmpi 1640培养基中培养并收集其对数生长期细胞,计数后以3
×
105cells/管分装入样品管、阴性对照管、阳性对照管。样品管、阴性对照管和阳性对照管均加入预冷pbs缓冲液(ph=7.2),4℃、1500
×
g离心5min洗涤后置于冰上。
[0054]
(2)将实施例1制得的纯化母体肽或衍生肽溶解于含1%dmso(二甲基亚砜)的pbs缓冲液(ph=7.2)中,取纯化母体肽或衍生肽溶液到样品管(200μl微量离心管)中,而阴性对照管和阳性对照管则分别加入50μl含有1%dmso的pbs缓冲液(ph=7.2)。样品管和阳性对照管中均加入浓度为20nm的重组hcd47-fc或mcd47-fc蛋白(sino biological,china),使多肽的终浓度均为25μm,充分混合后将样品管和阴性对照管、阳性对照管放置于冰水浴
中孵育30min。
[0055]
(3)取步骤(2)孵育后的混合物50ul加入步骤(1)的cho-k1-hsirpα或cho-k1-msirpα细胞中(样品管是cho-k1-hsirpα或cho-k1-msirpα细胞+重组hcd47-fc或mcd47-fc蛋白+母体肽或衍生肽溶液;阴性对照管只加cho-k1-hsirpα或cho-k1-msirpα细胞;阳性对照管cho-k1-hsirpα或cho-k1-msirpα细胞+重组hcd47-fc或mcd47-fc蛋白),再重悬细胞后加入5ul购自thermo fisher的检测流式抗体(anti-human fc pe),并混匀放置于冰水浴中孵育30min。
[0056]
(4)在步骤(3)孵育后的每管溶液中加入1ml预冷的pbs缓冲液(ph=7.2)离心洗涤,然后分别加入200μl的pbs缓冲液(ph=7.2)后重悬细胞,再用流式细胞仪(beckman coulter cytoflex)检测细胞的平均荧光强度,并根据各组的平均荧光强度计算阻断率,计算阻断率公式为:阻断率=(阳性对照管平均荧光值-样品管平均荧光值)/阳性对照管平均荧光值
×
100%。
[0057]
另外,再次设置9组样品管和1组对照管,且每组均有三个副管,其中样品管分别为衍生肽(seq id no.2)至(seq id no.10),对照管是具有cd47/sirpa阻断功能的pep-20肽awsatwsnywrh(seq id no.15)。分别将实施例1制得的纯化衍生肽和pep-20肽溶解于含1%dmso(二甲基亚砜)的pbs缓冲液(ph=7.2)中,取纯化衍生肽溶液到样品管(200μl微量离心管)中,而对照管则加入pep-20肽溶液。样品管和对照管中均加入浓度为20nm的重组hcd47-fc或mcd47-fc蛋白(sino biological,china),使得样品管和对照管中的多肽终浓度均为100μm,其余步骤同步骤(1)-(4)。
[0058]
实验结果:
[0059]
图2或图3分别是母体肽或衍生肽浓度为25μm或100μm的实验结果图。由图2可知,荧光越强,阻断效果越小,阴性对照管cho-k1 m/hsirpα无荧光,阳性对照管m/hcd47蛋白的荧光最强,而母体肽wsmtwwnyw(seq id no.1)阻断人源cd47/sirpα蛋白或鼠源cd47/sirpα蛋白的相互作用要优于衍生肽wsmtwsnyw(seq id no.3)、wsatwwnyw(seq id no.7)。
[0060]
由图3可知,在阻断人源cd47/sirpα蛋白时,衍生肽wsmtwsnyw(seq id no.3)和衍生肽wsatwsnmw(seq id no.10)的阻断效果高于对照组pep-20肽awsatwsnywrh(seq id no.15);在阻断鼠源cd47/sirpα蛋白时,wsqtwsnyw(seq id no.2)、wsmtwsnyw(seq id no.3)、wsytwsnyw(seq id no.4)、wswtwsnyw(seq id no.5)、wsatwwnyw(seq id no.7)、wsatwsnmw(seq id no.10)的阻断效果高于对照组pep-20肽awsatwsnywrh(seq id no.15)。因此,衍生肽工作浓度为100μm时,wsmtwsnyw(seq id no.3)和wsatwsnmw(seq id no.10)在阻断人源或鼠源cd47/sirpα蛋白的效果最好。
[0061]
综上所述,多肽浓度越高,阻断效果最好,且在低浓度时,母体肽wsmtwwnyw(seq id no.1)的阻断效果要明显优于衍生肽。
[0062]
实施例3:母体肽及衍生肽对原代巨噬细胞体外吞噬效果的影响
[0063]
母体肽(seq id no.1)和衍生肽(seq id no.2)-(seq id no.10)都是l构型氨基酸,因此选用阻断效果最好的母体肽wsmtwwnyw(seq id no.1)或经脂肪酸修饰母体肽(seq id no.1)后得到的衍生肽来分别探究对吞噬细胞的影响。
[0064]
1、巨噬细胞体外诱导
[0065]
具体包括以下步骤:
[0066]
c57bl/6小鼠经脱颈及表面消毒后解剖,取小鼠大腿,剔除肌肉组织,取髌骨,腓骨,胫骨,剪开骨关节处,用注射器抽取dmem培养基将骨髓细胞冲洗出来,并用移液枪将骨髓细胞吹打散开,经滤网过滤后4℃、1500
×
g离心5min收集细胞,在温度4℃下裂解红细胞5min,然后加入pbs缓冲液(ph=7.2)离心洗涤2次,再加入2ml dmem培养基重悬细胞(离心后贴在底部的骨髓细胞团重新吹成的单细胞悬液)并计数,调整细胞密度为1
×
106cells/ml后在dmem培养基中培养,并在dmem培养基中加入粒细胞-巨噬细胞集落刺激因子gm-csf(peprotech,usa)使其终浓度为20ng/ml,3天后半量更换新鲜培养基,弃掉未贴壁细胞后补加终浓度为20ng/ml粒细胞-巨噬细胞集落刺激因子gm-csf(peprotech,usa),共培养7天后得到的巨噬细胞用于后续实验。
[0067]
2、cfse标记肿瘤细胞
[0068]
具体包括以下步骤:
[0069]
(1)向cfse荧光染料中加入dmso(二甲基亚砜)使染料充分溶解并混匀制成浓度为10mm的cfse储液;
[0070]
(2)用pbs缓冲液(ph=7.2)离心洗涤收集待标记的mc38结直肠癌肿瘤细胞,调整细胞密度至5
×
106cells/ml,充分混匀后吸取1ml细胞悬液加入15ml离心管底部并放置于室温;
[0071]
(3)用pbs缓冲液(ph=7.2)将步骤(1)制得的cfse储液稀释至终浓度为1μm,倾斜含mc38结直肠癌肿瘤细胞的离心管并向离心管口壁缓慢滴加终浓度为1μm的cfse染料,缓慢盖上离心管,迅速倒置离心管并涡旋震荡使得染料快速混匀,室温避光孵育10min;
[0072]
(4)向步骤(3)孵育后的离心管中加入6倍以上细胞液体积的预冷dmem完全培养基,并充分混匀,冰水浴中孵育5min,终止标记;用完全培养基将细胞4℃、1500
×
g离心5min洗涤2次,制得已标记的肿瘤细胞,之后放置于冰上备用。
[0073]
3、体外巨噬细胞吞噬实验:
[0074]
吞噬实验包括以下步骤:
[0075]
(1)取预冷无血清培养基(gibco,usa)加入低吸附96孔板中,分别加入100μm实施例1制备的母体肽wsmtwwnyw(seq id no.1)、经脂肪酸修饰母体肽(seq id no.1)所得到的衍生肽和100μm的pbs缓冲液(ph=7.2),其中加入pbs缓冲液(ph=7.2)的为对照组,再分别往含母体肽wsmtwwnyw(seq id no.1)、经脂肪酸修饰母体肽(seq id no.1)所得到的衍生肽和pbs缓冲液(ph=7.2)的孔板中加入1
×
106cells/well已标记的mc38结直肠癌肿瘤细胞,在冰水浴中孵育30min;
[0076]
(2)将培养的巨噬细胞分别加入步骤(1)孵育后的低吸附96孔板中,巨噬细胞的终浓度为1
×
105cells/well,轻轻震荡混匀后放置于细胞培养箱中37℃共孵育4h,共孵育结束后收集巨噬细胞,再加入50ul 10%的sd大鼠血清(取sd大鼠的血,静置2h后12000转离心,取上层血清),孵育15min封闭fcγ受体后加入anti-mouse f4/80抗体,混匀后放置于冰水浴中孵育30min,再加入1ml预冷的facs buffer离心洗涤,重悬细胞,最后每管分别加入4μl的7-氨基放线菌素(7-aad)染料,混匀后避光孵育5min,将避光孵育后的待测样品过滤后转移至流式样品管用流式细胞仪(beckman coulter cytoflex)检测。
[0077]
如图4所示,母体肽(seq id no.1)以及经脂肪酸修饰母体肽(seq id no.1)所得到的衍生肽的吞噬率均高于对照组,其中母体肽(seq id no.1)的吞噬效果最好,这是因为
cd47阻断肽孵育后的巨噬细胞对肿瘤细胞的吞噬功能增强。
[0078]
实施例4:探究衍生肽在mc38结直肠癌移植瘤模型中的抗肿瘤效果
[0079]
因为母体肽(seq id no.1)和衍生肽(seq id no.2)-(seq id no.10)都是l构型氨基酸且具有不抗酶降解性,进行不了体内实验,所以采用经脂肪酸修饰母体肽(seq id no.1)后得到的衍生肽增强半衰期和抗酶解稳定性后来作后续实验。
[0080]
1、测试抗肿瘤效果
[0081]
具体包括以下步骤:
[0082]
(1)将mc38结直肠癌肿瘤细胞在含有dmem培养基(含10%fbs,100u/ml青霉素和100μg/ml链霉素)的细胞培养皿中培养,再将细胞培养皿置于37℃、5%co2条件下的细胞培养箱中,然后收集对数增长期的mc38结直肠癌肿瘤细胞,用预冷pbs缓冲液(ph=7.2)离心洗涤后计数并调整细胞密度为5
×
106cells/ml,放置于冰水浴中,选取6-8周龄实验c57bl/6小鼠,按照1
×
106cells/只的细胞密度皮下接种于c57bl/6小鼠右侧背部来构建mc38移植瘤模型;
[0083]
(2)荷瘤7天左右(肿瘤生长至30-70mm3)后观察小鼠成瘤状况,按照肿瘤体积将小鼠进行随机分组,隔天测量小鼠体重和肿瘤体积,并于记录当天开始给药,肿瘤体积计算公式:v=1/2
×
a(长)
×
b(宽)
×
c(高);
[0084]
(3)分组及给药:分别设置给药组和对照组,其中给药组小鼠腹腔注射0.75mg/kg经脂肪酸修饰母体肽(seq id no.1)后得到的衍生肽,对照组小鼠注射等量pbs缓冲液(ph=7.2),连续给药14天。
[0085]
由图5可知,随着mc38肿瘤接种天数的增加,给药组和对照组的肿瘤体积越来越大。在刚开始接种的时候,由于接种时间太短,所以给药组和对照组的肿瘤体积差距不大,但是随着接种天数的增加,给药组的肿瘤体积只有对照组的一半,因此,经脂肪酸修饰母体肽(seq id no.1)后得到的衍生肽经腹腔注射后可显著抑制小鼠肿瘤的生长。
[0086]
另外,为了证明脂肪酸修饰后的衍生肽的安全性,治疗结束后,采集了给药组和对照组小鼠的血液检测血常规,来分析脂肪酸修饰后的衍生肽给药组与pbs缓冲液(ph=7.2)对照组的血液学参数。
[0087]
由图6可知,给药组的红细胞数目、红细胞积压、血红蛋白、平均红细胞体积、平均红细胞血红蛋白含量、平均红细胞血红蛋白浓度以及红细胞分布宽度变异系数跟对照组基本一致,未发现用药后的任何副作用。因此,给药组完全避免了cd47抗体易产生的血液毒性。
[0088]
以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1