一种腺样囊性癌类器官模型、其构建方法和应用
1.本发明涉及生物医药领域,具体涉及一种腺样囊性癌类器官模型、其构建方法和应用。
背景技术:
2.腺样囊性癌(adenoid cystic carcinoma,acc)是一种起源于分泌腺的罕见高度恶性肿瘤,好发于头颈唾液腺,乳腺,肺部,食管,前列腺等部位,易侵袭神经和血管,常伴随肺部及骨转移。其病理亚型可分为:筛管型、管状型和实体型,在同一种肿瘤中,这三种类型的肿瘤常混合出现,其中实体型恶性程度较高,预后更差。目前,acc的患者临床上主要以手术切除为主,放疗为辅。对于复发/转移或晚期的患者(不合适手术及放疗)可以考虑化疗及靶向治疗,但是目前临床上没有统一标准的化疗方案或者靶向药物治疗方案来延长患者的生存期。
3.类器官(organoids)是指在体外三维培养构建的,依赖于人造细胞外基质的多细胞团,其具有自我更新和自我组织能力,并在一定程度上维持其来源组织的类似于器官的生理结构和功能。类器官具备维持器官部分生理活性、可长期稳定培养等特征,与传统体外模型相比更接近体内的生理状态,是近年来最具影响力的科学研究工作之一,目前类器官在肿瘤研究领域潜力巨大。因此,腺样囊性癌类器官临床前研究模型的构建,对患者化疗及靶向治疗药物筛选,药物评价,提供个性化治疗方案显得尤其重要。
4.目前腺样囊性癌模型常使用的是腺样囊性癌商品化细胞系和腺样囊性癌人源化异种移植小鼠模型,但是,对于腺样囊性癌商品化细胞系来说,永生化的像腺样囊性癌商品化细胞系已经适应了体外的培养环境,稳定传代的腺样囊性癌商品化的细胞系是遗传背景相同的优势单克隆细胞群体,缺乏原代细胞的遗传学和生物学特征,缺乏肿瘤异质性细胞群体和多种细胞群体相互作用,更无法反应真实世界的药物筛选反应。对于腺样囊性癌人源化异种移植小鼠模型来说,虽然唾液腺腺样囊性癌pdx模型,能很好的保留原始肿瘤的分子遗传特征、细胞组成、组织结构和原始肿瘤的复杂性,并且模型遗传稳定性好。但是,唾液腺腺样囊性癌是以腺上皮、肌上皮细胞,双相分化、具有管状、腺样和实性结构为特点,不同肿瘤类型的pdx成功率并不完全相同,其中,除恶性程度较高的实性结构的腺样囊性癌外,其他类型的pdx建模成功率普遍较低,并且pdx模型还存在建模实验周期长,成本高等问题,无法短期内大量扩增及药物筛选。
5.因此,亟需一种具备原代肿瘤细胞的遗传学和生物学特征、更好进行药物筛选的腺样囊性癌类器官模型。
技术实现要素:
6.本发明的目的是解决现有模型建模成功率低、模型不稳定、无法真实反映体内药物筛选、建模周期长、成本高等不足。
7.为了达到上述目的,本发明提供了一种腺样囊性癌类器官模型(pdo模型)的构建
方法,包含以下步骤,步骤一,完全培养基的配制:在基础培养基中加入生长因子,得到完全培养基;步骤二,离体腺样囊性癌肿瘤组织的活化:取部分所述完全培养基,在完全培养基中加入1%~2%的青霉素-链霉素得到原代完全培养基,将离体腺样囊性癌肿瘤组织放置于所述原代完全培养基中,低温活化;步骤三,腺样囊性癌肿瘤组织预处理:将步骤二中活化处理后的腺样囊性癌肿瘤组织分切成肿瘤小块,用混合预制酶重悬所述肿瘤小块,并通过全自动组织处理器处理,将处理后的肿瘤小块继续进行消化处理,得到细胞悬液;步骤四,pdo模型的构建:在所述细胞悬液中加入终止培养基终止消化,经过滤、离心、弃上清后得到细胞沉淀,利用所述完全培养基将所述细胞沉淀重悬并计数,再次离心后用所述完全培养基重悬得到重悬后细胞悬液,将重悬后细胞悬液与基质胶按照预设比例混合,得到具有一定细胞浓度的混合物,将所述混合物接种于多孔细胞培养板中,待基质胶凝固后,继续培养,得到pdo模型;
8.其中,所述生长因子包含hepes、glutamax、胎牛血清、青霉素-链霉素、primocin、b27、n2、nac、烟酰胺、4%~8%r-spondin1、4%noggin、50ng/mlrhegf、5ng/ml rhfgf2、10ng/ml rhfgf10、1μmol/l~2μmol/l前列腺素ae2、0.5~1μmol/l a83-01、10μmol/l~20μmol/l y27632、0.3μmol/l~0.5μmol/l chir 99021、1μmol/l~2μmol/l forskolin、2μg/ml~4μg/ml氢化可的松及2%~4%胰岛素-转铁蛋白-硒;前述的百分浓度为质量浓度。
9.较佳地,步骤一中,所述基础培养基为advanced dmem/f-12培养基。
10.较佳地,步骤三中,所述混合预制酶包含liberase酶、透明质酸酶、胶原iv型酶和dnase i中的任意两种以上的组合。
11.较佳地,步骤三中,所述消化的条件是37℃,震荡消化10~30min。
12.较佳地,步骤四中,所述过滤、离心的条件为100μm滤网过滤,1000rpm,5min。
13.较佳地,步骤四中,所述预设比例是指重悬后细胞悬液与所述基质胶的体积比为3:2。
14.较佳地,步骤四中,所述混合物中细胞浓度为5
×
104/50μl~2
×
105/50μl。
15.较佳地,步骤四中,所述培养指在37℃、5%co2浓度下培养1~2周后按照1:2~1:5的比例进行传代。
16.本发明提供了一种上述的腺样囊性癌类器官模型的构建方法制备得到的腺样囊性癌类器官模型。
17.本发明还提供了腺样囊性癌类器官模型在筛选预防和/或治疗腺样囊性癌药物中的应用。
18.本发明的有益效果:
19.(1)本发明构建的腺样囊性癌类器官模型(pdo模型),具备原代肿瘤细胞的遗传学和生物学特性,有效的解决了现有模型在临床应用中存在的缺陷,更好地模拟临床上腺样囊性癌的生长特点和肿瘤的微环境,制备得到的类器官能够稳定的传代及增殖,可以在短时间内完成扩增,建模成功率高,实现腺样囊性癌细胞的体外培养,适用于药物评价、新药筛选、毒性测试、个性化治疗,从而更好地用于肿瘤的治疗研究;
20.(2)本发明中的腺样囊性癌类器官的培养基配方包含各种因子及化学小分子组合物,简单易制,能够批量配置;
21.(3)本发明构建模型中所使用的原料成本低,模型实用性强,具有高度产业利用价
值。
附图说明
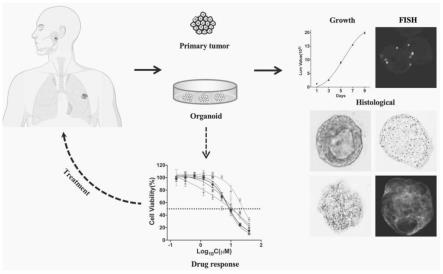
22.图1为pdo模型的构建与应用流程图。
23.图2为铺板后类器官的大小和数量变化。上栏标尺:2mm;下栏标尺:500μm。
24.图3为不同的pdo模型的明视野全景图。左栏标尺:1
㎜
;中栏标尺:200μm;右栏标尺:50μm。
25.图4为肿瘤组织和pdo模型的he染色和免疫组化染色图。标尺:100μm。
26.图5为pdo模型的免疫荧光染色图。标尺:50μm。
27.图6为肿瘤组织和pdo模型关于myb基因分离的fish结果图。标尺:20μm。
28.图7为肿瘤组织和pdo模型关于myb基因分离的阳性细胞比例的fish结果图。标尺:20μm。
29.图8为pdo模型和原发肿瘤之间的全外显子测序结果图。
30.图9为不同浓度顺铂下的pdo模型状态。
31.图10为pdo模型作为化疗药物筛选平台。
32.图11为pdo模型作为靶向药物筛选平台。
33.图12为不同药物筛选的ic
50
值。
具体实施方式
34.现有的pdx模型不能够稳定的传代及增殖,建模成功率较低,无法更好模拟肿瘤的生长特点和肿瘤微环境,从而不利于肿瘤药物的筛选。本发明提供的腺样囊性癌类器官模型的构建方法所制备的腺样囊性癌类器官模型可以稳定进行传代与增殖,可以更好模拟肿瘤生长环境,从而进行肿瘤药物的筛选。以下结合附图和实施例对本发明的技术方案做进一步的说明。
35.本发明中所用生长因子包含hepes、glutamax、胎牛血清、青霉素-链霉素、primocin、b27、n2、nac、烟酰胺、4%~8%r-spondin1、4%noggin、50ng/mlrhegf、5ng/ml rhfgf2、10ng/ml rhfgf10、1μmol/l~2μmol/l前列腺素ae2、0.5~1μmol/l a83-01、10μmol/l~20μmol/l y27632、0.3μmol/l~0.5μmol/l chir 99021、1μmol/l~2μmol/l forskolin、2μg/ml~4μg/ml氢化可的松及2%~4%胰岛素-转铁蛋白-硒;前述的百分浓度为质量浓度。
36.在本发明的描述中,需要说明的是,实施例中未注明具体来源者,按照常规条件或制造商建议的条件进行,所述试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
37.实施例1pdo模型的构建方法
38.(1)完全培养基的配制
39.本实施例中采用advanced dmem/f-12作为基础培养基,advanced dmem/f-12培养基与其他基础培养基相比,添加了胰岛素、转铁蛋白、牛血清白蛋白、乙醇胺、抗坏血酸、谷胱甘肽以及多种微量元素(亚硒酸钠、偏钒酸铵、氯化锰和硫酸铜)。与经典dmem/f-12培养基相比,在不影响细胞生长速率和形态的情况下,使用advanced dmem/f-12可减少50~
90%的血清添加量,有助于降低培养条件波动,延长同一批次血清的使用时间。在基础培养基中加入生长因子来配制完全培养基。其中,具体的生长因子及其浓度包含:1%hepes、1%glutamax、1%胎牛血清、1%青霉素-链霉素、100μg/ml primocin、2%b27、1%n2、1.25mmol/l nac、10mmol/l烟酰胺、4%r-spondin1、4%noggin、50ng/ml rhegf、5ng/ml rhfgf2、10ng/ml rhfgf10、1μmol/l前列腺素e2、0.5μmol/l a83-01、10μmol/l y27632、0.3μmol/l chir 99021、1μmol/l forskolin、2μg/ml氢化可的松及2%胰岛素-转铁蛋白-硒。上述百分浓度为质量浓度。
40.根据文献报道,igf信号通路在肿瘤发生发展中具有促进acc细胞增殖的相关作用,氢化可的松和胰岛素能作用于igf信号通路,从而进一步活化促增殖的相关因子,促进细胞增殖;另外,胰岛素可促进葡萄糖和氨基酸摄取、细胞内运输以及蛋白和核酸的合成,转铁蛋白是铁载体,也有助于降低氧自由基和过氧化物的毒性水平,硒是谷胱甘肽过氧化物酶和其他蛋白的一种辅因子,在培养基中用做抗氧化剂,均能较好维持细胞的状态。因此本实施例中的生长因子中特异性的加入了氢化可的松及胰岛素-转铁蛋白-硒以作用于igf通路。
41.原代培养过程中,为了预防细菌污染,取部分完全培养基,在所述的完全培养基中加入2%的青霉素-链霉素构成原代完全培养基,以便于后续对肿瘤中组织进行原代培养,防止肿瘤组织被污染。
42.(2)腺样囊性癌肿瘤组织的获取
43.如图1所示,从上海交通大学医学院附属第九人民医院获取离体腺样囊性癌肿瘤组织,肿瘤组织离体后迅速放置于含有2%青霉素-链霉素的原代培养基中,在所述肿瘤组织尚未转移至实验室进行后续实验之前,为了保证肿瘤组织的活性,均将肿瘤组织进行低温活化保存,若立即进行实验则将装在原代培养基中的肿瘤组织置于冰上保存,若稍适进行实验则将装在原代培养基中的肿瘤组织置于4℃冰箱中保存。
44.(3)肿瘤组织预处理
45.在无菌环境和条件下,将所述的肿瘤组织中的坏死及肌肉和脂肪组织去除,利用手术刀将肿瘤组织分切成1
㎜×1㎜×1㎜
的肿瘤小块,用15ml总的混合预制酶重悬分切好的肿瘤小块,使用混合预制酶将肿瘤小块打散。如果肿瘤小块细胞不分散开会出现贴壁生长,生长会受到抑制,细胞就会停止分裂增殖,出现接触抑制。其中,混合预制酶包含liberase酶(根据罗氏厂家推荐的浓度使用)、透明质酸酶(工作浓度为200u/ml)、胶原iv型酶(工作浓度为2mg/ml)和dnase i(工作浓度为1mg/ml),根据消化的肿瘤小块,如果较小,选用透明质酸酶、胶原iv型酶和dnase i的混合酶,如果较大,为了尽量消化彻底,还会再加入liberase酶。将肿瘤小块重悬之后转移至c-tube管中,用全自动组织处理器将肿瘤小块分散成单个细胞悬液,放置于37℃的恒温摇床上,恒温摇床转速为100rpm,震荡消化10~30min,对肿瘤小块进行分离,得到细胞悬液。
46.(4)pdo模型的构建与传代
47.在无菌环境和条件下,取部分完全培养基,在所述完全培养基中加入10%血清用于做终止培养基。将消化好的细胞悬液用终止培养基进行终止消化,使用100μm的细胞筛网对消化后的细胞悬液进行过滤,1000rpm,离心5min,弃上清得到细胞沉淀,利用完全培养基将所述细胞沉淀进行重悬得到重悬后细胞悬液,并对细胞进行计数。按照3:2的体积比用完
全培养基重悬后细胞悬液与基质胶matrigel胶(或者bme基质胶)混合(一开始为了细胞快速生长体积比可稍高如3:2,后续培养期间可以换成1:2的体积比进行细胞的快速扩增),配制成5
×
104cell/每50μl~2
×
105cell/每50μl的细胞浓度,经过细胞预实验后发现在此细胞浓度下,细胞不至于太少没有差异性,也不至于太多没有生长空间造成数值误差,按照每孔50μl的细胞接种于预热的24孔板中,将24孔板放置于37℃的培养基固化培养30min,待matrigel胶凝固后,每孔加入1ml的完全培养基,得到pdo模型。培养期间每隔2~3天更换培养基并在显微镜下观察形态,如图2所示,从左到右分别为第0天到第5天同一视野下腺样囊性癌类器官的大小和数量变化。由图2可观察到,类器官保持着较佳的形态大小,视野中没有出现太多杂质细胞,说明随着时间的推移,类器官发生凋亡细胞较少,保持较好的生长状态。在培养1~2周后按照1:2~1:5的比例进行传代,如图3所示,是10个已构建好的pdo模型,分别为acc1、acc3、acc4、acc5、acc6、acc7、acc9、acc10、acc11、acc12。从左至右分别为pdo模型的明视野全景图,由图3可以看到,在此培养条件下构建的pdo模型细胞球数量多,状态好,建模成功率较高。
48.实施例2pdo模型的鉴定
49.对已构建的pdo模型进行病理组织形态学观察。
50.(1)紫木精-伊红(he染色)
51.选取已构建的1个pdo模型,对pdo模型及对应的亲本肿瘤组织进行he染色,如图4所示,以acc1为例,根据he染色结果显示,亲本肿瘤组织和pdo模型在组织形态学特征上具有较好的一致性,在光学显微镜下,pdo模型中可以观察到核异形性明显,细胞团外层的细胞核占比大,排列较整齐,内层细胞细胞核占比小,排列不规则,并且能观察到囊腔样结构,符合核异形性的肿瘤细胞特性。
52.(2)免疫组化及免疫荧光染色
53.选取已构建的1个pdo模型,对pdo模型及对应的亲本肿瘤组织进行免疫组织化学染色检测腺样囊性癌标志p63、pan-ck、e-cadherin、myb及反映细胞增殖活性指标的ki-67,如图4所示,以acc1为例,亲本肿瘤组织和pdo模型均呈现出p63(+)、pan-ck(+)、e-cadherin(+)、myb(+)及相似的ki-67(+)阳性表达率,在分子特征上所述亲本肿瘤组织和所述pdo模型保持了高度一致性。
54.选取已构建的1个pdo模型,对pdo模型进行免疫荧光染色,来检测腺样囊性癌标志物ck14,p63,ki67及c-kit的表达情况,其中,ki67和p63是细胞核标志物,呈现核高亮染色,而c-kit和ck14是细胞质膜标志物,呈现质膜高亮染色。如图5所示,以acc1为例,1个pdo模型的ki67和p63核染都出现不同程度的阳性比例,同样的,作为在acc组织中高表达达到90%的标志物c-kit,同样在绝大比例的pdo模型细胞中表达,ck14作为上皮细胞常见的标志物,在acc组织中也有一定比例的细胞阳性表达率,这也与pdo模型中细胞阳性比例相符合。通过以上4个常见肿瘤标志物的免疫荧光染色,发现pdo模型细胞阳性比例与免疫组化中pdo模型的结果相似,同样与原发肿瘤的一致性较好,结果再次表明,所述的pdo模型高度保持了acc肿瘤分子特征,证明pdo模型的稳定性。
55.(3)荧光原位杂交(fish)染色
56.根据文献报道,myb基因断裂或基因融合是acc原发肿瘤中常见的分子现象,是acc诊断中的重要生物标志物。因此使用myb分离探针对1个pdo模型及对应的亲本肿瘤组织进
行荧光原位杂交技术(fluorescence in situ hybridization,fish)染色检测,若myb基因没有断裂,则fish结果会显示两对红蓝信号融合的现象,反之,若出现红蓝信号的距离明显分离,则为阳性信号(白色箭头标识),通常来讲100个细胞中出现10个以上的阳性信号细胞,则可判定为myb基因断裂阳性。结果如图6所示,以acc1为例,根据pdo模型和对应的亲本肿瘤组织的myb基因分离fish图所示,pdo模型和对应的亲本肿瘤组织中都有明显的红蓝信号分离的阳性结果,因此可以证明pdo模型可以较好的维持原发肿瘤的分子遗传信息特征,具有较好的模型稳定性。如图7所示,这里列举了1个pdo模型及其对应的亲本肿瘤组织的8个独立视野,均发现较高比例的阳性信号细胞,即发生了myb基因断裂,这一结果也佐证了图6的结论。
57.实施例3生物信息学测序分析
58.(1)外显子组分析
59.通过200x全外显子测序发现,选取5例acc患者(acc1-tumor、acc2-tumor、acc3-tumor、acc4-tumor、acc5-tumor)及其对应的pdo(acc1-pdo、acc2-pdo、acc3-pdo、acc4-pdo、acc5-pdo)中,高频突变基因在患者组织pdo模型或患者肿瘤组织均可检出;同时,如图8所示,患者组织pdo模型与患者肿瘤组织可共同检测出一些常见的突变基因,如rp1l1、muc12和muc16(图中以方框标示)。外显子组的数据证实了患者组织pdo模型与患者肿瘤组织在遗传学上保持了较高的一致性。
60.实施例4pdo模型在药物筛选中的应用
61.acc临床上极易发生复发及转移,嗜神经侵袭性生长,易发生远端肺部及骨转移,目前临床上缺乏标准的或者最佳用药和方案的选择,用以延长acc患者的远期生存期。因此,合适的临床前研究模型,用以寻找及验证该肿瘤相关特异性靶基因,及有效药物筛选和指导临床用药尤其重要。ic
50
是指被测量的拮抗剂的半抑制浓度,在凋亡方面,可以理解为一定浓度的某种药物诱导肿瘤细胞凋亡50%,该浓度称为50%抑制浓度,即凋亡细胞与全部细胞数之比等于50%时所对应的浓度,ic
50
值可以用来衡量药物诱导凋亡的能力,即诱导能力越强,该数值越低,也可以反向说明某种细胞对药物的耐受程度。根据acc化疗及靶向治疗相关临床用药及开展临床试验用药的文献报道,选择具体药物及药物反应结果如下:
62.(1)化疗药物筛选
63.目前临床上用于acc一线化疗药物是顺铂(cisplatin),因此首先选择顺铂单药做了初步预实验,顺铂浓度为0.1563μmol/l~40μmol/l。如图9所示,发现不同浓度顺铂作用下的pdo模型状态显著改变。
64.还使用了临床上常见的阿霉素(doxorubicin)及紫杉醇(paclitaxel)来进行药物筛选试验,并使用acc-83(腺样囊性癌细胞系)、acc-lm(腺样囊性癌肺转移细胞系)作为对照(acc-83和acc-lm来源于北京大学口腔医学院)。如图10、图12所示,结果显示顺铂的ic
50
值分别为acc-83(腺样囊性癌细胞系)7.768μmol/l、acc-lm(腺样囊性癌肺转移细胞系)7.867μmol/l、scc-1(细胞系)11.52μmol/l、acc-1(pdo)22.20μmol/l和acc-12(pdo)11.56μmol/l;阿霉素的ic
50
值分别为acc-83(腺样囊性癌细胞系)0.2595μmol/l、acc-lm(腺样囊性癌肺转移细胞系)0.7389μmol/l、acc-1(pdo)1.576μmol/l和acc-12(pdo)1.124μmol/l。与临床试验(nct00002632)中紫杉醇无一应答一致的是,紫杉醇的药物测试在几个pdo模型和细胞系中的敏感性都不好。结果显示紫杉醇作为微管稳定剂不是acc治疗的有效药物。
65.可见,本发明构建的pdo模型可以用于腺样囊性癌化疗药物的筛选。
66.(2)靶向药物筛选
67.因acc具有独特的病理学特征,肿瘤由腺上皮细胞和肌上皮细胞组成,每种细胞表达的分子标志物各不相同,如:腺上皮高表达c-kit(cd117),bcl-2;肌上皮细胞高表达egfr和myb等。以及myb-nfib融合基因、notch1激活突变、vegfr高表达等,这些差异都使得该肿瘤治疗比较困难。基于上述原因结合目前临床上正在进行ii期临床试验的靶向药物,开展myb抑制剂药物的筛选。
68.对于莫能霉素(monensin),尼日利亚霉素(nigericin)和南昌霉素(nanchangmycin)三种myb抑制剂药物,使用acc-83(腺样囊性癌细胞系)、acc-lm(腺样囊性癌肺转移细胞系)、scc-1(鳞状细胞癌细胞系)、hacat(正常上皮细胞系)作为对照,如图11、图12所示,结果显示莫能霉素的ic
50
值分别为acc-83(细胞系)的1.599μmol/l、acc-lm(细胞系)的0.8349μmol/l、acc-1(pdo)0.08964μmol/l和acc-12(类器官)0.9806μmol/l;尼日利亚霉素的ic
50
值分别为acc-83(细胞系)的0.8078μmol/l、acc-lm(细胞系)的0.3136μmol/l、acc-1(pdo)0.01597μmol/l和acc-12(pdo)0.4467μmol/l;南昌霉素的ic
50
值分别为acc-1(pdo)1.133μmol/l和acc-12(pdo)0.2418μmol/l。
69.可见,本发明构建的pdo模型可以用于腺样囊性癌靶向药物的筛选。
70.本实验中所用细胞系是经过药物筛选验证后的,选用此类细胞系来做对照,目的是与本发明中pdo组药物筛选结果作参考,根据最近文献报道有关其他瘤种的情况,对于pdo组药物筛选的结果,一般来说,pdo组ic
50
值跟细胞系的ic
50
值相近,或者稍高一些均是合理的,当然体内实验的ic
50
值一般会更高,只是一般相对于细胞系来说,pdo组的药物筛选结果更接近体内实验。如根据有关文献中研究报道,顺铂药物的细胞系组的ic
50
值为27.7μm,pdx组的ic
50
值为127.4μm,已成功建立pdx模型用于体外药物的筛选。因此,本发明中部分pdo组药物筛选的ic
50
值稍高于细胞系组,也是可以说明pdo组能够明显诱导肿瘤细胞的凋亡,具有较好的药物筛选效果的。
71.综上所述,本发明构建方法制备得到的腺样囊性癌类器官模型具有较好的原代肿瘤细胞的遗传学和生物学特征,可以应用于药物筛选、药物评价等肿瘤研究中,有望成为高通量药物筛选的有力工具。
72.尽管本发明的内容已经通过上述优选实施例作了详细介绍,但应当认识到上述的描述不应被认为是对本发明的限制。在本领域技术人员阅读了上述内容后,对于本发明的多种修改和替代都将是显而易见的。因此,本发明的保护范围应由所附的权利要求来限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1