乳腺癌生物标志物ZNF662基因及其检测方法与应用
乳腺癌生物标志物znf662基因及其检测方法与应用
技术领域
1.本发明属于生物学技术领域,具体涉及一种乳腺癌的生物标志物znf662基因及其检测方法与应用。
背景技术:
2.乳腺癌是女性最常见的恶性肿瘤之一,发病率一直排行全球女性癌症的第一,同时也是全球女性癌症死亡的主要原因之一。在我国乳腺癌的新发病率占女性新发总恶性肿瘤的15%。在治疗方面,手术仍是乳腺癌的首选,与此同时,非手术治疗逐渐变得成熟起来。尽管近年来治疗策略取得了重大进展,但由于乳腺癌是一种异质性极强的疾病,患者的临床表现和治疗反应各不相同,因此乳腺癌患者的临床治疗仍然存在巨大的挑战。早期发现、早期诊断和早期治疗对于改善乳腺癌患者预后,提高患者生活质量具有重要意义。
3.乳腺癌常见早期筛查技术包括:(1)乳腺超声检查:简单方便,无创无辐射,敏感度和准确度高,但难以发现微小钙化及毛刺样改变,不能可靠区分良恶性。(2)乳腺x线检查:对于各层次结构能清晰显示,对钙化灶敏感度高,但对40岁以下及致密性乳腺诊断准确性欠佳,其辐射性也存在争议。(3)乳腺mri检查:敏感性最高,对于深部病灶显示好,但检查时间长,价格昂贵,有条件限制使其一般做为上述检查的补充措施。(4)基因检测:作为当今基因组学不断发展的重要成果之一,其在恶性肿瘤早期筛查的临床应用也越来越受到重视,然而乳腺癌缺乏特异性的生物标志物使其受到限制。
4.dna甲基化生物标志物定义为在致癌过程中发生dna甲基化变化的分子靶标。这种生物标志物可用于癌症的早期检测,预测和/或监测治疗反应以及复发性癌症的检测。因此肿瘤特异性dna甲基化生物标记的发现并检查候选dna生物标记将其用于临床是目前研发的重点。目前研究较广泛和验证较充分的dna甲基化生物标记物有:组织因子途径抑制剂2(tfpi2),septin9(sept9),谷胱甘肽s-转移酶pi1(gstp1),和6-甲基鸟嘌呤-dna甲基转移酶(mgmt)以及5-羟甲基胞嘧啶。异常dna甲基化的发现是用于癌症诊断和治疗的特定标记的主要候选对象。近年来,随着临床检验诊断技术的完善与发展,恶性肿瘤中dna甲基化生物标志物具体的甲基化位点也越来越受关注。但总体而言,dna甲基化标志物在肿瘤中的临床应用仍需更多的基础研究和临床讨论。
5.dna甲基化贯穿于肿瘤发生发展的整个过程中,且由于其敏感性、特异性和易于分析的特点很有希望成为常规的临床肿瘤标志物。
6.本技术通过基因dna甲基化检测,提高样本的检测灵敏度和特异性,提高早期诊断率。且利用本方法进行检测,方法简单无创,易行方便,经济实惠,容易被大众所接受。
7.dna甲基化检测相较于常规检测手段更有利于早期癌症的发现,原因如下:(1)表观遗传的变化,比如dna甲基化的改变在肿瘤形成的早期发生,具有组织和癌种特异性;(2)dna甲基化类型贯穿肿瘤组织和同一类型的肿瘤,但体细胞突变通常只在癌细胞的亚群或克隆中;(3)dna甲基化在更大的基因区域中保持稳定,因此能通过多个cpg二核苷酸进行检测;(4)可同时设计多对引物进行联合检测;(5)适用于各种体液检测,可用来补充细胞学检
测未明或阴性时。
8.申请号为cn201780015221.8的发明专利公开了znf662可作为生物标记物用于子宫内膜癌、卵巢癌、阴道癌、阴门癌、妊娠性滋养层细胞疾病、原发性腹膜癌等妇科肿瘤的诊断,但是并未公开锌指蛋白znf662在乳腺癌领域的相关应用。
技术实现要素:
9.有鉴于此,本专利基于znf662基因在多数正常乳腺组织中表达较高,但在乳腺癌组织中的表达明显降低,并且与乳腺肿瘤分期呈负相关这一发现,结合公共数据库分析,检测znf662可以成为辅助乳腺癌患者筛查、诊断和治疗的生物标志物。
10.本发明的目的之一在于提供一种乳腺癌的生物标志物,该标志物可用于乳腺癌的早期检测、乳腺癌患病预测、监测治疗反应以及乳腺癌的复发检测。
11.为实现上述目的,本发明采用以下技术方案:
12.乳腺癌的生物标志物,所述生物标志物为znf662基因;所述待测样本来源于疑似乳腺癌的患者;所述znf662基因核苷酸为seq id no:1。
13.进一步,乳腺癌的生物标志物,所述生物标志物为znf662基因,所述待测样本为来源于疑似乳腺癌患者的离体样本;所述znf662基因核苷酸为seq id no:1。
14.本专利通过msp法检测乳腺癌疑似患者的乳腺组织中znf662基因甲基化状态来判断疑似患者是否患有乳腺癌,当znf662基因启动子未发生甲基化时,则判定患者为非乳腺癌,当znf662基因启动子发生甲基化,判定为患者为乳腺癌。
15.本专利利用tcga数据库,ualcan数据库和kaplan-meier plotter数据库分析发现,与正常乳腺组织相比,znf662在乳腺肿瘤组织中启动子甲基化状态提高,且与乳腺肿瘤分期呈正相关,同时znf662基因在乳腺癌组织中的表达明显降低,znf662基因表达与乳腺肿瘤分期呈负相关,即说明甲基化状态越高,表达水平就越低。
16.正常情况下,znf662基因启动子区域的cpg岛是非甲基化的,而乳腺癌患者的znf662基因启动子区域的cpg岛会发生甲基化。
17.进一步,所述生物标志物为未发生甲基化的znf662基因和/或已发生甲基化的znf662基因。
18.进一步,所述生物标志物为znf662基因的启动子,所述启动子的核苷酸为seq id no:2。
19.本发明的目的之二在于提供一种用于检测所述生物标志物的引物。
20.为实现上述目的,本发明采用以下技术方案:
21.用于检测所述生物标志物的引物,所述引物包括3对引物对,分别为:具有seq id no:3所示核苷酸的正向引物1,具有seq id no:4所示核苷酸的反向引物1;具有seq id no:5所示核苷酸的正向引物2,具有seq id no:6所示核苷酸的反向引物2;具有seq id no:7所示核苷酸的正向引物3,具有seq id no:8所示核苷酸的反向引物3。
22.进一步,引物对1为表达引物(181bp);引物对2为甲基化引物(133bp);引物对3为非甲基化引物(136bp)。
23.本发明的目的之三在于提供一种含有上述引物的试剂。
24.为实现上述目的,本发明采用以下技术方案:
25.一种含有上述引物的试剂,所述试剂还包括甲基化检测试剂和用于提取样本dna的试剂。
26.本发明的目的之四在于提供一种用所述引物和/或所述试剂检测znf662基因启动子甲基化状态的方法。
27.为实现上述目的,本发明采用以下技术方案:
28.一种用所述引物和/或所述试剂检测znf662基因启动子甲基化状态的方法,具体包括以下步骤:
29.(1)用所述提取样本dna的试剂提取dna样本;
30.(2)利用所述引物和/或所述试剂,通过msp方法检测所述dna样本中znf662基因启动子的甲基化水平,得到其msp电泳图结果。
31.进一步,采用methltarget测序检测进一步验证msp结果,将得到的结果与正常组的启动子甲基化位点进行对比,判断其甲基化状态。
32.进一步,所述方法适用于各种体液检测,所述样本包括外周血、粪便、组织和/或细胞。
33.本发明的目的之五在于提供一种所述生物标志物、所述引物和/或所述试剂在制备用于诊断乳腺癌的试剂盒中的应用。
34.为实现上述目的,本发明采用以下技术方案:
35.所述生物标志物、所述引物和/或所述试剂在制备用于诊断乳腺癌的试剂盒中的应用。
36.进一步,所述生物标志物、所述引物和/或所述试剂在制备用于乳腺癌早期诊断的试剂盒中的应用。
37.进一步,所述生物标志物、所述引物和/或所述试剂在制备用于乳腺癌患病风险预测的试剂盒中的应用。
38.进一步,所述生物标志物、所述引物和/或所述试剂在制备用于乳腺癌预后判断的试剂盒中的应用。
39.本发明的目的之六在于提供一种znf662基因的甲基化抑制剂在制备用于治疗乳腺癌的药物中的应用,该甲基化抑制剂通过抑制znf662基因发生甲基化,实现抑制乳腺癌细胞的增殖及克隆形成能力,抑制乳腺癌细胞的迁移和侵袭能力,诱导乳腺癌细胞周期于g0-g1期/g2-m期阻滞,从而在体内抑制乳腺癌细胞的生长。
40.本专利研究发现,乳腺癌细胞经去甲基化药物aza(5-氮杂-2'-脱氧胞苷)和组蛋白去乙酰化酶抑制剂tsa(曲古菌素a)处理后,znf662基因表达会有不同程度的上调,znf662基因启动子异常高甲基化状态会导致znf662基因的表达沉默。
41.本发明的有益效果在于:
42.(1)本专利利用tcga数据库、ualcan数据库和kaplan-meier plotter数据库进行分析,与正常乳腺组织相比,znf662在乳腺肿瘤组织中启动子甲基化状态提高,且与乳腺肿瘤分期呈正相关,同时znf662基因在乳腺癌组织中的表达明显降低,znf662基因表达与乳腺肿瘤分期呈负相关,即说明甲基化状态越高,表达水平就越低;并且znf662基因在某些种类的乳腺癌细胞系如mb231、yccb1中的表达较低;
43.(2)本专利研究发现znf662基因高表达患者比低表达患者预后更好,生存周期更
长;znf662基因在乳腺癌中甲基化cpg岛高风险组比低风险组组预后更差;并发现znf662基因启动子异常高甲基化状态会导致znf662基因的表达沉默;
44.(3)本专利研究发现通过抑制znf662基因甲基化的发生,可以抑制乳腺癌细胞的增殖及克隆形成能力,抑制乳腺癌细胞的迁移和侵袭能力,诱导乳腺癌细胞周期于g0-g1期/g2-m期阻滞,从而在体内抑制乳腺癌细胞的生长,为乳腺癌的治疗提供了新的思考和方法,即采用znf662基因甲基化抑制剂抑制znf662基因发生甲基化,从而实现乳腺癌的治疗;
45.(4)本专利公开的方法可同时设计多对引物对znf662基因进行联合检测;
46.(5)本专利公开的方法适用于各种体液检测;
47.(6)在乳腺癌中,对锌指蛋白znf662的研究尚属空白,本技术通过体内、体外实验率先证实znf662作为一个全新的抑癌基因,其在乳腺癌中由于启动子高甲基化而表达下调,为乳腺癌早期诊断标志物的筛选提供了新选择。
附图说明
48.图1是利用tcga数据库和ualcan数据库分析znf662在不同分期的乳腺癌组织和正常乳腺组织中的表达差异;
49.图2是利用kaplan-meier plotter数据库分析znf662表达与乳腺癌患者的预后的关系;
50.图3是通过rt-pcr检测znf662 mrna在乳腺癌细胞系和正常乳腺上皮细胞中的表达情况;
51.图4是利用ualcan数据库分析znf662在不同分期的乳腺癌组织和正常乳腺组织中的的启动子甲基化状态;
52.图5是利用cbioportal数据库分析znf662在乳腺肿瘤组织中启动子甲基化状态与表达水平的相关性;
53.图6是利用survivalmeth数据库分析发现znf662在乳腺癌中甲基化cpg岛高风险组与低风险组的预后差异;
54.图7是通过rt-pcr验证经去甲基化药物处理后znf662在乳腺癌细胞系中的表达情况,其中
①④
表示mb231与yccb1细胞系未经去甲基化药物处理后的znf662 mrna表达水平,
②⑤
表示mb231与yccb1细胞系经过aza(5-氮杂-2'-脱氧胞苷)处理后的znf662 mrna表达水平,
③⑥
表示mb231与yccb1细胞系经过tsa(曲古菌素a)处理后的znf662 mrna表达水平;(**表示p《0.01)
55.图8是通过msp检测乳腺肿瘤组织中znf662的甲基化状态;
56.图9是methtarget检测乳腺肿瘤组织中znf662的甲基化状态;
57.图10-11是通过rt-pcr和western blot验证构建的znf662过表达乳腺癌细胞系(***表示p《0.001);
58.图12是通过细胞增殖实验验证znf662抑制乳腺癌细胞增殖,其中,图12-a表示mb231 0~27h的吸光度,图12-b表示yccb10~27h的吸光度(**表示p《0.01);
59.图13-14是通过克隆形成实验验证znf662抑制乳腺癌细胞集落形成(***表示p《0.001);
60.图15-17是通过流式细胞技术验证znf662诱导乳腺癌细胞g0-g1期/g2-m期阻滞
(***表示p《0.001);
61.图18-19是通过transwell实验验证znf662抑制乳腺癌细胞的迁移能力(***表示p《0.001);
62.图20-21是通过transwell实验验证znf662抑制乳腺癌细胞的侵袭能力(***表示p《0.001);
63.图22-23是通过裸鼠皮下成瘤实验验证znf662在体内抑制乳腺癌细胞的成瘤能力。
具体实施方式
64.下面将结合具体的实施例对本发明的技术方案进行更进一步地清楚、完整地描述。显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部实施例。因此,基于本发明中的实施例,本领域技术人员在没有付出创造性劳动前提下所获得的其他所有实施例都属于本发明的保护范围。
65.下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的仪器设备,如无特殊说明,均为实验室常规仪器设备;下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
66.实施例1.细胞组织dna的提取
67.以下步骤均在无酶条件下进行。
68.1.细胞的提取
69.(1)待细胞生长至适宜密度,倒去旧培养基,加入1ml预冷pbs,水平晃动清洗一遍细胞。重复上述步骤两次,甩干瓶内残液,加入1ml胰酶,置于孵箱消化5min,再将瓶内液体转移至离心管内;
70.(2)将离心管置于普通离心机内,注意配平,设置参数为800rpm,5min;
71.(3)离心结束后,吸弃最上层上清液,离心管内加入180μl buffer atl,轻柔吹打混匀,转移至ep管内;
72.(4)ep管内加入20μl蛋白酶k,轻柔吹打混匀,置于55℃恒温器孵育30min;
73.(5)ep管内加入20μl 20mg/μl rnase a,震荡混匀15s,室温孵育2-5min;
74.(6)ep管内加入200μl buffer al,震荡混匀15s,置于70℃恒温器孵育10min;
75.(7)ep管内加入200μl无水乙醇,震荡混匀15s;
76.(8)将ep管内液体转移至套柱内,将套柱置于普通离心机内,注意配平,设置参数为8000rpm,1min;
77.(9)移去下层废液,再向上层离心柱加入500μl buffer aw1,将离心柱放置于普通离心机内,设置参数为8000rpm,1min;
78.(10)移去下层废液,再向上层离心柱加入500μl buffer aw2,将离心柱放置于普通离心机内,设置参数为12000rpm,3min;
79.(11)移去下层废液,将离心柱放置于普通离心机内,设置参数为12000rpm,60s空离;
80.(12)套入新无酶ep管,向上层离心柱中加入30μl buffer ae/三蒸水,静置3min,将离心柱放置于普通离心机内,设置参数为8000rpm,60s;
81.(13)离心结束后,可见ep管内有液体即为提取好的dna,分光光度计nanodrop 2000测量浓度,储存于-20℃冰箱。
82.2.外周血、粪便、组织dna的提取
83.(1)液氮罐中取出组织,使用经灭菌处理的研杵在研钵内充分研磨,取适量组织粉末置于1.5ml ep管内,再加入600μl tnes buffer和20μl蛋白酶k振荡混匀,55℃恒温器过夜;
84.(2)冷却常温后再加入200μl nacl溶液(6mol/l),振荡混匀;
85.(3)将ep管置于普通离心机内,注意配平,设置参数为12000rpm,10min;
86.(4)离心结束后,吸取最上层上清液置新1.5ml ep管内,加入500μl预冷异丙醇,轻柔上下颠倒混匀数次,常温静置10min;
87.(5)将ep管置于普通离心机内,注意配平,设置参数为6000rpm,5min;
88.(6)离心结束后,可见ep管内有些许白色沉淀,即为dna,小心吸弃上清液,注意勿吸到沉淀;
89.(7)加入1ml预冷的70%乙醇,轻柔上下颠倒混匀数次;
90.(8)将ep管置于普通离心机内,注意配平,设置参数为6000rpm,5min;
91.(9)重复步骤(6)(7)(8)(6);
92.(10)于冰上敞开ep管盖子5min,干燥管内残液;
93.(11)加入30μl te buffer,混匀后,分光光度计nanodrop 2000测量浓度,储存于-80℃冰箱。
94.实施例2.亚硫酸盐修饰提取的dna、甲基化检测
95.1.dna重亚硫酸盐修饰
96.以下步骤均在无酶条件下进行。
97.表1
98.混合液(mix)成分体积m-dilution buffer300μlm-dissolving buffer500μl无酶水900μl
99.按照表1配制混合液,并震荡混匀。
100.(1)取上述混合液130μl,并添加20μl实施例1中提取的dna,瞬离混匀,在恒温器中98℃孵育10min,64℃孵育150min,4℃孵育20h。
101.(2)孵育完成加入600ul m-binding bufferr,瞬离混匀,然后液体过柱,将离心柱放置于普通离心机内,设置参数为12000rpm,30s;
102.(3)移去下层废液,再向上层离心柱加入200μl m-wash buffer,将离心柱放置于普通离心机内,设置参数为12000rpm,30s;
103.(4)移去下层废液,再向上层离心柱加入200μl m-desulphonation buffer,常温静置20min,将离心柱放置于普通离心机内,设置参数为12000rpm,30s;
104.(5)移去下层废液,再向上层离心柱加入200μl m-wash buffer,将离心柱放置于普通离心机内,设置参数为12000rpm,30s;
105.(6)重复步骤(6);
106.(7)套入新无酶ep管,向上层离心柱中加入10μl m-elution buffer,将离心柱放置于普通离心机内,设置参数为12000rpm,30s;
107.(8)离心结束后,无酶ep管储存于-20℃冰箱。
108.2.组织测序及公共数据库分析筛选潜在的甲基化位点作为乳腺癌的诊断生物标志物
109.为明确在乳腺癌中有意义的分子标记物,申请人前期通过对乳腺癌和乳腺正常组织进行测序,从中筛选出异常甲基化和差异表达的基因。再从筛选的基因中根据倍数变化及校正p值排序挑选出具有明显趋势的基因。再利用tcga数据库,ualcan数据库和kaplan-meier plotter数据库(http://kmplot.com/analysis/)筛选潜在的甲基化位点作为早期乳腺癌的诊断生物标志物,如图1所示,与正常乳腺组织相比,znf662在乳腺癌组织中的表达明显降低,同时znf662表达与乳腺肿瘤分期呈负相关。通过图2可以看出,znf662高表达患者比低表达患者预后更好,生存周期更长。通过rt-pcr检测znf662 mrna在乳腺癌细胞系和正常乳腺上皮细胞中的表达情况,结果如图3所示。
110.本专利研究发现znf662在乳腺肿瘤组织中甲基化水平明显高于正常乳腺组织,如图4所示,与正常乳腺组织相比,znf662在乳腺肿瘤组织中启动子甲基化状态提高,且与乳腺肿瘤分期呈正相关。进一步结合cbioportal数据库(http://www.cbioportal.org/)在线分析,如图5所示,znf662在乳腺肿瘤组织中启动子甲基化状态与表达水平呈负相关,即甲基化状态越高,表达水平就越低。
111.3.甲基化特异性pcr(msp)
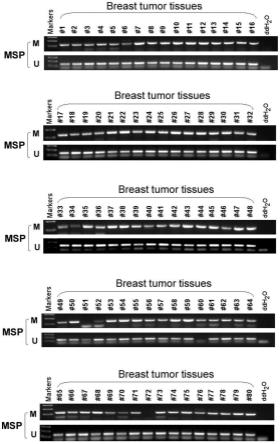
112.为了甲基化检测方法能简化及临床推广应用,根据前期测序结果及公共数据库分析,采用甲基化特异性pcr进一步验证和优化,以便该检测方法能推广应用,具体步骤如下:
113.以下步骤均在无酶条件下进行。
114.(1)按照表2配制混合液。
115.表2
116.混合液(mix)成分体积10
×
pcr buffer1.25μlmg cl21μl引物10.75μl引物20.75μldntps1μltaq-gold酶0.09375μl
117.按照表2配制混合液,并用无酶水定容至12μl,瞬离混匀。
118.(2)ep管加入上述亚硫酸盐修饰的dna 0.5μl,瞬离混匀;
119.(3)将ep管置于pcr仪内,并按照表3设置参数,循环数为40。
120.表3
121.反应温度反应时间95℃10min95℃30s58℃30s(u)
60℃30s(m)72℃30s72℃10min
122.(4)pcr仪扩增的同时,制备琼脂糖凝胶:按2%比例配置(如:20ml 1
×
tae+0.4g琼脂糖粉);微波炉高火打至沸腾,加入1μl nucleic acid stain来回旋转混匀后快速倒入凝胶模具,等待1h后凝固;
123.(5)扩增结束后,轻柔缓慢垂直向上拔出梳子,将琼脂糖凝胶移入电泳槽,将dna marker和扩增好的pcr产物一同上样加入孔中;
124.(6)设置电源参数为:120v,25min;
125.(7)电泳完成,凝胶成像图像分析仪曝光,分析结果并保存。
126.survival meth数据库分析发现znf662在乳腺癌中甲基化cpg岛高风险组比低风险组组预后更差,详见图6。使用去甲基化药物aza(5-氮杂-2'-脱氧胞苷)和组蛋白去乙酰化酶抑制剂tsa(曲古菌素a)处理乳腺癌细胞后,znf662表达都有不同程度的上调,提示znf662的表达沉默可能是由于启动子异常高甲基化状态,详见图7。
127.本专利选取160例乳腺肿瘤患者的组织样本(癌旁由病理科医生确认为病理正常)。msp结果如图8所示,znf662基因在乳腺肿瘤组织中呈现高甲基化状态,甲基化率为86.9%(21/160)。
128.为了验证msp的结果,申请人在22例乳腺癌组织和10例正常乳腺组织中进行了methltarget测序检测,结果如图9所示,znf662在乳腺癌组织中的启动子甲基化位点明显高于正常乳腺组织。
129.实施例3.筛选稳定表达znf662的人乳腺癌细胞株
130.1.材料
131.(1)细胞系:本专利所使用的乳腺癌细胞系为mb231和yccb1;细胞完全培养基为rpmi-1640+10%胎牛血清+1%p-s双抗;培养条件为37℃,5%co2的孵育箱。
132.(2)质粒:本专利构建的m98-znf662质粒是通过将带有标记的znf662全长基因序列插入到m98框架质粒中,然后将重组质粒转化到大肠杆菌dh5a内,并已经过测序核证;对照质粒为m98框架质粒。
133.2.筛选稳定表达znf662的人乳腺癌细胞株
134.(1)转染前一天细胞铺板,细胞消化后均匀种植于六孔板内,第二天观察或待板内细胞生长密度约为70%左右即可进行转染;
135.(2)转染试剂为lip2000脂质体,按如下体系配置:
136.①
a液:250μl/孔rpmi-1640(-)稀释4μg/孔对照质粒及目的znf662质粒,来回轻柔吹打混匀,常温静置5min;
137.②
b液:250μl/孔rpmi-1640(-)稀释lip2000脂质体5μl/孔,来回轻柔吹打混匀,常温静置5min;
138.③
5min后将a液和b液轻柔吹打混合,常温静置20min;
139.(3)取出待转染的六孔板,吸弃旧培养基,加入适量pbs,水平晃动清洗一遍细胞,吸弃pbs,加入500μl/孔rpmi-1640(-);
140.(4)静置20min后将a液和b液的转染混合液吸入孔板内的rpmi-1640(-),来回晃动
轻柔混匀,放回培养箱;
141.(5)4-6h后,吸弃孔内培养基,换为2ml/孔的完全培养基水平晃动后放回培养箱;
142.(6)48h后即可用g418进行稳定株筛选(课题组前期研究已经得出mb231 g418筛选浓度为24μl/ml,yccb1 g418筛选浓度为8μl/ml),或按照实验需求安排;
143.(7)g418筛选10-14d后,可按照半量g418作为维持剂量;
144.(8)稳定株提取细胞rna/蛋白,通过rt-pcr/western blotting验证znf662的过表达。
145.如图10-11所示,本专利从转录水平与翻译水平表明znf662质粒转染的mb231和yccb1细胞相较于对照细胞其znf662转录翻译量增加,这意味着成功构建了znf662过表达乳腺癌细胞系。
146.实施例4.细胞增殖实验
147.(1)常规细胞消化离心,离心结束后倒去上清,根据需要加入适量完全培养基重悬细胞,充分吹打混匀,取适量细胞悬液转移至无菌ep管内;
148.(2)从ep管中吸取10μl均匀打至细胞计数板上,显微镜镜下计数,一共四个象限,按照“数上不数下,数左不数右”基本原则计算四个象限内的细胞;
149.(3)根据公式计算细胞悬液浓度,按照1000-2000个细胞/100ul/孔(96孔板),计算所需细胞悬液量,再加入所需要稀释的完全培养基,充分吹打混匀;
150.(4)以每孔100ul的培养基量铺96孔板,每个时间段均需要重复3-5个复孔,转移至细胞培养箱静置2-4h等待细胞贴壁;
151.(5)细胞贴壁后,每孔加入10ul cck8,轻拍96孔板壁帮助混匀后放回细胞培养箱内,严格避光操作;
152.(6)加入cck8 2h后根据酶标仪的cck8参数设置测量每孔在od值=450nm的吸光度,连续测量0h,24h,48h,72h,分析保存结果。
153.结果如图12所示,实验结果表明稳定过表达znf662的乳腺癌细胞系生长速度减慢,这意味着过表达znf662可以明显抑制乳腺癌细胞的增殖能力。
154.实施例5.细胞克隆形成实验
155.(1)常规细胞消化离心,离心结束后倒去上清,根据需要加入适量完全培养基重悬细胞,充分吹打混匀,取适量细胞悬液转移至无菌ep管内;
156.(2)从ep管中吸取10μl均匀打至细胞计数板上,显微镜镜下计数,一共四个象限,按照“数上不数下,数左不数右”基本原则计算四个象限内的细胞;
157.(3)根据公式计算细胞悬液浓度,按照100/200/400个细胞/2ml完全培养基/孔(6孔板),计算所需细胞悬液量,然后向每个孔内加入所需要细胞悬液量,充分吹打混匀,缓慢移至细胞培养箱内;
158.(4)间断观察6孔板内细胞生长状况,一般10-14d后,肉眼/显微镜下可见细胞集落形成明显,即倒去旧培养基,加入1ml pbs,水平晃动清洗一遍细胞。重复上述步骤1次,甩干瓶内残液,再向每孔加入适量的4%多聚甲醛,室温固定30min;
159.(5)回收4%多聚甲醛,再向每孔加入适量的结晶紫染液,室温染色30min;
160.(6)回收结晶紫染液,将6孔板置于装有流水的泡沫盒内,缓慢来回漂洗残余结晶紫,期间不断更换流水直至颜色变清淡紫色即可;
161.(7)倒置6孔板于吸水纸上过夜吸干水分,观察染色结果,分析并扫描保存。
162.结果如图13-14所示,实验结果表明稳定过表达znf662的乳腺癌细胞系形成集落数目减少,这意味着过表达znf662明显抑制乳腺癌细胞克隆形成能力。
163.实施例6.细胞周期实验
164.(1)常规细胞消化离心,离心结束后倒去上清,加入5ml的pbs,充分吹打混匀,放置离心管于离心机内,设置参数:1000rpm/5min;
165.(2)离心结束后倒去上清,加入100ul pbs,缓慢吹打轻柔混匀,再加入5ml预冷的75%冰乙醇固定,缓慢吹打轻柔混匀,做好标记,封口胶封闭离心管,储存于4℃冻库过夜;
166.(3)过夜后放置离心管于离心机内,设置参数:2000rpm/5min,注意冰乙醇很滑,离心结束后小心用枪头吸弃上清液;
167.(4)加入5ml的pbs,充分吹打混匀,放置离心管于离心机内,设置参数:2000rpm/5min;
168.(5)倒去上清,加入1.2ml的pbs,充分吹打混匀,转移至3管ep管内,每管400ul;
169.(6)每管ep管加入2.5ul rna酶,置于37℃恒温器内孵育30min;
170.(7)严格避光条件下每管ep管加入5ul碘化丙啶(pi),静置30min后上流式细胞仪;
171.(8)实验室技术人员检测细胞周期分析保存数据。
172.结果如图15-17所示,实验结果表明稳定过表达znf662可分别将mb231和yccb1细胞的细胞周期阻滞于g0/g1期和g2-m期,提示znf662显著诱导乳腺癌细胞周期于g0-g1期/g2-m期阻滞。
173.实施例7.细胞迁移实验
174.(1)常规细胞消化离心,离心结束后倒去上清,根据需要加入适量rpmi-1640(-)重悬细胞,充分吹打混匀,取适量细胞悬液转移至无菌ep管内;
175.(2)从ep管中吸取10μl均匀打至细胞计数板上,显微镜镜下计数,一共四个象限,按照“数上不数下,数左不数右”基本原则计算四个象限内的细胞;
176.(3)24孔板内选取适当孔数,每孔加入800ul含20%fbs的细胞完全培养基,再放入小室;
177.(4)根据公式计算细胞悬液浓度,按照小室上室3
×
10^4个细胞计算所需细胞悬液量,再加入rpmi-1640(-)共计200ul轻柔吹打混匀后加入小室上室,缓慢转移至细胞培养箱;
178.(5)适当天数后,一般1-2d,取出24孔板,倒弃板内液体,吸弃小室上室的液体,然后向24孔板内每孔加入800ul 4%多聚甲醛,放回小室,室温固定30min;
179.(6)回收4%多聚甲醛,再向24孔板内每孔加入适量的结晶紫染液,放回小室,室温染色30min;
180.(7)回收结晶紫染液,将小室置于装有流水的泡沫盒内,缓慢来回漂洗残余结晶紫,期间不断更换流水直至颜色变清淡紫色即可;
181.(8)使用棉签轻柔擦去小室上室的内面细胞,倒置小室于吸水纸上过夜吸干水分;
182.(9)显微镜下观察结果,生命科学研究院预约拍照分析并保存。
183.结果如图18-19所示,实验结果表明稳定过表达znf662的乳腺癌细胞系迁移细胞数目减少,提示过表达znf662明显抑制乳腺癌细胞迁移能力。
184.实施例8.细胞侵袭实验
185.(1)基质胶(matrigel胶)置于4℃冰箱过夜融化成凝胶状;
186.(2)使用rpmi-1640(-)以1:7的比例稀释matrigel胶,充分吹打混匀;
187.(3)加入适量稀释的matrigel胶于小室上室内,置于细胞培养箱内适当时间直至凝固成固体胶状;
188.(4)剩余步骤同transwell小室迁移实验。
189.结果如图20-21所示,实验结果表明稳定过表达znf662的乳腺癌细胞系侵袭细胞数目减少,这提示过表达znf662明显抑制乳腺癌细胞的侵袭能力。
190.实施例9.裸鼠成瘤实验
191.(1)订购5只4-6周龄雌性balb/c裸鼠;
192.(2)常规培养细胞,待细胞生长至适宜数量时,常规细胞消化离心,离心结束后倒去上清,根据需要加入适量pbs重悬细胞,充分吹打混匀,取适量细胞悬液转移至无菌ep管内;
193.(3)从该ep管内再吸取适量细胞悬液稀释10倍后转移至新无菌ep管内;从第二个ep管中吸取10μl均匀打至细胞计数板上,显微镜镜下计数,一共四个象限,按照“数上不数下,数左不数右”基本原则计算四个象限内的细胞;
194.(4)根据公式计算细胞悬液浓度,乘以10后即为初始未稀释的细胞悬液浓度,按照200
×
104细胞量计算所需细胞悬液量,再加入pbs共计150ul轻柔吹打混匀后转移至新无菌ep管内待用;
195.(5)裸鼠臀部左右两侧分别皮下注射相同细胞数量相同体积的对照组/过表达znf662的细胞;
196.(6)待肉眼出现质地较硬的肿瘤块后,每隔3d测量瘤体长宽,计算肿瘤体积;
197.(7)若肿瘤体积超过1cm3后,根据实验动物伦理原则,处死裸鼠;
198.(8)逐层解剖分离裸鼠肿瘤组织,按照同一裸鼠对照组过表达组上下一一对应顺序依次摆放拍照称重;
199.(9)拍照完成后,将肿瘤组织固定于4%多聚甲醛,拟根据实验需求安排下一步实验。
200.裸鼠皮下成瘤实验结果表明,znf662目的组所形成的移植瘤的大小、重量与体积均明显低于对照组。进一步体内验证znf662基因能够在体内抑制乳腺癌细胞的生长,结果如图22-23所示。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1