索拉非尼耐药分子标记物及其相关试剂的应用
1.本发明属于生物医学技术领域,尤其涉及肿瘤领域,具体为一种索拉非尼耐药分子标记物及其相关试剂应用。
背景技术:
2.原发性肝癌(primary liver cancer,plc)在我国目前常见的恶性肿瘤中,发病率排第四位,死亡率排第二位,严重威胁我国人民的生命和健康。肝癌早期患者(巴塞罗纳0期a期),手术切除和肝移植等治疗可以有效地提高肝癌患者的治愈率和生存预后。然而由于肝癌起病隐匿,早期症状缺乏特异性,很多患者被诊断为肝癌时,就已经处于中期或晚期。长期以来,由于药物治疗方案少,而且临床有效率低,中晚期肝癌普遍显示预后差、生存率低。
3.索拉非尼(sorafenib)是最早用于肝癌治疗药物,可作用于craf、braf、v600ebraf、c-kit、flt-3、vegfr-2、vegfr-3、pdgfr-β靶点,起到抑制肿瘤细胞增殖和抗血管生成作用。然而,索拉非尼仅能将中位生存期提高三个月,且有效率低,尚不足10%、而且出现了很多无效治疗现象。因此,亟需索拉非尼的药敏分子分型方案,提高肝癌治疗疗效。
技术实现要素:
4.为了克服现有技术的问题,本发明的第一个目的在于提供一种索拉非尼耐药标记物,采用其可对索拉非尼耐药人群进行提示,为肝癌精准治疗提供依据。本发明的第二个目的提出索拉非尼耐药标记物在非治疗目的的索拉非尼用药研究中的应用。本发明的第三个目的是,提供该索拉非尼耐药标记物相关试剂的一些应用,该标记物的相关试剂包括:检测其表达的定量试剂、抑制剂等,这些相关试剂的应用能够填补肝癌精准诊疗领域的空白。
5.本发明的目的是这样实现的:
6.本发明的第一方面:发现ctnnb1及以ctnnb1为核心的一组基因pik3ca、hnrnpul2-bscl2、paxip1、cdkl5、lztfl1、s1pr2、klhl11、rp11-159g9.5、fam171a2、zbed6、peli1、prim1的高表达与索拉非尼耐药相关。因此这些基因表达能够作为指导原发性肝癌治疗的潜在生物标记物。即提供了一组索拉非尼耐药标记物,所述索拉非尼耐药标记物为ctnnb1或者是与ctnnb1相关联的一组标记物中的任意一种,所述与ctnnb1相关联的一组标记物为pik3ca、hnrnpul2-bscl2、paxip1、cdkl5、lztfl1、s1pr2、klhl11、rp11-159g9.5、fam171a2、zbed6、peli1、prim1。所述索拉非尼耐药标记物为rna或其逆转录的cdna,或蛋白。
7.具体筛选过程为:
8.发明人收集了多例原发性肝癌患者的手术标本,多点取样,通过三维培养的方法,成功建立了涵盖数百个位点的肝癌类器官生物库。团队通过苏木精-伊红(hematoxylin-eosin,he)染色,证实类器官保留了患者的病理学特征。通过对类器官和对应的患者标本的免疫荧光、免疫组化染色,发现肝癌类器官与临床上肝癌患者的分子标记物也是一致的。
9.选取近百个位点,进行组织和对应类器官的外显子、转录组测序,分析了组织与对
应类器官的基因组特征。从体细胞突变、拷贝数变异和转录组相似性等多维度验证了类器官生物库高度保留组织样本的分子特征。此外,团队建立的大规模肝癌组织和类器官队列与以往肝癌研究一致,具有肝癌的高发突变。另外,发明人的肝癌数据反映了不同程度的肿瘤间(inter-tumor)和肿瘤内异质性(intra-tumor heterogeneity),为研究肝癌药敏异质性提供了依据。
10.选取临床上常用的肝癌药物索拉非尼对类器官生物库进行大规模药物筛选,以探索肝癌药敏分子分型。将这些位点划分为索拉非尼敏感和不敏感组,将所有位点均敏感的患者,判定为该药物敏感的患者。发明人将类器官药敏与临床治疗效果相比对,发现其药敏效果是高度一致的。
11.为了研究肝癌一线靶向药物索拉非尼的药敏分子分型,对多个类器官位点进行了转录组测序,通过lasso模型及生信分析,解析出索拉非尼的耐药分子标记物ctnnb1及以pik3ca、hnrnpul2-bscl2、paxip1、cdkl5、lztfl1、s1pr2、klhl11、rp11-159g9.5、fam171a2、zbed6、peli1、prim1。其训练集auc为0.94。之后,通过同样的方法,对多个肝癌标本进行类器官培养、药敏测试和转录组测序,进行分子分型研究,得到索拉非尼的验证集为auc为0.90。进一步将索拉非尼的药敏分子分型在多例肝癌患者组织标本中验证,索拉非尼auc为0.91,进一步说明发明人的药敏分子分型具备较好的药敏预测效果。
12.本发明的第二方面:索拉非尼耐药标记物在非治疗目的的索拉非尼用药研究中的应用。
13.包括在一些药效方面的基础性研究应用、对索拉非尼改进研究的药效测定方面的应用。
14.本发明的第三方面:检测所述索拉非尼耐药标记物表达量的定量试剂在制备索拉非尼耐药评估试剂及药敏检测试剂中的应用。
15.进一步的,所述索拉非尼耐药评估试剂及药敏检测试剂为索拉非尼在治疗肝癌过程中进行耐药评估及药敏检测的试剂,所述耐药评估及药敏检测的样本为患者肝癌组织;所述定量试剂为转录组测序,或通过pcr、基因芯片、组织芯片、nanostring技术、免疫组化试剂中任意一种。
16.进一步的,提供了一种索拉非尼耐药性评估试剂盒,包含检测所述索拉非尼耐药标记物表达量的定量试剂。
17.进一步的,提供了一种原发性肝癌的索拉非尼耐药分析系统,包括:靶点表达量检测装置:用于检测样本中所述索拉非尼耐药标记物的表达量;所述样本为患者肝癌组织;耐药分析装置:基于索拉非尼耐药标记物的表达量,确定肝癌的用药效果;结果输出装置:用于输出耐药分析装置分析得到的结果。所述靶点表达量检测装置采用的试剂包括组织转录组测序,或通过pcr、基因芯片、组织芯片、nanostring技术、免疫组化任意一种或几种。标记物表达量显著低表达或高表达时,判定为肝癌索拉非尼敏感或耐药。在具体实施过程中定量试剂检测的样本为患者的组织,可取自患者的手术样本或穿刺样本。
18.本发明的第四方面:抑制索拉非尼耐药标记物表达的药物在制备治疗肝癌的药物组合物中的应用,所述药物组合物中包含有索拉非尼。
19.进一步的,提供一种治疗肝癌的药物组合物,包含索拉非尼及抑制所述索拉非尼耐药标记物表达的药物。
20.本发明的优点和有益效果是:
21.确定了ctnnb1以及pik3ca、hnrnpul2-bscl2、paxip1、cdkl5、lztfl1、s1pr2、klhl11、rp11-159g9.5、fam171a2、zbed6、peli1、prim1基因的高表达与索拉非尼耐药相关,即为索拉非尼耐药标记物。这些标记物可用于预测索拉非尼的药效。通过对肝癌患者的组织测序,或通过pcr、基因芯片、组织芯片、nanostring技术、免疫组化试剂的方法检测相关分子的表达,可为索拉非尼的用药与肝癌的精准治疗提供线索。
附图说明
22.下面结合附图和实施例对本发明作进一步说明。
23.图1为肝细胞肝癌(hepatocellular carcinoma,hcc)患者的类器官保留患者的病理特征和组织标记物。其中,图1a.hcc患者不同位点的he及免疫组化染色;图1b.hcc患者类器官的显微镜下状态和he染色;图1c.类器官的免疫荧光染色;图1d.类器官的免疫组化染色。
24.图2为类器官保留患者的外显子、转录组特征。其中,图2a.外显子测序揭示类器官保留了患者的突变特征。图2b.转录组测序显示类器官保留了患者的转录组特征。
25.图3为类器官药敏测试。图3a,索拉非尼的药敏曲线,图3b,对376例类器官的7种肝癌靶向药物测试。图3c,类器官的体外药敏测试,与临床患者的药物反应具有一致性。
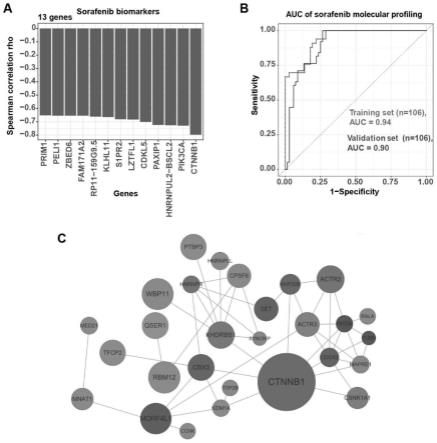
26.图4为索拉非尼药敏分子分型。图4a.索拉非尼的药敏分子分型。图4b.索拉非尼训练集和验证集的auc。图4c,索拉非尼的耐药靶点互作图。
27.图5为索拉非尼分子分型在100例肝癌组织中的验证。
28.图6为靶向ctnnb1增强索拉非尼的药敏效果。图6所示为6位肝癌患者的药敏曲线,圆形点标记的曲线表示原始的肝癌类器官的药敏曲线,方形点标记的曲线表示敲低ctnnb1(a)或过表达ctnnb1(b)的药敏曲线。横坐标显示了不用同的索拉非尼药物浓度,纵坐标显示了该浓度下类器官的存活比例。图6a,在索拉非尼耐药的位点中,敲低ctnnb1可以显著增强索拉非尼的药物敏感度。图6b,在索拉非尼敏感的位点中,过表达ctnnb1也可以使得索拉非尼敏感度降低。
具体实施方式
29.下面结合实验数据,进一步说明本发明的技术方案。
30.实施例1
31.索拉非尼耐药标记物的筛选:
32.本实施例通过3d培养的方法,成功建立了涵盖376个位点的肝癌类器官生物库。以肝细胞肝癌(hepatocellular carcinoma,hcc)患者的手术标本为例,发明人通过he染色的方法,证实类器官保留了患者的病理学特征(图1a、1b)。通过对类器官和对应的患者标本进行免疫荧光、免疫组化染色,发现肝细胞癌患者及其类器官高中hcc诊断标记物afp、hepatocyte阳性(图1c、1d),而胆管癌标记物epcam阴性,与临床上肝癌患者的分子标记物也是一致的。说明本实施例建立的类器官体系很好的保留了患者的病理特征。
33.本实施例选取99个位点,进行组织和对应类器官的外显子、转录组测序,分析了组织与对应类器官的基因组特征。从体细胞突变、拷贝数变异和转录组相似性等多维度验证
了类器官生物库高度保留组织样本的分子特征。团队建立的大规模肝癌组织和类器官队列与以往肝癌研究一致,具有肝癌的高发突变(图2a)。在转录组层面,类器官和对应患者的组织也具有高度的相关性(图2b)。
34.本实施例对376个类器官进行肝癌一线药物索拉非尼、仑伐替尼,常用的二/三线药物瑞戈非尼、阿帕替尼、贝伐单抗,以及针对胆管癌fgfr2融合的药物pemigatinib、胆管癌idh1突变的药物ivosidenib的药敏测试。发明人绘制了一线药物索拉非尼的药敏曲线(图3a)和所有靶向药物的热图(图3b)。且患者类器官的药敏反应,与患者临床的实际用药效果总体是一致的(图3c)。因此,体外类器官水平上的药敏测试,能反应临床患者的药敏水平。
35.为了研究肝癌一线靶向药物索拉非尼的药敏分子分型,本实施例对106个类器官位点进行了转录组测序,通过lasso模型及生信分析,解析出索拉非尼的耐药分子标记物ctnnb1、pik3ca、hnrnpul2-bscl2、paxip1、cdkl5、lztfl1、s1pr2、klhl11、rp11-159g9.5、fam171a2、zbed6、peli1、prim1(图4a),其训练集auc为0.94(图4b)。随后通过同样的方法,收集了106个肝癌标本进行类器官培养、药敏测试和转录组测序,进行分子分型研究,得到索拉非尼的验证集为auc为0.90(图4b)。本实施例对索拉非尼的耐药基因绘制了互作网络,揭示了这些耐药分子之间的联系(图4c)。
36.本实施例在100例肝癌患者的组织中验证了此药敏分子分型的有效性。在肝癌组织中,索拉非尼的药敏分子分型auc为0.91(图5)。
37.在索拉非尼的分子分型中,根据耐药基因的互作图,选择了ctnnb1这一居于核心区的基因,作为耐药的关键靶点。在索拉非尼耐药的位点中,敲低ctnnb1可以显著增强索拉非尼的药物敏感度(图6a),在索拉非尼敏感的位点中,过表达ctnnb1也可以使得索拉非尼敏感度降低(图6b)(注:ctnnb1基因编码β-catenin蛋白)。
38.实施例2
39.索拉非尼耐药标记物在非治疗目的的索拉非尼用药研究中的应用。本实施例中为对索拉非尼活性的研究:选取特定肝癌组织,将不同批次的索拉菲尼与之作用,测定实施例1中筛选的索拉非尼耐药标记物(ctnnb1、pik3ca、hnrnpul2-bscl2、paxip1、cdkl5、lztfl1、s1pr2、klhl11、rp11-159g9.5、fam171a2、zbed6、peli1、prim1)中的一种或几种的定量表达,比较表达量,由此判断各个批次索拉菲尼的生物活性。
40.实施例3
41.本实施例提供一种rt-qpcr索拉非尼耐药性评估试剂盒,包含检测实施例1中所筛选出的索拉非尼耐药标记物ctnnb1(不同试剂盒可以为pik3ca、hnrnpul2-bscl2、paxip1、cdkl5、lztfl1、s1pr2、klhl11、rp11-159g9.5、fam171a2、zbed6、peli1、prim1中任意一种,本实施例中选择检测ctnnb1)表达量的定量试剂。该试剂盒包含ctnnb1的rna的上下游引物。利用本发明的试剂盒结合常用的rna提取试剂以及反转录试剂,可以特异性地检测样本中ctnnb1的表达量,有助于提前判断肝癌患者对索拉非尼的耐药性。可以在肝癌病人进行手术或者病理穿刺取得肝癌组织后即刻测定,在使用索拉非尼前即可评估药物疗效,为患者提供个性化精准的治疗方案。
42.实施例4
43.本实施例提供一种原发性肝癌的索拉非尼耐药分析系统,包括:
44.rt-qpcr靶点表达量检测装置:用于检测样本中索拉非尼耐药标记物ctnnb1的表达量;所述样本为患者肝癌组织;所述靶点表达量检测装置采用的试剂为rt-qpcr定量试剂,包括该基因上下游引物;
45.耐药分析装置:基于索拉非尼耐药标记物的表达量,确定肝癌的用药效果;
46.结果输出装置:用于输出耐药分析装置分析得到的结果。
47.在患者使用索拉非尼前即可评估药物疗效,为患者提供个性化精准的治疗方案。
48.实施例5
49.一种治疗肝癌的药物组合物,包含索拉非尼及抑制索拉非尼耐药标记物的药物。对于实施例4中已经检测出对索拉非尼耐药性较强的原发性肝癌患者,采用本实施例中的药物组合物进行治疗,能够更好的提高疗效。
50.最后应说明的是,以上仅用以说明本发明的技术方案而非限制,尽管参照较佳布置方案对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1