一种基于DNAzyme变构调节的DNA四面体样纳米机器、miRNA检测方法及应用
一种基于dnazyme变构调节的dna四面体样纳米机器、mirna检测方法及应用
技术领域
1.本发明涉及mirna检测技术领域,具体涉及一种基于dnazyme 变构调节的dna四面体样纳米机器、mirna检测方法及应用。
背景技术:
2.micrornas(mirnas)通过在转录后水平调控mrna,进而调控下游蛋白质的变化,在细胞增殖、发育和成熟等方面发挥关键作用, mirnas也因此成为新治疗方法的最有吸引力的工具和靶点之一。另一方面,mirnas的异常表达与许多人类疾病如实体瘤、骨髓瘤和b 细胞淋巴瘤等密切相关。因此,mirna也被认为是早期癌症诊断和预后的重要肿瘤生物标志物。与无细胞mirna相比,细胞内mirna 在高浓度和稳定性方面表现出显著的优势,而且原位检测细胞内的 mirna可以避免不同rna提取方法的效率限制。因此,建立一种高灵敏度和特异性的集成纳米机器同时实现细胞内mirna检测和负反馈浓度调节,有利于提高肿瘤的早期诊断和治疗效率。
3.dna不仅是遗传信息的载体,也是dna纳米结构的分子构建模块。dna可以自我折叠成复杂的三级结构,形成具有特定识别和催化能力的功能性核酸,如适配体、dnazymes、i-基序以及g四联体等。这些功能性核酸在生物分子检测、成像和药物传递方面已显示出极大的潜力。其中,dnazymes是一种具有催化功能的单链核酸,同时具有dna和酶的双重作用,与蛋白酶相比,结构更稳定,也更易于合成和编程。通过dna链置换,可以在不改变dnazyme序列的基础上,实现dnazyme的变构,调节其活性。为了实现对mirna 的同时检测和调控,可以引入一条mirna抑制链来介导dnazyme 的活性。简而言之,dnazyme的活性取决于其构象改变,而其构象受到mirna抑制剂的调控。mirna抑制剂和靶标的结合可以触发从锁定的dnazyme结构到活化的dnazyme的构象变化。后者能够切割底物并释放荧光用于细胞内mirna传感。与此同时,mirna抑制剂能竞争性抑制mirna与下游基因的相互作用,从而调节靶细胞的功能。因此,这种mirna抑制剂控制的变构dnazyme可用于mirna 传感和靶细胞的同步调节。然而,dnazyme的细胞渗透性不足,需要选择合适的递送系统。
4.目前,转运dnazyme及其底物到细胞内主要依赖于转染试剂和无机纳米材料。然而这些添加的成分具有生物相容性风险,并会使 dnazyme的制备更加复杂。dna四面体作为dna折纸技术的典型代表,因其具有结构稳定、生物相容性好、易于灵活编程等优点,广泛应用于靶向给药、光热治疗、体内成像等领域。例如,dna四面体可作为纳米载体用来递送sirna以沉默靶基因,或传递亚甲蓝用于体内光动力治疗。然而,如何利用dna四面体转运dnazyme仍旧是一个亟待解决的问题。
技术实现要素:
5.有鉴于此,本发明的目的在于提供一种基于dnazyme变构调节的dna四面体样纳米机器,可用于微量mirna的传感及浓度调节,具有良好的灵敏度和特异性。
6.为解决上述技术问题,本发明提供了以下技术方案:
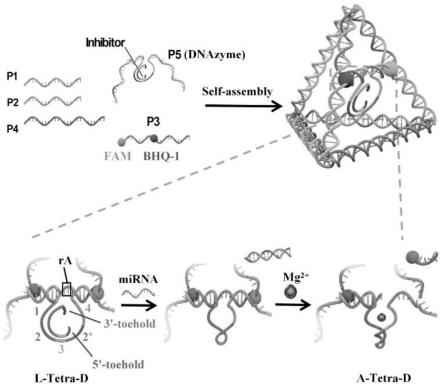
7.本发明提供了一种基于dnazyme变构调节的dna四面体样纳米机器,所述纳米机器由寡核苷酸链p1-p5和一条抑制剂链组成,所述寡核苷酸链p5与抑制剂链互补,所述抑制剂链含有dna识别序列,所述dna识别序列能够与待测mirna结合。
8.优选的,所述寡核苷酸链p1、p2、p4、p3部分序列、p5部分序列构成所述dna四面体的主框架;所述p5链的中间部分为e6型 dnazyme。
9.优选的,所述寡核苷酸链p1、p2、p4构成所述dna四面体的框架p
124
,所述寡核苷酸链p5和抑制剂链构成锁定的变构dnazyme p5i;所述抑制剂链的5'和3'末端分别设计两个脚趾区域。
10.优选的,所述p3链的5'端第10位碱基为rna修饰的底物,所述第10位碱基为核糖核苷酸;所述p3链中的第24位碱基可以替换为淬灭基团。
11.优选的,所述寡核苷酸链p1-p5的序列如seq id no.1-5所示,所述抑制剂链的序列选自seq id no.6-9所示序列中的一种。
12.本发明提供了上述dna四面体样纳米机器的制备方法,所述方法包括如下步骤:
13.将寡核苷酸链p1、p2、p4与缓冲液混合,经第一反应得到dna 四面体的框架p
124
;寡核苷酸链p5、抑制剂链与缓冲液混合,经第二反应得到锁定的变构dnazyme p5i;
14.将p
124
、p5i、p3与缓冲液混合,经第三反应即得所述的dna四面体样纳米机器。
15.优选的,所述缓冲液的组成为:10mm hepes、100mm nacl和 50mm mgcl2,ph 6.0。
16.本发明还提供了一种mirna的检测方法,所述方法包括如下步骤:
17.将上述的dna四面体样纳米机器与靶mirna混合孵育,所得产物经凝胶电泳以及荧光检测即可检测靶mirna。
18.优选的,所述孵育的温度为20-40℃,所述孵育的时间为0.5-10h。
19.本发明还提供了上述的dna四面体样纳米机器或上述的检测方法在mirna检测或调节中的应用。
20.本发明提供了一种基于dnazyme变构调节的dna四面体样纳米机器,可作为一种检测和调节工具,用于细胞内微量mirna的传感以及浓度调节,其不仅能够携带荧光染料用于mirna传感,还能够提供用于mirna浓度调节的抑制剂。而且,本发明所述的dna 四面体样纳米机器使dnazyme和底物在空间上更加接近,并在一定程度上包裹dnazyme,可显著增强dnazyme的灵敏度、细胞渗透能力和抗酶降解能力,为疾病的同时诊断和治疗提供了一种新方法。
附图说明
21.图1为基于dnazyme变构调节的dna四面体样纳米机器自组装示意图。
22.图2为基于dnazyme变构调节的dna四面体样纳米机器的自组装及与mirna的反应验证。
23.图3为dna四面体样纳米机器与靶mirna反应前后的荧光强度变化。
24.图4为基于dnazyme变构调节的dna四面体样纳米机器的原子力表征。
25.图5为抑制剂链3'端脚趾结构的碱基个数优化结果。
26.图6为反应温度优化结果。
27.图7为反应时间优化结果。
28.图8为dna四面体样纳米机器的灵敏度和线性范围结果,其中 a为dna四面体样纳米机器的灵敏度,b为dna四面体样纳米机器的线性范围。
29.图9为dna四面体样纳米机器的特异性结果,其中,a为检测不同mirna的荧光曲线,b为检测不同mirna的荧光强度柱状图。
具体实施方式
30.本发明提供了一种基于dnazyme变构调节的dna四面体样纳米机器,所述纳米机器由寡核苷酸链p1-p5和一条抑制剂链组成,所述寡核苷酸链p5与抑制剂链互补,所述抑制剂链含有dna识别序列,所述dna识别序列能够与待测mirna结合。
31.本发明中,所述寡核苷酸链p1-p5的序列优选如seq id no.1-5 所示,所述抑制剂链的序列选自seq id no.6-9所示序列中的一种;所述寡核苷酸链p1-p5和抑制剂链的序列具体如表1所示;
32.表1寡核苷酸链和抑制剂链的序列
33.[0034][0035]
本发明中,所述三股链(p1、p2和p4)以及p3和p5的部分序列构成了四面体的主框架;所述p3链的5'端设计为rna修饰的底物即ra,“ra”表示该a碱基为核糖核苷酸;所述加粗下划线的碱基t表示此处可修改为bhq1淬灭基团。本发明中,所述p5链的中间部分设计为e6型dnazyme。本发明中,所述抑制剂链的5'和 3'末端设计了两个脚趾区域(即toehold序列),所述5'端的脚趾区域与靶mirna互补,能够与mirna发生脚趾介导的链置换反应 (tmsdr),所述抑制剂链中gtctgataagctatcgct序列(表1 抑制剂链中下划线序列)与p5链通过碱基互补进行配对;所述抑制剂链3'末端的脚趾区域可在一定程度上阻止dnazyme的活性序列 (即图1中的序列1和序列4)与ra靠近,抑制变构dnazyme对 ra的提前切割,从而维持该纳米机器的稳定性。本发明中,所述寡核苷酸链p1、p2、p4构成所述dna四面体的框架p
124
,所述寡核苷酸链p5和抑制剂链构成锁定的变构dnazyme p5i;所述p5链与抑制剂链预先杂交的目的在于阻止p5链上序列2(agctt)与2* (aagct)的互补以抑制dnazyme的切割活性。
[0036]
本发明中,待测mirna与dna四面体样纳米机器中的抑制剂链inhibitor通过碱基互补配对互补,抑制剂链inhibitor同时还与寡核苷酸链p5通过碱基互补配对互补,当检测不同的mirna序列,根据待测的mirna序列更改p5序列和inhibitor序列即可实现不同靶标mirna的检测。
[0037]
本发明提供了上述dna四面体样纳米机器的制备方法,所述方法包括如下步骤:
[0038]
将寡核苷酸链p1、p2、p4与缓冲液混合,经第一反应得到dna 四面体的框架p
124
;寡核苷酸链p5、抑制剂链与缓冲液混合,经第二反应得到锁定的变构dnazyme p5i;
[0039]
将p
124
、p5i、p3与缓冲液混合,经第三反应即得所述的dna四面体样纳米机器。
[0040]
本发明中,所述缓冲液的组成优选为:10mm hepes、100mmnacl和50mm mgcl2,ph 6.0。本发明中,所述寡核苷酸链p1、p2、 p4的摩尔比优选为1:1:1;所述第一反应的反应条件优选为:95℃ 10min、冷却至20℃;所述得到dna四面体的框架p
124
优选的保存于4℃。本发明中,所述寡核苷酸链p5与抑制剂链的摩尔比优选为 1:1.2;所述第二反应的反应条件优选为:95℃4min、65℃30min、50℃ 30min、37℃30min、22℃30min、20℃保持。本发明中,所述p
124
、 p5i、p3的体积比优选为113:105:10;所述p3链和p5链的摩尔比优选为1:1;所述第三反应的反应条件优选为:30℃10min、20℃60min。
[0041]
本发明还提供了一种mirna-21的检测方法,所述方法包括如下步骤:
[0042]
将上述的dna四面体样纳米机器与靶mirna-21混合孵育,所得产物经凝胶电泳以及荧光检测即可检测靶mirna-21。
[0043]
本发明中,所述mirna-21的核苷酸序列为: uagcuuaucagacugauguuga(seq id no.10);所述dna 四面体样纳米机器与靶mirna-21的体积比优选为19:1;所述孵育的温度优选为20-40℃,更优选为25℃;所述孵育的时间优选为0.5-10h,更优选为2.5h。本发明对所述凝胶电泳和荧光检测的具体方法并没有特殊限定,在本发明的具体实施例中,所述凝胶电泳优选为非变性聚丙烯酰胺凝胶,所述电泳的电压优选为80v,所述电泳的时间优选为 48min。本发明中,所述凝胶电泳结束后优选的使用染法常温染色凝胶10min,然后放入凝胶成像仪中检测。
[0044]
本发明还提供了上述的dna四面体样纳米机器或上述的检测方法在mirna检测或调节中的应用。
[0045]
本发明中,所有数据均使用spss软件进行分析,以均值
±
标准差的形式展示,采用两独立样本t检验,以p《0.05为差异有统计学意义;使用graphpad软件作图。
[0046]
为使本发明的目的、技术方案和优点更加清楚明白,下面结合实施例对本发明进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0047]
下述实施例中,如无特殊说明,均为常规方法。
[0048]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0049]
实施例1
[0050]
基于dnazyme变构调节的dna四面体样纳米机器的组装流程如图1,其制备方法包括如下步骤:
[0051]
1.将各0.02nmol的p1、p2、p4混合得到11.3μldna混合物,然后在95℃下变性10min,缓慢冷却至20℃,并在4℃下储存得到构建四面体框架p
124
;
[0052]
2.将p5链和抑制剂链以1:1.2(分别为0.02nmol和0.024nmol) 的摩尔比混合,在95℃下加热4min,65℃下加热30min,50℃加热 30min,37℃加热30min,22℃加热30min,并保持在20℃得到10.5μl 锁定的变构dnazyme p5i;
[0053]
3.将p
124
、p5i与1μl的p3(0.02nmol)混合,在30℃下加热10min, 20℃下孵育1h,得到总体积为22.8μl的四面体样纳米机器。
[0054]
实施例2
[0055]
1.实施例1所述四面体样纳米机器检测mirna:
[0056]
将22.8μl实施例1合成好的四面体样纳米机器与1.2μl靶 mirna-21(0.024nmol)
混合,在25℃下孵育2.5h,得到24μl反应产物。
[0057]
取5μl反应产物混合1μl loading buffer加入5%的非变性聚丙烯酰胺凝胶(solarbio(北京)科技有限公司,中国)中,电压和电泳时间分别设置为80v、48min;电泳结束后,使用泡染法常温染色凝胶10min。然后采用凝胶成像仪器(chemdoc xrs,bio-rad公司,美国)对gel-red染色后的凝胶进行分析,得到结果如图2。
[0058]
可以看出,泳道1是一条核酸序列,泳道2到泳道5是部分杂交序列,泳道6是组装成功的四面体样纳米机器。从泳道1到泳道6,随着新链的加入,由于分子量的增加和更复杂的空间结构,产物在凝胶电泳中的迁移速率依次减慢,表明本发明的四面体样纳米机器能够在预设的实验条件下高效合成,并且泳道中没有明显的杂带出现,表明合成的效率较高。
[0059]
泳道7是dna四面体样纳米机器与靶mirna-21杂交反应的产物。由于mirna-21与抑制剂链i的5'端互补,同时被抑制剂i预先结合的dnazyme的序列b和另一侧的b*也是互补的,随着mirna-21 的加入,mirna-21与抑制剂链5'端的结合能暴露出dnazyme的发夹区域b,紧接着b和b*的结合与mirna-21和i的结合相互促进,最终能够将抑制剂链从四面体上置换下来。变构的dnazyme由于恢复了自身的发夹结构,能够发挥活性切割底物链。因此泳道7会产生抑制剂链与mirna的杂交产物,以及抑制剂链被置换、p3被切割后的纳米机器。因此,本发明同时设置了泳道8和泳道9两个对照,其中,泳道8是没有抑制剂链时的纳米机器直接切割ra的产物,泳道 9是抑制剂链与mirna的杂交产物。可见,在泳道7中可以明显观察到mirna抑制剂与mirna杂交后的条带,证明该纳米机器能够调控mirna量。而且,在泳道7中还观察到迁移速率加快的纳米机器条带,这是由于其上的抑制剂链脱落以及p3的部分短序列l脱落。虽然该短链l由于较小的分子量而在5%的凝胶电泳中无法显示,但通过后续的荧光实验能进一步证实修饰fam荧光的短链的脱落。
[0060]
2.荧光实验
[0061]
(1)根据实施例1制备dna四面体样纳米机器,其中,制备过程中使用的p3链的ra两端分别修饰有荧光基团fam和特异性荧光淬灭基团bhq1;
[0062]
(2)根据实施例2的方法将步骤(1)制备得到的dna四面体样纳米机器与靶mirna-21进行杂交反应,得到的产物在蓝光切胶仪 (sangon(上海)生物工程科技有限公司,中国)下观察荧光强度变化,得到结果如图3。
[0063]
可以看出,与靶标反应后的纳米机器的荧光强度明显高于加入靶标前,表明本发明的dna纳米机器能够用于检测mirna。可以看出,电泳和荧光强度的变化均证明了本发明四面体样纳米机器的合成以及与mirnas反应的可行性。
[0064]
实施例3
[0065]
原子力显微镜表征
[0066]
取20μl多聚赖氨酸(5μg/μl)溶液滴在云母表面,静置10min 后,用氮气吹干并清洗表面。取5μl实施例1合成好的基于dnazyme 变构调节的四面体样纳米机器滴加在预先干燥的云母表面,静置 3~5min使样品均匀分散并吸附在云母片上,随后滴加20μl缓冲液于此样品表面,将其置于布鲁克原子力显微镜(multimode 8,bruker 公司,美国)下扫描,得到图4。
[0067]
可以看出,本发明制备得到的dna四面体样纳米机器具有四面体的形状和相应的大小,进一步确认了四面体样纳米机器的成功制备。
[0068]
实施例4
[0069]
四面体样纳米机器与mirna反应的条件优化
[0070]
在p3链的腺嘌呤核糖核苷酸(dnazyme的切割位点)两端分别标记荧光基团fam和特异性的荧光猝灭基团bhq1,根据实施例1 所述的方法合成新的带荧光的四面体样纳米机器;然后利用f-7000 荧光分光光度计(日立公司,日本)对加入靶标前后四面体样纳米机器的荧光强度(即吸光度值)进行监测。
[0071]
(1)抑制剂链3'端的碱基个数优化:
[0072]
将22.8μl合成好的四种四面体样纳米机器(即抑制剂链3'端的碱基个数分别为6~9个)与1.2μl靶标mirna-21(0.024nmol)混合,在25℃下孵育2.5h,将24μl反应产物用depc水稀释到200μl后,加入微量石英比色皿中,设置荧光分光光度计的激发波长为475nm,发射波长为500~600nm,记录其在523nm处的吸光度值,记作f。此外,设置加入等量(1.2μl)缓冲液的对照组,记录2.5h后其在523nm 处的荧光强度,记为f0。计算(f-f0)/f0得到碱基个数优化结果,得到结果如图5。
[0073]
由图5可以看出,随着3'端脚趾结构的碱基个数的增加,抑制剂对变构dnazyme活性的抑制能力随之增加,意味着背景信号f0随之降低,该纳米机器的检测性能提升。但是当碱基个数过长时,可能也会由于空间位阻的增大,阻碍3'端的脚趾结构与mirna-21的互补,从而阻碍检测过程的进行。而且,随着3'端脚趾结构的碱基个数从6 个增加到8个,dna四面体样纳米机器的荧光强度变化值逐渐增大,比值从1.09增加到1.30再上升到1.83,当碱基个数增加到9个时, dna四面体样纳米机器的荧光强度变化减少,比值降到1.54,因此抑制剂链i中的3'端脚趾结构的碱基个数最佳长度为8个碱基。
[0074]
(2)与靶mirna-21的反应温度优化:
[0075]
将22.8μl合成好的四面体样纳米机器与1.2μl靶标mirna-21 (0.024nmol)混合,在20℃、25℃、30℃、35℃和40℃下分别孵育2.5h,将24μl反应产物稀释后,加入微量石英比色皿中,在475nm 的激发波长下测量500至600nm波长范围内的荧光光谱,记录其在 523nm处的荧光强度为f。同样,设置加入等量(1.2μl)缓冲液的对照组,记录其在不同温度下2.5h后523nm处对应的荧光强度,记为f0,计算(f-f0)/f0得到反应温度优化结果,结果如图6。
[0076]
可以看出,由于随着温度的升高,分子运动间碰撞并反应的几率会增大,故变构dnazyme的性能可能会提高。且由于dnazyme只有在发夹结构时,才具有切割活性,当温度过高时,dnazyme趋向于形成单链结构,越难维持互补的发夹结构(发夹结构稳定性降低),故切割活性可能会随之降低。本发明所述四面体样纳米机器在20℃、 25℃、30℃、35℃和40℃的(f-f0)/f0计算值分别为1.09、1.30、1.83 和1.54,在25℃时可以达到最大的相对吸光度值。
[0077]
(3)与靶mirna-21的反应时间优化:
[0078]
将22.8μl合成好的四面体样纳米机器与1.2μl靶标mirna-21 (0.024nmol)混合,在25℃分别孵育0.5、1.5、2.5、5、7.5和10h,将24μl反应产物稀释后,加入微量石英比色皿中,设置激发波长为 475nm,用荧光分光光度计测量其发射波长在523nm处的荧光强度记为f。同样,设置加入1.2μl缓冲液的对照组,分别记录其在0.5、 1.5、2.5、5、7.5和10h后,25℃下523nm处的荧光强度,记为f0,计算(f-f0)/f0得到反应时间优化结果,结果如图7。
[0079]
可以看出,本发明dna四面体样纳米机器与靶标mirna在0.5、 1.5、2.5、5、7.5和
10h的(f-f0)/f0计算值分别为1.18、1.66、1.83、 1.88、1.90和1.95。随着链置换反应时间的延长,被切断的p3底物链逐渐增多,荧光信号也不断攀升,并在2.5h到达平台期,此后保持平稳。因此,为了在最短的时间内保证最好的检测效果,dna四面体样纳米机器的最优孵育时间为2.5h。
[0080]
实施例5
[0081]
基于dnazyme变构调节的dna四面体样纳米机器的灵敏度
[0082]
将不同浓度的靶mirna-21与合成好的四面体样纳米机器(抑制剂链3'端的碱基个数分别为8个)混匀,使mirna-21的终浓度分别为1pm、10pm、100pm、1nm、10nm、100nm、200nm、500nm和 1μm。在25℃下孵育2.5h后,在475nm的激发波长下测量500至600 nm波长范围内的吸光度值。同时,检测空白样本(等量缓冲液)下的吸光度值,计算得到检测限和标准曲线,结果如图8。
[0083]
可以看出,随着目标mirna-21浓度的升高,产物在2.5h、25℃的吸光度数值逐渐增加。通过计算,在1pm至1nm的目标浓度范围内,产物的吸光度值与mirna浓度呈良好的线性关系,相关系数r2达到0.9562,回归方程为:y=8.191
×
lg(c)+65.31,其中y表示测得的发射光谱在523nm处的吸光度值,c表示靶mirna-21的浓度。测量三次空白样本的吸光度值,根据计算公式lod=3σ/k(σ表示空白样本荧光值的标准偏差,k表示线性回归方程的斜率)得最低检测限为0.77pm。
[0084]
实施例6
[0085]
基于dnazyme变构调节的dna四面体样纳米机器的特异性
[0086]
将不同的mirna分子,包括单碱基突变的mirna-21(miss-1)、双碱基突变的mirna-21(miss-2)、三碱基突变的mirna-21(miss-3)、以及mirna-155、mirna-25、let-7、mixture(let-7、mirna-155、 mirna-25和mirna-21的混合物),与合成好的四面体样纳米机器混匀,在25℃下孵育2.5h后,在475nm的激发波长下测量发射波长在500至600nm范围内的吸光度值。同时,检测空白样本(等量缓冲液)下的吸光度值,结果如图9。其中,mirna-21(miss-1)、双碱基突变的mirna-21(miss-2)、三碱基突变的mirna-21(miss-3)、 mirna-155、mirna-25、let-7的核苷酸序列如下表2。
[0087]
表2不同mirna分子的序列
[0088]
[0089]
其中,下划线表示错配的碱基。
[0090]
可以看出,当没有靶标mirna-21存在时,没有明显的fam荧光信号被检测到,其在523nm处的吸光度值约为57.51;当加入与 inhibitor不互补的mir-155、mir-25和let-7时,fam荧光信号呈现微弱的增强,吸光度值分别为63.96、68.70和66.86;当加入碱基错配的miss-1、miss-2和miss-3时,fam荧光信号呈现较小的增高,检测到吸光度值分别为90.71、83.76和82.53;而当加入靶mirna-21 时,观察到显著增高的荧光信号,吸光度值达到165.97;当环境中存在mir-155、mir-25和let-7的干扰时,该dna四面体样纳米机器检测靶标的吸光度值达到163.45。经统计计算,其与单纯靶mirna 存在时的吸光度值之间的差异没有统计学意义。表明本发明所述 dna四面体样纳米机器能够抵抗其他mirna分子干扰,不与其发生杂交反应,具有良好的特异性。
[0091]
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1