RPN11标记物在检测骨髓瘤及其患病风险、预后分析及治疗药物中的应用
rpn11标记物在检测骨髓瘤及其患病风险、预后分析及治疗药物中的应用
技术领域
1.本发明属于多发性骨髓瘤的诊疗领域,特别涉及rpn11标记物在检测骨髓瘤及其患病风险、分子分型、预后分析及治疗药物中的应用。
背景技术:
2.多发性骨髓瘤(mm)是仅次于淋巴瘤的第二大血液系统恶性肿瘤,其主要临床特征为血液中的浆细胞在骨髓内克隆性恶性增生性疾病,约占血液系统恶性肿瘤的10%。2021年美国癌症协会发表的《2020年癌症数据报告》显示:mm的年新发病例为176404例,占所有新发肿瘤病例的0.9%;年新发死亡病例为117077例,占所有新发死亡肿瘤病例的1.2%。mm在我国目前发病率也呈现逐年上升的趋势,并且与欧美国家相比,我国的中位发病年龄明显早于西方国家。目前模型认为,mm从临床意义不明的单克隆免疫球蛋白血症(mgus)发展为焖燃型骨髓瘤(smm),最后发展为有症状的多发性骨髓瘤(mm),最终发展为浆细胞白血病(pml)。
3.多发性骨髓瘤是一种具有高度异质性的恶性浆细胞疾病,在过去的几年里,随着新药的出现患者的生存已得到极大的改善,但在分子分型及预后评估方面仍面临挑战。现有研究表明,几乎所有mm病例都有细胞遗传学的异常,表现为igh基因的增强子易位形成融合基因、超二倍体和亚二倍体核型,以位于14号染色体的igh基因增强子发生易位为主。igh基因增强子可与不同染色体发生易位融合,其中t(4;14)属于高危基因型,患者约占15%-20%。t(4;14)是4号染色体基因fgfr/mmset与igh基因的增强子融合,在此类患者中,组蛋白甲基转移酶mmset均会出现异常高表达。目前mm患者的治疗方案及预后评估主要依赖于igh基因增强子易位的基因分型来确定,但约20%的患者存在基因型与病情发展预判不匹配的情况,目前缺乏一类能够有效预测t(4;14)易位的mm患者总生存期和预后的标志物,同时也缺少一种独立于igh基因增强子易位,能够有效提示预后和治疗方案的分子分型方案。
4.同时,近年来,以硼替唑咪为代表的针对20s蛋白酶体的抑制剂显著改善了mm患者的总体生存率。然而,在治疗过程中,蛋白酶体抑制剂药物仍会引起血小板减少、胃肠疾病和周围神经病变等严重副作用,克服硼替唑咪治疗的毒性和耐药性是mm患者治疗方面的难题,特别是对于t(4;14)易位多发性骨髓瘤的患者,且目前也尚缺乏能够有效预测mm患者对硼替唑咪治疗反应性的标志物。
技术实现要素:
5.本发明的目的在于为检测焖燃型骨髓瘤及多发性骨髓瘤及其患病风险、多发性骨髓瘤患者的分子分型、多发性骨髓(尤其是伴有t(4;14)易位)瘤患者的预后分析、预测多发性骨髓瘤患者对硼替佐米治疗反应性提供检测试剂和试剂盒,且为t(4;14)易位多发性骨髓瘤的治疗提供新的药物组合。本发明的“rpn11”是指包含gene id no.10213所对应的核苷酸序列及相应编码序列np_005796.1所示的蛋白,以及在原核及真核系统中纯化得到的
蛋白。rpn11核苷酸序列如seq id no:1所示和编码蛋白序列如seq id no:2所示。
6.为了实现本发明目的本发明在研究过程中提供了rpn11基因及其编码蛋白在多发性骨髓瘤中对肿瘤细胞(伴有t(4;14)易位)存活、增殖的影响,主要包括:
7.1)提供了原核系统体外纯化的rpn11蛋白。
8.2)提供了rpn11基因的shrna序列。
9.3)提供了利用慢病毒稳定过表达或敲低rpn11基因的多发性骨髓瘤lp-1细胞系(伴有t(4;14)易位)。
10.4)提供了稳定过表达或敲低rpn11的kms11细胞(伴有t(4;14)易位的细胞系)注射nog小鼠(nod/shi-scid il2rγnull mice)所形成的多发性骨髓瘤动物模型。
11.本发明的第一方面:设计一种用于检测焖燃型骨髓瘤及多发性骨髓瘤(尤其是伴有t(4;14)易位)及其患病风险、多发性骨髓瘤患者的分子分型、多发性骨髓瘤患者的预后分析、预测多发性骨髓瘤患者对硼替佐米治疗反应性的检测试剂,所述检测试剂包括:
12.(1)rpn11的特异性结合分子和/或rpn11的特异性抗体;
13.(2)特异性扩增rpn11的mrna或rpn11的cdna的引物或引物对、探针或芯片。
14.进一步地优化,所述检测试剂同时包含mmset的特异性抗体和/或mmset的特异性结合分子。
15.进一步地优化,所述检测试剂同时包含特异性扩增mmset mrna或mmset cdna的引物或引物对、探针或芯片。
16.在实施例1-4中:所述预后分析为将rpn11表达水平与mmset表达水平单独或联合分析对多发性骨髓瘤患者的预后评估。
17.在实施例1-4中:所述预后分析评价包括预测接受化疗或靶向治疗的多发性骨髓瘤患者的生存时间。
18.在实施例1-4中:蛋白包括全长蛋白或蛋白片段。
19.在实施例1-4中:检测试剂包括rpn11的特异性抗体、rpn11的特异性结合分子、特异性扩增引物、探针、核酸芯片(如dna芯片)或蛋白质芯片。
20.在实施例1-4中:检测试剂偶联有或带有可检测标记。
21.在实施例1-4中:可检测标记选自下组:生色团、化学发光基团、荧光团、同位素或酶。
22.在实施例1-4中:核酸芯片包括基片和点样在基片上的特异性寡核苷酸探针,特异性寡核苷酸探针包括与rpn11多核苷酸(mrna或dna)特异性结合的探针。
23.在实施例1-4中:蛋白质芯片包括基片和点样在基片上的特异性抗体,所述的特异性抗体包括抗rpn11的特异性抗体。
24.在实施例1-4中:离体样本包括:组织样本、细胞样本、血液样本、或其组合。
25.在实施例1-4中细胞样本包括:mgus患者的细胞样本、smm患者的细胞样本,mm患者的细胞样本和正常志愿者细胞样本。
26.在实施例1-4中细胞样本包括:初治mm患者的细胞样本、硼替佐米复发或耐药mm患者的细胞样本和正常志愿者细胞样本。
27.在实施例1-4中细胞样本包括:rpn11低表达/mmset低表达的mm患者的细胞样本、rpn11低表达/mmset高表达的mm患者的细胞样本、rpn11高表达/mmset低表达的mm患者的细
胞样本、rpn11高表达/mmset高表达的mm患者的细胞样本。mmset的高表达是t(4;14)易位mm患者的重要特征,本发明首次联合rpn11和mmset的表达用于准确预测t(4;14)易位mm患者的预后特征。
28.本发明的第二方面:设计一种用于检测焖燃型骨髓瘤及多发性骨髓瘤(尤其是伴有t(4;14)易位)及其患病风险、多发性骨髓瘤患者的预后分析、预测多发性骨髓瘤患者对硼替佐米治疗反应性的试剂盒,所述试剂盒含有检测rpn11基因、rpn11的mrna、rpn11的cdna、rpn11表达蛋白之一或其组合。
29.进一步地,所述试剂盒同时含有mmset基因、mmset的mrna、mmset的cdna、mmset表达蛋白之一或其组合。
30.进一步地,所述试剂盒还含有rpn11基因、rpn11的mrna、rpn11的cdna、rpn11表达蛋白之一或其组合作为对照品或质控品。
31.进一步地,所述试剂盒同时含有mmset基因、mmset的mrna、mmset的cdna、mmset表达蛋白之一或其组合作为对照品或质控品。
32.在实施例1-4中,所述试剂盒中还包括标签说明书,所述标签或说明书注明所述试剂盒用于检测焖燃型骨髓瘤或多发性骨髓瘤及其患病风险。
33.在实施例1-4中,所述试剂盒还含有rpn11(或同时包含mmset)基因、mrna、cdna、和/或蛋白作为对照品或质控品。
34.在实施例1-4中,所述的检测焖燃型骨髓瘤或多发性骨髓瘤及其患病风险是指检测其是否已发生,和/或判断发生的可能性(易感性)。
35.在实施例1-4中,所述判断包括预先判断(预测)多发性骨髓瘤患者的预后情况及该亚型患者对硼替佐米治疗的反应性。
36.在实施例1-4中,当所述试剂盒用于检测焖燃型骨髓瘤或多发性骨髓瘤或其患病风险,以及对于多发性骨髓瘤患者预后或硼替佐米治疗反应性的预测时所述的标签或说明书中注明以下内容:如果检测对象的rpn11表达量显著高于对照表达量,则该对象患有多发性骨髓瘤或对硼替佐米治疗反应性较差的风险大于正常人;
37.在实施例1-4中,所述的对照表达量为正常人群中相同样本中的rpn11表达水平、除了多发性骨髓瘤患者之外的一般癌症患者人群中相同样本中的表达rpn11水平。
38.本发明的第三方面:设计一种用于治疗耐药t(4;14)易位多发性骨髓瘤的药物组合物,其所述药物组合物包含rpn11的抑制剂与来那度胺或地塞米松。
39.进一步地,所述rpn11的抑制剂为中和性抗体、小分子化合物、反义核酸的之一或其组合。
40.进一步地,所述rpn11的抑制剂为小分子抑制剂capzimin。
41.在实施例5-8中,所述的rpn11的抑制剂为中和性抗体、小分子化合物、反义核酸,或其组合。
42.在实施例5-8中,所述的rpn11的抑制剂用于对蛋白酶体抑制剂靶向治疗耐药的t(4;14)易位多发性骨髓瘤患者。
43.在实施例5-8中,所述的rpn11的抑制剂单独使用,或与蛋白酶体抑制剂联合使用,或与增敏免疫调剂或抗肿瘤辅助药物联合使用。
44.特别的,所述的rpn11的抑制剂为小分子抑制剂capzimin,该抑制剂相比已知的
rpn11抑制剂(如opa),具有剂量更小、治疗效果更明显、毒副作用更小等优势。本发明首次在t(4;14)易位多发性骨髓瘤中使用opa及capzimin,并发现其对t(4;14)易位多发性骨髓瘤传统疗法的协同增敏作用。
45.在实施例5-8中,所述组分占所述药物组合物总重量的0.1-99.9wt%,较佳地10-99.9wt%,更佳地70%-99.9wt%。
46.在实施例5-8中,所述药物组合物为液态、固体、或半固体。
47.在实施例5-8中,所述的药物组合物的剂型为口服剂型、注射剂、或外用药物剂
48.在实施例5-8中,所述的载体选自下组:输液剂载体和/或注射剂载体,较佳地,所述的载体是选自下组的一种或多种载体:生理盐水、葡萄糖盐水、或其组合。
49.采用上述技术方案所产生的有益效果在于:
50.本发明利用了rpn11随着多发性骨髓瘤的发病进程(mugs,smm,mm)而表达逐步升高,同时高表达rpn11和mmset的多发性骨髓瘤患者预后更差,且高表达rpn11的多发性骨髓瘤患者对硼替佐米治疗的反应性更差的特点,设计的检测焖燃型骨髓瘤及多发性骨髓瘤及其患病风险、多发性骨髓瘤患者的分子分型、多发性骨髓瘤患者的预后分析、预测多发性骨髓瘤患者对硼替佐米治疗反应性提供检测试剂和试剂盒检测性能更灵敏、更准确。特别是将rpn11和组蛋白甲基转移酶mmset组合使用,避免了患者存在基因型与病情发展预判不匹配的情况,能够有效预测t(4;14)易位的mm患者总生存期和预后情况。
51.并且,本发明设计的为t(4;14)易位多发性骨髓瘤的治疗提供新的药物组合中,rpn11抑制剂能有效促进t(4;14)易位多发性骨髓瘤细胞的凋亡。
52.此外,本发明提出了rpn11抑制剂capzimin在t(4;14)易位多发性骨髓瘤中克服硼替唑咪耐药,以及增强来那度胺和地塞米松协同治疗效果。为t(4;14)易位多发性骨髓瘤的个性化治疗提供新方案。
附图说明
53.图1示出本发明实施例中提供的rpn11在mgus、smm和mm中的表达情况。
54.其中,*表示p《0.05,**表示p《0.01,***表示p《0.001。
55.图2示出本发明实例提供的rpn11表达水平与预后关系。
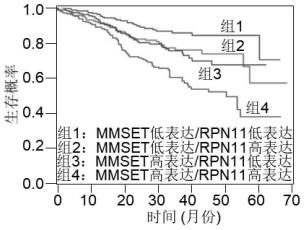
56.图3示出rpn11表达水平与mmset表达水平联合分析与预后关系。
57.图4示出rpn11表达水平与硼替佐米治疗反应性关系。
58.图5示出rpn11对于t(4;14)易位多发性骨髓瘤细胞表型的影响。
59.图6示出动物表型:nog小鼠(nod/shi-scid il2rγnull mice)皮下成瘤实验结果。
60.图7示出rpn11抑制剂(opa或capzimin)对t(4;14)易位mm细胞的抑制作用。
61.图8示出rpn11抑制剂(opa或capzimin)与来那度胺(lenalidomide)或地塞米松(dexamethasone)的协同作用。
具体实施方式
62.下面结合实施例对本发明作进一步的描述:
63.实施例1
64.从gse5900和gse4204数聚集中获取rpn11基因在正常健康人(n=22)、mgus(n=44)、smm(n=12)和mm(n=538)患者样本中的表达水平。结果如图1中显示,相比于正常健康样本,rpn11表达水平在smm和mm患者样本中显著升高。
65.实施例2
66.对大规模多发性骨髓瘤患者样本(n=858)数据集(multiple myeloma research foundation)进行kaplan-meier生存分析,结果如图2所示,多发性骨髓瘤患者较高的rpn11表达水平与患者较短的总生存期显著相关。rpn11在多发性骨髓瘤患者中表达较高时预后更差。
67.实施例3
68.对大规模多发性骨髓瘤患者样本(n=858)数据集(multiple myeloma research foundation)进行kaplan-meier生存分析,结果如图3所示,rpn11和mmset共同高表达的多发性骨髓瘤患者预后最差。说明在mmset高表达的多发性骨髓瘤患者中,rpn11高表达能够作为提高预测患者总体生存期和整体存活率准确性的有效指标。由于mmset在t(4;14)易位多发性骨髓瘤患者中高表达,因此本实施例也说明rpn11高表达是预测t(4;14)易位多发性骨髓瘤患者预后的有效指标。
69.实施例4
70.从gse161195和gse117156单细胞测序数聚集中获取rpn11基因在正常健康人(n=22)、初治mm患者(ndmm,n=9)和硼替佐米复发或耐药mm患者(经过硼替佐米治疗出现早期进展(小于18个月)或者初次使用硼替佐米治疗未能有效缓解(大于4个月),rrmm,n=35)患者样本的mm细胞(cd138阳性)中的表达水平。结果如图4中显示,相比于正常健康人(healthy),ndmm和rrmm患者样本中rpn11表达水平显著升高;相比于ndmm,rrmm患者中rpn11表达水平也显著升高,说明rpn11高表达能够作为预测患者对硼替佐米治疗反应性的有效指标。
71.实施例5
72.本实施使用的lp-1细胞系为t(4;14)易位的mm细胞系,用于特异性说明rpn11对于t(4;14)易位多发性骨髓瘤细胞表型的影响。
73.首先构建稳定过表达和敲低rpn11的lp-1细胞系,具体步骤如下:将rpn11的cdna序列克隆到gv208表达质粒中,将以rpn11为靶点的shrna序列克隆到gv112中。重组体与辅助载体共转染到hek-293t细胞中。48h后收集病毒上清,过滤澄清,超离心浓缩,浓缩病毒被用来用hitransb-2感染lp-1细胞。
74.对稳定过表达和敲低rpn11的lp-1细胞用cck试剂盒检测细胞增殖,具体步骤如下:转染后的细胞培养48h后,用0.25%胰酶消化进行细胞计数,将细胞接种于96孔板中,浓度为1
×
104/ml,每孔加100μl;避光条件下,96孔板中每孔加入10μl的cck8试剂,晃动培养板3min,然后将培养板放入培养箱中继续培养,2h后取出,在酶标仪450nm波长处测定od值。结果如图5a所示,敲低rpn11后,相比对照组,细胞增殖受到明显抑制;过表达rpn11后,细胞增殖能力明显增强。因此rpn11能够显著促进t(4;14)易位的多发性骨髓瘤细胞的增殖。
75.对稳定过表达和敲低rpn11的lp-1细胞进行克隆形成能力分析。具体步骤如下:将细胞计数并传至6孔板中,每孔5000个细胞,在37℃培养箱培养14天,隔两天换液,最后用冷的pbs洗2遍细胞,用4%多聚甲醛室温固定10分钟,用0.1%结晶紫染色液染20min,用pbs冲
洗干净。结果如图5b所示,敲低rpn11后,相比对照组,细胞集落形成受到明显抑制;过表达rpn11后,细胞集落形成明显增强。因此rpn11能够显著促进t(4;14)易位的多发性骨髓瘤细胞的集落形成。
76.对稳定过表达和敲低rpn11的lp-1细胞进行细胞凋亡检测。具体步骤如下:用喜树碱(cpt)处理细胞24h,pbs洗涤,用annexin v-apc/碘化丙啶(pi)双染色在室温下避光处理15min,使用facs calibur流式细胞仪对每个样本进行细胞采集和分析。结果如图5c所示,敲低rpn11后,相比对照组,细胞凋亡明显增多;过表达rpn11后,细胞凋亡明显减少。因此rpn11能够显著抑制t(4;14)易位的多发性骨髓瘤细胞的凋亡。
77.实施例6
78.本实施例使用的kms11细胞系为包含t(4;14)易位的mm细胞系,用于特异性说明rpn11对于t(4;14)易位多发性骨髓瘤动物表型的影响。
79.利用过表达或敲低rpn11的慢病毒感染kms11细胞,进行肿瘤异种移植实验,将kms11细胞(5
×
106个细胞)皮下注射至5周龄雌性nog小鼠。最后通过ki-67和cleaved caspase-3组织免疫化学染色检测移植瘤的增殖和凋亡水平。结果如图6所示,敲低rpn11后,移植瘤的增殖能力降低,凋亡细胞数量显著增加;过表达rpn11后,移植瘤的增殖能力升高,凋亡细胞数量显著减少。
80.实施例7
81.分别使用vehicle或rpn11抑制剂(opa或capzimin)处理野生型或硼替佐米耐药lp-1细胞(lp-1或lp-1br),通过cck细胞计数实验和细胞凋亡实验检测lp-1br细胞的增殖和凋亡情况。结果如图7所示,相比于对照组,使用rpn11抑制剂处理的lp-1和lp-1br细胞增殖能力显著减弱,凋亡细胞数量显著增加。cck细胞计数实验显示细胞存活能力减弱(图7a),细胞凋亡实验显示rpn11抑制剂可促进lp-1和lp-1br细胞的凋亡(图7b)。且与传统抑制剂opa(体外使用浓度为10μm)相比,新型rpn11抑制剂capzimin(体外使用浓度为2μm)在抑制lp-1和lp-1br细胞存活,促进lp-1和lp-1br细胞凋亡的效果更加显著,且药物使用的剂量更低。
82.实施例8
83.利用rpn11抑制剂(opa或capzimin)或/和来那度胺(lenalidomide)或地塞米松(dexamethasone)(在一系列浓度范围内)处理lp-1细胞,使用cck细胞计数实验检测细胞增殖能力。结果如图8所示,相比仅用rpn11抑制剂或来那度胺或地塞米松,rpn11抑制剂和来那度胺/地塞米松联合处理对于抑制lp-1细胞的生长增殖能力具有协同作用。且与传统抑制剂opa相比,新型rpn11抑制剂capzimin与来那度胺或地塞米松协同使用对于lp-1细胞的增殖抑制效果更加显著,且药物使用剂量更低。
84.以上实施例将有助于本领域的技术人员进一步理解本发明,但不构成对本发明的任何限制,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1