一种基于抑制脂多糖产生的功能性益生菌的筛选方法与流程
1.本发明属于微生物技术领域,涉及一种基于抑制脂多糖产生的功能性益生菌的筛选方法。
背景技术:
2.益生菌制剂由于其具有安全性好,且不会产生副作用的优势,已被广泛应用于多种疾病的预防或治疗中,尤其是与胃肠功能、代谢相关的疾病,因此,近年来,研究人员致力于鉴定能够对人类健康产生可重复性有益作用的益生菌菌株,以用于相应疾病的预防或治疗中。
3.然而,功能性益生菌的鉴定是一个复杂且耗时耗力的过程,事实上,目前功能性益生菌的发现很大程度上是通过经验性的自上而下的方法,即,研究不同健康状态下的个体中的微生物分布,那些通常在健康状态的个体中富集的微生物被认为是有益的,然后对其进行测试和验证。在过去的一个世纪里,这种经验性的方法导致了一系列益生菌候选物的发现,包括一些双歧杆菌和乳杆菌菌株,随后是大肠杆菌nissle 1917,最近是嗜黏蛋白阿克曼氏菌(akkermansia muciniphila)。虽然这种经验自上而下的方法为益生菌的开发提供了强大的先导,但在缺乏先验机制信息的情况下,它本质上需要多个循环的试验和试错来确定菌株对健康的益处,这导致了不同文献之间有时会产生相互矛盾(它们的疗效证据有时是不一致的),从而使循证临床指南的益生菌使用规则的制定变得复杂。
4.综上所述,现有技术存在的问题是:现有功能性益生菌的筛选方法操作复杂,效率低,且筛选结果可能会有矛盾。因此,如何提供一种简单高效的功能性益生菌的筛选方法,提高功能性益生菌筛选的成功率,成为本领域技术人员亟待解决的问题。
技术实现要素:
5.针对现有技术的不足,本发明的目的在于提供一种基于抑制脂多糖产生的功能性益生菌的筛选方法。
6.为达到此发明目的,本发明采用以下技术方案:第一方面,本发明提供一种基于抑制脂多糖产生的功能性益生菌的筛选方法,所述筛选方法包括测试候选益生菌的抑制脂多糖产生的能力,具体包括:将候选益生菌与产脂多糖的菌株共培养,得培养液,检测培养液中脂多糖的浓度,选择脂多糖的浓度低的对应的候选益生菌作为筛选得到的功能性益生菌;所述产脂多糖的菌株包括大肠埃希氏菌、肠炎沙门氏菌、阴沟肠杆菌、福氏志贺氏菌、幽门螺杆菌、肺炎克雷伯菌、鲍曼不动杆菌或铜绿假单胞菌中的任意一种或至少两种的组合。
7.所述至少两种的组合例如大肠埃希氏菌与肠炎沙门氏菌的组合、阴沟肠杆菌和福氏志贺氏菌的组合、幽门螺杆菌和肺炎克雷伯菌的组合等,其他任意的组合方式均可。
8.优选地,所述共培养的温度为35-40℃,时间为12-24 h。
9.上述35-40℃中的具体数值例如35℃、35.5℃、36℃、36.5℃、37℃、37.5℃、38℃、38.5℃、39℃、39.5℃、40℃等。
10.上述12-24 h中的具体数值例如12 h、13 h、14 h、15 h、16 h、17 h、18 h、19 h、20 h、21 h、22 h、23 h、24 h等。
11.优选地,所述共培养中所用的培养基中包括胰蛋白胨、酵母粉、氯化钠、牛肉膏、磷酸氢二钾、葡萄糖、牛心浸出粉或胎牛血清中的任意一种或至少两种的组合,所述至少两种的组合例如胰蛋白胨和酵母粉的组合、磷酸氢二钾和葡萄糖的组合、葡萄糖和牛心浸出粉的组合等,其他任意的组合方式均可。
12.优选地,所述培养基中的组分以浓度计包括胰蛋白胨8-12 g/l、酵母粉3-7 g/l、氯化钠8-12 g/l、牛肉膏1-3 g/l、磷酸氢二钾1-3 g/l、葡萄糖1-3 g/l、牛心浸出粉8-12 g/l和胎牛血清1%-5%(质量百分含量)。
13.上述8-12 g/l中的具体数值例如8 g/l、8.5 g/l、9 g/l、9.5 g/l、10 g/l、10.5 g/l、11 g/l、11.5 g/l、12 g/l等。
14.上述3-7 g/l中的具体数值例如3 g/l、3.5 g/l、4 g/l、4.5 g/l、5 g/l、5.5 g/l、6 g/l、6.5 g/l、7 g/l等。
15.上述1-3 g/l中的具体数值例如1 g/l、1.5 g/l、2 g/l、2.5 g/l、3 g/l等。
16.上述1%-5%中的具体数值例如1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%、5%等。
17.优选地,所述共培养中,候选益生菌与产脂多糖的菌株的接种量之比为(1-2):(1-2)。
18.上述(1-2)中的具体数值例如1、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2等。
19.优选地,所述检测是指使用脂多糖elisa(酶联免疫吸附测定)检测试剂盒进行检测。
20.优选地,所述检测包括将培养液离心,收集上清,过滤,收集上清液,用脂多糖elisa检测试剂盒检测上清液中的脂多糖浓度。
21.优选地,所述离心的转速为200-600 g,离心的时间为5-15 min。
22.上述200-600 g中的具体数值例如200 g、300 g、400 g、500 g、600 g等。
23.上述5-15 min中的具体数值例如5 min、6 min、7 min、8 min、9 min、10 min、11 min、12 min、13 min、14 min、15 min等。
24.优选地,所述过滤包括先通过0.45 μm过滤器过滤,将上清通过0.22 μm过滤器再过滤。
25.优选地,所述筛选方法还包括对候选益生菌进行耐胃肠液能力测试和/或耐胆盐能力测试。
26.优选地,所述耐胃肠液能力测试包括:将候选益生菌与人工模拟胃液混合,在36-38℃下孵育2-4 h,得第一混合液,将第一混合液与人工模拟肠液混合,在36-38℃下孵育6-10 h,得第二混合液,检测第二混合液中的活菌数,计算候选益生菌的存活率,存活率越高说明候选益生菌的耐胃肠液能力越强。
27.上述36-38℃中的具体数值例如36℃、36.1℃、36.2℃、36.3℃、36.4℃、36.5℃、36.6℃、36.7℃、36.8℃、36.9℃、37℃、37.1℃、37.2℃、37.3℃、37.4℃、37.5℃、37.6℃、37.7℃、37.8℃、37.9℃、38℃等。
28.上述2-4 h中的具体数值例如2 h、2.2 h、2.4 h、2.6 h、2.8 h、3 h、3.2 h、3.4 h、3.6 h、3.8 h、4 h等。
29.上述6-10 h中的具体数值例如6 h、6.5 h、7 h、7.5 h、8 h、8.5 h、9 h、9.5 h、10 h等。
30.优选地,所述人工模拟胃液的ph为1.5-3.5,例如1.5、1.7、2、2.2、2.5、2.7、3、3.2、3.5等。
31.优选地,所述人工模拟胃液中含有2-3 g/l胃蛋白酶,例如2 g/l、2.1 g/l、2.2 g/l、2.3 g/l、2.4 g/l、2.5 g/l、2.6 g/l、2.7 g/l、2.8 g/l、2.9 g/l、3 g/l等。
32.优选地,所述人工模拟肠液中含有0.6-1 g/l胰蛋白酶,例如0.6 g/l、0.65 g/l、0.7 g/l、0.75 g/l、0.8 g/l、0.85 g/l、0.9 g/l、0.95 g/l、1 g/l等。
33.优选地,所述人工模拟肠液的ph为6.5-8.5,例如6.5、6.7、7、7.2、7.5、7.7、8、8.2、8.5等。
34.优选地,所述耐胆盐能力测试包括:将候选益生菌接种于含有质量百分含量为0.2%-0.4%的胆盐的培养基中,在36-38℃下孵育3-5 h,得培养液,检测培养液在600 nm处的吸光度,吸光度越大说明候选益生菌的耐胆盐能力越强。
35.上述0.2%-0.4%中的具体数值例如0.2%、0.22%、0.24%、0.26%、0.28%、0.3%、0.32%、0.34%、0.36%、0.38%、0.4%等。
36.上述36-38℃中的具体数值例如36℃、36.1℃、36.2℃、36.3℃、36.4℃、36.5℃、36.6℃、36.7℃、36.8℃、36.9℃、37℃、37.1℃、37.2℃、37.3℃、37.4℃、37.5℃、37.6℃、37.7℃、37.8℃、37.9℃、38℃等。
37.上述3-5 h中的具体数值例如3 h、3.2 h、3.5 h、3.7 h、4 h、4.2 h、4.5 h、4.7 h、5 h等。
38.优选地,耐胆盐能力测试中所述培养基包括含有质量百分含量为0.2%-0.4%的胆盐的mrs培养基。
39.优选地,所述筛选方法包括如下步骤:(1)将候选益生菌与人工模拟胃液混合,在36-38℃下孵育2-4 h,得第一混合液,将第一混合液与人工模拟肠液混合,在36-38℃下孵育6-10 h,得第二混合液,检测第二混合液中的活菌数,计算候选益生菌的存活率,选择存活率高的候选益生菌进行下一步测试;(2)将步骤(1)筛选得到的候选益生菌接种于含有质量百分含量为0.2%-0.4%的胆盐的培养基中,在36-38℃下孵育3-5 h,得培养液,检测培养液在600 nm处的吸光度,选择吸光度大的候选益生菌进行下一步测试;(3)将步骤(2)筛选得到的候选益生菌与产脂多糖的菌株在35-40℃下共培养16-20 h,得培养液,将培养液离心,收集上清,过滤,收集上清液,用脂多糖elisa检测试剂盒检测上清液中的脂多糖浓度,选择脂多糖的浓度低的对应的候选益生菌作为筛选得到的功能性益生菌。
40.优选地,所述功能性益生菌具有抗幽门螺杆菌的功效。
41.优选地,所述功能性益生菌具有改善或治疗慢性非传染性疾病的功效,所述慢性非传染性疾病包括胃炎、结肠炎或肥胖症。
42.优选地,所述结肠炎包括溃疡性结肠炎。
43.本发明所述的数值范围不仅包括上述列举的点值,还包括没有列举出的上述数值范围之间的任意的点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
44.与现有技术相比,本发明具有如下有益效果:本发明首次构建出一种基于抑制脂多糖产生的功能性益生菌的筛选方法,所述筛选方法操作简单,试剂成本低,适于进行高通量实验,高效且成功率高,经筛选得到的抑制脂多糖产生能力强的益生菌,在抗幽门螺杆菌感染以及治疗胃炎、结肠炎、肥胖症等慢性非传染性疾病中具有优异的表现。因此,所述筛选方法可用于抗幽门螺杆菌感染的菌株的筛选,以及改善或治疗胃炎、结肠炎、肥胖症等慢性非传染性疾病的菌株的筛选,在实际应用中,本领域技术人员仅需要利用本发明方法筛出候选菌株后,进行动物实验或临床试验验证即可,大大节约了成本,提高了筛选效率,具有重要的应用价值。
附图说明
45.图1是实施例6中各组小鼠的体重变化曲线图。
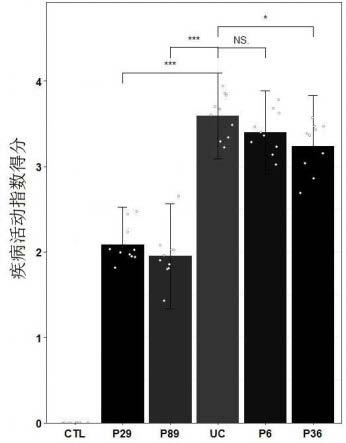
46.图2是实施例6中各组小鼠的疾病活动指数(dai)评分统计结果图。
具体实施方式
47.为更进一步阐述本发明所采取的技术手段及其效果,以下结合本发明的优选实施例来进一步说明本发明的技术方案,但本发明并非局限在实施例范围内。
48.以下实施例中,若无特殊说明,所以的试剂及耗材均购自本领域常规试剂厂商;若无特殊说明,所用的实验方法和技术手段均为本领域常规的方法和手段。
49.材料及方法:下面实施例中使用到的乳杆菌或者双歧杆菌等益生菌均来自微康益生菌(苏州)股份有限公司菌种库;胎牛血清、pbs和胰蛋白酶购自thermo公司;哥伦比亚培养基购自英国oxoid公司;通用培养基:胰蛋白胨10 g/l、酵母粉5 g、氯化钠10 g、牛肉膏2 g、k2hpo4·
3h2o 1 g、葡萄糖2 g、牛心浸出粉10 g、胎牛血清30 ml,加水定容至1 l,灭菌冷却后备用;mrs固体培养基:称取蛋白胨10 g、牛肉膏10 g、葡萄糖20 g、乙酸钠2 g、酵母粉5 g、柠檬酸氢二铵2 g、k2hpo4·
3h2o 2.6 g、mgso4·
7h2o 0.1 g、mnso
4 0.05 g、琼脂20 g和半胱氨酸盐酸盐0.5 g,使用去离子水溶解,再加入1 ml吐温80,定容至1 l,灭菌冷却后,倒入灭菌后的培养皿中备用;mrs液体培养基:称取蛋白胨10 g、牛肉膏10 g、葡萄糖20 g、乙酸钠2 g、酵母粉5 g、柠檬酸氢二铵2 g、k2po4·
3h2o 2.6 g、mgso4·
7h2o 0.1 g、mnso
4 0.05 g和半胱氨酸盐酸盐0.5 g,使用去离子水溶解,再加入1 ml吐温80,定容至1 l,灭菌冷却后备用。
50.实施例1:候选益生菌的活化和培养本实施例中使用的益生菌候选菌株来自微康益生菌(苏州)股份有限公司菌株资源库,本次实验随机选择乳杆菌或双歧杆菌共100株(编号为p1-p100),活化和培养步骤如下:
(1)分别将冻存于-80℃的甘油管的候选益生菌接入液体mrs培养基中,37℃恒温培养18 h进行活化,活化后用于后续试验。
51.(2)候选益生菌菌液制备:将步骤(1)得到的候选益生菌培养液离心(8000 rpm,10 min),收集菌泥,用pbs清洗3次,得菌悬液(浓度调节为1
×
10
9 cfu/ml)。
52.实施例2:耐胃肠液益生菌的筛选筛选步骤如下:(1)模拟胃液的制备:将胃蛋白酶溶于ph 3.0的pbs中使其终浓度为2.5 g/l,经0.22 μm滤膜过滤后制备成模拟胃液。
53.(2)模拟肠液的制备:将胰蛋白酶溶于ph 8.0的pbs中使其终浓度为0.8 g/l,经0.22 μm滤膜过滤后制备成模拟肠液。
54.(3)候选益生菌在模拟胃液-模拟肠液中的存活率测定:
①ꢀ
将候选益生菌用0.85%生理盐水重悬后,与模拟胃液(ph 3.0)混合,将其菌液密度调节为1
×
10
8 cfu/ml,混匀后将其放置于37℃孵育3 h;
②ꢀ
取孵育得到的培养液1 ml加入至9 ml模拟肠液(ph 8.0)中,混匀后于37℃培养8 h后检测活菌数。候选益生菌的存活率用以下公式计算:存活率= lg n1/lg n0;n =经过模拟胃液-模拟肠液处理之后候选益生菌的活菌数,n0=未处理前候选益生菌的活菌数。结果见表1。
55.表1 耐胃肠液益生菌的筛选结果
表1续如表1所示,各候选益生菌在模拟胃液-模拟肠液中的存活率大小不等,本发明选取存活率大于0.5的候选菌株(46株)进行下一步筛选。
56.实施例3:耐胆盐益生菌的筛选选取实施例2中存活率大于0.5的候选菌株(46株)进行耐胆盐试验。
57.候选益生菌在胆盐中的生长测定:将1 ml浓度为1
×
10
9 cfu/ml的候选益生菌的菌悬液接种于含有0.3%胆盐的mrs-thio(mrs中含有0.2%的巯基乙酸钠)培养基中,37℃培养4 h,得培养液,在600 nm处测吸光值,od600值越大说明菌株耐受胆盐的能力越强。结果见表2。
58.表2 耐胆盐益生菌的筛选结果如表2所示,各候选益生菌在对胆盐的耐受能力不同,本发明选取od600大于0.30的候选菌株(23株)进行下一步筛选。
59.实施例4:脂多糖产生菌群的构建脂多糖产生菌群构建使用的大肠埃希氏菌atcc25922、肠炎沙门氏菌atcc14028、阴沟肠杆菌atcc13047、福氏志贺氏菌cmcc51572、幽门螺杆菌atcc43504、肺炎克雷伯菌atcc700603、鲍曼不动杆菌atcc19606和铜绿假单胞菌atcc27853均购自上海北诺生物科技有限公司。
60.脂多糖产生菌活化和培养步骤如下:(1)将上述冻存于-80℃的甘油管的脂多糖产生菌接入通用培养基中,37℃恒温培
养18 h活化;(2)脂多糖产生菌菌液制备:将步骤(1)得到的脂多糖产生菌的培养液离心(3000 rpm,10 min)后用pbs清洗3次,得菌悬液,浓度调节为1
×
10
8 cfu/ml;(3)将上述8种脂多糖产生菌的菌悬液各取1 ml混合均匀后,获得脂多糖产生菌群混合液。
61.实施例5:抑制脂多糖产生的功能性益生菌的筛选选取实施例3中胆盐耐受能力强(od600 》 0.3)的候选菌株(23株)进行抑制脂多糖产生试验。
62.取1 ml脂多糖产生菌群混合液(1
×
108cfu)与1 ml候选菌株的菌悬液(1
×
108cfu)加入到8 ml通用培养基中,在37℃培养18 h。并设对照组:取1ml脂多糖产生菌群混合液(1
×
108cfu)与1ml pbs溶液加入到8 ml通用培养基中,在37℃培养18 h。18 h后,将各组培养液在400
×
g离心10 min后,上清液通过0.45 μm过滤器过滤,然后通过0.22 μm过滤器再过滤,收集上清液。然后使用脂多糖elisa检测试剂盒(购自上海酶联生物科技有限公司)测定上清液中脂多糖(lps)浓度,单位为μg/ml。结果见表3。
63.表3 抑制脂多糖产生益生菌的筛选结果
如表3所示,不同候选益生菌抑制脂多糖产生的能力不同,其中p29和p89抑制脂多糖产生能力最强,其次是p2和p83。因此,这些益生菌是功能性益生菌的潜力菌株。
64.实施例6:改善溃疡性结肠炎的功能验证本实施例选取筛选得到的抑制脂多糖产生能力最强的功能性菌株p29和p89,以及几乎没有抑制作用的p6和p36作为对比进行实验,研究这四种菌对溃疡性结肠炎小鼠体重和疾病活动指数(dai)的影响。查询微康益生菌(苏州)股份有限公司菌株库档案,p29为鼠李糖乳酪杆菌(lacticaseibacillus rhamnosus),p89为罗伊氏粘液乳杆菌(limosilactobacillus reuteri),p6为植物乳植物杆菌(lactiplantibacillus plantarum),p36为青春双歧杆菌(bifidobacterium adolescentis)。
65.实验步骤如下:(1)p29、p89、p6和p36冻干粉的制备:将p29按照占培养基总质量3%的接种量接种到mrs培养基中,于37℃下培养18 h,得到培养液;将培养液离心,得到菌体;将菌体用冻干保护剂(含有海藻糖100 g/l、脱脂奶粉100 g/l,溶剂为水)重悬(冻干保护剂与菌体的质量比为2:1),得到重悬液;将重悬液采用真空冷冻法进行冻干,得到p29冻干粉,检测其活菌数为2000亿cfu/g。用同样的方法获得p89、p6和p36冻干粉,检测其活菌数分别为3000亿cfu/g、2500亿cfu/g和3000亿cfu/g。
66.(2)动物分组和建立溃疡性结肠炎(uc)小鼠模型:将c57bl/6小鼠随机分为6组,每组10只,分别为正常对照组(ctl组),uc模型组(uc组),鼠李糖乳酪杆菌p29组(p29组)、罗伊氏粘液乳杆菌p89组(p89组)、植物乳植物杆菌p6组(p6组)和青春双歧杆菌p36组(p36组)。
67.通过在饮用水中经口给予3%葡聚糖硫酸钠dss(w/v)7天诱导实验性结肠炎。ctl组每天给予正常饮用水,连续一周,其他组给予3%葡聚糖硫酸钠(w/v),每日1次,连续一周。同时,p29组、p89组、p6组和p36组小鼠经口给予步骤(1)制得的相应的益生菌冻干粉的溶液(用生理盐水溶解,每只小鼠每天灌胃1
×
10
9 cfu),而ctl组和uc组给予生理盐水(0.1 ml/10 g)。
68.(3)每天记录所有小鼠的体重、粪便硬度、直肠出血、摄食量,同时观察小鼠的精神、活动、进食、腹泻情况和粪便性状情况等临床症状。疾病活动指数(dai)评分是uc必不可少的临床表现评价指标,是评价结肠损伤的重要指标,dai评分标准见表4:表4 疾病活动指数评分表
结果为:正常对照组(ctl组)小鼠活动、进食正常,无腹泻及便血;uc模型组(uc组)小鼠活动少,肉眼可见黏液脓血便;与uc组相比,p29组和p89组小鼠腹泻及便血情况明显较轻。
69.根据各组小鼠体质量变化,绘制体重变化曲线,如图1所示,从图1中可以看出,ctl组小鼠体重逐渐增加,uc组小鼠体重显著下降,p29组和p89组小鼠体质量减轻情况较uc组有明显改善,而p6组和p36组改善效果较差。
70.dai评分结果如图2所示,与uc组相比,p29组和p89组的小鼠dai评分显著降低(p 《 0.001),而p6组和p36组小鼠dai评分仍然较高。
71.以上结果充分证明,本发明筛选得到的功能性益生菌p29和p89具有显著地改善或治疗溃疡性结肠炎的功效,同时说明本发明基于抑制脂多糖产生的益生菌筛选方法非常高效且成功率高。
72.实施例7:抗幽门螺杆菌的功能验证本实施例探究p29、p89、p6和p36对幽门螺杆菌的生长抑制作用:(1)将幽门螺旋杆菌atcca43504从-80℃取出,涂布于含5%绵羊血(v/v)的哥伦比亚血琼脂培养基中活化培养,在微需氧环境中,37℃下培养48 h;(2)将p29、p89、p6和p36分别接种于mrs液体培养基中,37℃下培养18 h进行活化,连续活化2次,得到活化液;将活化液按2%(v/v)的接种量接种于mrs液体培养基中,37℃下培养18 h,得到菌液;将菌液在8000 g下离心10 min,使用pbs重悬菌体,得到益生菌菌悬液(各益生菌的浓度一致);(3)抑菌圈实验:将100 μl幽门螺旋杆菌atcca43504的菌液(密度为10
9 cfu/ml)涂布到不含抗生素且已打孔的含5%绵羊血的哥伦比亚血琼脂培养基(培养基体积为20 ml)表面,分别加入以下任一组液体,从而形成不同的实验组别:待测益生菌菌悬液100 μl;阳性对照(质量浓度为0.025%的甲硝唑溶液)100 μl;阴性对照(pbs缓冲液)100 μl;空白对照(mrs液体培养基)100 μl。用牛津杯法测定其在48 h和72 h抑制幽门螺杆菌生长的效果,结果如表5所示。
73.表5 抑菌圈结果
由表5可知,mrs液体培养基对幽门螺杆菌无抑制作用,而不同的益生菌菌悬液对幽门螺杆菌的生长均具有抑制作用,其中,p29菌悬液的抑菌效果最明显,培养48 h时抑菌圈直径可达13.2
±
1.7 mm以上,培养72 h时抑菌圈直径可达18.2
±
2.5 mm以上;其次为p89菌悬液,两种菌悬液的抑菌效果显著好于p6和p3的菌悬液,甚至好于阳性对照。
74.以上结果充分证明,本发明筛选得到的功能性益生菌p29和p89具有显著地抗幽门螺杆菌的效果,同时说明本发明基于抑制脂多糖产生的益生菌筛选方法非常高效且成功率高。
75.申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1