一种微生物菌群利用白酒丢糟释放酚酸类物质的方法
1.本发明属于生物技术领域,具体涉及一种微生物菌群利用白酒丢糟释放酚酸类物质的方法。
背景技术:
2.酚酸类物质在植物中存在广泛,包括阿魏酸、咖啡酸、没食子酸、香草酸、原儿茶酸、迷迭香酸、对香豆酸等,例如阿魏酸(ferulic acid,fa)作为植物界普遍存在的一种酚酸,在麦麸、玉米麸皮、谷物壳中含量尤其丰富,具有多种有益生理功能,如:抗氧化和消除自由基、抗血栓、降血脂、防治冠心病、抗菌消炎、抗突变防癌以及调节免疫等,因而在医药、保健品、化妆品原料方面有着很高的应用价值。
3.我国是白酒生产大国,每年约有3900万吨丢糟迫切需要被无害化处理和资源化利用。丢糟中木质纤维素含量最为丰富,其中木质纤维素达到了50%以上,同时包含氨基酸、维生素、矿物质、氮、磷、有机质等成分。而白酒丢糟大量堆积容易霉变,造成大量的木质纤维素资源浪费和生态环境的污染问题,故开发白酒丢糟废弃物新的高价值有效利用途径具有重要的意义。
4.目前已有研究发现,可采用化学和酶解方法生产阿魏酸,相比于化学方法,酶解法具备催化效率更高、能耗低、安全环保、专一性强的优势。通过微生物分解植物细胞壁释放阿魏酸则能耗低、安全环保、专一性强,但目前单一菌株释放阿魏酸的产量较低,仍需要寻找高产量的阿魏酸释放微生物以解决实际生产需要。
技术实现要素:
5.鉴于以上技术问题,本发明提供以下技术方案:
6.本发明提供一种微生物菌群利用白酒丢糟释放酚酸类物质的方法,包括如下步骤:以白酒丢糟为原料,富集并驯化得到能够利用白酒丢糟且遗传稳定的微生物菌群;利用所述微生物菌群发酵白酒丢糟,收获发酵液中的酚酸类物质。
7.优选地,所述微生物菌群为拟杆菌、丛毛单孢菌、苍白杆菌、肠杆菌、吞菌弧菌、肠球菌、鞘氨醇杆菌中的至少两种。
8.优选地,所述富集驯化的具体操作过程为:
9.将白酒大曲及丢糟加入lb液体培养基中进行富集培养,得到富集液,再以白酒丢糟为营养物质进行驯化培养,经过多次传代,筛选得到稳定遗传的微生物菌群;
10.其中,所述驯化培养基中白酒丢糟的浓度为100g/l,ph为7.0
±
0.1。
11.优选地,所述发酵是将活化的所述微生物菌群种子液以质量分数10%接种至发酵培养基中,于37℃、180r/min培养3~7d;
12.其中,所述发酵培养基按重量份数计由以下原料组成:(nh4)2so
4 1.3份、kh2po
4 0.37份、mgso4·
7h2o 0.25份、cacl2·
h2o 0.07份、fecl
3 0.02份、酵母粉5份、白酒丢糟10份,ph为7.0
±
0.1。
13.优选地,所述酚酸类物质为阿魏酸、咖啡酸、4-羟基苯乙酸、对羟苯基乙醇、3-羟基苯乙酮、没食子酸、香草酸、对羟基苯丙酸。
14.本发明还提供一种根据上述方法制备得到的发酵液。
15.本发明还提供了所述发酵液在释放酚酸类物质中的用途。
16.本发明还提供一种用于释放酚酸类物质的微生物制剂,其包括所述微生物菌群和/或所述发酵液,以及微生物上可接受的辅料或载体。
17.对比现有技术,本发明有以下益处:
18.1、本发明利用白酒酿造副产物白酒丢糟为原料,降低了阿魏酸等酚酸类物质生产的原料成本;并且本发明采用微生物菌群进行酚酸类物质的释放,相较于纯培养的单菌,微生物菌群多菌协同效应能更有效的实现植物细胞壁的降解从而释放酚酸类物质。
19.2、本发明利用富集驯化得到的微生物菌群,以白酒丢糟为原料,发酵得到发酵液,利用该发酵液浸提得到酚酸类物质,定量检测在第60天传代的微生物菌群发酵液中阿魏酸的含量为2.15mg/l、咖啡酸的含量为0.917mg/l。
20.3、本发明提供的方法培养周期短,发酵条件更易控制,便于实施,有利于工业化生产。
附图说明
21.图1是微生物菌群物种组成情况(属水平);
22.图2是驯化过程微生物菌群生物量的变化;
23.图3是驯化过程培养液ph的变化;
24.图4是发酵过程微生物菌群的生物量变化;
25.图5是发酵过程培养液ph的变化;
26.图6是葡萄糖标准曲线;
27.图7是木糖标准曲线;
28.图8是阿魏酸标准曲线;
29.图9是阿魏酸酯酶、木聚糖酶及纤维素酶等酶活分析;
30.图10是微生物菌群释放阿魏酸等酚酸类物质分析;
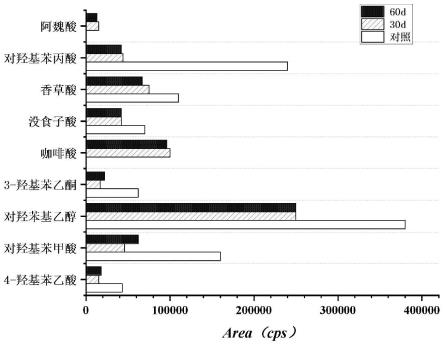
31.图11是发酵液中阿魏酸和咖啡酸的定量分析。
具体实施方式
32.以下结合具体实施方式对本发明做进一步说明。下述实施例中,如无特殊说明,所使用的实验方法均为常规方法,所用的试剂等均可从化学或生物试剂公司购买。
33.本发明实施例中所用菌群富集培养基的溶剂为水,溶质及其在菌群富集培养基(lb培养基)中的浓度如下:蛋白质10g/l、酵母粉5g/l、nacl 10g/l,ph为7.0
±
0.1。
34.本发明实施例中所用种子培养基同上富集培养基。
35.本发明实施例中所用菌群驯化培养基的溶剂为水,溶质及其在驯化培养基中的浓度如下:白酒丢糟100g/l,ph为7.0
±
0.1。
36.本发明实施例中所用菌群发酵培养基,溶质及其在发酵培养基中的浓度如下:(nh4)2so41.3g、kh2po
4 0.37g、mgso4·
7h2o 0.25g、cacl2·
h2o 0.07g、fecl
3 0.02g、酵母粉
5g、白酒丢糟10g,ph为7.0
±
0.1。
37.所有培养基均在121℃灭菌20分钟。接种量为2%,培养条件为37℃、180rpm。
38.实施例1
39.微生物菌群的筛选及驯化
40.收集从宜宾某酒厂中采集得到的丢糟和大曲作为样品。称取10g样品置于90ml无菌生理盐水(250ml的三角瓶)中,180r/min恒温震荡1h,吸取1ml混匀液于已灭菌的富集培养基中活化,摇床培养条件设置为180r/min、37℃,培养24h。
41.将其接入含有100g/l白酒丢糟的驯化培养基中,180r/min、37℃条件下培养,连续传代2个月,得到天然的微生物菌群,检测每次传代过程中ph与菌体量变化。
42.通过16srdna高通量测序物种丰度分析,如图1所示,微生物菌群主要包含如下:以拟杆菌(taibaiella)、丛毛单孢菌(comamonadaceae)、苍白杆菌(ochrobactrum)、肠杆菌(escherrichia)、吞菌弧菌(peredibacter)、肠球菌(enterococcus)、鞘氨醇杆菌菌(sphingobacterium)等。
43.如图2、3所示,微生物菌群在15d内连续5代的传代过程中,通过检测od值稳定在0.2~0.3之间,ph稳定在5.0~6.0的范围内。
44.实施例2
45.微生物菌群发酵周期及木质纤维素酶系测定
46.1、发酵周期及ph变化
47.取活化后的种子液以质量分数10%的接种量接入50ml发酵培养基,于37℃、180r/min恒温摇床培养,检测7d培养过程中微生物菌群的生物量及ph变化。
48.如图4、5所示,微生物菌群在发酵培养中于2d进入生长稳定期,生物量维持在1.5~2.0范围内,ph在0~3d期间随着菌体的生长从初始的7.0逐渐增加,3~7d后稳定在8.5~9.0之间。
49.2、粗酶液制备
50.取活化后的种子液以质量分数10%的接种量接入50ml发酵培养基,发酵培养3d后,取50ml发酵液于8000r/min、4℃下离心10min,保留上清液获得粗酶液,测定传代过程中微生物菌群的纤维素酶、木聚糖酶及阿魏酸酯酶酶活变化。
51.2.1、阿魏酸酯酶酶活评定
52.阿魏酸标准曲线的制作:精密称取阿魏酸0.1000g于无水乙醇中溶解,于1000ml容量瓶中定容,分别吸取2ml、4ml、6ml、8ml、10ml、12ml、15ml,于100ml容量瓶中定容,配制成2μg/ml、4μg/ml、6μg/ml、8μg/ml、10μg/ml、12μg/ml、15μg/ml不同浓度的阿魏酸溶液,以无水乙醇作为空白,于320nm波长下测吸光度。阿魏酸浓度为横坐标,吸光值为纵坐标,列出直线回归方程(如图6)。
53.取1ml粗酶液加入0.02g阿魏酸乙酯,在37℃条件下反应2h,加入0.5ml 1mol/lph 9.0的tris-hcl,冰浴10min后12000rpm离心5min取上清并分别稀释适当倍数。以按照上述步骤操作的未反应的粗酶液作为对照,在320nm下测定od值。
54.酶活定义:最适反应条件下,每分钟产生1μmol阿魏酸所需要的酶量为1个酶活力单位。
55.酶活计算方法:
[0056][0057]
ε
阿魏酸
=14700l/mol
[0058]v反应体积
=2ml
[0059]v样品
=1ml
[0060]
t=120min
[0061]
d=1cm
[0062]
df=样品稀释数
[0063]
2.2、木聚糖酶酶活测定
[0064]
木糖标准曲线的制作:取试管6支,用移液枪移取1%木糖标准溶液0.0、0.2、0.4、0.6、0.8、1.2ml,再加蒸馏水2.0、1.8、1.6、1.4.、1.2、1.0、0.8ml再移取加dns试剂2ml混匀后在沸水浴中加热10min,取出立即用冷水冷却,再加蒸馏水至25ml摇匀,测吸光度。木糖浓度为横坐标,吸光值为纵坐标,列出直线回归方程(如图7)。
[0065]
取1ml稀释后的粗酶液分别与4支25ml试管中(其中一支添加1ml柠檬酸钠缓冲溶液为空白对照),分别加入1.5mlph为4.8的柠檬酸-柠檬酸钠缓冲溶液和1ml1mg/ml木聚糖溶液,摇匀后放入50℃水浴中反应10min,加入2ml dns试剂混匀,放入沸水浴中准确反应10min,取出冷却至室温后用蒸馏水定容至25ml并混匀,在540nm处测定吸光值,以空白对照调零。
[0066]
木聚糖酶的酶活定义为:在50℃,ph为5.0的条件下,每分钟酶解木聚糖产生1μmol所需的酶量为1个酶活单位,即1u。发酵所产木聚糖酶的酶活是以每升发酵液所含酶活单位表示,即u/l。
[0067]
木聚糖酶酶活(u/l)=(w
×d×
106)/(t
×v×
m)
[0068]
其中:w-根据吸光值从木糖标准曲线上查得的木糖质量,mg;
[0069]
d-酶液的稀释倍数;
[0070]
t-酶解反应时间,min
[0071]
v-所取酶液体积,ml;
[0072]
m-木糖分子量,g/mol。
[0073]
2.3、纤维素酶酶活测定
[0074]
葡萄糖标准曲线的绘制
[0075]
标准曲线绘制:取试管6支,加入1.0mg/ml的葡萄糖标准溶液0.0、0.1、0.2、0.3、0.4、0.5ml加蒸馏水2.0、1.9、1.8、1.7、1.6、1.5ml加dns试剂1.5ml混匀后在沸水浴中加热5分钟,取出立即用冷水冷却,用水定容至10ml摇匀,测吸光度。以吸光度为纵坐标,葡萄糖的含量为横坐标,绘制标准曲线。
[0076]
取4支试管编为1-4号,分别在三支试管中加入1.5ml的1%羧甲基纤维素钠(cmc-na)溶液,向1-3号试管加入1ml的粗酶液,4号试管加入等体积的柠檬酸缓冲溶液作为空白对照。将4支试管均置于50℃水浴锅中温育30min。取出后加入1.5ml dns试剂终止反应。沸水浴5min,冷却至室温,加蒸馏水定容至10ml,旋涡振荡混匀。以4号管为对照组调零,测定1-3号管在od540nm处的吸光度值。根据葡萄糖标准曲线测定还原糖量(如图8)。
[0077]
定义:每分钟由底物cmc-na分解产生1μmol还原糖所需要的纤维素酶量定义为一
个纤维素酶活力单位,用u/l表示。
[0078]
计算公式:
[0079][0080]
公式中5.56为1mg葡萄糖的μmol数,即1000/180=5.56
[0081]
如图9所示,微生物菌群在15d内连续5代的传代过程中,微生物菌群阿魏酸酯酶酶活稳定在200~450u/l范围内,木聚糖酶酶活稳定在190~290u/l之间,纤维素酶酶活稳定在100~160u/l之间。
[0082]
实施例4
[0083]
微生物菌群酚酸类物质释放分析及阿魏酸产量测定
[0084]
取活化后的种子液取1ml接种到50ml发酵培养基中,于37℃、180r/min恒温摇床中培养72h。然后在培养得到的发酵液中加入50ml 70%的无水乙醇,于37℃、180r/min的摇床中浸提30min,取50ml浸提液于离心管中,在7000r/min条件下离心10min,取上清液用0.22μm滤膜过滤,稀释后进行lc-ms(液相色谱条件为waters acquity uplc beh c18 1.7μm,2.1*50mm,10%0.1%乙酸水,90%甲醇,柱温25℃,流速:0.2ml/min,质谱条件tem 500℃,is-4500v,cur 25psi,gs1 50 psi,gs2 50 psi,检测模式mrm,阿魏酸192.9》134,dp-43v,ep-11v,ce-16v,cxp-5v,咖啡酸178.9》134.9,dp-20v,ep-10v,ce-19v,cxp-9v)定性分析酚酸类物质及定量分析阿魏酸和咖啡酸的含量。
[0085]
含量计算方法:
[0086][0087]
式中:
[0088]
cr-对照品溶液浓度(μg/l)
[0089]
ax-供试品待测成分的峰面积(cps)
[0090]
ar-对照品的峰面积(cps)
[0091]
d-供试品稀释倍数
[0092]
如图10所示,通过lc-ms定性分析,发酵液中包含的酚酸类物质有阿魏酸、咖啡酸、4-羟基苯乙酸、对羟苯基乙醇、3-羟基苯乙酮、没食子酸、香草酸、对羟基苯甲酸。
[0093]
通过对照样浓度及峰面积计算阿魏酸和咖啡酸含量,如图11所示,可得到第60天传代的微生物菌群发酵液中阿魏酸含量为2.15mg/l、咖啡酸含量为0.917mg/l。
[0094]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1