一种氮杂稠环类化合物及其合成方法
1.本发明属于药物化学领域,具体公开一种氮杂稠环类化合物及其合成方法。
背景技术:
2.氮杂稠环化合物是有机合成、医药、农药、材料等中重要的结构单元。芳香氮杂稠环结构在天然产物和药物分子中十分常见。氮杂稠环化合物具有良好的生物活性,在抗肿瘤、治疗失眠症等方面有着广泛的应用。氮杂稠环化合物还具有特殊的荧光性质,在荧光探针,有机发光材料等方面也有着重要的应用。因此,氮杂稠环化合物的合成引起了许多有机化学家的关注。从杂环的构建角度来看,该类化合物的合成主要通过单环的构建、多环同时构建合成氮杂稠环化合物。
3.酮是有机化学中最常见的化合物之一,具有稳定、无毒、易于合成的优点。它不仅广泛存在于药物分子和天然产物中,而且常作为原料用于精细化学品和材料的合成。酮的制备方法简单,是理想的合成前体。我们设想能否通过酮的羰基迁移进而实现稠环的构建。然而,由于c
–
c键的动力学惰性,酮的酰基迁移主要集中在高度紧张的酮上。对于非刚性结构的酮,最常见的策略是使用导向基团形成稳定的螯合物。虽然这种策略有效,但导向基团的使用使整体合成复杂化,并限制了可获得产物的范围。如果可以实现杂芳基酮的分子内酰基迁移,则可以设想用于氮杂稠环制备的迁移环化策略。因此,发展一种非应力酮酰基迁移的新策略用于氮杂稠环的合成是必要的。
技术实现要素:
4.鉴于以上技术问题,本发明提供以下技术方案:
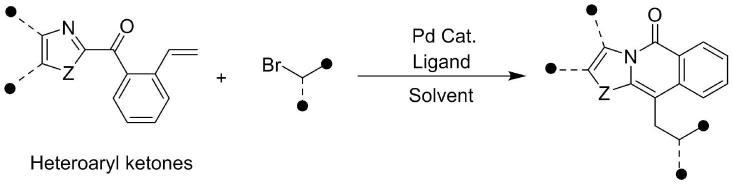
5.本发明提供一种氮杂稠环类化合物的合成方法,包括以下步骤:以取代或未取代的杂芳基酮与卤化物为原料,在钯催化剂、配体及溶剂的存在下发生脱芳构化反应生成螺环中间体,所述螺环中间体通过芳构化驱动的分子内酰基迁移,引发杂芳基酮的骨架重排,制得如式ⅰ或式ⅱ所示的化合物:
[0006][0007]
其中,x选自硫原子、氮原子或氧原子;
[0008]
r1选自烷基、芳基、酯基或磺酰基;
[0009]
r2、r3、r4、r5、r6、r7分别独立地选自烷基、芳基、酯基、磺酰基、巯基、氨基、硼烷基、卤素、硫醚、亚磺酰基、磷脂、烯烃、炔基、硒醚、含氟烷烃或氘代原子;
[0010]
合成路线如下所示:
[0011][0012]
优选地,所述卤化物选自:
[0013]
[0014][0015]
优选地,所述取代或未取代的杂芳基酮选自:
[0016]
[0017][0018]
优选地,所述钯催化剂为醋酸钯、三二亚苄基丙酮钯或四三苯基膦钯;所述配体为氮配体或膦配体;所述混合溶剂选自极性溶剂和/或醚类溶剂。
[0019]
优选地,所述膦配体为双齿膦配体。
[0020]
优选地,所述杂芳基酮与所述溴化物的摩尔比为1∶1.0~2.0;所述杂芳基酮与所述钯催化剂的摩尔比为8~15∶1;所述杂芳基酮与所述配体的摩尔比为1∶ 0.1~0.15。
[0021]
优选地,所述脱芳构化反应是在惰性氛围、120℃~140℃下反应24~36h。
[0022]
优选地,所述反应过程中加入弱碱盐,且所述杂芳基酮与所述弱碱盐的摩尔比为1∶0.8~1.2。
[0023]
本发明还提供一种根据上述合成方法得到的如式ⅰ或式ⅱ所示的化合物:
[0024][0025]
其中,x选自硫原子、氮原子或氧原子;
[0026]
r1选自烷基、芳基、酯基或磺酰基;
[0027]
r2、r3、r4、r5、r6、r7分别独立地选自烷基、芳基、酯基、磺酰基、巯基、氨基、硼烷基、卤素、硫醚、亚磺酰基、磷脂、烯烃、炔基、硒醚、含氟烷烃或氘代原子;
[0028]
优选地,所述化合物的结构式选自:
[0029]
[0030]
[0031][0032][0033]
对比现有技术,本发明的有益效果为:
[0034]
1、本发明将杂芳基酮和烷基溴化物反应,在过渡金属钯催化剂的作用下通过生成前芳香中间体,得到特殊高能量的含螺环骨架化合物,所得的中间体通过芳构化驱动的分子内酰基迁移,引发杂芳基酮的骨架重排,从而得到高度功能化的氮杂稠环化合物。该方法由芳香族中间体的芳构化驱动实现非张力杂芳基酮的酰基迁移,可适用于氮杂稠环化合物的合成,且不再需要导向基团,避免了现有合成方法中导向基团的使用使整体合成复杂化并限制可获得产物的范围的问题出现。
[0035]
2、本发明提供的方法具有良好的官能团兼容性,除了适用于咪唑酮类化合物的骨架重排外,还可用于噻唑以及噁唑酮的骨架重排。
[0036]
3、本发明提供的方法可以用于复杂天然产物和药物分子中氮杂稠环结构的快速、高效引入,为稠环药物的研发提供新的思路。
具体实施方式
[0037]
以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
[0038]
具体实施方式中所用的试剂、溶剂均通过商业途径购得,没有进行严格的处理。实验过程中的检测是通过薄层色谱板采样后在紫外灯(zf-1s)下照射显示完成。产物均使用柱层析硅胶(200-300目)进行纯化。所报道化合物的氢谱、碳谱及氟谱数据在jeol ecz400r核磁共振仪上获得。δ为化学位移单位报告,所用氘代试剂为氘代氯仿(cdcl3)和氘代二甲亚砜(dmso),四甲基硅烷(tms) 为内标。氢谱中峰的裂分包括单峰(s),双峰(d),三重态(t),及多重峰(m)。偶合常数j的单位为hz,化学位移值单位为ppm。
[0039]
本发明提供一种氮杂稠环类化合物的合成方法,包括以下步骤:以取代或未取代的杂芳基酮与卤化物为原料,在钯催化剂、配体及溶剂的存在下发生脱芳构化反应生成螺环中间体,所述螺环中间体通过芳构化驱动的分子内酰基迁移,引发杂芳基酮的骨架重排,制得如式ⅰ或式ⅱ所示的化合物:
[0040][0041]
其中,x选自硫原子、氮原子或氧原子;
[0042]
r2、r3、r4、r5、r6、r7分别独立地选自烷基、芳基、酯基、磺酰基、巯基、氨基、硼烷基、卤素、硫醚、亚磺酰基、磷脂、烯烃、炔基、硒醚、含氟烷烃或氘代原子;
[0043]
合成路线如下所示:
[0044][0045]
本发明实施例提供的(苯并)咪唑杂芳基酮、(苯并)噻唑杂芳基酮、(苯并)恶唑杂芳基酮及二氟烷基溴衍生物的制备采用以下方法:
[0046]
1、制备(苯并)咪唑杂芳基酮的一般程序:
[0047][0048]
添加1-甲基苯并咪唑(2.7mmol)、三乙胺(4.0mmol)、乙腈(1.0ml) 和2-乙烯基苯甲酰氯(4.0mmol)的混合物,并在165℃下加热1h,然后向其中添加10.0ml丙酮,并在搅拌下将溶液倒入7%的盐酸(40.0ml)中。搅拌混合物并用木炭回流至少30分钟。滤液用20%的氢氧化钠碱化,分离化合物,纯化后得到所需产物杂芳基酮。或
[0049][0050]
步骤1:将1-甲基苯并咪唑或1-甲基咪唑(14.0mmol)、乙腈(2.0ml)、三乙胺(21.0mmol)和苯甲酰氯(21.0mmol)的混合物在165℃下加热1h,然后向其中添加25.0ml丙酮,并在搅拌下将溶液倒入7%的盐酸(120.0ml) 中。搅拌混合物并用木炭回流至少30分钟。滤液用20%的氢氧化钠碱化,分离化合物s1;
[0051]
步骤2:将三氟乙烯基硼酸钾(3.75mmol)、碳酸钾(5.0mmol)、醋酸钯 (0.025mmol,5.61mg)、化合物s1(2.5mmol)、1.4-二氧六环(2.5ml)和水(1.0ml)放入schlenk烧瓶中。然后,置换氮气三次。将反应混合物在110℃下搅拌12小时,并将反应混合物冷却至室温。用二氯甲烷(10.0ml)萃取水层。合并的有机相,无水硫酸钠干燥,减压下蒸发。纯化粗产物,得到所需产物杂芳基酮。
[0052]
2、制备(苯并)噻唑杂芳基酮的一般程序:
[0053][0054]
步骤1:将噻唑或苯并噻唑(5.0mmol)、碘化亚铜(19.0mg,2mol%)、 1-(2-溴苯基)乙酮(10.0mmol)、氟硼酸(2.5mmol,40%在水溶液中)和二甲亚砜(7.5ml)添加到密封管中,氮气保护。在130℃条件下反应9小时(通过tlc监测)。反应完成后,将混合物冷却至室温,乙酸乙酯(20.0ml)萃取,饱和碳酸氢钠水溶液、盐水依次清洗有机层,合并有机相并用无水硫酸钠干燥,通过旋转蒸发仪除去溶剂,用快速色谱法纯化s2;
[0055]
步骤2:将三氟乙烯基硼酸钾(3.75mmol)、碳酸钾(5.0mmol)、醋酸钯 (0.025mmol,
5.61mg)、化合物s2(2.5mmol)、1.4-二氧六环(2.5ml)和水(1.0ml)放入schlenk烧瓶中。然后,置换氮气三次。将反应混合物在110℃下搅拌12小时,并将反应混合物冷却至室温。用二氯甲烷(10.0ml)萃取水层。合并的有机相,无水硫酸钠干燥,减压下蒸发。纯化粗产物,得到所需产物杂芳基酮。
[0056]
3、制备(苯并)恶唑杂芳基酮的一般程序:
[0057][0058]
步骤1:在可密封管中加入n,n-二甲基-4-氨基吡啶(370.0mg,30.0mol%)、苯甲酰氯(20.0mmol)和苯并恶唑(10.0mmol)。用氮气流冲洗管道。向试管中加入乙腈(20.0ml),然后加入三乙胺(4.2ml)。反应混合物在80℃下搅拌24小时。反应完成后,将混合物冷却至室温,乙酸乙酯(20.0ml)萃取,饱和碳酸氢钠水溶液、盐水依次清洗有机层,合并有机相并用无水硫酸钠干燥,通过旋转蒸发仪除去溶剂,用快速色谱法纯化s3;
[0059]
步骤2:将三氟乙烯基硼酸钾(3.75mmol)、碳酸钾(5.0mmol)、醋酸钯 (0.025mmol,5.61mg)、化合物s3(2.5mmol)、1.4-二氧六环(2.5ml)和水(1.0ml)放入schlenk烧瓶中。然后,置换氮气三次。将反应混合物在110℃下搅拌12小时,并将反应混合物冷却至室温。用二氯甲烷(10.0ml)萃取水层。合并的有机相,无水硫酸钠干燥,减压下蒸发。纯化粗产物,得到所需产物杂芳基酮。
[0060]
4、二氟烷基溴衍生物制备的一般程序:
[0061][0062]
将二氟溴乙酸(10.0mmol)添加到圆底烧瓶中,在0℃下将干燥的二氯甲烷(30.0ml)、草酰氯(15.0mmol)和1-2滴n,n-二甲基甲酰胺添加到反应混合物中,并在室温下反应3h。然后将反应转移到0℃下,向反应混合物中加入乙醇(12.0mmol)和三乙胺(15.0mmol)。在该温度下搅拌反应混合物10分钟,接着在室温下搅拌反应混合物14小时。用1.0m的盐酸(5.0ml)猝灭反应混合物。二氯甲烷萃取,盐水清洗有机相,无水硫酸钠干燥有机相,通过快速柱层析纯化残渣,得到目标产物。
[0063]
5、二氟烷基溴衍生物制备的一般程序:
[0064][0065]
将酸(10.0mmol)添加到圆底烧瓶中,在0℃下将干燥的二氯甲烷(30.0ml)、草酰氯(15.0mmol)和1-2滴n,n-二甲基甲酰胺添加到反应混合物中,并在室温下进行反应3h。浓缩后,溶解在四氢呋喃(30.0ml)中,将反应转移到0℃,向混合物中加入乙醇(15.0mmol),在此温度下搅拌反应混合物10分钟,并向反应混合物中加入三乙胺(15mmol)。在室温下搅拌反
应混合物约14小时。用1.0m的盐酸(5.0ml)猝灭反应混合物。二氯甲烷萃取,盐水清洗有机相,无水硫酸钠干燥有机相,通过快速柱层析纯化残渣,得到目标产物。
[0066]
下面通过具体实施例对本发明进行说明。
[0067]
实施例1
[0068]
以(1-甲基-1h-苯并[d]咪唑-2-基)(2-乙烯基苯基)甲酮1(0.1mmol)作为模型底物,采用二氟溴乙酸乙酯(brcf2cooet)(0.15mmol,1.5当量)作为偶联剂、二氯化钯(0.01mmol,10mol%)为催化剂、1,5-双(二苯基膦)戊烷(dpppent)(0.012mmol,12mol%)为配体,并加入碳酸钠(0.1mmol,1.0当量),在温度130℃下、1,4-二氧六环与四氢呋喃(体积比1∶2)(1.0ml)的混合溶剂中反应24小时,获得产物1,产率90%。
[0069][0070]
yellowsolid,mp=253
–
254℃.1hnmr(400mhz,cdcl3)δ=8.79
–
8.77(m,1h),8.50
–
8.48(m,1h),7.59
–
7.53(m,2h),7.34
–
7.26(m,2h),7.19
–
7.14(m,1h),7.05
–
7.02(dd,j=1.2hz,j=8.0hz,1h),4.20
–
4.15(m,2h),3.87
–
3.81(m,5h),1.19
–
1.16(m,3h).13cnmr(100mhz,cdcl3)δ=164.36(t,j=32.0hz),159.59,140.87,138.07,135.08,132.04,127.57,127.50,125.70,122.43,121.36,121.14,118.91,116.84,115.18,106.73,79.91,63.19,32.68,29.85(t,j=24.0hz),13.67.19fnmr(376mhz,cdcl3)δ=-102.73,-104.91.hrms(esi)m/zcalculatedforc
21h19
f2n2o3[m
+
h]
+
385.1358,found385.1358.
[0071]
实施例2
[0072]
以(1-甲基-1h-苯并[d]咪唑-2-基)(2-乙烯基苯基)甲酮1(0.1mmol)作为模型底物,采用二氟溴乙酸乙酯(brcf2cooet)(0.1mmol,1.0当量)作为偶联剂、醋酸钯(0.01mmol,10mol%)为催化剂、1,5-双(二苯基膦)戊烷(dpppent)(0.012mmol,12mol%)为配体,并加入碳酸钠(0.12mmol,1.2当量),在温度为130℃下、1,4-二氧六环与四氢呋喃(体积比1∶2)(1.0ml)的混合溶剂反应24小时,获得产物1,产率54%。
[0073]
实施例3
[0074]
以(1-甲基-1h-苯并[d]咪唑-2-基)(2-乙烯基苯基)甲酮1(0.1mmol)作为模型底物,采用二氟溴乙酸乙酯(brcf2cooet)(0.2mmol,2.0当量)作为偶联剂、三二亚苄基丙酮钯(0.01mmol,10mol%)为催化剂、1,6-双(二苯基膦)己烷(dppph)(0.012mmol,12mol%)为配体,并加入碳酸钠(0.08mmol,0.8当量),在温度为120℃下、1,4-二氧六环/四氢呋喃(体积比1∶2)(1.0ml)的混合溶剂中反应24小时,获得产物1,产率68%。
[0075]
实施例4
[0076]
以(1-甲基-1h-苯并[d]咪唑-2-基)(2-乙烯基苯基)甲酮1(0.08mmol)作为模型底物,采用二氟溴乙酸乙酯(brcf2cooet)(0.15mmol,1.5当量)作为偶联剂、三二亚苄基丙酮钯(0.01mmol,10mol%)为催化剂、1,2-双(二苯基膦)乙烷(dppe)(0.012mmol,12mol%)为配体,并加入碳酸钠(0.1mmol,1.0当量),在温度130℃下、乙腈(1.0ml)作为溶剂,反应24小时,获得产物1,产率57%。
[0077]
实施例5
[0078]
以(1-甲基-1h-苯并[d]咪唑-2-基)(2-乙烯基苯基)甲酮1(1.5mmol)作为模型底物,采用溴代四氢吡喃(0.15mmol,1.5当量)作为偶联剂、三二亚苄基丙酮钯(0.01mmol,10mol%)为催化剂、1,2-双(二苯基膦)乙烷(dppe)(0.012 mmol,12mol%)为配体,在温度130℃下、乙腈(1.0ml)作为溶剂,反应24 小时,获得产物2,产率52%。
[0079][0080]
yellow solid,mp=106
–
107℃.1h nmr(400mhz,cdcl3)δ=8.82(d,j= 8.0hz,1h),8.54(d,j=8.1hz,1h),7.72
–
7.50(m,2h),7.39
–
7.28(m,2h),7.15(t, j=7.7hz,1h),7.04(d,j=8.0hz,1h),3.98
–
3.81(m,2h),3.79(s,3h),3.22(td,j =11.6hz,j=2.4hz,2h),3.01(d,j=7.2hz,2h),1.78(m,1h),1.55
–
1.35(m,4h). 13c nmr(100mhz,cdcl3)δ=159.45,139.31,138.04,135.69,131.76,127.88, 127.76,125.55,122.20,121.72,120.81,119.36,116.88,106.55,89.14,67.95,36.60, 33.66,32.82,30.80.hrms(esi)m/z calculated for c
22h22
n2o2na[m
+
na]
+ 369.1573,found 365.1575.
[0081]
实施例6
[0082]
以(1-甲基-1h-苯并[d]咪唑-2-基)(2-乙烯基苯基)甲酮1(0.1mmol)作为模型底物,采用雄诺龙溴代物(0.15mmol,1.5当量)作为偶联剂、三二亚苄基丙酮钯(0.01mmol,10mol%)为催化剂、1,2-双(二苯基膦)乙烷(dppe)(0.01 mmol)为配体,在温度130℃下、乙腈(1.0ml)作为溶剂,反应24小时,获得产物3,产率49%。
[0083][0084]
yellow solid(dr=4.6:1),mp=130
–
131℃.1h nmr(400mhz,cdcl3)δ=8.88(ddd,j=8.0hz,j=4.4hz,j=1.2hz,1h),8.64
–
8.52(m,1h),7.71
–ꢀ
7.63(m,2h),7.45
–
7.28(m,2h),7.21(td,j=7.8hz,j=1.0hz,1h),7.12(d,j= 8.0hz,1h),3.85(s,3h),3.21
–
3.13(m,1h),3.01(dd,j=15.0hz,j=12.4hz,1h), 2.42
–
2.20(m,3h),2.16
–
1.98(m,3h),1.79(dd,j=12.8hz,j=3.8hz,2h),1.73
ꢀ–
1.67(m,2h),1.60
–
1.47(m,3h),1.42
–
1.34(m,4h),1.30
–
1.21(m,4h),1.05(s, 3h),1.00(s,1h),0.84(s,3h),0.82(s,1h).13c nmr(100mhz,cdcl3)δ= 210.95,158.06,140.78,138.54,136.56,130.62,128.81,128.01,125.63,122.30, 121.70,120.97,119.08,117.10,107.34,106.20,89.38,55.48,53.90,50.74,46.80, 45.09,43.81,38.70,37.56,36.56,35.82,33.92,32.37,28.92,25.60,24.62,22.08, 20.70,12.05.hrms(esi)m/z calculated for c
36h42
n2o2na[m
+
na]
+
557.3139, found 557.3138.
[0085]
实施例7
[0086]
以苯并噻吩杂芳基酮(0.1mmol)作为标准底物,在140℃下,和二氟溴乙酸乙酯
(0.15mmol)、二氯化钯(10mol%)、1,1'-双(二苯基膦)二茂铁(dppf) (0.015mmol,15mol%)、碳酸钠(1.0当量)混合,在1,4-二氧六环与四氢呋喃(体积比1∶2)(1.0ml)的混合溶剂中反应36小时,获得目标产物4,产量66%。
[0087][0088]
yellow solid,mp=103
–
104℃.1h nmr(400mhz,cdcl3)δ=9.16
–
9.13 (m,1h),8.58
–
8.55(m,1h),7.73
–
7.69(m,1h),7.62
–
7.59(m,1h),7.53
–
7.51(m, 1h),7.49
–
7.45(m,1h),7.44
–
7.40(m,1h),7.37
–
7.33(m,1h),4.29
–
4.24(q,j= 7.2hz,2h),3.66
–
3.57(m,2h),1.25(t,j=7.2hz,3h).13c nmr(100mhz, cdcl3)δ=163.99(t,j=32.0hz),161.56,141.85,138.88,135.27,132.84,128.44, 126.36,126.23,125.42,125.11,122.93,121.49,121.11,119.81,115.37(t,j=253.0 hz),98.58,63.32,35.22(t,j=25.0hz),13.76.19f nmr(376mhz,cdcl3)δ=
ꢀ‑
102.37(t,j=16.4hz,2f).hrms(esi)m/z calculated for c
20h15
f2no3sna [m
+
na]
+
410.0633,found 410.0632.
[0089]
实施例8
[0090]
6-(cycloheptylmethyl)-5-methylbenzo[4,5]imidazo[1,2-b]isoquinolin-11(5h)-one
[0091]
该化合物的制备方法同实施例1,化合物结构式如下:
[0092][0093]
yellow solid,mp=118
–
119℃.1h nmr(400mhz,cdcl3)δ=8.89
–
8.86 (m,1h),8.59
–
8.56(m,1h),7.69
–
7.62(m,2h),7.38
–
7.30(m,2h),7.21
–
7.17(m, 1h),7.09
–
7.07(m,1h),3.84(s,3h),3.02(d,j=7.2hz,2h),1.78
–
1.68(m,3h), 1.66
–
1.42(m,6h),1.32
–
1.24(m,4h).13c nmr(100mhz,cdcl3)δ=159.66, 139.42,138.43,135.94,131.73,128.09,127.79,125.54,122.17,122.02,120.78, 119.50,117.02,106.52,90.98,41.16,34.32,33.65,31.95,28.21,26.36.hrms(esi) m/z calculated for c
24h26
n2ona[m
+
na]
+
381.1937,found 381.1940.
[0094]
实施例9
[0095]
2,2-difluoro-3-(5-isopropyl-11-oxo-5,11-dihydrobenzo[4,5]imidazo[1,2-b]isoquin olin-6-yl)propanoate
[0096]
该化合物的制备方法同实施例1,化合物结构式如下:
[0097][0098]
yellowsolid,mp=146
–
147℃1hnmr(400mhz,cdcl3)δ=8.99
–
8.97(m,1h),8.58
–
8.56(dd,j=1.6hz,j=8.0hz,1h),7.78
–
7.76(m,1h),7.69
–
7.65(m,1h),7.46
–
7.43(m,1h),7.39
–
7.34(m,2h),7.28
–
7.24(m,1h),5.25
–
5.15(m,1h),4.26
–
4.20(q,j=7.2hz,2h),3.97(t,j=16.0hz,2h),1.71(s,3h),1.69(s,3h),1.24
–
1.21(m,3h).13cnmr(100mhz,cdcl3)δ=164.52(t,j=32.0hz),159.91,142.04,139.69,138.55,132.86,132.29,129.27,127.86,125.13,122.73,121.73,121.35,119.44,117.40,112.89,111.23,80.31,77.32,77.00,76.68,63.29,49.97,31.68(t,j=24.0hz),20.41,13.76.19fnmr(376mhz,cdcl3)δ=-102.39.hrms(esi)m/zcalculatedforc
23h23
f2n2o3[m
+
h]
+
413.1671,found413.1666。
[0099]
实施例10
[0100]
2,2-difluoro-3-(1-methyl-5-oxo-2,3-diphenyl-1,5-dihydroimidazo[1,2-b]isoquinolin-10-yl)propanoate
[0101]
该化合物的制备方法同实施例1,化合物结构式如下:
[0102][0103]
yellowsolid,mp=74
–
75℃.1hnmr(400mhz,cdcl3)δ=8.41(dd,j=8.3hz,j=1.4hz,1h),7.71(d,j=8.6hz,1h),7.60(m,1h),7.34(dt,j=4.2hz,j=2.8hz,3h),7.32
–
7.28(m,2h),7.27(d,j=2.2hz,2h),7.25(m,2h),7.24
–
7.22(m,1h),7.21
–
7.18(m,1h),4.21
–
4.01(m,4h),3.69(s,3h),1.15(t,j=7.2hz,3h).13cnmr(100mhz,cdcl3)δ=164.53(t,j=45.0hz),156.77,141.30,137.84,133.41,131.49,131.05,130.88,130.34,129.12,128.61,128.15,127.56,127.00,121.59,120.96,120.84,118.07,115.60,79.38,63.15,35.12,30.32(t,j=24.0hz),13.64.19fnmr(376mhz,cdcl3)δ=-103.61hrms(esi)m/zcalculatedforc
29h24
f2n2o3na[m
+
na]
+
509.1647,found509.1652.
[0104]
实施例11
[0105]
2,2-difluoro-3-(1-methyl-5-oxo-1,5-dihydroimidazo[1,2-b]isoquinolin-10-yl)propanoate
[0106]
该化合物的制备方法同实施例1,化合物结构式如下:
[0107][0108]
yellowsolid,mp=243
–
244℃.1hnmr(400mhz,cdcl3)δ=8.46(m,1h),7.72
–
7.49(m,3h),7.28
–
7.20(m,1h),6.70(d,j=2.5hz,1h),4.16(q,j=7.1hz,2h),3.86(m,
5h),1.15(t,j=7.2hz,3h).13cnmr(100mhz,cdcl3)δ=164.24(t,j=18.0hz),157.36,139.08,137.90,131.38,127.71,123.66,121.33,121.04,115.93(t,j=287.0hz),112.70,106.60,79.65,64.73,38.88,29.95(t,j=24.0hz),14.35.19fnmr(376mhz,cdcl3)δ=-104.38(t,j=14.1hz,2f).hrms(esi)m/zcalculatedforc
17h17
f2n2o3[m
+
h]
+
335.1202,found335.1198.
[0109]
实施例12
[0110]
3-(2,3-bis(4-isopropylphenyl)-1-methyl-5-oxo-1,5-dihydroimidazo[1,2-b]isoquinolin-10-yl)-2,2-difluoropropanoate
[0111]
该化合物的制备方法同实施例1,化合物结构式如下:
[0112][0113]
yellowsolid,mp=60
–
61℃.1hnmr(400mhz,cdcl3)δ=8.42(d,j=8.4hz,1h),7.70(d,j=8.6hz,1h),7.63
–
7.54(m,1h),7.24
–
7.09(m,9h),4.18
–
4.03(m,4h),3.67(s,3h),2.89(td,j=6.9,4.0hz,2h),1.25(s,6h),1.23(s,6h),1.13(t,j=7.3hz,3h).13cnmr(100mhz,cdcl3)δ=172.71(t,j=35.0hz),164.63,158.25,149.80,147.77,141.42,137.82,133.42,131.42,130.97,130.84,128.26,127.69,126.63,125.10,124.95,121.44,120.93,118.05(t,j=239.0hz),79.26,63.13,35.25,33.82,33.74,30.42(t,j=32.0hz),23.80,23.73,13.65.19fnmr(376mhz,cdcl3)δ=-104.67(t,j=14.1hz,2f).hrms(esi)m/zcalculatedforc
35h37
f2n2o3[m
+
h]
+
571.2767,found571.2764.
[0114]
实施例13
[0115]
2,2-difluoro-3-(5-oxo-5h-thiazolo[3,2-b]isoquinolin-10-yl)propanoate
[0116]
该化合物的制备方法同实施例1,化合物结构式如下:
[0117][0118]
yellowsolid,mp=116
–
117℃.1hnmr(400mhz,cdcl3)δ=8.56(dd,j=8.3hz,j=1.5hz,1h),8.07(d,j=4.7hz,1h),7.78
–
7.72(m,1h),7.69(d,j=8.3hz,1h),7.48(t,j=7.6hz,1h),6.79(s,1h),4.26(q,j=7.0hz,2h),3.67(t,j=16.5hz,2h),1.24(t,j=14.6hz,3h).13cnmr(100mhz,cdcl3)δ=164.03(t,j=31.0hz),159.20,143.03,136.07,132.79,128.40,124.96,124.02,121.49,120.70,115.73(t,j=230.0hz),109.37,97.59,63.32,35.29(t,j=25.0hz),13.76.19fnmr(376mhz,cdcl3)δ=-102.35.hrms(esi)m/zcalculatedforc
16h14
f2no3s[m
+
h]
+
338.0657,found338.0655.
[0119]
实施例14
[0120]
2,2-difluoro-3-(13-oxo-13h-naphtho[1',2':4,5]thiazolo[3,2-b]
isoquinolin-8-yl)propanoate
[0121]
该化合物的制备方法同实施例1,化合物结构式如下:
[0122][0123]
yellowsolid,mp=202
–
203℃.1hnmr(400mhz,cdcl3)δ=9.31(d,j=9.2hz,1h),8.61(dd,j=8.1hz,j=1.4hz,1h),7.95
–
7.86(m,2h),7.85
–
7.80(m,1h),7.76(m,1h),7.69
–
7.64(m,1h),7.59(m,1h),7.54
–
7.48(m,1h),7.42
–
7.39(m,1h).,4.28(q,j=7.2hz,2h),3.71(t,j=16.6hz,2h),1.26(t,j=7.1hz,3h).13cnmr(100mhz,cdcl3)δ=164.01(t,j=32.0hz),161.56,150.43,147.99,146.38,142.28,136.53,135.15,134.37,132.73,131.34,129.76,128.54,128.43,127.11,126.91,126.34,125.99,125.32,123.78,122.83,121.89,121.49,121.30,118.35,115.48(t,j=251.0hz),99.88,98.69,63.34,35.34(t,j=25.0hz),13.81.19fnmr(376mhz,cdcl3)δ=-102.23(t,j=17.1hz,2f).hrms(esi)m/zcalculatedforc
24h17
f2no3sna[m
+
na]
+
460.0789,found460.0785.
[0124]
实施例15
[0125]
2,2-difluoro-3-(11-oxo-11h-benzo[4,5]oxazolo[3,2-b]isoquinolin-6-yl)propanoate
[0126]
该化合物的制备方法同实施例1,化合物结构式如下:
[0127][0128]
yellowsolid,mp=228
–
229℃.1hnmr(400mhz,cdcl3)δ=8.54
–
8.50(m,2h),7.75
–
7.69(m,2h),7.46
–
7.42(m,1h),7.41
–
7.34(m,3h),4.29
–
4.23(q,j=7.2hz,2h),3.79
–
3.72(m,2h),1.27
–
1.24(m,3h).13cnmr(100mhz,cdcl3)δ=164.08(t,j=32.0hz),158.67,149.17,146.97,136.99,132.93,128.11,127.84,126.27,124.51,124.41,122.47,121.82,117.55,116.48,115.44,115.03,109.94,82.71,77.32,77.00,76.68,63.14,29.87(t,j=25.0hz),13.80.19fnmr(376mhz,cdcl3)δ=-103.98(t,j=16.6hz,2f).hrms(esi)m/zcalculatedforc
20h15
f2no4na[m
+
na]
+
394.0861,found394.0856.
[0129]
实施例16
[0130]
rearrangementproductderivedfromketoconazole
[0131]
该化合物的制备方法同实施例1,化合物结构式如下:
[0132]
[0133]
pink solid,mp=115
–
116℃.1h nmr(400mhz,cdcl3)δ=8.50(d,j= 8.2hz,1h),7.79(d,j=2.9hz,1h),7.71(d,j=8.4hz,1h),7.66(d,j=8.3hz,1h), 7.57(t,j=7.4hz,1h),7.52(d,j=2.3hz,1h),7.39
–
7.33(m,1h),7.02(d,j=2.9 hz,1h),6.87(td,j=9.0hz,j=8.5hz,j=4.6hz,1h),6.62(s,2h),6.26(s,2h), 4.80(s,2h),4.32(p,j=5.8hz,2h),4.13(q,j=7.1hz,3h),3.86
–
3.70(m,4h), 3.59(q,j=7.6hz,j=6.1hz,4h),3.01(d,j=5.6hz,2h),2.96(t,j=5.2hz,2h), 2.14(d,j=3.5hz,3h),1.11(t,j=7.1hz,3h).13c nmr(100mhz,cdcl3)δ= 169.42,164.46(t,j=32.0hz),156.44,152.30,145.45,139.06,138.11,136.19, 134.36,132.95,131.54,131.47,129.56,127.76,127.39,125.15,121.54,118.57(t,j= 224.0hz),114.47,109.15,106.57,80.85,74.62,67.70,67.02,63.09,51.51,50.87, 50.53,46.32,41.42,29.92(t,j=23.0hz),21.35,3.64.19f nmr(376mhz,cdcl3) δ=-103.05,-104.77.hrms(esi)m/z calculated for c
39h38
f2cl2n4o7na[m
+
na]
+ 805.1979,found 805.1985.
[0134]
实施例17
[0135]
rearrangement product derived fromadapalene
[0136]
该化合物的制备方法同实施例1,化合物结构式如下:
[0137][0138]
yellow solid,mp=218
–
219℃.1h nmr(400mhz,cdcl3)δ=8.81(d,j= 7.8hz,1h),8.61(d,j=1.6hz,1h),8.52(dd,j=8.3hz,j=1.6hz,1h),8.07
–ꢀ
7.93(m,4h),7.84(dd,j=8.6hz,j=1.8hz,1h),7.69
–
7.61(m,2h),7.59
–
7.49 (m,2h),7.36
–
7.25(m,2h),7.15(t,j=7.6hz,1h),6.99(t,j=7.9hz,2h),4.60(t, j=11.9hz,2h),3.86(d,j=34.5hz,8h),2.20(d,j=3.0hz,6h),2.16
–
2.06(m, 3h),1.81(t,j=3.1hz,6h).13c nmr(100mhz,cdcl3)δ=165.45,159.67, 159.01,141.88,140.88,139.02,138.24,136.22,135.17,132.22,132.09,131.29, 131.10,129.77,128.55,127.79,127.61,126.78,125.94,125.74,125.66,125.43, 125.20,124.70,122.49,121.36,121.16,119.14,116.96,112.07,106.69,81.03,64.10 (t,j=39.0hz),55.13,40.54,37.17,37.06,32.74,29.04.19f nmr(376mhz,cdcl3) δ=-101.53.hrms(esi)m/z calculated for c
47h43
f2n2o4[m
+
h]
+
737.3185, found737.3181.
[0139]
实施例18
[0140]
3-(5a,6-diazido-5-methyl-11-oxo-5,5a,6,11-tetrahydrobenzo[4,5]imidazo[1,2-b]is oquinolin-6-yl)-2,2-difluoropropanoate
[0141]
该化合物的制备方法同实施例1,化合物结构式如下:
[0142]
[0143]
colorless liquid.1h nmr(400mhz,cdcl3)δ=7.96(dt,j=7.6hz,j=1.0 hz,1h),7.82
–
7.70(m,3h),7.61(td,j=7.4hz,j=1.1hz,1h),7.32
–
7.25(m, 3h),4.25(p,j=7.1hz,2h),3.85(ddd,j=20.4hz,j=15.4hz,j=9.6hz,1h), 3.66(s,3h),3.48(ddd,j=16.5hz,j=15.3hz,j=9.8hz,1h),1.32(t,j=7.2hz, 3h).13c nmr(100mhz,cdcl3)δ=168.42,163.32(t,j=32.0hz),148.97, 148.86,141.49136.67,135.05,130.40,124.51,124.17,123.60,122.63,120.01, 113.84(t,j=250.0hz),109.57,99.85,82.93,82.90,82.87,82.83,63.42,43.25(t,j= 25.0hz),31.39,26.85,13.73.19f nmr(376mhz,cdcl3)δ=-102.17(d,j= 991.7hz,2f).hrms(esi)m/z calculated for c
21h19
f2n8o3[m
+
h]
+
469.1527,found 469.1538.
[0144]
实施例19
[0145]
2,2-difluoro-3-(5-methyl-11-oxo-5,11-dihydrobenzo[4,5]imidazo[1,2-b]isoquinoli n-6-yl)propanoate-3,3-d2
[0146]
该化合物的制备方法同实施例1,化合物结构式如下:
[0147][0148]
pale yellow solid.1h nmr(400mhz,cdcl3)δ=8.84(d,j=8.0hz,1h), 8.65
–
8.43(m,1h),7.62(d,j=4.0hz,2h),7.37(t,j=7.7hz,1h),7.31(dt,j=8.1 hz,j=3.9hz,1h),7.21(t,j=7.8hz,1h),7.10(d,j=8.0hz,1h),4.17(q,j=7.2 hz,2h),3.88(s,3.44h),1.17(t,j=7.2hz,3h).
[0149]
实验过程中,为了进一步确定目标化合物的结构,我们分别选取实施例1、实施例7及实施例15制备的化合物培养了其单晶,通过x射线衍射分析确定了其结构,数据如表1~3所示。
[0150]
表1实施例1化合物的晶体数据和结构细化
[0151][0152][0153]
表2实施例7化合物的晶体数据和结构细化
[0154][0155][0156]
表3实施例15化合物的晶体数据和结构细化
[0157][0158][0159]
上面对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1