一种VAT1L蛋白片段及其在人源包虫病中的应用的制作方法
一种vat1l蛋白片段及其在人源包虫病中的应用
技术领域
1.本发明涉及免疫医学领域,特别涉及一种vat1l蛋白片段、重组蛋白或其突变、核酸序列及其在检测或治疗人源包虫病中的应用。
背景技术:
2.包虫病又名棘球蚴病,是一种人畜共患病,在中国中西部地区(西藏、青海、四川、新疆等地)感染尤其严重。人源包虫病主要分为囊型包虫病和泡型包虫病。影像学检测是最直观最常用的包虫病诊断方法,但是由于包虫病的潜伏期较长,并且只有在包虫病形成的包囊大到一定程度时才能够通过影像学检测到,所以血清学检测是影像学诊断包虫病的重要辅助手段之一。目前,可以被用来诊断包虫病的血清学诊断抗原主要有抗原b(antigen b)和抗原5(antigen 5)以及与这两种抗原相关的一些重组抗原。
3.迄今为止,已经描述了几种用于包虫病实验室诊断的方法,包括抗体,抗原和细胞因子的检测。其中,抗体检测的发展主要依赖于包虫抗原种类的发展。但是不论天然纯化抗原还是重组纯化抗原,均在特异性和/或敏感性方面有一定的不足。更为重要的是人源包虫病因涉及到取样困难、分离包虫蛋白困难等因素,一直没有出现更多的可用于血清学检测的抗原。
4.现有技术中开发针对包虫抗原的抗体的困难如下:
5.1)从包虫病人术后分离的包虫囊中提取包虫蛋白并鉴定,本身是一个技术难点。如果鉴定到的包虫蛋白本身种类就很少,想从中选取可能作为包虫抗原的蛋白将更加困难。
6.2)单一抗原种类少。目前最广泛应用的包虫病诊断抗原是抗原b和抗原5,许多研究表明这两种抗原在血清检测时会产生一定的假阳性或假阴性。
7.3)商品化包虫抗原是天然纯化抗原,分离纯化自细粒棘球蚴破碎后的可溶性抗原片段,是一种包含多种包虫蛋白的混合物。混合的蛋白越多越容易在血清检测时产生更多假阴性或假阳性的结果。
技术实现要素:
8.为解决现有技术中开发针对包虫抗原的抗体的困难,本发明提供了一种vat1l蛋白片段及其在人源包虫病中的应用。本发明通过寻找更多可以用来诊断包虫病的抗原,扩充包虫抗原数据库,使这些抗原或单一或组合都有可能提升实验室诊断包虫病的特异性和灵敏性,还产生从包虫病人术后分离的包虫囊中提取更多包虫蛋白并鉴定的成熟实验流程。
9.为解决上述技术问题,本发明的方案之一提供了一种多肽,其中,所述多肽包含如seq id no:1、seq id no:2、seq id no:3、seq id no:4和seq id no:5所示的氨基酸序列的一种或多种。
10.为解决上述技术问题,本发明的方案之二提供了一种重组蛋白或其突变,其中,所
述重组蛋白包含如seq id no:6所示的氨基酸序列;所述突变的氨基酸序列与所述重组蛋白的氨基酸序列具有至少80%、85%、90%、95%、98%、99%的同一性,并维持所述重组蛋白的功能。
11.为解决上述技术问题,本发明的方案之三提供了一种分离的核酸,其中,所述分离的核酸编码如本发明的方案之一所述的多肽或发明的方案之二所述的重组蛋白或其突变。优选地,编码如发明的方案之二所述的重组蛋白的核苷酸序列如seq id no:7所示。
12.为解决上述技术问题,本发明的方案之四提供了一种重组表达载体,其中,所述重组表达载体包含如本发明的方案之三所述的分离的核酸。
13.为解决上述技术问题,本发明的方案之五提供了一种转化体,其中,其包含如本发明的方案之三所述的分离的核酸或如本发明的方案之四所述的重组表达载体,其中,所述转化体为细菌或真核细胞。优选地,所述细菌为e.coli bl21。更优选地,所述转化体表达如seq id no:1~6所示的氨基酸序列。
14.为解决上述技术问题,本发明的方案之六提供了一种用于检测包虫病的试剂盒,所述试剂盒包括如本发明的方案之一所述的多肽或本发明的方案之二所述的重组蛋白或其突变。
15.优选地,所述试剂盒为间接elisa检测试剂盒。
16.更优选地,所述间接elisa检测试剂盒还包括第二抗体、包被液、洗液、显色液、终止液和稀释液。
17.为解决上述技术问题,本发明的方案之七提供了一种标志物组合,其中,所述标志物组合包括如本发明的方案之一所述的多肽或本发明的方案之二所述的重组蛋白或其突变。
18.在优选的实施例中,所述标志物组合还包括egr、抗原b和抗原5中的一种或多种。
19.为解决上述技术问题,本发明的方案之八提供了一种抗包虫病的sirna或mrna疫苗,其中,所述sirna或mrna疫苗包含与编码如本发明的方案之一所述的多肽或本发明的方案之二所述的重组蛋白或其突变的核苷酸序列互补的rna序列。
20.为解决上述技术问题,本发明的方案之九提供了一种生产如本发明的方案之一所述的多肽或本发明的方案之二所述的重组蛋白或其突变的方法,其中,所述方法包括以下步骤:将如本发明的方案之五所述的转化体培养于适合其发酵的条件下,使其表达所述多肽或重组蛋白或其突变。
21.为解决上述技术问题,本发明的方案之十提供了一种如本发明的方案之一所述的多肽或本发明的方案之二所述的重组蛋白或其突变或本发明的方案之七所述标志物组合在制备抗包虫病抗体或在诊断细粒棘球蚴所致疾病的诊断剂中的应用。
22.在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
23.本发明所用试剂和原料均市售可得。
24.本发明的积极进步效果在于:
25.(1)找到了一个包虫新抗原vat1l,可以用来制作elisa试剂盒并用于临床检测人源包虫病,并可以与egr抗原作为互相补充。
26.(2)此包虫新抗原可大量纯化,方便大规模筛选人源包虫病。
附图说明
27.图1为五个囊液组分提取到的全蛋白的sds-page和western blotting结果展示。左图是以no.1病人血清作为一抗、五个囊液组分作为抗原的wb结果展示。中图是以正常西藏人血清作为一抗、五个囊液组分作为抗原的wb结果展示。右图是五个囊液组分的蛋白凝胶结果展示。实验证明,囊液全蛋白对病人血清存在强烈的免疫反应,而对正常西藏人血清基本无反应,且绝大部分引起免疫反应的蛋白条带不是高丰度蛋白条带。
28.图2为vat1l重组蛋白的纯化结果展示。图中所示为vat1l重组蛋白的梯度洗脱结果,每个泳道上样量均为10μl。每个泳道依次分别指的是超声后菌体全蛋白、镍柱上样后的流穿、20mm咪唑至1m咪唑洗脱梯度。
29.图3为纯化后vat1l重组蛋白的wb验证实验结果展示。数字1-9指9个在进行包虫囊摘除术前取的病人血清。control指未患病的正常西藏人血清。egr_sds-page是指商品化抗原egr的蛋白凝胶结果展示,箭头所指蛋白条带为antigen b。
30.图4为elisa实验结果展示。vat1l_od(+)和egr_od(+)指的是607例b超阳性血浆的od值,vat1l_od(-)和egr_od(-)指的是636例正常人血浆的od值。
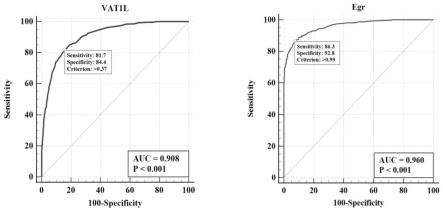
31.图5为vat1l重组蛋白和商品化抗原egr的roc曲线。左图为vat1l的roc曲线,criterion是指vat1l对血清检测时,大于0.37是阳性(患包虫病),小于等于0.37是阴性(未患包虫病)。右图为egr的roc曲线,criterion是指egr对血清检测时,大于0.99是阳性(患包虫病),小于等于0.99是阴性(未患包虫病)。
具体实施方式
32.下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
33.实施例一包虫病人术后分离的包虫囊鉴定到更多包虫蛋白的过程
34.1.首先将10个包虫病人术后分离的包虫囊根据其组织结构分为四部分提取蛋白,由内向外分别是原头蚴、囊液、生发层和角皮层;又根据其是否处于活性期,将10个包虫囊分为活性包虫囊组和非活性包虫囊组。
35.2.每个包虫囊的四个组分均进行了蛋白提取,并将提取的蛋白进行液态酶解,随后使用qe质谱仪进行lc-ms/ms鉴定;
36.3.qe下机的原始数据使用maxquant蛋白鉴定软件,使用人和包虫蛋白数据库合集,进行包虫蛋白质鉴定,统计鉴定结果并确定包虫蛋白含量多的包虫囊部分,结果如表1和表2所示;
37.由表1和表2可知,有两点基本结论:一是鉴定到包虫蛋白更多的组织部分是囊液和原头蚴这两个部分;二是只有活性包虫囊组的囊液和原头蚴部分提取的蛋白中包含有更多的包虫蛋白。
38.表1活性包虫囊组的蛋白质鉴定结果
[0039][0040][0041]
_1表示原头蚴;_2表示囊液;_3表示生发层;_4表示角皮层。
[0042]
表2非活性包虫囊组的蛋白质鉴定结果
[0043][0044]
_1表示原头蚴;_2表示囊液;_3表示生发层;_4表示角皮层
[0045]
实施例二western blot验证、切胶酶解并质谱鉴定(gelc-ms/ms)
[0046]
1.接下来,根据10个样本的囊液和原头蚴的qe鉴定结果,选取no.1-no.5五个活性包虫囊组的原头蚴和囊液组分分别进行与病人血清的wb实验,以便验证包虫病人和正常西藏人血清与提取的全蛋白之间是否有免疫反应。
[0047]
2.因部分样本的原头蚴组分提取到的蛋白总量很少,故主要进行了囊液组分蛋白的western blotting实验,结果如图1所示,以no.1病人血清为例展示,包虫病人和正常西藏人血清与5个囊液组分蛋白的免疫反应图谱。其他病人血清和正常西藏人血清对5个样本蛋白的免疫反应图谱均与no.1病人相似。
[0048]
3.又根据这5个囊液组分的sds-page图谱,对照wb的免疫条带对sds-page胶进行了切胶酶解,以期能够通过切胶分离鉴定到相应分子量区段里的更多包虫蛋白,增加找到与血清发生免疫反应的包虫抗原的几率。另外,这样可以减少高丰度蛋白对鉴定的影响。
[0049]
4.为了减少损失和减轻工作量,我们统一将5个囊液组分蛋白根据wb免疫条带分成了10个组分,随后各组分分别进行了胶内酶解。
[0050]
5.经过qe-hf-x质谱仪的lc-ms/ms分析后,maxquant软件使用与实施例一中相同的数据库进行了蛋白搜库鉴定。结果如表3所示。
[0051]
6.通过数据分析可知,1_2、2_2和5_2这三个样本切胶分离所鉴定到的包虫蛋白包含了其余四个样本所鉴定到的包虫蛋白,所以,后续包虫抗原的候选从这三个样本各组分共同鉴定到的包虫蛋白中寻找。
[0052]
表3五个囊液组分切胶酶解的蛋白质鉴定结果
[0053][0054]
括号中的数字表示总鉴定出的蛋白质,而括号外的数字表示每个组分中的包虫蛋白。_2表示囊液。
[0055]
实施例三筛选作为候选抗原的包虫蛋白
[0056]
1.同一组分在三个样本中鉴定到的共同蛋白作为候选抗原库,最终10个组分一共产生了93个唯一蛋白。
[0057]
2.这93个蛋白首先与人的蛋白数据库进行同源比对,删除同源性大于20%的蛋白或蛋白片段和已经被选为包虫抗原的那些蛋白后,剩余的蛋白进行b细胞抗原表位的预测。
[0058]
实施例四抗原表位预测以及重组质粒构建
[0059]
1.抗原表位预测使用了一个在线预测工具http://tools.iedb.org/bcell/,将蛋
白质序列导入,选择bepipred linear epitope prediction 2.0预测方法,即可得到关于此蛋白可能成为抗原表位的序列列表。
[0060]
2.根据每一个候选蛋白的抗原表位列表,选取包含一个或多个表位的序列片段组成重组蛋白的序列,并且将此序列导入比对工具中与人的蛋白质数据库进行比对,只有与人的蛋白相似度≤20%的序列片段才被选为构建重组蛋白。
[0061]
3.最终14个蛋白序列片段通过分子克隆技术插入到pet-30a(+)质粒中构建重组质粒,并通过测序确认片段已被插入。
[0062]
实施例五重组蛋白的表达与纯化
[0063]
1.重组质粒转入bl21(de3)中进行小量试表达,确认蛋白可以表达且分子量正确后,再进行扩培。
[0064]
2.收集的菌液经过超声提取蛋白后,再通过质粒携带的his-tag进行镍柱纯化,图2展示了本发明vat1l片段构建的重组蛋白的纯化结果。
[0065]
实施例六vat1l重组蛋白的western blotting验证
[0066]
1.14个重组蛋白中有8个表达成功,因此纯化后的8种重组蛋白均分别与9个术后病人血清进行了western blotting实验,结果显示只有4个重组蛋白与病人血清免疫反应较大,其中包含vat1l重组蛋白,后续使用vat1l重组蛋白作为包虫抗原候选进行更多病人血清的elisa验证试验。
[0067]
2.图3展示了vat1l重组蛋白和商品化抗原egr(产品名称:包虫纯化抗原echinococcus granulosus,货号:ym-vi08,供应商:杭州亿米诺生物科技有限公司)与9个病人血清的wb实验结果,结果表明,vat1l重组蛋白的免疫反应率为56%,商品化抗原egr的免疫反应率为67%(只统计43kd和34kd之间有明显条带的样本),vat1l重组蛋白检测出了1号阳性患者,而egr未检出。表4展示了vat1l重组蛋白的b细胞抗原表位、核苷酸序列和氨基酸序列。
[0068]
表4 vat1l重组蛋白的b细胞抗原表位、核苷酸序列和氨基酸序列
[0069][0070]
实施例七一种包虫重组抗原vat1l重组蛋白的elisa实验验证
[0071]
所检测的对象为607例b超阳性血浆(含疑似)和636例正常人血浆(确定为阴性),按照间接elisa的标准操作步骤进行实施,结果显示vat1l重组蛋白阳性检出率为82%,阴性检出率为84%;而用商品化抗原egr检测相同的血浆时阳性检出率为86%,阴性检出率为92%。
[0072]
1.elisa实验具体操作步骤
[0073]
(1)抗原定量:每种抗原在包被前均使用移液枪吹匀,并使用微量紫外分光光度计给抗原定量,以确保蛋白未降解。在a280处无吸收峰,则说明抗原量很低不宜用于包被;若蛋白析出或有不溶,则滴加8m尿素后吹匀,离心取上清测浓度。
[0074]
(2)包被:对比抗原管壁浓度及测量值,就低取值;包被量为2μg/ml、10ml/板,按照实际使用量配制包被抗原量;包被的elisa板上标记:抗原编号、名称、标签、包被日期及板子编号等,若包被浓度不是2μg/ml则需要标明包被浓度。标记完elisa板后,加入包被抗原,100μl/孔,4℃包被过夜或37℃包被2h。
[0075]
(3)洗板:包被完的板子,用洗板机洗板1次,于吸水纸上拍干。50
×
洗液配方为:154.4g的tris;149.0g的nacl;24.0ml的tween-20;800ml纯水;约45ml浓盐酸调ph7.2,纯水定容到1000ml。4℃保存。
[0076]
(4)封闭:2%脱脂奶粉作为封闭液进行封闭,200μl/孔,4℃封闭过夜或37℃封闭2h。
[0077]
(5)洗板:封闭完的板子,用洗板机洗板1次,于吸水纸上拍干。
[0078]
(6)加一抗:加入血浆样本,使用pbs按照体积比1:500稀释血浆,37℃孵育1h。
[0079]
(7)洗板:用洗板机洗板3次以上,于吸水纸上拍干。
[0080]
(8)加二抗(厂商:碧云天;货号:a0201):因一抗来源为人的血浆,故二抗使用山羊抗人1:500加入,37℃孵育1h。
[0081]
(9)洗板:用洗板机洗板3次以上,于吸水纸上拍干。洗板同时,配制好显色液(tmb)。
[0082]
(10)显色:准备好终止液后,加入显色液100μl/孔,可以晃动板子加速显色过程并注意密切观察。
[0083]
(11)tmb显色:显色到4min时(一般不能让空白和阴性显色太高),加入50μl/孔终止液,加入终止液后需要静置10min,使终止彻底、颜色均一(可以晃动板子加速终止过程),终止后读数
[0084]
(12)读数:酶标仪必须预热30min以上;tmb显色检测波长为:450nm。打开相应的酶标仪测量软件,读数。将数据存储到指定位置并完善数据。
[0085]
(13)注意事项:
[0086]
96孔板用枪加样时,注意避免产生气泡,并且避免所加样品挂壁。
[0087]
加完样,整板观察,要求孔底无气泡;发现气泡时,震荡板子或用枪头去除气泡。
[0088]
洗板时需密切关注,确保洗板完全、彻底。
[0089]
显色时需密切关注,结合阴性、空白、阳性对照的显色情况,及时终止。
[0090]
(14)各种试剂配方
[0091]
包被液:碳酸钠-碳酸氢钠缓冲液,ph9.6:na2co
3 1.59g,nahco
3 2.93g,纯水定容至1000ml;最后用ph试纸检测ph值。4℃保存。
[0092]
2.elisa结果分析
[0093]
(1)阴阳性判断标准:选取阴性血清样本的平均值(x),标准差(sd),其置信区间上限cut-off值为x+2sd。待测样本在450nm处的od值大于等于x+2sd可判为阳性,小于x+2sd可判为阴性。
[0094]
(2)roc曲线:使用medcalc软件(版本19.4.0)绘制roc曲线(receiver operating characteristic curve)评估抗原的最优检测效力。
[0095]
(3)通过计算,使用本发明的包虫抗原免疫607例b超阳性血浆(含疑似)和636例正常人血浆(确定为阴性),其敏感性为82%,特异性为84%;而用商品化抗原egr检测相同的血浆时敏感性为86%,特异性为92%。图4展示了vat1l重组蛋白和商品化抗原egr的检测od值的箱型图。
[0096]
(4)图5展示了vat1l重组蛋白和商品化抗原egr的roc曲线。虽然vat1l重组蛋白的特异性低于商品化抗原egr的特异性,但是vat1l重组蛋白敏感性与商品化抗原egr基本持平,且经过medcalc软件的逻辑回归模拟vat1l重组抗原和商品化抗原egr的双特征roc曲线得知,两种抗原一起的检测效力非常好。说明vat1l重组抗原很可能可以作为商品化抗原的补充,对未被商品化抗原检测出阳性的样本进行再检测,所以vat1l重组蛋白可以作为包虫新抗原候选。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1