一种大肠杆菌益生菌EcN无抗生素高效稳定表达体系构建与应用
一种大肠杆菌益生菌ecn无抗生素高效稳定表达体系构建与应用
技术领域
1.本发明涉及一种大肠杆菌益生菌ecn无抗生素高效稳定表达体系构建与应用,属于基因工程技术领域。
背景技术:
2.大肠杆菌(escherichia coli)是一种革兰氏阴性、兼性厌氧菌,是目前应用最广泛的表达宿主。它具有遗传背景清晰、基因编辑改造效率高且操作简单、培养成本低和生长周期短等优势。大肠杆菌表达系统中最为主要的元件是质粒载体,即可以独立于基因组之外复制的环状dna元件。相比于基因组整合,质粒作为表达载体操作简单,可以根据目的基因的表达需求去选择不同拷贝数的质粒。此外,可以同时使用几个质粒,实现多个目的基因同时高效地表达或是复杂合成生物学模块的构建。目前,大部分质粒都是通过抗性筛选标记维持分离稳定性,然而在工业生产中,抗生素的使用不仅会造成耐药菌的出现,对环境带来影响,而且工厂在处理培养基和废液时需要额外地消除抗生素。鉴于质粒的局限性,很多需要在细菌中稳定且避免抗生素污染表达的产物直接整合到基因组上表达,但是基因组整合需要的程序一般比较复杂,耗时较长,且基因组整合拷贝数低,难以实现基因的高效表达,因此,工业上对无抗生素质粒系统的需求很大。
3.大肠杆菌nissle 1917(ecn)血清型为o6:k5:h1,最初是由德国医生alfred nissle从一名士兵的粪便中分离出来,该士兵在志贺氏菌引起的腹泻病爆发期间未受到感染,在这之后,ecn开始被用作非处方益生菌,在欧洲以商品名“mutaflor”销售。ecn拥有两个隐性质粒pmut1和pmut2,其中pmut1大小为3173bp,ncbi登录号为mw240712;pmut2大小为5514bp,ncbi登录号为cp023342。这两个隐性质粒均具有多个拷贝且天然在ecn中稳定存在,隐性质粒的开发有望取代传统抗生素维持的质粒。因此,基于生物安全性益生菌ecn构建新型无抗生素表达平台具有重要的意义。
技术实现要素:
4.发明人根据目前对于隐性质粒pmut1和pmut2结构的预测结果,从中筛选出一些元件,并采用截短相关元件的方式,以期能够获得稳定性、表达量较好的质粒,从而能够实现外源基因在大肠杆菌中无抗性且稳定的表达。在对pmut1截短hth、rnai、hyp1或hyp2元件,或者对pmut2截短duf、toxin或toxin-antitoxin元件后,均导致会质粒的分离稳定性或是结构稳定性降低,使得质粒在不添加抗生素的情况下更易丢失或是质粒发生突变,这也说明上述元件对于质粒的维持以及功能具有重要的作用。而在pmut1上截短了rop和/或nika元件,或者在pmut2上截短了mobb、mobc、mobd和/或hyp元件时,质粒仍可维持较好的稳定性。
5.本发明的第一个目的是提供能够在大肠杆菌中稳定表达的质粒,所述质粒是截去了pmut1质粒上的rop、nika或同时截去了rop和nika;或者,所述质粒是从pmut2质粒上截去
mobb、mobc、mobd、hyp任意一个或同时截去mobb、mobc、mobd和hyp。
6.在一种实施方式中,所述元件rop、nika、mobb、mobc、mobd、hyp的序列分别如seq id no.2、seq id no.1、seq id no.7、seq id no.8、seq id no.9、seq id no.10所示。
7.在一种实施方式中,所述质粒上还含有抗性筛选标记、营养缺陷型标记或必需互补基因等。
8.优选地,在以pmut1质粒为出发质粒时,将抗性筛选标记、营养缺陷型标记、必需互补基因整合至质粒上元件hth与nika之间;在以pmut2质粒为出发质粒时,将抗性筛选标记、营养缺陷型标记或必需互补基因整合至质粒上元件mobc与duf之间。
9.本发明的第二个目的是提供含有所述质粒的重组大肠杆菌。
10.在一种实施方式中,以大肠杆菌ecn及其衍生菌株作为出发菌株。
11.优选地,将所述大肠杆菌ecn中的pmut1质粒或pmut2质粒敲除,或同时敲除pmut1质粒和pmut2质粒。
12.更优选地,当表达截短的pmut1质粒时,将大肠杆菌ecn中的pmut1质粒敲除,或是同时敲除pmut1质粒和pmut2质粒;
13.或者,当表达截短的pmut2质粒时,将大肠杆菌ecn中的pmut2质粒敲除,或是同时敲除pmut1质粒和pmut2质粒;
14.或者,表达截短的pmut1质粒和pmut2质粒时,同时敲除pmut1质粒和pmut2质粒;
15.在大肠杆菌ecn中同时敲除pmut1质粒和pmut2质粒相对于仅敲除pmut1质粒或仅敲除pmut2质粒,在目的蛋白的表达效果方面没有差异。
16.本发明的第三个目的是提供一种在大肠杆菌中稳定表达目的蛋白或代谢产物的方法,所述方法是在所述质粒上连接目的蛋白的编码基因或代谢产物相关的基因构建得到重组质粒,再将重组质粒转入大肠杆菌或其衍生菌株中得到重组大肠杆菌,将重组大肠杆菌在不添加抗生素的体系中培养以实现目的蛋白的表达。
17.优选地,在以pmut1质粒为出发质粒时,将目的蛋白的编码基因整合至质粒上元件hth与nika之间;在以pmut2质粒为出发质粒时,将目的蛋白的编码基因整合至质粒上元件mobc与duf之间。
18.在一种实施方式中,在大肠杆菌培养基中培养所述重组大肠杆菌获得种子液,再将种子液接种至不含抗生素的大肠杆菌培养基中,在37℃下发酵生产目的蛋白。
19.在一种实施方式中,以大肠杆菌ecn及其衍生菌株作为宿主。
20.优选地,将所述大肠杆菌ecn中的pmut1质粒或pmut2质粒敲除,或同时敲除pmut1质粒和pmut2质粒。
21.更优选地,当表达截短的pmut1质粒时,将大肠杆菌ecn中的pmut1质粒敲除,或是同时敲除pmut1质粒和pmut2质粒;
22.或者,当表达截短的pmut2质粒时,将大肠杆菌ecn中的pmut2质粒敲除,或是同时敲除pmut1质粒和pmut2质粒;
23.或者,表达截短的pmut1质粒和pmut2质粒时,同时敲除pmut1质粒和pmut2质粒。
24.在一种实施方式中,所述目的蛋白包括绿色荧光蛋白或肝素裂解酶ⅲ。
25.优选地,所述肝素裂解酶ⅲ来源于多形拟杆菌(bacteroides thetaiotaomicron)。
26.本发明的有益效果:
27.本发明首先对ecn隐性质粒pmut1和pmut2质粒上的元件进行预测,获得了一系列元件。本发明通过截短隐性质粒的一个或多个元件,得到pmut1衍生质粒pmut1
’‑
del-rop、pmut1
’‑
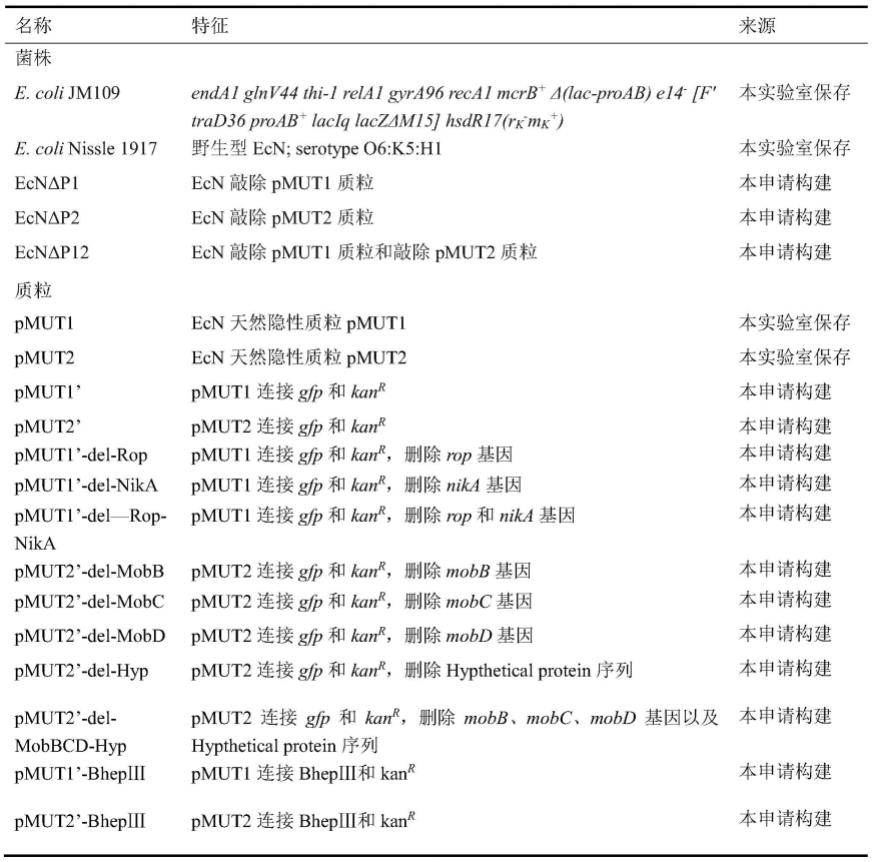
del-nika、pmut1
’‑
del-rop-nika以及pmut2衍生质粒pmut2
’‑
del-mobb、pmut2
’‑
del-mobc、pmut2
’‑
del-mobd和pmut2
’‑
del-hyp、pmut2
’‑
del-mobbcd-hyp。将这些质粒导入e.coli nissle 1917衍生菌株中,在不含抗生素的条件中培养,可使质粒在宿主细胞中的稳定存在,且实现质粒上目的蛋白的稳定表达,可以稳定维持6.5~13天。
附图说明
28.图1为隐性质粒pmut1预测图谱。
29.图2为隐性质粒pmut2预测图谱。
30.图3为pmut1衍生质粒分离稳定性测定。图a-d分别为pmut1’、pmut1
’‑
del-rop、pmut1
’‑
del-nika和pmut1
’‑
del-rop-nika的质粒分离稳定性分析。
31.图4为pmut2衍生质粒分离稳定性测定。图a-f分别为pmut2’、pmut2
’‑
del-mobb、pmut2
’‑
del-mobc、pmut2
’‑
del-mobd、pmut2
’‑
del-hyp和pmut2
’‑
del-mobbcd-hyp的质粒分离稳定性分析。
32.图5为pmut1衍生质粒蛋白表达强度测定。
33.图6为pmut1衍生质粒蛋白表达强度测定。
34.图7为隐性质粒衍生质粒应用于bhepⅲ的表达。
具体实施方式
35.(一)菌株及载体
36.本发明涉及到的菌株以及质粒见表1
37.表1.本发明所用菌株和质粒
[0038][0039]
(二)酶类及其他生化试剂
[0040]
primestar max dna聚合酶购于宝日医生物技术(北京)有限公司。质粒提取试剂盒、卡那霉素购于生工生物工程(上海)有限公司;蛋白胨(tryptone)、酵母提取物(yeast extract)购于英国oxoid公司,其余试剂为国产分析纯。
[0041]
(三)引物
[0042]
本发明所用引物均在苏州安升达有限公司合成,序列见表2。
[0043]
表2.本发明所用引物
[0044][0045][0046]
(四)培养基
[0047]
lb培养基(g/l):酵母粉5.0,蛋白胨10.0,nacl 10.0,ph 7.0;固体培养基含20.0g/l琼脂;筛选e.coli克隆或者液体培养时,根据需要在培养基中添加终浓度为50μg/ml卡那霉素。
[0048]
大肠杆菌采用lb液体或固体培养基(按需要添加相应的抗生素)在37℃培养12h,液体培养转速为220rpm。
[0049]
以下实施例中未作具体说明的分子生物学实验方法,均参照《分子克隆实验指南》
(第三版)j.萨姆布鲁克一书中所列的具体方法进行,或者按照试剂盒和产品说明书进行。
[0050]
(五)bhepⅲ酶活测定
[0051]
取1.5ml菌液,在12000rpm,4℃条件下离心5分钟,用20mm tris-hcl(ph 7.4)洗涤两次并用等量的tris-hcl将菌液重悬。将重悬的细胞置于冰上进行超声破壁处理,然后在4℃,12000rpm的条件下离心15分钟。离心后的上清液即为粗酶液,将40μl粗酶液加入到960μl预热的肝素钠底物溶液中(20mm tris-hcl,20mg
·
ml-1
肝素钠,ph7.4)中吹吸混匀,使用分光光度计检测232nm处的吸收峰,计算δa232/δt。
[0052]
实施例1
[0053]
隐性质粒截短质粒的构建
[0054]
以gfp-kan
r-1-f/r为引物,pcr扩增得到gfp和kanr片段,以pmut1-zaiti-f/r为引物,ecn裂解菌液为模板,pcr扩增得到pmut1线性载体,将pmut1线性载体与gfp和kanr片段通过一步克隆方法连接得到含有gfp的质粒pmut1’,其中gfp和kanr片段插入位点为hth与nika之间。以gfp-kan
r-t2-f/r为引物,pcr扩增得到gfp和kanr片段,以pmut2-zaiti-f/r为引物,ecn裂解菌液为模板,pcr扩增得到pmut2线性载体,将pmut2线性载体与gfp和kanr片段通过一步克隆方法连接得到质粒pmut2’,其中gfp和kanr片段插入位点为mobc与duf之间。
[0055]
后续基于pmut1’和pmut2’对质粒进行截短。
[0056]
以pmut1’为模板,分别使用引物del-rop-f/r和del-nika-f/r,使用表3中的pcr反应体系得到pmut1
’‑
del-rop和pmut1
’‑
del-nika线性片段;以pmut1
’‑
del-rop为模板,del-nika-f/r为引物,使用表3中的pcr反应体系得到pmut1
’‑
del-rop-nika线性片段,将上述pcr产物进行回收纯化,转化大肠杆菌jm109,将重组菌株涂布于含kanr抗生素的lb培养基,在37℃下培养至长出单菌落,挑取单菌落进行测序,得到重组菌e.coli jm109-pmut1
’‑
del-rop、e.coli jm109-pmut1
’‑
del-nika和e.coli jm109-pmut1
’‑
del-rop-nika。
[0057]
以pmut2’为模板,分别使用引物del-mobb-f/r、del-mobc-f/r、del-mobd-f/r和del-hyp-f/r,使用表3中的pcr反应体系得到pmut2
’‑
del-mobb、pmut2
’‑
del-mobc、pmut2
’‑
del-mobd和pmut2
’‑
del-hyp线性片段;以pmut2
’‑
del-hyp为模板,del-mobbcd-f/r为引物,使用表3中的pcr反应体系得到pmut2
’‑
del-mobbcd-hyp线性片段,将上述pcr产物进行回收纯化,转化大肠杆菌jm109,将重组菌株涂布于含kanr抗生素的lb培养基,在37℃下培养至长出单菌落,挑取单菌落进行测序,得到重组菌e.coli jm109-pmut2
’‑
del-mobb、e.coli jm109-pmut2
’‑
del-mobc、e.coli jm109-pmut2
’‑
del-mobd、e.coli jm109-pmut2
’‑
del-hyp和e.coli jm109-pmut2
’‑
del-mobbcd-hyp。
[0058]
pcr反应体系如表3,扩增条件见表4,隐性质粒上元件的序列见表5。
[0059]
表3.pcr反应体系
[0060]
[0061]
表4.pcr扩增条件
[0062][0063]
表5.隐性质粒元件序列
[0064]
[0065]
[0066][0067]
实施例2
[0068]
ecn隐性质粒衍生质粒传代稳定性
[0069]
从实施例1构建得到的重组菌e.coli jm109-pmut1
’‑
del-rop、e.coli jm109-pmut1
’‑
del-nika、e.coli jm109-pmut1
’‑
del-rop-nika、e.coli jm109-pmut2
’‑
del-mobb、e.coli jm109-pmut2
’‑
del-mobc、e.coli jm109-pmut2
’‑
del-mobd、e.coli jm109-pmut2
’‑
del-hyp和e.coli jm109-pmut2
’‑
del-mobbcd-hyp中提取质粒,分别得到重组质粒pmut1
’‑
del-rop、pmut1
’‑
del-nika、pmut1
’‑
del-rop-nika、pmut2
’‑
del-mobb、pmut2
’‑
del-mobc、pmut2
’‑
del-mobd、pmut2
’‑
del-hyp和pmut2
’‑
del-mobbcd-hyp。
[0070]
将质粒pmut1’、pmut1
’‑
del-rop、pmut1
’‑
del-nika、pmut1
’‑
del-rop-nika分别转入ecnδp1中,验证正确的即为重组菌株ecnδp1-pmut1’、ecnδp1-pmut1
’‑
del-rop、ecnδp1-pmut1
’‑
del-nika、ecnδp1-pmut1
’‑
del-rop-nika;将质粒pmut2’、pmut2
’‑
del-mobb、pmut2
’‑
del-mobc、pmut2
’‑
del-mobd、pmut2
’‑
del-hyp和pmut2
’‑
del-mobbcd-hyp分别转入ecnδp2中,验证正确的即为重组菌ecnδp2-pmut2’、ecnδp2-pmut2
’‑
del-mobb、ecnδp2-pmut2
’‑
del-mobc、ecnδp2-pmut2
’‑
del-mobd、ecnδp2-pmut2
’‑
del-hyp和ecnδp2-pmut2
’‑
del-mobbcd-hyp。
[0071]
将重组菌株ecnδp1-pmut1’、ecnδp1-pmut1
’‑
del-rop、ecnδp1-pmut1
’‑
del-nika、ecnδp1-pmut1
’‑
del-rop-nika;ecnδp2-pmut2’、ecnδp2-pmut2
’‑
del-mobb、ecnδp2-pmut2
’‑
del-mobc、ecnδp2-pmut2
’‑
del-mobd、ecnδp2-pmut2
’‑
del-hyp和ecnδp2-pmut2
’‑
del-mobbcd-hyp在无抗生素的lb固体平板上划线,置于37℃恒温培养箱培养12h左右至长出单菌落。挑取平板上的单菌落接种于含25ml lb卡那抗性液体培养基的250ml三角摇瓶,37℃200rpm培养10h为种子培养液,每个菌株三个平行。
[0072]
种子液分别接种到含有kanr抗生素(抗生素浓度为50mg ml-1
)和不含抗生素的lb培养基中,每隔12小时以1%的量分别转接到新鲜的含有kanr抗生素和不含抗生素的培养基中。在培养基中培养12小时后测定菌体的gfp蛋白表达量,不加kanr培养基中菌株的荧光蛋白表达量与kanr培养基中菌株的荧光蛋白表达量的比值即为质粒的保持率。同时吸取菌液分别涂布于无抗生素的lb固体平板和含有kanr抗生素的lb固体平板,分别计数,以无抗生素的lb固体平板上的菌落数与含有kanr抗生素的lb固体平板菌落数比值计算质粒保持率,以验证上述通过荧光蛋白比值确定的质粒保持率,质粒保持率数值在95%以上即认为质粒稳定存在。
[0073]
如图3所示,在不添加抗生素的情况下,pmut1’、pmut1
’‑
del-rop、pmut1
’‑
del-nika和pmut1
’‑
del-rop-nika在宿主菌中分别可以稳定存在6.5天、7天、9天和8天。如图4,在不添加抗生素的情况下,pmut2
’‑
del-mobb、pmut2
’‑
del-mobc、pmut2
’‑
del-mobd和pmut2
’‑
del-hyp在宿主菌中分别可以稳定存在8.5天、12天、12天、13天、13天和12天。
[0074]
实施例3
[0075]
ecn隐性质粒荧光蛋白gfp表达
[0076]
将重组菌株ecnδp1-pmut1’、ecnδp1-pmut1
’‑
del-rop、ecnδp1-pmut1
’‑
del-nika、ecnδp1-pmut1
’‑
del-rop-nika;ecnδp2-pmut2’、ecnδp2-pmut2
’‑
del-mobb、ecnδp2-pmut2
’‑
del-mobc、ecnδp2-pmut2
’‑
del-mobd、ecnδp2-pmut2
’‑
del-hyp和ecnδp2-pmut2
’‑
del-mobbcd-hyp在lb固体平板上划线,置于37℃恒温培养箱培养12h左右至长出单菌落。单菌落接种于含25ml lb液体培养基的250ml三角摇瓶,37℃、200rpm培养10h为种子培养液,每个菌株三个平行。
[0077]
种子培养液以1%转接到含25ml lb液体培养基的250ml三角摇瓶,培养10h后将适当稀释的培养基添加到黑色96孔板中(corning透明平底),通过酶标仪infinite 200pro(tecan,澳大利亚)测定gfp荧光强度,激发波长:490nm,发射波长:530nm,增益值:55。
[0078]
结果如图5,nika的删除使得质粒的蛋白表达量降低了22%,rop与rop-nika的删除使得质粒的蛋白表达量均提高了19%左右。如图6,mobb、mobc、mobd、hyp的单独删除以及同时删除的删除对于隐性质粒蛋白表达影响不大。
[0079]
实施例4
[0080]
质粒pmut1
’‑
bhepⅲ与pmut2
’‑
bhepⅲ具体构建方式参见实施例1,将多形拟杆菌(bacteroides thetaiotaomicron)来源的肝素裂解酶ⅲ(ec 4.2.2.8)分别插入到pmut1和pmut2质粒上,插入位点同gfp插入的位点,分别构建得到重组质粒pmut1
’‑
bhepⅲ和pmut2
’‑
bhepⅲ,将重组质粒pmut1
’‑
bhepⅲ和pmut2
’‑
bhepⅲ分别转入ecnδp1和ecnδp2中,分别构建得到重组菌ecnδp1-pmut1
’‑
bhepⅲ和ecnδp2-pmut2
’‑
bhepⅲ。
[0081]
在lb固体平板上划线,置于37℃恒温培养箱培养12h左右至长出单菌落。单菌落接
种于含25ml lb液体培养基的250ml三角摇瓶,37℃、200rpm培养10h为种子培养液,每个菌株三个平行。
[0082]
种子培养液以1%转接到含25ml lb液体培养基的250ml三角摇瓶,每隔12h传代转接。如图7所示,10h时pmut1
’‑
bhepⅲ质粒对应的bhepⅲ酶活为5405u
·
l-1
,为对照质粒的2.16倍,在传代7天后仍可检测到与对照组相当的酶活。pmut2
’‑
bhepⅲ质粒对应的bhepⅲ酶活为3504u
·
l-1
,为对照质粒的1.4倍,在传代8.5天后仍可检测到与添加抗生素的对照组相当的酶活。
[0083]
对比例1
[0084]
参见实施例1的实施方式,构建得到pmut1’和pmut2’,并对pmut1’和pmut2’质粒进行截短,分别截除pmut1’质粒上hth、rnai、hyp1、hyp2元件,pmut2’质粒上的duf、toxin、toxin-antitoxin,上述截短均导致质粒的分离稳定性或是结构稳定性降低,使得质粒在不添加抗生素的情况下更易丢失或是质粒发生突变。
[0085]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1