一种鱼类细胞体外三维培养、诱导分化和冷冻保存方法与流程
1.本发明涉及鱼类细胞3d培养的技术领域,特别是指一种鱼类细胞体外三维培养、诱导分化和冷冻保存方法。
背景技术:
2.鱼类细胞的培养、诱导分化和冷冻保存一直是水产养殖业中的核心技术之一,其包含了鱼类常规细胞、生殖细胞和干细胞等,对于鱼类的育种、疾病防治和发育机制等研究具有重要的支持作用。中国专利cn102634481a于2012年8月15日公开了一种金钱鱼肾细胞体外培养方法,这种培养方法包括以下步骤:
3.(1)配置l-15基础培养基、原代培养基、含bfgf的原代培养基和传代培养基;(2)金钱鱼肾细胞原代培养:a、无菌取肾;b、消化分离肾细胞;c、接种;(3)金钱鱼肾细胞传代培养。这种培养方法对已有的海水鱼细胞培养方法进行借鉴和改良,摸索了适合金钱鱼肾细胞培养的培养方法,建立了稳定的肾细胞培养体系,首次建立了金钱鱼肾细胞系,以期为金钱鱼渗透压调节提供细胞模型,同时有助于金钱鱼功能基因组的深入研究;但是,这种鱼类细胞的培养方法依然延续了哺乳动物细胞的2d培养方式,无法实现在体外模拟鱼类细胞生长的真实微环境,进而影响最终评价指标的准确性。
4.目前,哺乳动物的细胞培养已经取得了长足进步,包含2d、3d和4d培养在内的多种培养体系已经成功建立,并被应用于细胞的深入研究中。水凝胶是一种聚合物与水分子构成的三维网络结构体系,其与生物体的细胞外基质具有极高的相似性。水凝胶内部丰富的孔径结构能够为细胞营养物质和代谢废物的传递提供充足的空间,是一种理想的细胞培养体系。例如:中国专利cn113699094a公开了一种无血清培养细胞的方法,这种方法依次包括如下步骤:(1)通过细胞计数板或细胞计数仪测定预培养细胞悬液中的细胞数,离心细胞悬液,细胞经离心聚集在离心管底部后,吸除上清液;(2)将生物材料水溶液与细胞混合,吹打细胞直至与生物材料水溶液混合均匀,细胞均匀分散在生物材料水溶液中形成生物材料包裹细胞的三维结构;(3)添加无血清细胞培养液浸没生物材料包裹细胞的三维结构,进行无血清培养细胞。这种生物材料包括天然生物材料或合成生物材料中的至少一种,天然生物材料包括壳聚糖及其衍生物、纤维素类材料、海藻酸盐及其衍生物、壳聚糖/甘油磷酸二钠混合物、淀粉类材料、血清白蛋白、明胶及其衍生物、鲱精蛋白、血纤蛋白原、胶原、肽类材料、木聚糖、透明质酸、鱼胶、角蛋白类、促凝血酶原激酶、还原角蛋白中的至少一种,合成生物材料包括聚氧乙烯-聚乳酸羟基乙酸共聚物、结冷胶、丙烯酸、聚氨基酸、丙烯酸衍生物、聚乙烯醇、嵌段式聚合物、合成肽类材料中的至少一种。但是,这种生物材料的水溶液均为不可逆水凝胶,水凝胶制备完成之后,无法再次转变为液态,使得后期分离细胞成为难题。另外,由于哺乳动物的细胞培养条件与鱼类的细胞条件存在差异性,现有的这种哺乳动物的3d细胞培养方法无法实现鱼类细胞3d培养和分离。
技术实现要素:
5.本发明的目的是提供一种鱼类细胞体外三维培养、诱导分化和冷冻保存方法,旨在解决现有技术中鱼类细胞的培养方法仍停留在2d培养方式上使其无法实现在体外模拟鱼类细胞生长的真实微环境进而影响最终评价指标的准确性以及现有的哺乳动物3d细胞培养方法中生物材料水溶液为不可逆水凝胶导致后期细胞分离困难无法实现鱼类细胞3d培养和分离的问题。
6.为了解决上述技术问题,本发明的技术方案是这样实现的:
7.本发明的一种鱼类细胞体外三维培养、诱导分化和冷冻保存方法,包括以下步骤:1)取热可逆聚合物,添加于鱼类细胞溶剂中,于0-13℃下,溶解0.5-12h,得热可逆水凝胶,热可逆水凝胶的质量浓度为0.5-15%;2)将步骤1)所得的热可逆水凝胶,在0-13℃下,添加鱼类细胞,共混1-5min,鱼类细胞的密度为10
2-106个/ml,升温至14-38℃,得鱼类细胞三维培养水凝胶体系;3)在步骤2)所得的鱼类细胞三维培养水凝胶体系中添加完全培养基进行培养或诱导分化,或将步骤2)所得的鱼类细胞三维培养水凝胶体系进行冷冻保存。
8.本发明利用热可逆水凝胶通过物理交联形成了鱼类细胞三维培养水凝胶体系,实现了鱼类细胞在热可逆水凝胶中的三维培养、诱导分化和冷冻保存,这种热可逆水凝胶在低温下为可注射的液体形态而且升高温度之后变成固体水凝胶形态,这种鱼类细胞三维培养水凝胶体系的内部存在孔径结构,能够为鱼类细胞营养和代谢物质的交换、细胞迁移、增殖和分化提供充足的空间,将鱼类细胞三维培养水凝胶体系置于细胞完全培养基中持续培养,通过添加分化诱导剂还可以实现其细胞分化的定向调节,或者,或采用程序降温仪等专门的降温设施处理之后置于液氮中实现细胞的保种,最后,经过低温实现溶解,利用离心,可获得增殖、分化或保种的鱼类细胞。这种鱼类细胞体外三维培养、诱导分化和冷冻保存方法由于热可逆水凝胶的使用使得后期细胞分离容易,鱼类细胞在培养、诱导分化和冷冻保存过程中营养成分丰富,满足了鱼类细胞正常生长的需求,真正模拟了鱼类细胞在体外生长的真实微环境,而且,上述物理交联过程不会对鱼类细胞产生破坏作用,不影响鱼类细胞的增殖和分化,提高了最终评价指标的准确性,有效推动了水产养殖关键技术的长足进步。
9.作为一种优选的实施方案,所述步骤1)中,鱼类细胞溶剂为mem、dmem、leibowitz l-15和m199中的任意一种或几种。不同的溶剂是为了满足不同鱼类细胞的需要,鱼类细胞生长在其适宜的溶剂中,有利于鱼类细胞的正常生长。另外,本发明的溶剂还可以进一步添加血清、hepes、青霉素、链霉素和fbs等活性成分形成完全培养基;优选地,添加活性成分为血清、hepes和青霉素组合物,进一步地,用于鱼类细胞诱导分化的试剂需要在鱼类细胞完全培养基即溶剂、血清、hepes和青霉素基础上,加入对应的细胞诱导分化因子,即诱导剂;用于鱼类细胞冷冻保存的冷冻保存剂除了上述溶剂、血清、hepes和青霉素之外,还需要添加dmso,以降低冷冻过程对于鱼类细胞的伤害。
10.作为一种优选的实施方案,所述鱼类细胞溶剂为dmem和leibowitz l-15按照体积比为70-90:10-30组成的混合物;或者,所述鱼类细胞溶剂为mem和m119按照体积比为60-85:15-40组成的混合物。本发明的鱼类细胞不仅可以是淡水鱼细胞,还可以是海水鱼细胞,dmem与leibowitz l-15组成的溶剂适合于海水鱼细胞,这种混合溶剂可以充分提供海水鱼细胞生长做必需的营养成分;mem和m119组成的溶剂适合于淡水鱼细胞,这种混合溶剂可以充分提供淡水鱼细胞生长做必需的营养成分。
11.作为一种优选的实施方案,所述热可逆水凝胶的凝胶化温度为14-38℃,凝胶化时间为30-200s。本发明的热可逆水凝胶在0-13℃下为可注射的液体形态,在14-38℃下为固体水凝胶形态;热可逆聚合物在低温下溶解于鱼类细胞溶剂中,得到可注射的液体;然后,鱼类细胞与这种可注射的液体物理共混,通过升高环境温度,构建鱼类细胞三维培养水凝胶体系;其中,可以通过添加氯化钠、磷酸钠等中性盐类实现鱼类细胞三维培养水凝胶体系渗透压的调节。
12.作为一种优选的实施方案,所述热可逆聚合物的分子量为2-1500kda;优选地,所述热可逆聚合物的分子量为150-800kda。本发明的热可逆聚合物在鱼类细胞溶剂中形成热可逆水凝胶,这种热可逆水凝胶是一种温敏型可注射热可逆水凝胶,这种热可逆水凝胶可以为多糖类水凝胶、蛋白类水凝胶或合成聚合物类温敏水凝胶。
13.作为一种优选的实施方案,所述热可逆聚合物为羟丁基壳聚糖、羟丁基甲壳素、羟丙基壳聚糖、胶原蛋白、明胶、嵌段共聚物中的任意一种或几种。这些热可逆聚合物天然可降解,能够有利地促进细胞增值;这种热可逆聚合物形成的热可逆水凝胶的凝胶强度适中,使用性能好。
14.作为一种优选的实施方案,所述热可逆聚合物为羟丁基壳聚糖和明胶按照质量比为1-5:0.5-5组成的混合物;或者,所述热可逆聚合物为羟丁基壳聚糖和胶原蛋白按照质量比为1-5:0.2-2组成的混合物;或者,所述热可逆聚合物为嵌段共聚物和胶原蛋白按照质量比为3-10:0.5-5组成的混合物;或者,所述热可逆聚合物为嵌段共聚物和明胶按照质量比为3-10:2-8组成的混合物。本发明的热可逆聚合物采用复合热可逆聚合物,这种复合热可逆聚合物相互补充,相互促进,使所得的热可逆水凝胶即具有良好的生物相容性,也具有优异的凝胶强度。
15.作为一种优选的实施方案,所述热可逆聚合物为羟丁基壳聚糖、胶原蛋白与明胶按照质量比为0.5-5:0.2-10:0.5-10组成的混合物。本发明的胶原蛋白和明胶所形成的水凝胶具有很好的细胞增殖促进效果,但是,其温敏性差,强度可控性也差,羟丁基壳聚糖能够形成温敏水凝胶,正好可以够弥补上述不足;这种复合热可逆聚合物可以发挥更好的作用。
16.作为一种优选的实施方案,所述鱼类细胞为青鱼细胞、草鱼细胞、鲤鱼细胞、真鲷鱼细胞、鲈鱼细胞、大菱鲆鱼细胞、赤点石斑鱼细胞中的任意一种。本发明的鱼类细胞不仅可以是淡水鱼细胞,还可以是海水鱼细胞,淡水鱼细胞包括青鱼细胞、草鱼细胞、鲤鱼细胞等,海水鱼细胞包括真鲷鱼细胞、鲈鱼细胞、大菱鲆鱼细胞、赤点石斑鱼细胞等,这些鱼类细胞可以是鱼体细胞,也可以是鱼干细胞,还可以是鱼生殖细胞和胚胎等。
17.作为一种优选的实施方案,在所述步骤3)之后还包括:移除培养和诱导分化完成之后的完全培养基,或者,在冷冻保存完成之后,复苏,于0-13℃下,静置30-300s,于800-2000r/min转速下,离心2-6min,得目标细胞。本发明鱼类细胞在培养和诱导分化完成之后,直接移除鱼类细胞三维培养水凝胶体系外部的完全培养基,将鱼类细胞三维培养水凝胶体系放置于低温环境下,鱼类细胞三维培养水凝胶体系中的热可逆水凝胶即变成可注射的液体形态,此时,利用离心的方法即可实现细胞和热可逆水凝胶的分离,细胞分离容易,操作方便;当然,本发明鱼类细胞在冷冻保存完成之后,经过复苏,可以添加完全培养基,进行培养或诱导分化,在培养和诱导分化完成之后,再直接移除鱼类细胞三维培养水凝胶体系外
部的完全培养基,在低温环境中实现热可逆水凝胶的溶解,并采用离心方式,获得目标细胞。鱼类细胞在培养和诱导分化时,所使用的完全培养基为溶解热可逆聚合物形成热可逆水凝胶的鱼类细胞溶剂以及在鱼类细胞溶剂基础上添加的血清、hepes、青霉素、链霉素和fbs等活性成分。
18.与现有技术相比,本发明的有益效果是:本发明利用热可逆水凝胶通过物理交联形成了鱼类细胞三维培养水凝胶体系,实现了鱼类细胞在热可逆水凝胶中的三维培养、诱导分化和冷冻保存,这种热可逆水凝胶在低温下为可注射的液体形态而且升高温度之后变成固体水凝胶形态,这种鱼类细胞三维培养水凝胶体系的内部存在孔径结构,能够为鱼类细胞营养和代谢物质的交换、细胞迁移、增殖和分化提供充足的空间,将鱼类细胞三维培养水凝胶体系置于细胞完全培养基中持续培养,通过添加分化诱导剂可以实现其细胞分化的定向调节,或置于液氮中可以实现细胞的保种,最后,经过低温实现溶解,利用离心,可获得增殖、分化或保种的鱼类细胞。这种鱼类细胞体外三维培养、诱导分化和冷冻保存方法由于热可逆水凝胶的使用使得后期细胞分离容易,鱼类细胞在培养、诱导分化和冷冻保存过程中营养成分丰富,满足了鱼类细胞正常生长的需求,真正模拟了鱼类细胞在体外生长的真实微环境,而且,上述物理交联过程不会对鱼类细胞产生破坏作用,不影响鱼类细胞的增殖和分化,提高了最终评价指标的准确性,有效推动了水产养殖关键技术的长足进步。
附图说明
19.图1为本发明实施例一所得的热可逆水凝胶的扫描电子显微镜照片图;
20.图2为本发明实施例一所得的鱼类细胞三维培养水凝胶体系的形态变化图;
21.图3为本发明实施例一所得的鱼类细胞三维培养水凝胶体系的流变学性质图;
22.图4为本发明实施例一所得的鱼类细胞三维培养水凝胶体系的扫描电子显微镜照片图;
23.图5为本发明实施例一所得的冷冻保存后赤点石斑鱼肾脏细胞的分裂增殖情况图;
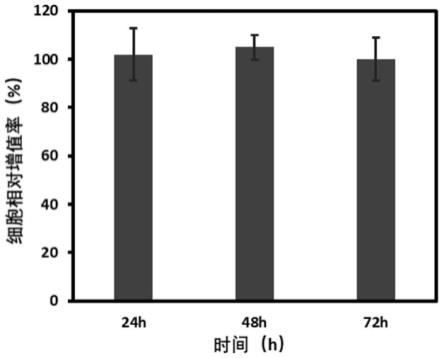
24.图6为本发明实施例二所得的花鲈肝脏细胞的分裂增殖情况图;
25.附图3中,
‑‑‑
表示储能模量,—表示耗能模量。
具体实施方式
26.下面将结合本发明的具体实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
27.本发明的一种鱼类细胞体外三维培养、诱导分化和冷冻保存方法,包括以下步骤:
28.1)取热可逆聚合物,添加于鱼类细胞溶剂中,于0-13℃下,溶解0.5-12h,得热可逆水凝胶,热可逆水凝胶的质量浓度为0.5-15%;
29.2)将步骤1)所得的热可逆水凝胶,在0-13℃下,添加鱼类细胞,共混1-5min,鱼类细胞的密度为10
2-106个/ml,升温至14-38℃,得鱼类细胞三维培养水凝胶体系;
30.3)在步骤2)所得的鱼类细胞三维培养水凝胶体系中添加完全培养基进行培养或
诱导分化,或将步骤2)所得的鱼类细胞三维培养水凝胶体系进行冷冻保存。
31.优选地,所述步骤1)中,鱼类细胞溶剂为mem、dmem、leibowitz l-15和m199中的任意一种或几种。
32.进一步地,所述鱼类细胞溶剂为dmem和leibowitz l-15按照体积比为70-90:10-30组成的混合物;或者,所述鱼类细胞溶剂为mem和m119按照体积比为60-85:15-40组成的混合物。
33.优选地,所述热可逆水凝胶的凝胶化温度为14-38℃,凝胶化时间为30-200s。
34.优选地,所述热可逆聚合物的分子量为2-1500kda。
35.进一步地,所述热可逆聚合物的分子量为150-800kda。
36.优选地,所述热可逆聚合物为羟丁基壳聚糖、羟丁基甲壳素、羟丙基壳聚糖、胶原蛋白、明胶、嵌段共聚物中的任意一种或几种。
37.进一步地,所述热可逆聚合物为羟丁基壳聚糖和明胶按照质量比为1-5:0.5-5组成的混合物;或者,所述热可逆聚合物为羟丁基壳聚糖和胶原蛋白按照质量比为1-5:0.2-2组成的混合物;或者,所述热可逆聚合物为嵌段共聚物和胶原蛋白按照质量比为3-10:0.5-5组成的混合物;或者,所述热可逆聚合物为嵌段共聚物和明胶按照质量比为3-10:2-8组成的混合物。
38.更进一步地,所述热可逆聚合物为羟丁基壳聚糖、胶原蛋白与明胶按照质量比为0.5-5:0.2-10:0.5-10组成的混合物。
39.优选地,所述鱼类细胞为青鱼细胞、草鱼细胞、鲤鱼细胞、真鲷鱼细胞、鲈鱼细胞、大菱鲆鱼细胞、赤点石斑鱼细胞中的任意一种。
40.优选地,在所述步骤3)之后还包括:移除培养和诱导分化完成之后的完全培养基,或者,在冷冻保存完成之后,复苏,于0-13℃下,静置30-300s,于800-2000r/min转速下,离心2-6min,得目标细胞。
41.实施例一
42.本发明的一种鱼类细胞体外三维冷冻保存方法,包括以下步骤:
43.1)取分子量为1500kda的羟丁基甲壳素0.25g以及赤点石斑鱼肾脏细胞冷冻保存溶剂(溶剂为dmem与leibowitz l-15按照体积比为80:20组成的混合物45g,并添加4.5g dmso)49.5g,将羟丁基甲壳素添加于赤点石斑鱼肾脏细胞冷冻保存溶剂中,于8℃下,溶解6h,得质量分数为0.5%的热可逆水凝胶;
44.2)将步骤1)所得的热可逆水凝胶,在10℃下,添加赤点石斑鱼肾脏细胞悬液,热可逆水凝胶与赤点石斑鱼肾脏细胞悬液的体积比为1:1,物料共混,混合时间为5min,混合后赤点石斑肾脏细胞的密度为106个/ml,升温至18℃,静置200s,得鱼类细胞三维培养水凝胶体系;
45.3)将步骤2)所得的鱼类细胞三维培养水凝胶体系通过程序降温仪等专门的降温设施处理,然后,保存于液氮环境中,进行冷冻保存;
46.4)在步骤3)冷冻保存完成之后,复苏,覆盖上述dmem与leibowitz l-15混合物形成的完全培养基,分别培养24、48和72h,将鱼类细胞三维培养水凝胶体系外部的完全培养基移除,将鱼类细胞三维培养水凝胶体系置于0℃环境下,静置30s,于转速为800rmp/min的离心机中,离心6min,得冷冻保存后增殖的赤点石斑鱼肾脏细胞。
47.将步骤1)所得的热可逆水凝胶置于赛默飞公司生产的apreo 2型号的电子扫描显微镜上进行观察,由附图1可以看出,本发明所得的羟丁基甲壳素热可逆水凝胶的内部为三维多孔结构,孔径在50-150um之间,是细胞培养的理想载体。
48.将步骤2)所得的鱼类细胞三维培养水凝胶体系在不同温度下放置,由附图2可以看出,本发明所得的鱼类细胞三维培养水凝胶体系,在10℃环境下,为流动的液态;当环境温度升高至18℃时,这种流动的液态转变为水凝胶;再次降低环境温度至10℃时,水凝胶又恢复到流动的液态。
49.将步骤2)所得的鱼类细胞三维培养水凝胶体系置于赛默飞公司生产的hr10型号流变仪上测定流变学性质,由附图3可以看出,测定流变学测试结果显示,鱼类细胞三维培养水凝胶体系的成胶温度为18℃。
50.将步骤2)所得的鱼类细胞三维培养水凝胶体系置于上述电子扫描显微镜上进行观察,由附图4可以看出,赤点石斑鱼肾脏细胞能够均匀的分散到羟丁基甲壳素形成的热可逆水凝胶的内部。
51.将步骤4)所得的冷冻保存后增殖的赤点石斑鱼肾脏细胞采用cck-8法测定培养前后细胞密度的变化,由附图5可以看出,本发明冷冻保存后的赤点石斑鱼肾脏细胞在培养过程中,三个时间段的相对增值率均高于80%,这表明本发明的热可逆水凝胶适用于鱼类细胞的冷冻保存。
52.实施例二
53.本发明的一种鱼类细胞体外三维培养方法,包括以下步骤:
54.1)取分子量为800kda的羟丁基壳聚糖1g、分子量为150kda的胶原蛋白0.25g、分子量为200kda的明胶0.5g以及花鲈细胞培养溶剂(培养溶剂为dmem与leibowitz l-15按照体积比为70:30组成的混合物)48.25g,将羟丁基壳聚糖、明胶和胶原蛋白分别添加于花鲈细胞培养溶剂中,于0℃下,溶解12h,得质量分数为2%的热可逆水凝胶;
55.2)将步骤1)所得的热可逆水凝胶,在13℃下,添加花鲈肝脏细胞,物料共混,混合时间为3min,混合后花鲈肝脏细胞的密度为103个/ml,升温至38℃,静置120s,得鱼类细胞三维培养水凝胶体系;
56.3)在步骤2)所得的鱼类细胞三维培养水凝胶体系置于细胞培养板中,并覆盖上述dmem与leibowitz l-15混合物形成的完全培养基分别培养24、48和72h;
57.4)在步骤3)培养完成之后,移除鱼类细胞三维培养水凝胶体系外部的完全培养基,将鱼类细胞三维培养水凝胶体系置于4℃环境中,静置180s,于转速为1200rmp/min的离心机中,离心3min,得增殖后的花鲈细胞。
58.将步骤4)所得的增殖后的花鲈细胞采用cck-8法测定培养前后细胞密度的变化,由附图6可以看出,本发明在花鲈细胞培养过程中,细胞的相对增值率为90-110%,这表明本发明的热可逆水凝胶是一种鱼类细胞理想的3d培养体系。
59.实施例三
60.本发明的一种鱼类细胞体外三维诱导分化方法,包括以下步骤:
61.1)取分子量为2kda的嵌段共聚物4.0g、分子量为200kda的明胶3.5g以及草鱼胚胎干细胞诱导分化溶剂(溶剂为mem与m119按照体积比为80:20组成的混合物)42.5g,将嵌段共聚物和明胶分别置于草鱼胚胎干细胞诱导分化培养溶剂中,于13℃下,溶解0.5h,得质量
分数为15%的热可逆水凝胶;
62.2)将步骤1)所得的热可逆水凝胶,在0℃下,添加草鱼胚胎干细胞,物料共混,混合时间为1min,混合后草鱼胚胎干细胞的密度为102个/ml,升温至30℃,静置30s,得鱼类细胞三维培养水凝胶体系;
63.3)在步骤2)所得的鱼类细胞三维培养水凝胶体系置于细胞培养板中,并覆盖上述mem与m119混合物添加诱导剂之后形成的诱导分化试剂中进行诱导分化;
64.4)诱导分化完成之后,将鱼类细胞三维培养水凝胶体系外部的诱导分化完全培养基移除,鱼类细胞三维培养水凝胶体系置于13℃环境下,静置300s,于转速为2000rmp/min的离心机中,离心2min,得诱导分化后的草鱼胚胎干细胞。
65.采用cck-8法测定诱导分化后的草鱼胚胎干细胞的细胞密度,测试结果显示,所得草鱼胚胎干细胞密度为106个/ml。因此,该鱼类细胞三维培养水凝胶体系促进了草鱼胚胎干细胞的增值和分化,是一种理想的培养体系。
66.实施例四
67.本发明的一种鱼类细胞体外三维冷冻保存方法,包括以下步骤:
68.1)取分子量为1500kda的羟丁基壳聚糖1.0g、分子量为150kda的胶原蛋白0.25g以及大菱鲆鱼肾脏细胞冷冻保存溶剂(溶剂为dmem与leibowitz l-15按照体积比为90:10组成的混合物39.00g,并添加9.75g dmso)48.75g,将羟丁基壳聚糖和胶原蛋白分别添加至大菱鲆鱼肾脏细胞冻存溶剂中,于10℃下,溶解8h,得质量分数为2.5%的热可逆水凝胶;
69.2)将步骤1)所得的热可逆水凝胶,在5℃下,添加大菱鲆鱼肾脏细胞悬液,热可逆水凝胶与大菱鲆鱼肾脏细胞悬液的体积比为1:1,物料共混,混合时间为3min,混合后大菱鲆鱼肾脏细胞的密度为105个/ml,升温至14℃,静置250s,得鱼类细胞三维培养水凝胶体系;
70.3)将步骤2)所得的鱼类细胞三维培养水凝胶体系通过程序降温仪等专门的降温设施处理,然后,保存于液氮环境中,进行冷冻保存;
71.4)在步骤3)冷冻保存完成之后,复苏,覆盖上述dmem与leibowitz l-15混合物形成的完全培养基,分别培养24、48和72h,将鱼类细胞三维培养水凝胶体系外部的完全培养基移除,将鱼类细胞三维培养水凝胶体系置于4℃环境下,静置60s,于转速为1000rmp/min的离心机中,离心4min,得冷冻保存后增殖的大菱鲆鱼肾脏细胞。
72.采用cck-8法测定冷冻保存后增殖的大菱鲆鱼肾脏细胞的细胞密度,测试结果显示,所得冷冻保存后增殖的大菱鲆鱼肾脏细胞的细胞密度为7.8
×
104个/ml。因此,经过冷冻保存后大菱鲆鱼肾脏细胞的存活率超过75%,表明该鱼类细胞三维培养水凝胶体系适用于鱼类细胞的冷冻保存。
73.因此,与现有技术相比,本发明的有益效果是:本发明利用热可逆水凝胶通过物理交联形成了鱼类细胞三维培养水凝胶体系,实现了鱼类细胞在热可逆水凝胶中的三维培养、诱导分化和冷冻保存,这种热可逆水凝胶在低温下为可注射的液体形态而且升高温度之后变成固体水凝胶形态,这种鱼类细胞三维培养水凝胶体系的内部存在孔径结构,能够为鱼类细胞营养和代谢物质的交换、细胞迁移、增殖和分化提供充足的空间,将鱼类细胞三维培养水凝胶体系置于细胞完全培养基中持续培养,通过添加分化诱导剂可以实现其细胞分化的定向调节,或置于液氮中可以实现细胞的保种,最后,经过低温实现溶解,利用离心,
可获得增殖、分化或保种的鱼类细胞。这种鱼类细胞体外三维培养、诱导分化和冷冻保存方法由于热可逆水凝胶的使用使得后期细胞分离容易,鱼类细胞在培养、诱导分化和冷冻保存过程中营养成分丰富,满足了鱼类细胞正常生长的需求,真正模拟了鱼类细胞在体外生长的真实微环境,而且,上述物理交联过程不会对鱼类细胞产生破坏作用,不影响鱼类细胞的增殖和分化,提高了最终评价指标的准确性,有效推动了水产养殖关键技术的长足进步。
74.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1