基于赖氨酸的多肽在生物材料检测中的应用的制作方法
1.本发明涉及生物材料检测技术领域,具体涉及基于赖氨酸的多肽在dna链置换反应中的应用,优化dna检测的灵敏度和检测限。
背景技术:
2.酶是生物体内一类具有催化剂功能的蛋白质。生命中内大多数反应都是由各种不同的酶催化的。其中酶的活性主要依靠对底物的结合和活性中心的催化,而这依赖于起到关键作用的氨基酸残基。
3.由于赖氨酸的侧链上含有一个带正电的氨基,有时参与与带负电的非蛋白原子(如阴离子或羧酸基)形成氢键,因而在蛋白质活性或结合位点中很常见,例如dna六聚解旋酶,dna六聚解旋酶的dna链结合部位主要依靠6组赖氨酸残基及其相邻组氨酸形成的酰胺键与dna之间形成的氢键。
4.由于dna链置换方法突破了以往结构dna纳米技术的静态思维限制,可以实现2个生化反应的级联以及纳米尺度的运动或能量转换,所以已广泛应用于逻辑门运算模型、生化逻辑电路与神经网络、dna纳米机器人、dna反映网络等领域。但是,当dna网络过于复杂时,dna链置换反应花费很多时间,影响了基于此的dna检测的响应灵敏度及检测限。
5.公开号为cn113215224a、cn113528624a的专利说明书公开了扩增样品中靶标核酸分子的方法,通过快速变温的热循环来促进双链靶标核酸分子中变性泡的产生,从而加速链置换扩增(sea)反应。这两个专利技术的方法包括使聚合酶和一对寡核苷酸引物与样品接触,从而形成扩增混合物,其中引物被设计为与靶标核酸分子特异性杂交;使扩增混合物经第一温度和第二温度之间的多个热循环处理,从而通过聚合酶链式反应(pcr)扩增靶标核酸序列;其中第一和第二温度之差小于约20℃或30℃。
6.本发明则根据结合位点的特点,设计基于赖氨酸的多肽来提供氢键与dna链相互作用,达到了加速dna链置换的目的。
技术实现要素:
7.本发明提供了基于赖氨酸的多肽在dna链置换反应中的应用,该多肽能与dna链自组装形成聚集体,也可与dna链共价合成多肽-dna偶联聚合物。此类多肽/dna聚集体、多肽-dna偶联聚合物可明显加速dna链置换反应,有效提高了dna检测的灵敏度,显著降低了检测限。
8.具体技术方案如下:
9.基于赖氨酸的多肽在dna链置换反应中的应用,所述基于赖氨酸的多肽由15~40个氨基酸组成,且其中赖氨酸的数量占比为40%~90%;
10.所述基于赖氨酸的多肽可通过以下任一方式加速dna链置换反应,提高dna检测的灵敏度,降低检测限:
11.a.所述基于赖氨酸的多肽与dna链自组装形成多肽/dna聚集体;
12.b.所述基于赖氨酸的多肽与dna链共价合成多肽-dna偶联聚合物。
13.本发明针对由dna链置换反应速率慢引起的dna检测灵敏度低和检测限高的问题,先利用平台计算归纳了可行的基于赖氨酸的多肽链的特点,并且通过实验验证了由这些多肽参与的多肽/dna聚集体、多肽-dna偶联聚合物确实提高了dna链置换反应速率,优化了dna检测的灵敏度和检测限。
14.一方面,本发明将该类多肽冻干粉溶于纯水中进行自组装,形成的多肽聚集体与溶液中的dna链相互作用组装成多肽/dna聚集体。另一方面,本发明将该类多肽与dna链共价合成多肽-dna偶联聚合物。该聚集体、偶联物能通过促进dna链置换反应使dna检测的灵敏度提高,检测限降低,其中偶联物的效果优于聚合物的效果。
15.在一优选例中,所述的应用,除赖氨酸外,所述氨基酸还包括组氨酸、苯丙氨酸、谷氨酸、谷氨酰胺、精氨酸中的至少一种。
16.在一优选例中,所述的应用,所述基于赖氨酸的多肽选自下列多肽中的至少一种:
17.kh15,氨基酸序列如seq id no:1所示;
18.kf20,氨基酸序列如seq id no:2所示;
19.kq25,氨基酸序列如seq id no:3所示;
20.kkf30,氨基酸序列如seq id no:4所示;
21.kkkf40,氨基酸序列如seq id no:5所示。
22.在一优选例中,所述的应用,方式a中,所述多肽/dna聚集体中,所述基于赖氨酸的多肽与所述dna链的摩尔比为1~100:1。
23.在一优选例中,所述的应用,方式a中,所述多肽/dna聚集体的制备方法包括步骤:
24.1)将所述基于赖氨酸的多肽溶于水中,得到多肽溶液,室温静置,使其自组装形成多肽聚集体;
25.2)将所述dna链溶于水中,得到dna链溶液;
26.3)将步骤1)得到的多肽聚集体和步骤2)得到的dna链溶液混合于磷酸盐缓冲溶液中,得到所述多肽/dna聚集体。
27.作为优选,步骤3)中,所述磷酸盐缓冲溶液的ph为7;
28.所述磷酸盐缓冲溶液中,磷酸根离子的浓度为50mm;
29.所述磷酸盐缓冲溶液中还含有150mm的nacl。
30.作为一个总的发明构思,本发明还提供了一种提高dna链置换反应速率、提高dna检测的灵敏度、降低检测限的方法,采用以下任一方式修饰dna链后进行dna链置换反应:
31.a.将基于赖氨酸的多肽与dna链自组装形成多肽/dna聚集体,
32.b.将基于赖氨酸的多肽与dna链共价合成多肽-dna偶联聚合物;
33.所述基于赖氨酸的多肽由15~40个氨基酸组成,且其中赖氨酸的数量占比为40%~90%。
34.上述提高dna链置换反应速率、提高dna检测的灵敏度、降低检测限的方法中基于赖氨酸的多肽、方式a和方式b都可参考上文基于赖氨酸的多肽在dna链置换反应中的应用中的基于赖氨酸的多肽、方式a和方式b。
35.本发明与现有技术相比,主要优点包括:
36.1、无需借助其他物质,依靠多肽便可实现对dna链置换反应的速率提升,整个体系
简单可控。
37.2、多肽/dna聚合体的制备只需将多肽链溶于水后自发组装的聚集体与dna链溶液混合,操作简单,方便制备。
38.3、本发明的核心为dna链置换反应速率的提升,不仅优化了dna检测的灵敏度和检测限,而且为其他基于dna链置换的相关纳米技术领域提供了改进方法和思路。
附图说明
39.图1为dna链置换反应及荧光检测示意图;
40.图2为kh15/hairpin聚集体和单独hairpin链的dna链置换反应的荧光响应对比图;
41.图3为kkf30-hairpin偶联聚合物与单纯hairpin链的dna检测灵敏度对比图;
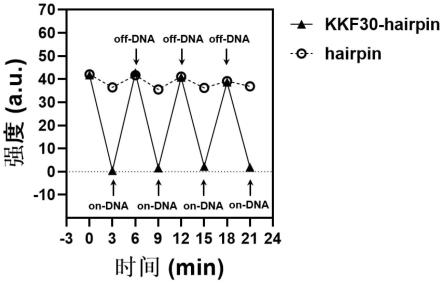
42.图4为kkf30-hairpin偶联聚合物与单纯hairpin链的dna检测的检测限对比图。
具体实施方式
43.下面结合附图及具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
44.多肽/dna聚集体及多肽-dna偶联聚合物的制备,以kh15/dna(hairpin)聚集体和kkf30-dna(hairpin)偶联聚合物为例。表1展示了举例的5种多肽以及实验所用的dna链的序列。
45.表1
[0046][0047]
步骤1
[0048]
(1)多肽kh15直接从生物公司购买,将kh15冻干粉置于高速离心机,3000r/min,3min。
[0049]
(2)用超纯水溶解kh15冻干粉,得到2mm的kh15溶液,置于低速振荡器中,震荡20min,得到溶解均匀的kh15溶液,室温静置,使其自组装形成kh15聚集体。
[0050]
(3)dna-hairpin(碱基序列如seq id no:6所示),on-dna(碱基序列如seq id no:7所示)及off-dna(碱基序列如seq id no:8所示)均从生物公司购买,将hairpin冻干粉置于高速离心机,3000r/min,3min。
[0051]
(4)用超纯水溶解hairpin冻干粉,得到100μm的hairpin溶液。on-dna和off-dna溶液均同(3)、(4)所述过程制备。
[0052]
(5)分别取kh15溶液与hairpin溶液1μl,混合于98μl的ph=7.0的磷酸盐缓冲溶液
dna之后,存在kh15时荧光强度的降低速率(即off-dna从hairpin/on-dna杂交链上争夺on-dna,形成on-dna/off-dna杂交链的速率)相对于没有kh15的情况快很多。说明,多肽的存在大大加快了链置换反应的速率。
[0071]
为了探究在多肽的存在下(无论多肽与dna链间为弱相互作用还是共价作用),聚集体或偶联物通过加速链置换反应速度提高了dna检测的灵敏度,使用荧光分光光度对多肽/dna聚合物或多肽-dna偶联聚合物以及单纯dna的情况下,检测相同浓度的同一条dna链。如图3,以kkf30-hairpin偶联聚合物为例,在kkf30存在的情况下,交替添加等量on-dna和off-dna链,荧光强度在0a.u.和40a.u.的强度值间稳定转变;而没有kkf30的情况下,交替添加等量on-dna和off-dna链,荧光强度变化并不明显,说明对体系内的所检测的dna链并不灵敏。
[0072]
为了探究在多肽的存在下,聚集体或偶联物通过加速链置换反应速度降低了dna检测的检测限,使用荧光分光光度对多肽/dna聚合物或多肽-dna偶联聚合物和纯dna的情况下,检测不同浓度的同一条dna链。如图4,以kkf30-hairpin偶联聚合物为例,在kkf30存在的情况下,检测on-dna的检测限为5nm;而没有kkf30的情况下,检测限仅为0.5μm,即小于0.5μm时数据波动均在初始强度误差范围内,无法线性拟合。
[0073]
此外应理解,在阅读了本发明的上述描述内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1