一种钙卫蛋白单克隆抗体及试剂盒的制作方法
1.本技术涉及单克隆抗体领域,更具体地说,它涉及一种钙卫蛋白单克隆抗体及试剂盒。
背景技术:
2.钙卫蛋白是一个分子量约为22-36kd的蛋白多聚体分子(主要为异二聚体或三聚体),具有s-100蛋白的结构特征。钙卫蛋白包括钙结合蛋白s100a8(14kd)和钙结合蛋白s100a9(8kd)两种蛋白分子组分,具有耐热性和耐水解的特性,这些特性使得钙卫蛋白在肠腔和外界环境中可以长期保持稳定而不被细菌和各种酶类降解。
3.健康成人血浆中的钙卫蛋白的含量为0.1-0.6mg/l,而粪便中的钙卫蛋白主要来自肠黏膜组织中的中性粒细胞的脱落,其含量大约是血浆钙卫蛋白含量的6倍。因此,粪便中的钙卫蛋白被认为是一种有效的肠道炎症标志物。
4.目前比较常用的抗原或抗体的检测方法为酶联免疫吸附测定法(enzyme linked immunosorbentassay,elisa),虽然其灵敏度较高,但是仍然存在操作繁琐、检测时间长的缺点。
技术实现要素:
5.为了解决上述技术问题,本技术提供一种钙卫蛋白单克隆抗体及试剂盒。
6.第一方面,本技术提供一种钙卫蛋白单克隆抗体,采用如下的技术方案:一种钙卫蛋白单克隆抗体,所述的抗体被命名为#10g10a9,所述单克隆抗体#10g10a9的重链可变区的cdr-h1的氨基酸序列如seq id no:9所示,cdr-h2的氨基酸序列如seq id no:10所示,cdr-h3的氨基酸序列如seq id no:11所示;所述单克隆抗体#10g10a9的轻链可变区cdr-l1的氨基酸序列如seq id no:13所示,cdr-l2的氨基酸序列如seq id no:14所示,cdr-l3的氨基酸序列如seq id no:15所示。
7.可选的,所述单克隆抗体#10g10a9的重链可变区的氨基酸序列如seq id no:12所示。
8.可选的,所述单克隆抗体#10g10a9的轻链可变区的氨基酸序列如seq id no:16所示。
9.第二方面,本技术提供了一种钙卫蛋白单克隆抗体,所述的抗体被命名为#14g10c9,所述单克隆抗体#14g10c9的重链可变区的cdr-h1的氨基酸序列如seq id no:17所示,cdr-h2的氨基酸序列如seq id no:18所示,cdr-h3的氨基酸序列如seq id no:19所示;所述单克隆抗体#14g10c9的轻链可变区cdr-l1的氨基酸序列如seq id no:21所示,cdr-l2的氨基酸序列如seq id no:22所示,cdr-l3的氨基酸序列如seq id no:23所示。
10.可选的,所述单克隆抗体#14g10c9的重链可变区的氨基酸序列如seq id no:20所示。
11.可选的,所述单克隆抗体#14g10c9的轻链可变区的氨基酸序列如seq id no:24所示。
12.第三方面,本技术提供了编码单克隆抗体#10g10a9的多核苷酸。
13.第四方面,本技术提供了编码单克隆抗体#14g10c9的多核苷酸。
14.第五方面,本技术提供了表达上述单克隆抗体的杂交瘤细胞株。
15.第六方面,本技术提供了单克隆抗体在试剂盒上的应用。
16.可选的,所述试剂盒中使用单克隆抗体#10g10a9作为包被抗体;使用单克隆抗体#14g10c9作为检测抗体。
17.本技术具有以下有益效果:本技术的钙卫蛋白检测试剂盒的操作简便,检测10分钟即可出结果;采用荧光免疫层析法,具有高灵敏度、高特异性;定量检测,优于比金标的半定量/定性检测;使用粪便检测,标本无需特殊处理;作为溃疡性结肠炎uc的重要标志物,其稳定性优于其他粪便标志物,检测更有意义。
附图说明
18.图1是本技术实施例2的单克隆抗体的sds-page电泳图。
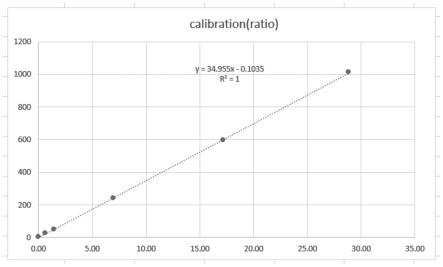
19.图2是本技术实施例4提供的一种钙卫蛋白检测试剂盒的校准曲线图。
20.图3是实施例5中临床测试一中关于本技术的试剂盒与elisa的相关性对比图。
21.图4是实施例5中临床测试一的数据差异图。
22.图5是实施例5中临床测试二中关于本技术的试剂盒与elisa的相关性对比图。
23.图6是实施例5中临床测试二的数据差异图。
具体实施方式
24.以下结合附图和实施例对本技术作进一步详细说明。
25.实施例1本技术实施例提供了一种钙卫蛋白单克隆抗体对,包括单克隆抗体#10g10a9和单克隆抗体#14g10c9。
26.单克隆抗体#10g10a9的氨基酸序列如表1所示;单克隆抗体#10g10a9的dna序列如表2所示;单克隆抗体#14g10c9的氨基酸序列如表3所示;单克隆抗体#14g10c9的氨基酸序列如表4所示。
27.表1抗体#10g10a9的氨基酸序列表
表2抗体#10g10a9的dna序列表
表3抗体#14g10c9的氨基酸序列表
表4抗体#14g10c9的dna序列表
实施例2一种钙卫蛋白单克隆抗体通过如下步骤制备而得:一、免疫原的选取免疫原的氨基酸序列如下:》s100a9(human)(seq id no:41)mtckmsqler nietiintfh qysvklghpd tlnqgefkel vrkdlqnflkkenknekvie himedldtna dkqlsfeefi mlmarltwas hekmhegdegpghhhkpglg egtp》s100a8(human)(seq id no:42)mltelekaln siidvyhkys likgnfhavy rddlkkllet ecpqyirkkg advwfkeldi ntdgavnfqe flilvikmgv aahkkshees hke免疫原的来源为韩国巴迪泰总公司抗原研发部。
28.二、小鼠免疫分别以s100a9和s100a8作为特异性抗原来制备单克隆抗体,其制备方法相同。以下以s100a9为例进行说明。
29.1.准备含有0.5mg/ml特异性抗原的pbs溶液和弗氏完全佐剂等体积混合,得到稳
定的乳化液。
30.2.用22-g的针给小鼠足底注射(每一个抗原2只小鼠)。
31.3.2周后,用等体积的含0.5mg/ml抗原的pbs和不完全弗氏佐剂配制成的乳化液再次足底注射。
32.4.第二次免疫后7天,用无菌剪刀切掉小鼠尾巴0.5cm采血。收集50μl血装于1.5ml的微量离心管,离心后,收集血清。
33.5.经elisa确定血清抗体滴度。
34.6.如果滴度太低不能用于融合(≥1/1000),每两周给小鼠加强免疫直至达到足够的应答。
35.7.当抗体滴度足够高时(≥1/1000),融合前3天,但要在前一次免疫的2周后,用浓度0.25mg/ml的抗原pbs溶液足底注射加强免疫。
36.8.在强化免疫的3天后进行细胞融合。
37.三、杂交瘤细胞融合1.饲养细胞制备:(1)处死小鼠,用酒精消毒体表。
38.(2)无菌条件下打开腹部皮肤,注意不要剪碎腹膜。
39.(3)向腹腔内注射5ml无血清培养基,轻轻拍打腹部后,取出培养基至50毫升离心管中,离心。
40.(4)离心后倒掉上层培养基,加入含有hat的完全培养基重悬细胞。
41.(5)取两个96孔板,每孔滴加1滴上述细胞悬液。
42.2.淋巴结细胞制备:(1)处死小鼠,用酒精消毒体表。
43.(2)无菌条件下取出大腿根部淋巴结,剃除其余组织,用5ml无血清培养液冲洗一次。
44.(3)将淋巴结置于已消毒的100目不锈钢网中,破碎,制成细胞悬液。
45.(4)把细胞悬液注入50ml离心管中,加10ml培养液,轻轻吹打数次,静置去除杂质。
46.(5)离心(1000转/分)计数,备用。
47.3.细胞融合:(1)按1:5的数量将混合淋巴结细胞和骨髓瘤细胞后,离心弃去上清。
48.(2)将1ml 40%的peg液一滴滴加入到细胞中,在60秒内加完,同时并不断轻微摇动离心管。
49.(3)在不断摇动离心管中加1ml无血清培养液,在60秒钟内加完。
50.(4)轻微摇动离心管60s。
51.(5)于2分钟内慢慢加完8ml无血清培养基。此时细胞对机械损伤非常敏感。
52.(6)离心(1500转/分,3分钟),去上清,用含有hat的完全培养液悬浮细胞,轻轻混匀。
53.(7)将细胞悬液滴加到已铺好饲养细胞的96孔板中,每孔加两滴细胞悬液。
54.(8)送入5%co2培养箱中37℃培养。
55.4.阳性杂交瘤细胞筛选
融合10天后,用间接elisa方法筛选阳性杂交瘤细胞:(1)包被:将抗原按照2μg/ml的浓度用pbs稀释,50μl/孔加入到96孔elisa板中,4℃孵育过夜后用pbs-t洗3次;然后甩干板上残余液体。
56.(2)封闭:每孔加入含有5%脱脂奶粉的pbs封闭液,37℃孵育30分钟,用同样的方法洗板。
57.(3)加一抗:每孔加入50μl稀释好的待检细胞培养液,37℃孵育30分钟,用同样的方法洗板。
58.(4)加二抗:每孔加入50μl稀释好的羊抗鼠-hrp抗体,37℃孵育30分钟,用同样的方法洗板。
59.(5)加底物:每孔加入50μl tmb缓冲液,室温反应10分钟,每孔加入50μl终止液。
60.(6)读数:用酶标仪在od450nm时读数。
61.(7)用excel进行数据整理和分析,杂交瘤细胞的elisa数值大于血清数值70%以上为阳性细胞株,选出能稳定分泌单克隆抗体的阳性杂交瘤细胞株。
62.5.杂交瘤细胞克隆化:(1)取上述融合后筛选出的杂交瘤细胞株,滴加入新的96孔板中,用培养基稀释到起始每孔50个细胞的浓度。
63.(2)后续对细胞悬液进行梯度稀释,并滴入96孔板中,直至到每孔含有0.2个细胞的浓度。
64.(3)向做好梯度的96孔板中,每孔滴加一滴饲养细胞悬液。
65.(4)送入5%co2培养箱中37℃培养。
66.(5)14天后进行单克隆筛选,筛选到的阳性单克隆转移至24孔细胞培养板扩大培养。
67.(6)对筛选到的阳性单克隆抗体,用小鼠抗体亚型快速检测试剂盒(干式免疫荧光)进行抗体亚型检测,结果显示,单克隆抗体#10g10a9为igg2b亚型,轻链为κ链,#14g10c9为igg1亚型,轻链为κ链。
68.(7)抗体配对:为了挑选包被抗体和检测抗体的最佳组合,对筛选到的11株单克隆抗体(1c11e7e11、2b6e10、4e12g9、7e8f5a8、10e2c8、10f11b11、10g10a9、11a5b8、11d10b9、14g10c9、15e12e9)两两配对进行双抗体夹心elisa实验,根据标准品的od值与阴性对照的背景值,选出最为理想的单克隆抗体对。抗体配对实验筛选结果如表5所示,结果显示,当#10g10a9作为包被抗体,#14g10c9作为检测抗体时,od450nm的数值大于1.5,确定采用#10g10a9和#14g10c9为最为理想的单克隆抗体对。
69.表5抗体配对实验筛选结果
注:
×
表示未进行该组测定(8)抗体测序:提取能分泌单克隆抗体的杂交瘤细胞的mrna,反转录合成cdna,选取10条重链可变区引物和12条轻链可变区引物进行pcr实验,获得大小正确的条带,将正确条带经内切酶消化后与载体连接,连接体系转化x-blue感受态细胞,选取克隆进行测序,测试结果如实施例1所示。
70.四、小鼠腹水生产将选出的阳性单克隆细胞株扩大培养后,注入已注射免疫抑制剂的小鼠腹腔内,7天后收集小鼠腹水,离心,冷冻备用。
71.五、抗体纯化1.抗体纯化(1)解冻腹水,4000rpm离心10分钟,去除脂质等杂质,取上清腹水与binding buffer 1:1混合后用0.22um针头过滤器过滤。
72.(2)把混合后的腹水缓慢加入protein g介质中并收集流出液体,反复上样2-3遍。
73.(3)用washing buffer洗3倍体积。
74.(4)用elution buffer洗脱抗体,用考马斯亮蓝检测流出抗体,收集洗出抗体。
75.(5)用thermo bca蛋白浓度测定试剂盒对洗出抗体进行浓度测定。
76.2.透析(1)将纯化抗体加入透析袋中在1xpbs中4℃边搅拌边透析,每4小时换一次透析液。透析液体积大于抗体体积50倍。
77.(2)透析结束取出抗体,4000rpm离心5分钟,然后用0.22um过滤器过滤,得到纯化抗体;通过sds-page电泳测定抗体纯度,结果如图1所示,图中,左侧为marker条带,右侧靠
上的为#10g10a9,右侧靠下的为#14g10c9。
78.(3)纯化抗体加入0.1%的nan3,分装,冷冻保管。
79.实施例3如实施例2所示的钙卫蛋白单克隆抗体在抗原检测上的应用,采用双抗夹心检测方法,以实施例1中的单克隆抗体#14g10c9作为检测抗体,以#10g10a9为包被抗体。
80.本技术实施例3公开了一种钙卫蛋白单克隆抗体在炎症性肠病免疫工具中的应用:免疫检测工具包括炎症性肠病检测试剂盒。
81.1.钙卫蛋白定量检测试剂盒(免疫荧光干式定量法)。
82.检测原理:钙卫蛋白检测试剂盒(免疫荧光干式定量法)的检测原理是免疫荧光快速定量检测技术、干化学层析法。采取样本(粪便)后与提取缓冲液混合后滴入反应板样本孔中,通过毛细血管作用在硝化纤维基质的测试带上扩散。此时探测带上的钙卫蛋白抗体-荧光复合物与样本中的钙卫蛋白结合并移动,同时被测试带上的其他钙卫蛋白抗体结合聚积。样本中钙卫蛋白越多测试带上积聚的复合物的量也越多,相反样本中钙卫蛋白的量越少测试带上积聚的复合物的量也越少。荧光信号的强度反映了被捕获的钙卫蛋白的浓度。经巴迪泰(广西)生物科技有限公司生产的a2000(或a5000)干式荧光免疫分析仪的判断,能够定量检测出粪便中钙卫蛋白的浓度。
83.2.试剂盒包括反应板、id芯片以及提取缓冲液试管。
84.反应板的测试线包有anti-calprotectin抗体(1.17μg
±
0.59μg),质控线上包有rabbit igg(0.39μg
±
0.2μg)。
85.反应板的探测线包有荧光标记的anti-calprotectin抗体络合物(0.8μg
±
0.4μg),荧光标记的anti-rabbit igg络合物(0.004μg
±
0.002μg)。
86.提取缓冲液中含有牛血清白蛋白以及防腐剂。
87.线性的检测:钙卫蛋白校准品的浓度为0μg/g、25μg/g、50μg/g、240μg/g、595μg/g、1010μg/g,将校准品加入试剂卡加样孔,每个浓度平行测定3次。反应10min后,以干式荧光免疫分析仪检测其反应信号强度,得到各校准品对应的荧光信号强度,见表6。
88.表6校准品对应的荧光信号强度校准品浓度,μg/g025502405951010荧光信号强度0.010.631.436.9317.1428.82以校准品浓度与其对应的荧光信号强度进行线性拟合,绘制校准曲线,如图2所示,r2=1,说明在0-1010μg/g范围内,荧光信号强度与检测浓度呈高度线性相关。
89.3.使用方法:(1)使用采样棒采集样本(粪便)。
90.(2)采样棒和提取缓冲液结合后摇晃10次充分让样本与提取缓冲液混匀。
91.(3)将没有采样棒的提取缓冲液另一处去除头部,先扔到前3滴。
92.(4)再把3滴混合液滴入反应板的样本孔中。
93.(5)常温下反应10分钟。
94.(6)常温下反应的反应板插入免疫荧光分析仪a2000的承载器中,按仪器说明书进行检测。
95.(7)当检测结果≤50mg/kg时,为正常;当检测结果>50mg/kg时,为阳性。
96.实施例4钙卫蛋白试剂盒的性能评价1.灵敏度实施例4的试剂盒的最小检测值为2mg/kg,说明本技术的试剂盒具有较高的灵敏度。
97.2.准确度实施例4的试剂盒的回收率在85-115%,说明本技术的试剂盒的准确度高。
98.3.精密度实施例4的试剂盒的批内精密度cv%≤8%,说明本技术的试剂盒的精密度高;批间精密度cv%≤5%,说明本技术的试剂盒的重复性好。
99.4.线性范围实施例4的试剂盒在2.00mg/kg~2000.00mg/kg范围内相关系数≥0.99。
100.综上所述,可以判定本技术的试剂盒的性能良好,具有灵敏度高、特异性强、准确度高的优点。
101.实施例5本技术的试剂盒与临床测试的对比试验临床测试一的受试者粪便样本由广西某医院提供。其中,受试者中有42名ibd患者(血清阳性)和68名健康者(血清阴性)。
102.临床测试二的受试者粪便样本由山东青岛某体检机构提供。其中,受试者中有44名ibd患者(血清阳性)和62名健康者(血清阴性)。
103.对照试剂选取瑞士buhlmann laboratories ag生产的货号为hr0593的粪便钙卫蛋白检测试剂盒(elisa)。对照试剂预期用途为体外定量检测粪便提取物中的钙卫蛋白含量,与本技术的试剂的样本类型以及预期用途一致。
104.本技术的钙卫蛋白试剂盒为考核试剂,配套检测仪器为巴迪泰(广西)生物科技有限公司生产的a2000干式荧光免疫分析仪。
105.临床测试一的检测钙卫蛋白临床对比试验的检测的原始数据结果如表7所示,数据处理如图3所示。
106.将对照试剂和考核试剂的数据进行一致性分析:用spss数据处理软件对上述数据,采用bland-altman(差异图)法分析,将原始数据记录于表8,数据处理如图4所示。
107.表7
表8
根据图3可以看出,对照试剂和考核试剂的测定结果相关系数r=0.9931,说明两者的相关性较好。
108.bland-altman plot是数据离散度的分析,根据图4可以看出,本技术的100例样本中只有四个样本的离散度较高,在允许范围内的正常现象,说明本技术的数据的离散性很好。
109.临床测试二的检测钙卫蛋白临床对比试验的检测的原始数据结果如表9所示,数据处理如图5所示。
110.将对照试剂和考核试剂的数据进行一致性分析:用spss数据处理软件对上述数据,采用bland-altman(差异图)法分析,将原始数据记录于表10,数据处理如图6所示。
111.表9
表10
根据图5可以看出,对照试剂和考核试剂的测定结果相关系数r=0.9913,说明两者的相关性较好。
112.bland-altman plot是数据离散度的分析,根据图6可以看出,本技术的100例样本中只有两个样本的离散度较高,在允许范围内的正常现象,说明本技术的数据的离散性很好。
113.因此,本技术的考核试剂与对照试剂的数据基本一致,能够满足临床实际需要。
114.本具体实施例仅仅是对本技术的解释,其并不是对本技术的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本技术的权利要求范围内都受到专利法的保护。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1