一种生产手性苯甘氨酸的基因工程菌的制备及应用的制作方法
1.本发明涉及生物技术领域,尤其涉及一种生产手性苯甘氨酸的基因工程菌的制备及应用。
背景技术:
2.自然界中存在着多种非天然氨基酸,可用于合成具有生物活性的高值化合物,广泛应用于食品和医药等多个领域。苯甘氨酸作为一种手性非天然氨基酸,具有l和d两种构型,它们在药物合成和工业生产中具有重要的作用。l-苯苷氨酸(l-phenylglycine)可作为医药中间体合成紫杉醇及氨苄青霉素、普那霉素等多种β-内酰胺类抗生素;d-苯甘氨酸(d-phenylglycine)广泛用于美洛西林和头孢菌素等抗生素以及多种农药的合成。目前工业生产苯苷氨酸大多采用化学合成法,合成过程中使用多种有毒试剂,环境污染大。同时,化学合成法难以得到单一手性的产物,给后续的拆分带来了难度,增加了纯化精制的成本。生物合成具有手性选择性强、反应条件温和及设备要求低等优势,成为替代化学法的一种绿色生产方式。
3.随着合成生物和酶催化技术的不断发展,生物合成已经逐步应用于医药、化工和食品等领域,关于手性苯甘氨酸生物合成的研究也越来越多。2016年,liu等人在大肠杆菌中表达了羟基扁桃酸合成酶(hmas)、羟基扁桃酸氧化酶(hmo)和羟基苯甘氨酸氨基转移酶(hpgt),利用l-苯丙氨酸作为底物合成了91.4mg/l的l-苯苷氨酸;2022年,zhu等人在大肠杆菌中引入了氨基酸脱氨酶(laad)、羟基扁桃酸合成酶(hmas)、扁桃酸脱氢酶(smdh)和亮氨酸脱氢酶(leudh),将l-苯丙氨酸转化为l-苯苷氨酸。但是,这些方法仍存在辅因子循环弱、原子经济性差和细胞毒性副产物等局限,例如zhu等人开发的方法中leudh依赖于nadh,胞内有限还原力将限制反应效率。最近,wang等人在大肠杆菌中表达了芳香氨基酸转氨酶(tyrb)、羟基扁桃酸合成酶(hmas)、羟基扁桃酸氧化酶(hmo)、亮氨酸脱氢酶(leudh)和谷氨酸脱氢酶(gdh),将10mm的l-苯丙氨酸转化为了3.72mm的l-苯苷氨酸。但是,这种方法利用芳香转氨酶进行转氨反应,再引入额外的谷氨酸脱氢酶来进行谷氨酸的循环,需要添加较高浓度的谷氨酸,同时,游离铵离子的传递影响了反应效率。
4.因此,本领域的技术人员致力于开发一种辅因子可循环、原子利用率高、经济可持续的手性苯甘氨酸绿色合成方法。
技术实现要素:
5.有鉴于现有技术的上述缺陷,本发明所要解决的技术问题是制备用于生产手性苯苷氨酸的基因工程菌,使氨基受体和氨基供体可以自循环,从而实现稳定的将l-苯丙氨酸高效转化为手性苯甘氨酸。
6.为实现上述目的,本发明提供了一种生产手性苯甘氨酸的基因工程菌的制备方法,步骤为将芳香氨基酸转氨酶和苯苷氨酸转氨酶的编码基因构建于pet载体,将羟基扁桃酸合成酶和羟基扁桃酸氧化酶的编码基因构建于prsf载体,同时转入宿主菌株得到的基因
id no:9所示;将优化后的述hmas合成至prsfduet-1的bamhi和hindiii酶切位点中间,获得prsfduet-hmas,优化后的hmo合成至prsfduet-hmas的ndei和xhoi酶切位点中间,获得重组表达质粒prsfduet-hmas-hmo;优化后的lpat或优化后的dpat合成至petduet-1的ndei和xhoi酶切位点中间,获得重组表达质粒petduet-lpat或petduet-dpat。
20.进一步地,步骤3还包括以下步骤:
21.将步骤1中制备的重组表达质粒petduet-lpat或重组表达质粒petduet-dpat用neb的限制性内切酶bamhi和hindiii进行双酶切,将酶切后的质粒进行回收;将步骤2获得的芳香氨基酸转氨酶编码基因tyrb片段和回收后的重组表达质粒petduet-lpat或回收后的重组表达质粒petduet-dpat进行无缝克隆,获得重组质粒petduet-tyrb-lpat或重组质粒petduet-tyrb-dpat;芳香氨基酸转氨酶编码基因tyrb片段的核苷酸序列如seq id no:10所示。
22.进一步地,宿主菌株为大肠杆菌bl21(de3)菌株。
23.本发明还提供了一种上述方法制备的基因工程菌在生产手性苯甘氨酸l-苯苷氨酸或d-苯苷氨酸中的应用。
24.进一步地,以l-苯丙氨酸为底物,利用基因工程菌进行生物催化反应,反应产物为l-苯苷氨酸或d-苯苷氨酸。
25.进一步地,该应用为将l-苯丙氨酸转化为l-苯苷氨酸或d-苯苷氨酸。
26.进一步地,转化的条件是:ph 6~8,转化温度为25~40℃,转化时间12~18h;转化l-苯丙氨酸制备手性苯苷氨酸时,l-苯丙氨酸的终浓度为20~80mm。
27.进一步地,催化反应通过该基因工程菌以全细胞的形式进行催化。
28.在本发明的较佳实施方式1中,详细说明构建基因工程菌lumy-e207的过程;
29.在本发明的另一较佳实施方式2中,详细说明构建基因工程菌lumy-e208的过程;
30.在本发明的另一较佳实施方式3中,详细说明基因工程菌lumy-e207转化l-苯丙氨酸制备l-苯苷氨酸的过程;
31.在本发明的另一较佳实施方式4中,详细说明基因工程菌lumy-e208转化l-苯丙氨酸制备d-苯苷氨酸的过程。
32.本发明的有益效果为:本发明提供了一种基因工程菌,并用于转化l-苯丙氨酸制备l-苯苷氨酸或d-苯苷氨酸。相对于目前手性苯苷氨酸生物合成法而言,本发明利用芳香氨基酸转氨酶和苯苷氨酸转氨酶形成了氨基受体和氨基供体的胞内自循环,提高了氨基利用效率,可以将l-苯丙氨酸几乎完全转化为l-苯苷氨酸或d-苯苷氨酸,是一种具有重要产业化前景的绿色生物合成技术。
33.以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
34.图1为本发明实施例1中lumy-e207转化l-苯丙氨酸制备l-苯苷氨酸的合成途径示意图;
35.图2为本发明实施例2中lumy-e208转化l-苯丙氨酸制备d-苯苷氨酸的合成途径示意图;
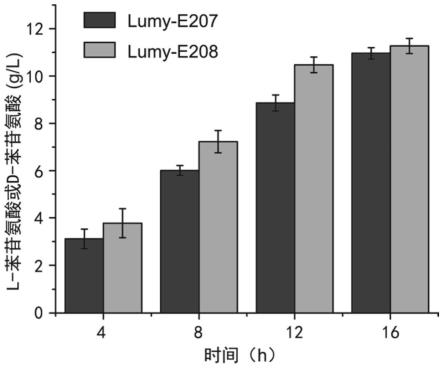
36.图3为本发明实施例3中lumy-e207生产l-苯甘氨酸和实施例4中lumy-e208生产d-苯苷氨酸的产量对比图。
具体实施方式
37.以下参考说明书附图介绍本发明的多个优选实施例,使其技术内容更加清楚和便于理解。本发明可以通过许多不同形式的实施例来得以体现,本发明的保护范围并非仅限于文中提到的实施例。
38.本发明使用的菌株和生长条件如下:
39.克隆宿主dh5α和bl21(de3)购自invitrogen公司,所有大肠杆菌在含有100mg/l相应抗生物(氨苄青霉素或卡那霉素)的lb培养基中,37℃培养。
40.其中,lb液体培养基配方是:蛋白胨10g/l,酵母膏5g/l,nacl 10g/l,ph 7.0;lb固体培养基在lb液体培养基中添加20g/l琼脂;121℃高温高压蒸汽灭菌20min。
41.所有质粒均为petduet-1或prsfduet-1(购自novagen公司)衍生质粒,用于表达目的基因。
42.实施例1
43.构建基因工程菌lumy-e207:
44.(1)合成羟基扁桃酸合成酶(achmas)编码基因(hmas)片段、羟基扁桃酸氧化酶(sahmo)编码基因(hmo)片段、l-苯苷氨酸转氨酶(allphgat)编码基因(lpat)和d-苯苷氨酸转氨酶(psdphgat)编码基因(dpat):
45.利用在线软件jcat,根据大肠杆菌的密码子偏好性将异壁放线菌(actinoalloteichus cyanogriseus)中的hmas基因、花青蓝链霉菌(streptomyces anthocyanicus)中的hmo基因、苍黄拟无枝酸菌(amycolatopsis lurida)中的lpat基因和施氏假单孢菌(pseudomonas stutzeri)中的dpat基因进行密码子优化,优化后hmas的核苷酸序列如seq id no:6所示,hmo的核苷酸序列如seq id no:7所示,lpat的核苷酸序列如seq id no:8所示,dpat的核苷酸序列如seq id no:9所示。将上述基因序列送金唯智公司(genewiz)进行基因合成,hmas合成至prsfduet-1的bamhi和hindiii酶切位点中间,获得prsfduet-hmas,hmo合成至prsfduet-hmas的ndei和xhoi酶切位点中间,获得重组表达质粒prsfduet-hmas-hmo;lpat和dpat分别合成至petduet-1的ndei和xhoi酶切位点中间,获得重组表达质粒petduet-lpat和petduet-dpat。
46.(2)获得芳香氨基酸转氨酶(ecaat)编码基因(tyrb)片段:
47.采用常规的方法制备大肠杆菌k12的基因组dna,该过程可参考科学出版社出版的《精编分子生物学指南》中细菌基因组的小量制备方法;
48.利用大肠杆菌k12基因组为模板,根据《分子克隆实验指南(第三版)》中描述的方法进行pcr扩增tyrb,tyrb的核苷酸序列如seq id no:10所示。
49.pcr引物:tyrb基因上游引物tyrb-f:5
′‑
accatcatcaccacagccagatgtttcaaaaagttgacgcctac-3
′
,下游引物tyrb-r:5
′‑
cttaagcattatgcggccgcttacatcaccgcagcaaacg-3
′
。
50.将得到的tyrb片段pcr产物用axygen公司的axyprep dna gel extraction kit,参照说明书中描述的方法对dna片段进行切胶回收。
51.(3)获得petduet-tyrb-lpat:
52.将步骤(1)中petduet-lpat质粒用neb的限制性内切酶bamhi和hindiii进行双酶切,将酶切后的质粒用axygen公司的axyprep dna gel extraction kit参照说明书中描述的方法进行回收。将tyrb基因片段和回收的petduet-lpat质粒用诺唯赞公司(vazyme)的clonexpress ultra one step cloning kit参照说明书中描述的方法进行无缝克隆,获得重组质粒petduet-tyrb-lpat。
53.(4)获得基因工程菌lumy-e207:
54.将5μl步骤(1)中得到重组质粒prsfduet-hmas-hmo和5μl步骤(3)中得到重组质粒petduet-tyrb-lpat通过热激的方法转化入大肠杆菌bl21(de3)感受态细胞中。将热激后的菌液涂布到含有100mg/l氨苄青霉素和卡那霉素的lb固体培养基平板上,37℃恒温培养箱中培养12小时。在平板上挑取单菌落至5ml lb液体培养基(含有100mg/l氨苄青霉素和卡那霉素)中,37℃摇床中培养,摇床转速为200转/分钟;将培养后的菌液进行pcr扩增验证,获得基因工程菌株lumy-e207,如图1所示,lumy-e207可用于转化l-苯丙氨酸制备l-苯苷氨酸。
55.实施例2
56.构建基因工程菌lumy-e208:
57.(1)获得petduet-tyrb-dpat:
58.将步骤(1)中petduet-dpat质粒用neb的限制性内切酶bamhi和hindiii进行双酶切,将酶切后的质粒用axygen公司的axyprep dna gel extraction kit参照说明书中描述的方法进行回收。将tyrb基因片段和回收的petduet-dpat质粒用诺唯赞公司(vazyme)的clonexpress ultra one step cloning kit参照说明书中描述的方法进行无缝克隆,获得重组质粒petduet-tyrb-dpat。
59.(2)获得基因工程菌lumy-e208:
60.将5μl步骤(1)中得到重组质粒petduet-tyrb-dpat和将5μl实施例1步骤(1)中得到重组质粒prsfduet-hmas-hmo通过热激的方法转化入大肠杆菌bl21(de3)感受态细胞中。将热激后的菌液涂布到含有100mg/l氨苄青霉素和100mg/l卡那霉素的lb固体培养基平板上,37℃恒温培养箱中培养12小时。在平板上挑取单菌落至5ml lb液体培养基(含有100mg/l氨苄青霉素和100mg/l卡那霉素)中,37℃摇床中培养,摇床转速为200转/分钟。将培养后的菌液进行pcr扩增验证,获得基因工程菌株lumy-e208,如图2所示,lumy-e208可用于转化l-苯丙氨酸制备d-苯苷氨酸。
61.实施例3
62.基因工程菌lumy-e207转化l-苯丙氨酸制备l-苯苷氨酸
63.(1)制备基因工程菌lumy-e207的全细胞催化剂:
64.将实施列1步骤(4)获得的基因工程菌lumy-e207,用接种环接种到50ml lb液体培养基(含有100mg/l氨苄青霉素和100mg/l卡那霉素)中进行菌株活化,37℃过夜培养;随后,按照1%(体积比)接种量将活化后的菌液接种到5l lb液体培养基(含有100mg/l氨苄青霉素和100mg/l卡那霉素)中,37℃,200rpm,培养3-5小时至od600达到0.6-0.8,加入0.2mm iptg,16℃,200rpm,诱导培养16h;收集所得的培养液,4℃,3500rpm,离心15分钟收集菌体,并用磷酸盐缓冲液将菌体洗涤2次后备用。
65.(2)lumy-e207转化l-苯丙氨酸制备l-苯苷氨酸
66.以步骤(1)收集的菌体为催化剂构建反应体系,菌体添加量为终浓度20g/l,加入80mm的l-苯丙氨酸,ph=8,反应条件为30℃,搅拌转速为200rpm,15h。用hplc法检测l-苯甘氨酸的生成量,使用agilent1260液相色谱仪,色谱柱为eclipse xdb-c18柱(4.6
×
150mm),检测波长215nm,柱温30℃,流动相为甲醇-水(20∶80,v/v),流速1ml/min。l-苯丙氨酸经基因重组菌转化后获得10.96g/l的l-苯甘氨酸,摩尔转化率达到93%以上。将反应液煮沸离心去除蛋白,经减压蒸馏结晶和硅胶柱分离纯化,获得l-苯甘氨酸纯品,e.e.值在99%以上。
67.实施例4
68.基因工程菌lumy-e208转化l-苯丙氨酸制备d-苯苷氨酸
69.(1)制备基因工程菌lumy-e208的全细胞催化剂:
70.将实施列2步骤(2)获得的基因工程菌lumy-e208,用接种环接种到50ml lb液体培养基(含有100mg/l氨苄青霉素和100mg/l卡那霉素)中进行菌株活化,37℃过夜培养;随后,按照1%(体积比)接种量将活化后的菌液接种到5l lb液体培养基(含有100mg/l氨苄青霉素和100mg/l卡那霉素)中,37℃,200rpm,培养3-5小时至od600达到0.6-0.8,加入0.2mm iptg,16℃,200rpm,诱导培养16h;收集所得的培养液,4℃,3500rpm,离心15分钟收集菌体,并用磷酸盐缓冲液将菌体洗涤2次后备用。
71.(2)lumy-e208转化l-苯丙氨酸制备d-苯苷氨酸
72.以步骤(1)收集的菌体为催化剂构建反应体系,菌体添加量为终浓度20g/l,加入80mm的l-苯丙氨酸,ph=8,反应条件为30℃,搅拌转速为200rpm,12h。用hplc法检测d-苯甘氨酸的生成量,使用agilent1260液相色谱仪,色谱柱为eclipse xdb-c18柱(4.6
×
150mm),检测波长215nm,柱温30℃,流动相为甲醇-水(20∶80,v/v),流速1ml/min。l-苯丙氨酸经基因重组菌转化后获得11.27g/l的d-苯甘氨酸,摩尔转化率达到93%以上。将反应液煮沸离心去除蛋白,经减压蒸馏结晶和硅胶柱分离纯化,获得d-苯甘氨酸纯品,e.e.值在99%以上。
73.lumy-e207生产l-苯甘氨酸和lumy-e208生产d-苯苷氨酸的产量对比如图3所示。
74.以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1