一种人源化的抗CD25的单域抗体及其应用的制作方法
一种人源化的抗cd25的单域抗体及其应用
技术领域
1.本发明涉及生物技术或免疫学技术领域,具体涉及一种人源化的能够与cd25特异性结合的单域抗体,以及含有该人源化单域抗体作为有效成分的药物组合物,及其药物治疗用途。
背景技术:
2.cd25是人白细胞介素2(il2)受体的α亚基,il-2是免疫应答中重要的细胞因子,其受体有α、β、γ三个亚基组成;单独的α亚基是il-2的中等亲和力受体,当α亚基与β、γ异源二聚体结合起来就构成了完整的高亲和力的受体,接受il-2的信号,激活t淋巴细胞开始有丝分裂,因而cd25主要参与t细胞的活化和免疫系统的激活,起始各种免疫应答和免疫移植排斥反应。此外,t细胞的过度活化会引起t细胞增殖失去控制而引发t细胞淋巴瘤。
3.静息t细胞、b细胞和单核细胞能表达少量cd25分子。不过,所述受体在激活时能快速转录并且表达(ellery等(2002)cytokine growth factor rev.13(1):27-40;morris等(2000)ann.rheum.dis.59(suppl.1):il09-14).表达所述高亲和力il-2r的细胞,能过量表达cd25(cd25-亚基),这会导致高和低亲和力il-2的结合特征(waldmann等(1993)blood 82(6):1701-12;de jong等(1996)j.immunol.156(4):1339-48).cd25是在某些自身免疫病,如类风湿关节炎、硬皮病和葡萄膜炎,及皮肤病,例如,牛皮癣和特应性皮炎,和多种淋巴样瘤,例如,t细胞白血病和何杰金病中由t细胞高水平表达的(waldmann(1993)immunol.today 14(6):264-70;kuttler等(1999)j.mol.med.77(1):226-9).另外,cd25表达与同种异体移植物排斥和移植物抗宿主反应相关(jones等(2002)j.immunol.168(3):1123-1130;anasetti等(1994)blood84(4):1320-7)。
4.因此,cd25是抗体介导的治疗的重要目标,例如,用于减轻自了免疫病的炎症,治疗肿痛,以及预防移植物排斥。不过,尽管所获得的结果以及迄今所获得的临床经验明确确定了cd25是免疫治疗的有用目标,它们还显示目前可以获得的鼠和嵌合抗体不能构成理想的治疗剂。因此,需要抗cd25的其他治疗性抗体,它能有效预防和/或治疗与表达cd25的细胞相关的多种疾病。
5.目前,cd25抑制剂临床主要运用于自身免疫病以及器官移植的免疫排斥,未来有望进一步拓展至肿瘤治疗领域。达利珠单抗(daclizumab)是由百健(biogen)和艾伯维(abbvie)合作开发的一款人源化、可选择性高亲和结合t细胞表面白细胞介素2(il-2)受体亚基cd25的单抗药物。达利珠单抗先后两次上市,首次于2009年上市,适应症为器官移植的免疫抑制,后来由于商业化问题,2009年退市。之后百健通过去岩藻糖基化降低了药物的adcc作用,达利珠单抗于2016年“复活”,用于多发性硬化症(ms)的治疗。多发性硬化症是一种自身免疫病,临床表现包括视力障碍、肢体瘫痪、感觉异常等。在多发性硬化症患者中,cd25呈高水平表达,t细胞被异常激活。达利珠单抗通过调节il-2通路,减少异常激活的t细胞,有效调节免疫紊乱。但是,2018年3月,百健和艾伯维宣布达利珠单抗全球退市。退市原因主要是达利珠单抗存在严重的不良事件,包括炎症性大脑功能紊乱及肝脏毒性导致的患
者死亡。巴利昔单抗(舒莱)是一种人/鼠嵌合的单克隆抗体,可定向拮抗il-2的受体α链(cd25),阻断t细胞与il-2结合,抑制teff细胞的增殖。2002年,巴利昔单抗在国内获批上市,适应症为预防肾移植术后的早期急性器官排斥。2019年,巴利昔单抗纳入医保。
6.2019年,三生国健的人源化抗cd25单克隆抗体注射液健尼哌上市,适应症为预防肾移植引起的急性排斥反应。健尼哌特异性作用于激活的t细胞il2受体α链,通过与cd25结合,拮抗il-2与受体结合所介导的t细胞增殖。
7.人源化单域抗体,fr区部分氨基酸序列由人源序列取代,保留亲本单域抗体的亲和力和特异性,又降低了其异源性,有利于应用于人体。
8.目前,现有技术中仍缺少亲和力强、具有药用价值的人源化的抗cd25的单域抗体产品。
技术实现要素:
9.本发明的目的是提供一种人源化的能够与cd25特异性结合的单域抗体及其用途。
10.本发明的第一方面是提供一种人源化的抗cd25的单域抗体,所述的单域抗体由重链构成,重链包括seq id no:17所示的重链cdr1、seq id no:18所示的重链cdr2和seq id no:19所示的重链cdr3,所述的重链还包括框架区fr;所述框架区fr包括fr1、fr2、fr3和fr4的氨基酸序列;框架区fr的氨基酸序列为下述(1)-(16)的一种:
11.(1)seq id no:20所示的fr1,seq id no:21所示的fr2,seq id no:26所示的fr3;seq id no:31所示的fr4;
12.(2)seq id no:20所示的fr1,seq id no:21所示的fr2,seq id no:25所示的fr3;seq id no:31所示的fr4;
13.(3)seq id no:20所示的fr1,seq id no:21所示的fr2,seq id no:24所示的fr3;seq id no:31所示的fr4;
14.(4)seq id no:20所示的fr1,seq id no:21所示的fr2,seq id no:23所示的fr3;seq id no:31所示的fr4;
15.(5)seq id no:20所示的fr1,seq id no:21所示的fr2,seq id no:30所示的fr3;seq id no:31所示的fr4;
16.(6)seq id no:20所示的fr1,seq id no:21所示的fr2,seq id no:29所示的fr3;seq id no:31所示的fr4;
17.(7)seq id no:20所示的fr1,seq id no:21所示的fr2,seq id no:28所示的fr3;seq id no:31所示的fr4;
18.(8)seq id no:20所示的fr1,seq id no:21所示的fr2,seq id no:27所示的fr3;seq id no:31所示的fr4;
19.(9)seq id no:20所示的fr1,seq id no:22所示的fr2,seq id no:26所示的fr3;seq id no:31所示的fr4;
20.(10)seq id no:20所示的fr1,seq id no:22所示的fr2,seq id no:25所示的fr3;seq id no:31所示的fr4;
21.(11)seq id no:20所示的fr1,seq id no:22所示的fr2,seq id no:24所示的fr3;seq id no:31所示的fr4;
22.(12)seq id no:20所示的fr1,seq id no:22所示的fr2,seq id no:23所示的fr3;seq id no:31所示的fr4;
23.(13)seq id no:20所示的fr1,seq id no:22所示的fr2,seq id no:30所示的fr3;seq id no:31所示的fr4;
24.(14)seq id no:20所示的fr1,seq id no:22所示的fr2,seq id no:29所示的fr3;seq id no:31所示的fr4;
25.(15)seq id no:20所示的fr1,seq id no:22所示的fr2,seq id no:28所示的fr3;seq id no:31所示的fr4;
26.(16)seq id no:20所示的fr1,seq id no:22所示的fr2,seq id no:27所示的fr3;seq id no:31所示的fr4。
27.上述所有序列,可以替换为与该序列具有“至少80%同源性”的序列或仅一个或少数几个氨基酸替换的序列;优选为“至少85%同源性”,更优选为“至少90%同源性”,更优选为“至少95%同源性”,最优选为“至少98%同源性”。
28.在一个实施方案中,其中所述重链cdr1、cdr2和cdr3的任何一个或多个cdr中,一个至五个任意氨基酸残基可以分别用其保守氨基酸取代。具体地,所述重链cdr1中,1至5个氨基酸残基可由其保守氨基酸替换;所述重链cdr2中,1至5个氨基酸残基可由其保守氨基酸替换;所述重链cdr3中,1至5个氨基酸残基可由其保守氨基酸替换。
29.在一个实施方案中,其中所述fr1、fr2、fr3及fr4的任何一个框架区域的氨基酸序列,一个至五个任意氨基酸残基可以分别用其保守氨基酸取代。
30.本发明的发明人在seq id no.32的驼源抗cd25单域抗体基础上,在合适的位置,经过科学合理的人源化改造,得到的保持其亲和力和adcc效应,并有效减低了免疫副反应的人源化的cd25单域抗体。
31.上述各互补决定区和各骨架通过如下顺序连接形成本发明单域抗体一级序列结构:fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4。
32.如本文所用,术语“序列同源性”表示两个(核苷酸或氨基酸)序列在比对中在相同位置处具有相同残基的程度,并且通常表示为百分数。优选地,同源性在被比较的序列的整体长度上确定。因此,具有完全相同序列的两个拷贝具有100%同源性。
33.在一些实施例中,与前述序列相比仅仅替换一个或少数几个氨基酸的序列,例如,包含1、2、3、4、5、6、7、8、9或10个保守氨基酸取代,也可以实现发明目的。这些变异形式包括(但并不限于):一个或多个(通常为1-50个,较佳地1-30个,更佳地1-20个,最佳地1-10个)氨基酸的缺失、插入和/或取代,以及在c末端和/或n末端添加一个或数个(通常为20个以内,较佳地为10个以内,更佳地为5个以内)氨基酸。实际上,在确定两个氨基酸序列之间的序列同源性程度或在确定单域抗体中的cdr1、cdr2和cdr3组合时,技术人员可以考虑所谓的“保守”氨基酸取代,在取代情况下,所述取代将优选为保守氨基酸取代。所述保守氨基酸,其通常可以被描述为氨基酸残基被具有相似化学结构的另一个氨基酸残基替代的氨基酸取代,并且该取代对多肽的功能、活性或其它生物学性质几乎没有或基本上没有影响。所述保守氨基酸取代在本领域是通用的,例如保守氨基酸取代是以下(a)-(d)组内的一个或少数几个氨基酸被同一组内另一个或少数几个氨基酸所取代:(a)极性带负电残基及其不带电酰胺:asp、asn、glu、gln;(b)极性带正电残基:his、arg、lys;(c)芳香族残基:phe、trp、
tyr;(d)脂肪族非极性或弱极性残基:ala、ser、thr、gly、pro、met、leu、ile、val、cys。特别优选的保守氨基酸取代如下:asp被glu取代;asn被gln或his取代;glu被asp取代;gln被asn取代;his被asn或gln取代;arg被lys取代;lys被arg、gln取代;phe被met、leu、tyr取代;trp被tyr取代;tyr被phe、trp取代;ala被gly或ser取代;ser被thr取代;thr被ser取代;gly被ala或pro取代;met被leu、tyr或ile取代;leu被ile或val取代;ile被leu或val取代;val被ile或leu取代;cys被ser取代。另外,本领域技术人员知晓,框架区序列fr1-4并非是不可改变的,fr1-4的序列可以采取本发明公开的序列的保守序列变体。
34.本发明中的“人源化的抗cd25的单域抗体”的含义,不仅包括完整的单域抗体,还包括人源化的抗cd25的单域抗体的片段、衍生物和类似物。如本文所用,术语“片段”、“衍生物”和“类似物”含义相同,均是指基本上保持本发明抗体相同的生物学功能或活性的多肽。本发明的多肽片段、衍生物或类似物可以是(i)有一个或多个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的多肽,而这样的取代的氨基酸残基可以是也可以不是由遗传密码编码的,或(ii)在一个或多个氨基酸残基中具有取代基团的多肽,或(iii)成熟多肽与另一个化合物(比如延长多肽半衰期的化合物,例如聚乙二醇)融合所形成的多肽,或(iv)附加的氨基酸序列融合到此多肽序列而形成的多肽(如前导序列或分泌序列或用来纯化此多肽的序列或蛋白原序列,或与fc标签形成的融合蛋白)。根据本文的教导,这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。
35.本发明的第二方面是提供一种人源化的抗cd25的单域抗体,所述单域抗体的氨基酸序列分别如seq id no.1-16所示,或者所述单域抗体与seq id no.1-16的氨基酸序列具有至少80%序列同源性,并且能够特异性结合cd25蛋白。
36.在一个实施方案中,所述人源化的抗cd25的单域抗体与选自seq id no:1-16的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%序列同源性,并且能够特异性结合cd25蛋白。
37.本发明的第三个方面是提供编码前述的人源化的抗cd25的单域抗体的核苷酸分子。
38.本发明的第四个方面是提供一种双特异性抗体,所述双特异性抗体包括第一抗原结合部分和第二抗原结合部分,第一抗原结合部分为前述的人源化的抗cd25的单域抗体。第二抗原结合部分为另一种抗体,另一种抗体可以为针对pd-1、cd4的抗体(可以为单抗、多抗、单域抗体或者抗体的其它任意形式)。
39.本发明的第五个方面是提供一种重组蛋白,其包含前述的人源化的抗cd25的单域抗体。
40.本发明的第六个方面是提供一种表达载体,其包含编码前述的人源化的抗cd25的单域抗体或者前述重组蛋白的核酸分子。
41.在一个优选的实施方案中,所使用的表达载体为rjk-v4-hfc1(通过基因工程手段将编码人源化的抗cd25的单域抗体的核苷酸分子整合入rjk-v4-hfc1中),根据需要还可以选择其他的通用型表达载体。
42.本发明的第七个方面是提供一种能够表达前述的人源化抗cd25的单域抗体或前述重组蛋白的宿主细胞,或其包含前述的表达载体。优选宿主细胞为细菌细胞、真菌细胞或哺乳动物细胞。
43.在另一个优选的实施方案中,所述的宿主细胞包括原核细胞或真核细胞,包括细菌,真菌。
44.在另一个优选的实施方案中,所述的宿主细胞选自下组:大肠杆菌、酵母细胞、哺乳动物细胞、噬菌体、或其组合。
45.在另一个优选的实施方案中,所述原核细胞选自下组:大肠杆菌、枯草杆菌、乳酸菌、链霉菌、奇异变形菌、或其组合。
46.在另一个优选的实施方案中,所述真核细胞选自下组:巴斯德毕赤酵母、酿酒酵母、裂殖酵母、木霉、或其组合。
47.在另一个优选的实施方案中,所述真核细胞选自下组:草地粘虫等昆虫细胞、烟草等植物细胞、bhk细胞、cho细胞、cos细胞、骨髓瘤细胞、或其组合。
48.在另一个优选的实施方案中,所述宿主细胞为悬浮expicho-s细胞。
49.在另一个优选的实施方案中,所述宿主细胞为悬浮293f细胞。
50.本发明的第八个方面是提供一种检测cd25蛋白水平的试剂盒,所述的试剂盒含有前述的人源化的抗cd25的单域抗体。
51.本发明的第九个方面是提供一种药物组合物,其包含前述的人源化的抗cd25的单域抗体和/或药学上可接受的载体。通常,可将这些物质配制于无毒的、惰性的和药学上可接受的水性载体介质中,其中ph通常根据抗体的等电点确定(水性载体介质的ph需偏离该抗体的等电点,且与该抗体的等电点相差大约2)。配制好的药物组合物可以通过常规途径进行给药,其中包括(但并不限于):静脉内、透皮(在患处直接涂抹或贴敷膏药)。
52.本发明的药物组合物含有安全有效量(如0.001-99wt%,较佳地0.01-90wt%,更佳地0.1-80wt%)的前述的单域抗体以及药学上可接受的载体或赋形剂。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。药物制剂应与给药方式相匹配。本发明的药物组合物可以被制成针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。药物组合物如针剂、溶液宜在无菌条件下制造。
53.在另一个优选的实施方案中,本发明提供了一种用于治疗肿瘤的药剂,其包含前述的人源化的抗cd25的单域抗体作为活性成分。
54.在另一个优选的实施方案中,本发明提供了一种用于治疗自身免疫性疾病的药剂,其包含前述的人源化的抗cd25的单域抗体作为活性成分。
55.本发明的第十个方面,提供了一种产生人源化抗cd25的单域抗体的方法,包括步骤:
56.(a)在适合产生单域抗体的条件下,培养本发明的第六个方面所述的宿主细胞,从而获得含所述人源化的抗cd25的单域抗体的培养物;以及
57.(b)从所述培养物中分离或回收所述的人源化的抗cd25的单域抗体;以及
58.(c)任选地,纯化和/或修饰步骤(b)中获得的人源化的cd25的单域抗体。
59.本发明的第十二个方面是提供针对前述的人源化的抗cd25的单域抗体或药物组合物在制备用于治疗或预防疾病的药物中的用途。
60.在一个优选的实施方案中,所述疾病为肿瘤,或者所述疾病为与cd25异常表达相关的病症。cd25异常表达一般指cd25高于正常水平的表达。
61.所述肿瘤诸如b细胞恶性肿瘤、淋巴瘤(霍奇金氏淋巴瘤(hodgkins lymphoma)、非
霍奇金氏淋巴瘤、慢性淋巴细胞性白血病、急性成淋巴细胞白血病、骨髓瘤)、骨髓增生病症、实体瘤(如乳腺癌、鳞状细胞癌、结肠癌、头颈癌、肺癌、泌尿生殖癌、直肠癌、胃癌、肉瘤、黑素瘤、食道癌、肝癌、睪丸癌、宫颈癌、肥大细胞瘤、血管瘤、眼癌、喉癌、口腔癌、间皮瘤、皮肤癌、直肠癌、喉癌、膀胱癌、乳腺癌、子宫癌、前列腺癌、肺癌、胰腺癌、肾癌、胃癌(stomach cancer)、胃癌(gastric cancer)、非小细胞肺癌、肾癌、脑癌及卵巢癌)。
62.另一个优选的实施方案中,前述的疾病选自为类风湿关节炎、硬皮病和葡萄膜炎、皮肤病,例如,牛皮癣和特应性皮炎,和多种淋巴样瘤、多发性硬化症。
63.另一个优选的实施方案中,预防疾病的药物主要用于预防肾移植后急性排斥反应的发生。此外,还可预防心脏、肺、肝、肾脏、胰、小肠、皮肤、角膜和血管移植后的急性免疫排斥。
64.有益效果
65.相对于现有技术,本发明的有益效果是:本发明提供的抗cd25单域抗体经过了人源化改造,保持了其亲和力和肿瘤细胞增殖阻断效果,并有效减低免疫副反应。
附图说明
66.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
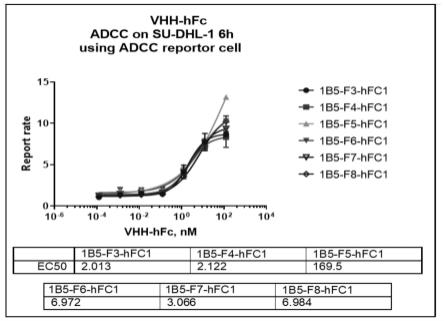
67.图1为实施例3中靶向cd25抗体筛选的文库富集情况;
68.图2为实施例12中的抗体抗原结合量效曲线测定图(tab、higg、一部分克隆);
69.图3为实施例12中的抗体抗原结合量效曲线测定图(另一部分克隆);
70.图4为实施例12中的抗体抗原结合量效曲线测定图(又一部分克隆);
71.图5为实施例12中的抗体抗原结合量效曲线测定图(另一部分克隆);
72.图6为实施例13中人源化单域抗体以及工具抗体诱导的adcc作用(tab、higg、一部分克隆);
73.图7为实施例13中人源化单域抗体以及工具抗体诱导的adcc作用(另一部分克隆);
74.图8为实施例13中人源化单域抗体以及工具抗体诱导的adcc作用(又一部分克隆);
75.图9为实施例13中人源化单域抗体以及工具抗体诱导的adcc作用(另一部分克隆);
76.图10为人源化抗体按照cdr、fr拆分后的氨基酸序列示意图;
77.图11为16种人源化抗体的完整氨基酸序列示意图。
具体实施方式
78.下面结合实施例对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
79.如本文所用,“单域抗体”(sdab,也被研发者ablynx称为纳米抗体或vhh)是本领域
技术人员公知的。单域抗体为其互补决定区是单域多肽的一部分的抗体。因此,单域抗体包含单个互补决定区(单个cdr1、单个cdr2和单个cdr3)。单域抗体的实例为仅有重链的抗体(该抗体天然不包含轻链)、衍生自常规抗体的单域抗体和工程化抗体。
80.单域抗体可以衍生自任何物种,包括小鼠、人、骆驼、美洲驼、山羊、兔和牛。例如,天然存在的vhh分子可以衍生自骆驼科物种(例如骆驼、单峰骆驼、美洲驼和原驼)提供的抗体。像完整的抗体一样,单域抗体能够选择性地结合特定抗原。单域抗体可以仅含有免疫球蛋白链的可变结构域,该结构域具有cdr1、cdr2和cdr3以及框架区。
81.如本文所用,术语“序列同源性”表示两个(核苷酸或氨基酸)序列在比对中在相同位置处具有相同残基的程度,并且通常表示为百分数。优选地,同源性在被比较的序列的整体长度上确定。因此,具有完全相同序列的两个拷贝具有100%同源性。
82.术语“人源化抗体”是指将目标抗体(如动物抗体)的重链可变区与人抗体的恒定区融合而得到的抗体,或将目标抗体的互补决定区(cdr1~3序列)移植至人抗体的可变区内,得到的抗体,或将目标抗体根据人抗体骨架区(fr1~4)的特征进行氨基酸的突变后获得的抗体。人源化抗体可用合成法或定点突变法。
83.本文中如seq id no.1-16所示的抗体为将目标抗体根据人抗体骨架区(fr1~4)的特征进行氨基酸的突变后获得的抗体。
84.在一些实施例中,与seq id no.1-16中的序列具有“至少80%同源性”的序列,或者“至少85%同源性”、“至少90%同源性”、“至少95%同源性”、“至少98%同源性”的序列都可以实现发明目的。
85.在一些实施例中,与seq id no:1-16中的序列相比仅仅替换一个或少数几个氨基酸的序列,例如,包含1、2、3、4、5、6、7、8、9或10个保守氨基酸取代,也可以实现发明目的。实际上,在确定两个氨基酸序列之间的序列同源性程度或在确定单域抗体中的cdr1、cdr2和cdr3组合时,技术人员可以考虑所谓的“保守”氨基酸取代,在取代情况下,所述取代将优选为保守氨基酸取代,所述保守氨基酸,其通常可以被描述为氨基酸残基被具有相似化学结构的另一个氨基酸残基替代的氨基酸取代,并且该取代对多肽的功能、活性或其它生物学性质几乎没有或基本上没有影响。所述保守氨基酸取代在本领域是通用的,例如保守氨基酸取代是以下(a)-(d)组内的一个或少数几个氨基酸被同一组内另一个或少数几个氨基酸所取代:(a)极性带负电残基及其不带电酰胺:asp、asn、glu、gln;(b)极性带正电残基:his、arg、lys;(c)芳香族残基:phe、trp、tyr;(d)脂肪族非极性或弱极性残基:ala、ser、thr、gly、pro、met、leu、ile、val、cys。特别优选的保守氨基酸取代如下:asp被glu取代;asn被gln或his取代;glu被asp取代;gln被asn取代;his被asn或gln取代;arg被lys取代;lys被arg、gln取代;phe被met、leu、tyr取代;trp被tyr取代;tyr被phe、trp取代;ala被gly或ser取代;ser被thr取代;thr被ser取代;gly被ala或pro取代;met被leu、tyr或ile取代;leu被ile或val取代;ile被leu或val取代;val被ile或leu取代;cys被ser取代。另外,本领域技术人员知晓,框架区序列fr1-4并非是不可改变的,fr1-4的序列可以采取本发明公开的序列的保守序列变体。
86.本发明的优选宿主细胞为细菌细胞、真菌细胞或哺乳动物细胞。
87.本发明的人源化单域抗体特异性针对具有正确空间结构的cd25蛋白。本发明得到的人源化单域抗体,表达体系选择灵活,既可以在原核系统中表达也可以在酵母细胞或哺
乳动物细胞的真核系统中表达,且其在原核表达系统中的表达成本低,可降低后期生产成本。本发明得到的人源化单域抗体,其抗体的多组合形式改造简单,通过基因工程的方式简单的串联即可以获得多价、多特异性的抗体,并且其免疫异质性很低,在不经过人源化改造的情况下也不会产生较强的免疫反应。本发明得到人源化单域抗体,其亲和力范围更为宽泛,在未进行亲和力成熟之前,其亲和力范围可以从nm级别至pm级别,为后期不同用途的抗体提供多个选择。
88.本专利是通过基因工程技术制备目标蛋白以及目标蛋白的截短体形式,然后将获得的抗原蛋白免疫内蒙古阿拉善双峰驼,通过多次免疫后,获得骆驼的外周血淋巴细胞或者脾细胞,通过基因工程的方式,将驼源抗体可变区编码序列重组到噬菌体展示载体中,通过噬菌体展示技术筛选出针对抗原蛋白的特异性抗体,并进一步检测其与抗原结合的能力以及在包括自身免疫疾病、肿瘤、移植排异治疗中的应用。
89.现将上述技术方案拆分详解,以具体实施例的方式描述:
90.以下结合实施例对本发明的特征和性能作进一步的详细描述。
91.实施例1针对人源重组cd25蛋白的单域抗体的制备。
92.本专利中用到的人源重组胞外结构域蛋白为公司自己表达纯化获得,人源重组cd25蛋白的表达载体设计方案具体如下:
93.(1)在ncbi中检索获得cd25的编码序列,其收录号为nm_000417.2,该序列编码产生的氨基酸序列登录号为np_000408.1,uniprot id为p01589。
94.(2)利用基因合成的方式将编码cd25蛋白的核苷酸序列克隆到载体pcdna3.4中。将构建好的载体进行sanger测序,比对原始序列,确认无误后,将该重组质粒进行大量抽提,去除内毒素,转染悬浮293f细胞进行目的蛋白的表达和纯化,纯度达到90%以上,满足动物免疫要求。
95.实施例2构建cd25蛋白的单域抗体文库
96.将1mg实施例1中纯化获得的人源重组cd25蛋白与等体积的弗氏完全佐剂混合,免疫一只内蒙古阿拉善双峰驼,每周免疫一次,共连续免疫7次,除首次免疫外,其余六次均是用1mg cd25蛋白与弗氏不完全佐剂等体积混合进行动物免疫,该免疫过程是为了集中刺激骆驼使其产生针对cd25蛋白的抗体。
97.动物免疫结束后,抽取骆驼外周血淋巴细胞150ml,并提取细胞的rna。利用提取的总rna合成cdna,并通过套式pcr反应以cdna为模板扩增vhh(抗体重链可变区)。
98.然后利用限制性内切酶分别酶切pmecs载体和vhh片段,然后将酶切后的片段和载体链接。将连接后的片段电转化至感受态细胞tg1中,构建cd25蛋白的噬菌体展示文库并测定库容,文库的库容大小约为1
×
109,同时,通过菌落pcr鉴定检测文库在目的片段的正确插入率。
99.结果显示,从文库中随机挑选的15个菌落进行pcr扩增后,有14个克隆可以扩增出为预测大小的条带,有1个克隆扩增出条带不正确,故正确插入率为(14/15)
×
100%≈93.3%。
100.实施例3:筛选抗cd25蛋白的单域抗体
101.取200μl实施例2中的重组tg1细胞至2
×
ty培养基中培养,期间加入40μl辅助噬菌体vcsm13侵染tg1细胞,并培养过夜以扩增噬菌体,次日利用peg/nacl沉淀噬菌体,离心收
集扩增噬菌体。
102.将稀释在100mm ph8.3的nahco3中的cd25蛋白500μg偶联在酶标板上,4℃放置过夜,同时设立阴性对照孔(培养基对照);第二天加入200μl的3%的脱脂乳,室温封闭2h;封闭结束后,加入100μl扩增后噬菌体文库(大约2
×
10
11
个噬菌体颗粒),室温作用1h;作用1小时后,用pbs+0.05%tween-20洗15遍,以洗掉未结合的噬菌体。
103.用终浓度为25mg/ml的胰蛋白酶将与cd25蛋白特异性结合的噬菌体解离下,并感染处于对数生长期的大肠杆菌tg1细胞,37℃培养1h,产生并收集噬菌体用于下一轮的筛选,相同筛选过程重复1轮,逐步得到富集。
104.当富集倍数达到10倍以上时,富集效果如图1所示。
105.图1中,p/n=生物淘选中阳性孔洗脱下的噬菌体感染tg1细菌后生长的单克隆细菌数/阳性孔洗脱下的噬菌体感染tg1细菌后生长的单克隆细菌数,该参数在富集发生后会逐渐增大;i/e=生物淘选中每轮加入阳性孔的噬菌体总量/生物淘选中每轮从阳性孔洗脱出的噬菌体总量,该参数在富集发生后会逐渐趋近于1。
106.实施例4:用噬菌体的酶联免疫方法(elisa)筛选针对cd25的特异性阳性克隆:
107.根据上述实施例3中的筛选方法对抗cd25蛋白的单域抗体进行3轮筛选,抗cd25蛋白的噬菌体富集因子达到10以上,筛选结束后,从筛选获得的阳性克隆中挑选384个单菌落分别接种于含100μg/ml氨苄青霉素的2
×
ty培养基的96深孔板中,并设置空白对照,37℃培养至对数期后,加入终浓度为1mm的iptg,28℃培养过夜。
108.利用渗透涨破法获得粗提抗体;将cd25重组蛋白分别释至100mm ph8.3的nahco3中并将100μg蛋白在酶标板(elisa板)中4℃包被过夜。将获得的抗体粗提液取100μl转移至加入抗原的elisa板上,室温孵育1h;用pbst洗去未结合的抗体,加入100μl经1:2000稀释后的mouse anti-ha tag antibody(hrp)(鼠抗ha辣根过氧化物酶标记抗体,thermo fisher),在室温孵育1h;用pbst洗去未结合的抗体,加入辣根过氧化物酶显色液,37℃下反应15min后,加入终止液,于酶标仪上450nm波长处,读取吸收值。
109.当样品孔od值大于对照孔5倍以上时,判定为阳性克隆孔;将阳性克隆孔的菌转摇在含有100μg/ml氨苄青霉素的lb培养基中以便提取质粒并进行测序。
110.根据序列比对软件vectornti分析各个克隆株的基因序列,把cdr1,cdr2和cdr3序列相同的株视为同一克隆株,而序列不同的株视为不同克隆株,最终获得特异性针对cd25蛋白的单域抗体1b5。
111.其抗体的氨基酸序列为fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4结构,构成整个vhh。获得的单域抗体重组质粒可以在原核系统中进行表达,最终获得单域抗体蛋白1b5。
112.1b5单域抗体的氨基酸序列seq id no.32所示。
113.实施例5:针对抗cd25的单域抗体的人源化
114.人源化方法采用对基于大数据分析结果而构建的抗体框架区域突变文库进行高通量筛选的方法完成。详细步骤为:
115.(1)人源/驼源抗体数据的序列分析:对从ncbi网站批量下载的13873例nb(human)序列进行氨基酸偏好性分析,同时对本公司2000例纳米抗体序列进行氨基酸偏好性分析,得到框架区各个位点氨基端比例数据;
116.(2)人源驼源综合加权分析:将上述源/驼源抗体序列统一按照imgt编号规则进行
编号并一一对应,结合上述两个物种中氨基酸比例分析结果,按照人源90%驼源10%的权重进行加权分析,统计出各个位点氨基酸加权后的比例,并由高到低排序;根据最终的加权结果,框架区单个位点仅保留所占比例》10%的氨基酸种类,并根据保留后比例综合为1的标准进行所占比例》10%氨基酸最终权重的计算,作为后续氨基酸定制文库的设计依据;
117.(3)氨基酸定制文库的方案设计:对待进行突变的单独位点,规定其》10%的氨基酸数目为n,规定其》10%中所占比例最高值与最低值的比值为v,对待进行突变的位点进行性质判断:若v≥3且n≤2则认为该位点属于“高集中度位点”,否则认为该位点属于“中低集中度位点”。依据此方法将定制氨基酸文库分为“高/中低集中度文库”两个分别进行氨基酸定制文库的构建,上述(2)中的最终权重即为文库中位点氨基酸种类及比例的参考依据。
118.(4)氨基酸定制文库的高通量筛选:
119.对抗体株,1b5构建人源化抗体文库,针对构建好的文库,分别用对应抗原进行淘选,并最终获得亲和力较高且人源化程度较高的抗体序列。
120.得到以下16种人源化抗体:框架区fr的氨基酸序列为下述(1)-(16)的一种:
121.(1)1b5-f1:seq id no:20所示的fr1,seq id no:21所示的fr2,seq id no:26所示的fr3;seq id no:31所示的fr4;
122.(2)1b5-f2:seq id no:20所示的fr1,seq id no:21所示的fr2,seq id no:25所示的fr3;seq id no:31所示的fr4;
123.(3)1b5-f3:seq id no:20所示的fr1,seq id no:21所示的fr2,seq id no:24所示的fr3;seq id no:31所示的fr4;
124.(4)1b5-f4:seq id no:20所示的fr1,seq id no:21所示的fr2,seq id no:23所示的fr3;seq id no:31所示的fr4;
125.(5)1b5-f5:seq id no:20所示的fr1,seq id no:21所示的fr2,seq id no:30所示的fr3;seq id no:31所示的fr4;
126.(6)1b5-f6:seq id no:20所示的fr1,seq id no:21所示的fr2,seq id no:29所示的fr3;seq id no:31所示的fr4;
127.(7)1b5-f7:seq id no:20所示的fr1,seq id no:21所示的fr2,seq id no:28所示的fr3;seq id no:31所示的fr4;
128.(8)1b5-f8:seq id no:20所示的fr1,seq id no:21所示的fr2,seq id no:27所示的fr3;seq id no:31所示的fr4;
129.(9)1b5-f9:seq id no:20所示的fr1,seq id no:22所示的fr2,seq id no:26所示的fr3;seq id no:31所示的fr4;
130.(10)1b5-f10:seq id no:20所示的fr1,seq id no:22所示的fr2,seq id no:25所示的fr3;seq id no:31所示的fr4;
131.(11)1b5-f11:seq id no:20所示的fr1,seq id no:22所示的fr2,seq id no:24所示的fr3;seq id no:31所示的fr4;
132.(12)1b5-f12:seq id no:20所示的fr1,seq id no:22所示的fr2,seq id no:23所示的fr3;seq id no:31所示的fr4;
133.(13)1b5-f13:seq id no:20所示的fr1,seq id no:22所示的fr2,seq id no:30所示的fr3;seq id no:31所示的fr4;
134.(14)1b5-f14:seq id no:20所示的fr1,seq id no:22所示的fr2,seq id no:29所示的fr3;seq id no:31所示的fr4;
135.(15)1b5-f15:seq id no:20所示的fr1,seq id no:22所示的fr2,seq id no:28所示的fr3;seq id no:31所示的fr4;
136.(16)1b5-f16:seq id no:20所示的fr1,seq id no:22所示的fr2,seq id no:27所示的fr3;seq id no:31所示的fr4。
137.上述1b5-f1~1b5-f16的人源化抗体,其重链cdr1如seq id no:17所示,其重链cdr2如seq id no:18所示,其重链cdr3如seq id no:19所示。所有人源化抗体的cdr1、cdr2、cdr3均与未人源化的1b5单域抗体的cdr1、cdr2、cdr3相同。人源化是针对fr框架区的序列。人源化抗体的结构依然是:fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4,1b5-f1~1b5-f16的人源化抗体按照cdr、fr拆分后的氨基酸序列如图10所示。
138.其中seq id no:20:esggglvkpggslrlscaas;seq id no:31:wgqgtlvtvss。
139.上述1b5-f1~1b5-f16的人源化抗体,其fr2序列如表1所示,其fr3序列如表2所示,其cdr1序列如表3所示,其cdr2序列如表4所示,其cdr3序列如表5所示,其完整氨基酸序列如图11所示。
140.上述1b5-f1~1b5-f16的人源化抗体,其对应的核苷酸序列依次为seq id no:33-seq id no:48。
141.表1 16种人源化抗体的fr2序列
[0142][0143]
表2 16种人源化抗体的fr3序列
[0144][0145]
表3 16种人源化抗体的cdr1序列
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
表4 16种人源化抗体的cdr2序列
[0146][0147]
表5 16种人源化抗体的cdr3序列
[0148][0149]
实施例6:人源化的抗cd25的单域抗体的fc融合抗体真核表达载体的构建
[0150]
(1)根据实施例5中获得的目标序列设计对应的核苷酸序列;
[0151]
(2)通过序列合成的方式将上述核苷酸序列(seq id no:33-48)合成至本公司设计改造的载体rjk-v4-hfc1中得到重组真核表达载体(具体地,将seq id no:33-48中的一条插入载体的多克隆位点mcs),该载体的构建方法如实施例10所述;
[0152]
(3)将步骤(2)构建好的重组真核表达载体转化至dh5α大肠杆菌中,培养进行质粒抽提,去除内毒素;
[0153]
(4)将抽提后的质粒再进行序列测序鉴定;
[0154]
(5)将确定无误后的重组载体准备后续真核细胞转染表达,通过实施例7或8的方法将vhh的fc蛋白表达后并通过实施例9的方法纯化上述抗体。
[0155]
实施例7:人源化的抗cd25蛋白的单域抗体在悬浮expicho-s细胞中表达
[0156]
(1)转染前3天以2.5
×
105/ml细胞传代和扩大培养expicho-s
tm
细胞,计算出的所需的细胞体积转移至装有新鲜的已预热的120ml(终体积)的expicho
tm
表达培养基的500ml摇瓶中;使细胞浓度达到约4
×
10
6-6
×
106活细胞/ml;
[0157]
(2)在转染前一天,将expicho-s
tm
细胞稀释浓度至3.5
×
106活细胞/ml,使细胞过夜培养;
[0158]
(3)转染当天,测定细胞密度和活细胞百分比。转染之前细胞密度应达到约7
×
10
6-10
×
106活细胞/ml;
[0159]
(4)用预热至37℃新鲜的expicho
tm
表达培养基将细胞稀释至6
×
106个活细胞/ml。计算出的所需的细胞体积转移至装有新鲜的已预热的100ml(终体积)的expicho
tm
表达培养基的500ml摇瓶中;
[0160]
(5)使轻轻颠倒混匀expifectamine
tm
cho试剂,用3.7ml optipro
tm
培养基稀释expifectamine
tm
cho试剂,回荡或混匀;
[0161]
(6)用冷藏的4ml optipro
tm
培养基稀释质粒dna,回荡混匀;
[0162]
(7)将expifectamine cho/质粒dna(质粒dna为实施例6制得的人源化的抗cd25的单域抗体的fc融合抗体真核表达载体)复合物室温孵育1-5分钟,然后轻轻加入制备的细胞
悬液中,加入过程中轻轻回荡摇瓶;
[0163]
(8)将细胞在37℃、8%co2、加湿的空气中震荡培养;
[0164]
(9)转染后第1天(18-22小时后)添加600μl expifectamine
tm
cho enhancer和24ml expicho feed。
[0165]
(10)在转染后约8天(细胞活率低于70%)收集上清。
[0166]
实施例8:抗cd25蛋白的单域抗体在悬浮293f细胞中的表达
[0167]
重组单域抗体表达实验流程(以500ml摇瓶为例):
[0168]
(1)转染前3天以2.5
×
105/ml细胞传代和扩大培养293f细胞,计算出的所需的细胞体积转移至装有新鲜的已预热的120ml(终体积)的opm-293 cd05 medium培养基的500ml摇瓶中。使细胞浓度达到约2
×
10
6-3
×
106活细胞/ml。
[0169]
(2)转染当天,测定细胞密度和活细胞百分比。转染之前细胞密度应达到约2
×
10
6-3
×
106活细胞/ml。
[0170]
(3)用预热的opm-293 cd05 medium将细胞稀释至1
×
106个活细胞/ml。计算出所需的细胞体积转移至装有新鲜的已预热的100ml(终体积)的培养基的500ml摇瓶中。
[0171]
(4)用4ml opti-mem培养基稀释pei(1mg/ml)试剂,回荡或吹打混匀;用4ml opt-mem培养基稀释质粒dna(质粒dna为实施例6制得的人源化的抗cd25的单域抗体的fc融合抗体真核表达载体),回荡混匀,并用0.22um的滤头过滤。室温孵育5min。
[0172]
(5)将稀释的pei试剂加入稀释的dna中,颠倒混匀。将pei/质粒dna复合物室温孵育15-20分钟,然后轻轻加入制备的细胞悬液中,加入过程中轻轻回荡摇瓶。
[0173]
(6)将细胞在37℃、5%co2、120rpm震荡培养。
[0174]
(7)转染后第24h、72h添加5ml opm-cho pff05补料。
[0175]
(8)在转染后约7天(细胞活率低于70%)收集上清。
[0176]
实施例9:人源化的抗cd25蛋白的单域抗体的纯化
[0177]
(1)将实施例7或8中获得蛋白表达上清用0.45μm的一次性滤头过滤除掉不可溶杂质;
[0178]
(2)将上述滤液使用蛋白纯化仪进行亲和层析纯化,利用人源fc与protein a结合的能力,使用偶联protein a的琼脂糖填料进行纯化;
[0179]
(3)将滤液通过1ml/分钟的流速流穿protein a预装柱,该步骤中滤液中的目标蛋白会与填料结合;
[0180]
(4)通过低盐和高盐缓冲液将柱上结合的杂质蛋白洗涤;
[0181]
(5)用低ph缓冲液将柱上结合的目标蛋白进行系统;
[0182]
(6)将洗脱液迅速加入ph9.0的tris-hcl溶液,进行中和;
[0183]
(7)将上述中和后的蛋白溶液透析后,进行sds-page分析,确定蛋白纯度在95%以上,且浓度在0.5mg/ml以上后,低温保存备用。
[0184]
实施例10:单域抗体真核表达载体rjk-v4-hfc1的构建
[0185]
所提及纳米抗体通用的目标载体rjk-v4-hfc1,为本公司在invitrogen商业化载体pcdna3.4(载体资料链接:https://assets.thermofisher.com/tfs-assets/lsg/manuals/pcdna3_4_topo_ta_cloning_kit_man.pdf)的基础上融合了人源igg1的重链编码序列中的fc区段后改造而来的,即该载体包含了igg1重链的铰链区(hinge)ch2和ch3区。具
体改造方案如下:
[0186]
(1)选取pcdna3.4上的限制性酶切位点xbai和agei;
[0187]
(2)在fc片段编码序列的5’端和3’端通过重叠pcr的方式分别引入多克隆位点(mcs,multiple cloning site)和6
×
his标签;
[0188]
(3)使用分别带有xbai和agei酶切位点的一对引物通过pcr的方式将上述片段扩增;
[0189]
(4)使用限制性内切酶xbai和agei分别酶切pcdna3.4和(3)中的重组dna片段;
[0190]
(5)将酶切后的载体和插入片段在t4连接酶的作用下连接,然后将连接产物转化至大肠杆菌,扩增,测序核实,获得重组质粒。
[0191]
实施例11:靶向人源cd25的工具抗体(tool antibody,tab)的表达和纯化
[0192]
本文中,tab1为camidanlumab tesirine,tab2为daclizumab(达利珠单抗),tab3为basiliximab(巴利昔单抗),序列来自imgt。
[0193]
将搜索到的序列委托通用生物系统(安徽)有限公司进行哺乳动物细胞表达系统密码子优化,并克隆至pcdna3.1载体。经过抗性筛选,选择质粒阳性菌扩增,使用质粒中提试剂盒(macherey nagel,cat#740412.50)抽提质粒。按照每100ml细胞加入100μg质粒(40μg重链+60μg轻链),使用pei在293f细胞(培养基:freestyle 293 expression medium,thermo,cat#12338026+f-68,thermo,cat#24040032)中瞬转表达;转染6~24h后加入5%体积的10%peptone(sigma,cat#p0521-100g),8%co
2 130rpm培养约7~8天;细胞活率降至50%时收取表达上清,使用proteina(ge,cat#17-5438-02)重力柱纯化;pbs透析后,使用nanodrop测定浓度,sec鉴定纯度,间接elisa验证结合能力;通过本方法获得的tab,浓度不小于2mg/ml,纯度大于95%。
[0194]
实施例12:人源化的针对cd25蛋白的特异性单域抗体(真核表达)的结合量效曲线测定
[0195]
(1)包被50μl 1μg/ml cd25蛋白(即human il-2ra),4℃过夜。
[0196]
(2)洗板;加入200μl 5%牛奶,37℃封闭2h。
[0197]
(3)将vhh-hfc稀释至2ug/ml,然后5倍梯度稀释抗体共8个浓度梯度。此外,还分别设置higg(实际是higg1)、tab对照;这里的vhh-hfc为实施例8制得的cd25蛋白的人源化单域抗体的fc融合抗体经实施例9纯化而得。
[0198]
(4)洗板;加入50μl经步骤(3)稀释得到的人源化单域抗体,两复孔,37℃孵育1h。
[0199]
(5)洗板;加入50μl hrp-goat anti higg二抗,37℃孵育30min。
[0200]
(6)洗板(多洗几次);加入50μl预先恢复常温的tmb,避光常温反应15min。
[0201]
(7)加入50μl终止液(1n hcl),酶标仪读数保存。
[0202]
(8)绘制曲线,计算ec50,结果如图2、3、4、5所示。
[0203]
可见16种人源化单域抗体均对cd25蛋白结合效力和特异性优异。
[0204]
实施例13:针对人源化单域抗体以及工具抗体诱导的adcc作用
[0205]
步骤如下:
[0206]
(1)将复苏后传代3-4代的su-dhl-1细胞收集后按10000个每孔铺入96孔板;
[0207]
(2)将higg(实际是higg1)、tab1、tab2、tab3和人源化的单域抗体样品配置最高浓度为10μg/ml的溶液,并进行10倍梯度稀释,最终得到7个浓度;higg指同型对照,不与任何
靶标结合的免疫球蛋白分子,通过商品化购买得到,以下同。这里的单域抗体为实施例8制得的cd25蛋白的人源化单域抗体的fc融合抗体经实施例9纯化而得。tab1、tab2、tab3由实施例11制得,以下同。
[0208]
(3)将梯度稀释好的上述抗体溶液按细胞悬液的等体积加入细胞培养孔;
[0209]
(4)对于样品孔和e/t孔(抗体浓度为0),收集pbmc细胞,按每孔250000个细胞,两倍于靶细胞悬液体积加入细胞培养孔;对于max孔,每孔加入两倍于靶细胞悬液体积的裂解液;对于min孔,每孔加入两倍于靶细胞悬液体积的试验缓冲液;
[0210]
(5)孵育6h后,用ldh试剂盒检测细胞杀伤,读取吸光度;
[0211]
(6)按照公式靶细胞杀伤率%=(样品-e/t)/(max-min),根据靶细胞杀伤率和浓度,进行四参数拟合,计算各抗体介导的adcc作用的ec50浓度,结果如图6、7、8、9所示。
[0212]
ec50浓度越低说明抗体介导的adcc功能越强,上述结果表明本发明制备的16种人源化单域抗体均具备adcc功能。
[0213]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1