一种白囊耙齿菌及其应用
1.本发明涉及植物病原菌防治技术领域,特别是涉及一种白囊耙齿菌及其应用。
背景技术:
2.柑橘黑点病是柑桔的重要病害,柑橘黑点病菌可以侵染芸香科寄主植物(包括柑橘、脐橙、葡萄柚等)的果实、叶片和枝干,在活体组织上引起黑点病症状。黑点病菌侵染果实、叶片,引起植物细胞的防卫反应,植物组织产生活性氧分子,将侵染点的病菌连同周围的几层细胞杀死,从而避免黑带病菌进一步发展,但却使侵染点附近的细胞因死亡而形成小黑点,造成黑点病的症状。即果实表面的小黑点并不是柑橘黑点病菌的子实体,但是黑点症状严重影响柑桔的外观品质,大大降低柑桔的商品价值,一般有明显黑点病症状的柑橘成为等外级商品,从而给柑橘产业带来较为严重的经济损失。但枝条等木质部组织上的病菌却可以杀死寄主组织,并在死亡的组织上形成子实体,成为新的侵染源不断在柑橘上造成黑点病。因而,枯枝落叶上的黑点病菌子实体是柑橘黑点病初侵染和再侵染的主要来源。采用可以降解柑橘园的枯枝落叶上的黑点病菌,成为防治柑橘黑点病的关键措施之一。
3.果园在生产过程中,产生了大量的枝干废弃物,除了果树自然生长产生的枯枝落叶,果树修剪产生的废弃枝干枯枝更多。这些废弃物上往往带有大量的植物病原菌,是春天果园植物病害初侵染的主要来源。随着国家环保政策的实施,果园废弃物禁止焚烧,每年产生的带有病原物的大量枝干废弃物亟待处理。白囊耙齿菌(irpex lacteus)是一种白腐真菌,有很强的木质素降解能力。筛选能够同时寄生分解病原菌能力强的白囊耙齿菌用于处理果园枯枝废弃物,具有重要的社会效益和应用价值。
4.白囊耙齿菌对其他植物病原菌的抑制作用已经有所研究。白囊耙齿菌ll210对番茄灰霉病病原菌菌丝生长的抑制作用,7天达到64.4%;对番茄晚疫病病原菌菌丝生长的抑制率,7天达到65.6%(cn112899171a);fm001促进蓝梅根部生长(cn106635821a),能够提高废弃物堆料物中降解酶的活力(cn114196555a),有的菌株可以产生虫草素等特殊物质 (cn109161488a),可以抑制小麦白粉病(motoo,k.,&seiya,t..(2007). studies on biocontrol of air-borne plant disease by a filamentous fungusproducing antifungal volatiles.japan agricultural research quarterly jarq, 41(4),261-265.),生物加工成乙醇,山毛榉木材的葡萄糖产量增加了一倍 (brethauer,s.,lawrence,s.r.,&hans-peter,s.m..(2017).enhancedsimultaneous saccharification and fermentation of pretreated beech wood by insitu treatment with the white rot fungus irpex lacteus in a membrane aeratedbiofilm reactor.bioresource technology,237:135-138.)。筛选菌寄生性强的菌株是研究的热点,但是由于此种真菌多样性大,代谢物质丰富多样其抑菌机制还不清楚,不同菌株呈现多种多样,但大部分是分泌抑制病原真菌生长的物质,而不是对植物病原菌的寄生作用,如果没有寄生作用,则对已经存在的病原菌作用不大。
技术实现要素:
5.本技术筛选到了一株可以对果园枯木的降解作用,对柑桔黑点病菌有高效的寄生作用的白囊耙齿菌(irpex lacteus)。
6.一种白囊耙齿菌,命名为白囊耙齿菌(irpex lacteus),株号j21l-26,保藏号为cctcc no:m2022714。本技术菌株j21l-26是从浙江省杭州市西湖区(北纬30.2422度,东经120.1069度)的腐朽枯木上采集并分离。通过多个序列比较,j21l-26菌株与白囊耙齿菌(irpex lacteus)序列最接近,亲缘关系最近,此结果与形态鉴定结果相同,表明我们分离到的a94 菌株是白囊耙齿菌(irpex lacteus)。将该新筛选到的j21l-26菌株命名为 irpex lacteus,株号j21l-26,于2022年5月25日保藏于中国典型培养物保藏中心,保藏号为cctcc no:m2022714。
7.本发明还提供了所述的白囊耙齿菌在抑制柑橘黑点病菌(diaporthecitri f.a.wolf)生长中的应用。
8.本发明还提供了所述的白囊耙齿菌在防治柑橘属植物柑橘黑点病菌 (diaporthe citri f.a.wolf)感染中的应用。
9.凡是能够感染柑橘黑点病菌的植株均能够使用。除所述柑桔外,柑橘属其他植物例如橙子、柚子均可应用。优选的,所述柑橘属植物为柑、桔、柚、柠檬或橙。
10.本发明还提供了一种柑橘黑点病菌抑制剂,活性成分包含所述的白囊耙齿菌。
11.本发明还提供了所述柑橘黑点病菌抑制剂的制备方法,将所述的白囊耙齿菌接种到发酵培养基培养后,去除菌体的发酵液即为柑橘黑点病菌抑制剂。
12.优选的,培养温度为25℃,培养时间为7-14天。
13.本发明还提供了一种柑橘黑点病菌的防治方法,使用所述的白囊耙齿菌或所述柑橘黑点病菌抑制剂喷施在植株上;或者白囊耙齿菌液体发酵液喷洒在柑橘植株上。
14.本发明经筛选分离到一株白囊耙齿菌,命名为白囊耙齿菌(irpexlacteus),株号j21l-26,保藏号为cctcc no:m2022714。菌株j21l-26 对果园枯枝落叶有很好的降解作用,对柑橘黑点病菌有高效的寄生作用。不但要对病原菌具有抑制、寄生分解作用,同时还对植物残体有强烈的分解作用,将极大减少柑橘黑点病的侵染来源,大大提高防治效果。
附图说明
15.图1为j21l-26在pda平板上培养5天的菌落形态图。
16.图2为j21l-26对柑橘黑点病菌的抑制寄生情况图。
17.图3为j21l-21对柑橘黑点病菌的抑制寄生情况图。
18.图4为j22l-1对柑橘黑点病菌的抑制寄生情况图。
19.图5为j20l-5对柑橘黑点病菌的抑制寄生情况图。
20.图6为以柑橘黑点病菌菌丝为基质培养j21l-26菌株情况图。
21.图7为以柑橘黑点病菌菌丝为基质培养j21l-21菌株情况图。
22.图8为以柑橘黑点病菌菌丝为基质培养j22l-1菌株情况图。
23.图9为以柑橘黑点病菌菌丝为基质培养j20l-5菌株情况图。
24.图10为不同菌株对柑橘黑点病菌菌丝的寄生率图。
25.图11为ct值与log x的线性关系(标准曲线)图。
具体实施方式
26.实施例1:菌种分离
27.从浙江省各地的枯木腐木上采集样品,采用组织分离法分离,过程如下:在超净工作台中,将手术刀及长镊子分别用75%乙醇溶液(v/v)消毒后,用酒精灯外焰灼烧其刀片或镊子尖端至发红后,手术刀刀片和镊尖朝上插于架上待其冷却后使用;于超净工作台中用75%乙醇溶液(v/v) 擦拭样品表面后,用手术刀将其沿纵切面切开,切取边长为0.5cm的内部菌肉,用镊子夹取至gpda培养基的培养皿内,每一个样品取3~6个分离块,放于25℃黑暗培养箱中培养;每天观察培养皿中,待接种菌块长出菌丝后,立即在解剖镜下(解剖镜预先用75%乙醇溶液(v/v)消毒后置于超净工作台中)进行单菌丝分离并其转移至新的pda板上;待新的pda板上菌落长至3cm~4cm直径时进行进一步实验。
28.gpda培养基:200g马铃薯,20g葡萄糖,3g磷酸二氢钾,30g琼脂,0.3g氯霉素(chloramphenicol),1000ml蒸馏水。
29.pda培养基:200g马铃薯,20g葡萄糖,18g琼脂,0.3g氯霉素 (chloramphenicol),1000ml蒸馏水。
30.pdb液体培养基:200g马铃薯,20g葡萄糖,18g琼脂,1000ml 蒸馏水。
31.从浙江省杭州市淳安县(北纬29.9031度,东经121.9037度)的腐木多孔菌上分离到一株菌株,命名为j21l-26。菌株j21l-21是从杭州市西湖区南高峰景区的腐木多孔菌上分离得到得一株菌株,菌株j22l-1和菌株j20l-5是从杭州市淳安县千岛湖岛屿的腐木多孔菌上分离得到的两株菌株。这4个样品的形态特征无明显差别,分离物的培养特征也无差异。
32.实施例2:对峙培养检测
33.白囊耙齿菌对柑橘黑点病菌的抑制寄生作用。
34.(1)接种与培养
35.将从浙江省各地分离了多株白囊耙齿菌(irpex lacteus)和柑橘黑点病菌菌株d.citri n27(分离自台州柑橘园黑点病发病枝条)重新接种于新的 9cm pda板,25℃培养箱黑暗培养10d后,于超净工作台中,用预先于酒精灯外焰烧红后冷却的5mm直径打孔器,在菌落边缘打下若干个菌饼,用灭菌过的干净牙签将其接种至事先倒好凝固的7cm培养基(倒前各加入50μg/ml的链霉素和80μg/ml的头孢霉素并混匀)中,在同一条直径上,irpex lacteus菌株和n27菌株的菌块分别接种于圆心的两边,相距 3cm。每个处理3个重复,设置一组只接种有n27菌株的菌块的对照组,其他条件皆与实验组相同。试验的培养皿放置在25℃培养箱黑暗培养5d。
36.(2)菌落半径的测量与记录
37.对对照组和实验组的n27菌落半径(n27菌饼中心至与irpex lacteus 菌株菌饼中心连接处的生长边缘)进行三次测量。对照组所得n27菌落半径值为r0,实验组为r。菌株j21l-26对柑橘黑点病菌d.citri n27的抑制率(inhibition rate,ir)计算公式如公式(1)所示:
[0038][0039]
对峙培养中,irpex lacteus菌株对n27菌株寄生率的计算:irpex lacteus 菌株
与n27菌株重叠生长区域面积(s)占n27全部菌落面积(sn)的百分率即为寄生率(parasitic rate,pr)。irpex lacteus菌株对柑橘黑点病菌d.citri n27的寄生率(pr)计算公式如公式(2)所示:
[0040][0041]
从浙江省各地分离了多株白囊耙齿菌(irpex lacteus),将不同的多孔菌菌株与柑橘黑点病菌d.citri n27接种至pda培养基上,25℃下进行黑暗对峙培养5d。通过对峙培养筛选了对柑橘黑点病菌的抑制情况,筛选出4株抑制作用明显(图2~5)。其中菌株j21l-26效果最好,菌株j21l-21 次之,菌株j22l-1,菌株j20l-5最差。其抑制率分别达到65.4%、53.7%、 52.1%、45.6%,寄生率分别67.7%、39.5%、34.4%、19.6%(表1)。菌株 j21l-26无论是抑制率还是寄生率,比同种的其他菌株都显著增加。
[0042]
表1不同白囊耙齿菌菌株对柑橘黑点病菌的抑制率和寄生率
[0043]
菌株j20l-5j21l-26j21l-21j22l-1抑制率45.5965.4153.7452.14寄生率19.5567.6739.5434.37
[0044]
实施例3
[0045]
以柑橘黑点病菌n27菌丝体作为基质,检测白囊耙齿菌菌株对柑橘黑点病菌的寄生能力。
[0046]
在固体pda培养基中活化后的d.citri n27菌落上,打三个菌饼于装有50ml液体pdb培养基的锥形瓶中,置于25℃,150rpm摇床中培养5 d,得到d.citri n27发酵液。而后,将培养好的菌液以7500rpm 4℃离心10min,弃上清液,于超净工作台中,加入适量ddh2o上下颠倒洗涤至菌丝体均匀分散于液体中,再次以7500rpm 4℃离心10min。弃上清,将菌丝体用灭菌过的药匙平铺于一次性pe培养皿中,使其覆盖整个7cm培养皿,厚度为5mm。白囊耙齿菌菌株在固体培养基上重新活化后,打下5mm 菌饼,接种于上述n27培养物之上,每个皿接种三个菌饼,设置三个重复。培养皿放于25℃培养箱中黑暗培养,定期观察生长情况。
[0047]
以d.citri n27菌丝体培养白囊耙齿菌菌株时,多孔菌对d.citri n27 的寄生率的计算:多孔菌白色菌丝生长区域面积(s)占n27菌丝体基质区域面积(sn)的百分率即为寄生率(pr)。该寄生率(pr)计算公式同实施例4中的公式(2)。
[0048]
结果如图6-9所示,供试的4株白囊耙齿菌株都能以n27的菌丝体为基质进行生长,说明这4株菌都可以寄生分解柑橘黑点病菌。其中菌株 j21l-26的寄生能力明显比其他菌株强,菌丝生长旺盛,寄生率达到91% (图10)。
[0049]
实施例4:菌种形态鉴定
[0050]
在标本上的形态特征:菌体平伏生长于木头表面,菌盖瓦状,淡黄色至米黄色,菌肉薄,纤维质;菌管同色,管口多角形至不规则形。
[0051]
生殖菌丝薄壁,分支多,有横隔,无锁状联合。囊状体明显,数量多,厚壁。担孢子长椭圆形,无色,光滑,非淀粉质,无梅尔泽试剂反应,(5~7)
ꢀ×
(2~3)μm。
[0052]
培养特征:在pda培养基上的菌丝呈白色,生长迅速,气生菌丝发达,无孢子产生(图1)。
[0053]
综合菌落形态特征、培养特征,将菌株j21l-26鉴定为白囊耙齿菌。
[0054]
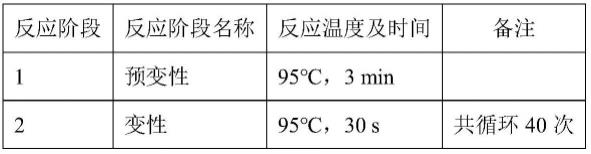
实施例5:分子鉴定
[0055]
(1)dna提取
[0056]
1)在pda平板上22℃培养j21l-26菌株7天后,用牙签刮取平板上的菌丝,放入已灭菌的含有300μl提取缓冲液1.5ml离心管中;
[0057]
提取缓冲液的配方为:1m kcl,100mm tris-hcl,10mm edta, ph=8.0;
[0058]
2)将挑取的菌丝用电磨机研碎,然后再加入300μl提取缓冲液,剧烈震荡2min;
[0059]
3)10000rpm离心10min;
[0060]
4)吸取上清液,转移至另一新的离心管中,弃沉淀;
[0061]
5)在上清液中加入等体积的异丙醇(分析纯),轻轻颠倒混匀数次后,12000rpm离心10min,沉淀核酸;
[0062]
6)轻轻倒去上清液,将含有沉淀的离心管倒置在吸水纸上排干水分;
[0063]
7)再加入300μl 70%乙醇溶液(v/v),轻轻颠倒混匀数次后,12000 rpm离心2min;
[0064]
8)轻轻倒去上清液,重复步骤7)一次;
[0065]
9)将离心管倒置在吸水纸上排干水分,置于37℃下15min,使乙醇充分挥发;
[0066]
10)用50μl ddh2o重悬沉淀,得到j21l-26的基因组dna,浓度达到30ng/μl。
[0067]
(2)真菌核糖体its rdna基因、核糖体ssu rdna基因、核糖体 lsu rdna基因、转录因子tef基因、rpb2基因的pcr扩增
[0068]
its引物:上游引物its1序列为: 5
′‑
tccgtaggtgaacctgcgg-3
′
,下游引物its4序列为: 5
′‑
tcctccgcttattgatatgc-3
′
;
[0069]
ssu基因引物:上游引物ns1序列为: 5
′‑
gtagtcatatgcttgtctc-3
′
,下游引物ns4序列为: 5
′‑
accctcagtgtagtgacccttggc-3
′
;
[0070]
lsu引物:上游引物lr5序列为:5
′‑
atcctgagggaaacttc-3
′
,下游引物lror序列为:5
′‑
cttccgtcaattcctttaag-3
′
;
[0071]
tef引物:上游引物ef1-983f序列为: 5
′‑
gcyccygghcaycgtgayttyat-3
′
;下游引物ef1-1567r序列为:5
′‑
achgtrccrataccaccratctt-3
′
(引物中字母k和r均为简并密码,k为g/t,r为a/g);
[0072]
rpb2引物:上游引物brpb2-6f序列为: 5
′‑
tggggyatggtntgyccygc-3
′
;下游引物brpb2-7r序列为: 5
′‑
gaytgrttrtgrtcrgggaavgg-3
′
。
[0073]
pcr扩增在50μl反应体系中进行,体系中含有:上下游引物各2μm, dntps 200μm,mgcl
2 1.5mm,10
×
pcr buffer 5μl,模版dna 2μl, taq酶2u。
[0074]
pcr扩增反应在朗基mg96g型pcr仪上进行。反应条件:94℃预变性2min;然后35个循环包括:94℃变性30s,55℃退火40s,72℃延伸 1min;最后72℃后延伸10min。
[0075]
(3)pcr产物的回收纯化
[0076]
pcr反应结束后,pcr产物经1%的琼脂糖凝胶(m/v)电泳检测后,采用爱思进生物技术公司的dna凝胶纯化试剂盒,按照试剂盒说明书的步骤进行,步骤如下:
[0077]
1)将50μl pcr产物全部加到1%的琼脂糖凝胶(m/v)的点样孔中,按5v/cm的电泳条件电泳30min;
[0078]
2)电泳结束后,在紫外灯下用刀片切取含目的dna片段的凝胶,置于2ml离心管中,称重;
[0079]
3)按照1mg凝胶加入3ml的de-a缓冲液的标准,加入de-a缓冲液到收集凝胶的2ml离心管中,75℃保温10min,期间振荡数次,至完全融化;
[0080]
4)加入0.5倍de-a体积的de-b缓冲液,混合均匀;
[0081]
5)将dna制备管放入2ml离心管中,将混合液转移到dna制备管中,12000rpm离心1min,弃上清;
[0082]
6)将dna制备管放回2ml离心管中,加500μl缓冲液w1,12000 rpm离心30s;
[0083]
7)将dna制备管放回2ml离心管中,加700μl缓冲液w2,12000 rpm离心30s;
[0084]
8)重复步骤7)一次;
[0085]
9)将dna制备管放回2ml离心管中,12000rpm离心2min;以排干膜上洗涤液;
[0086]
10)将dna制备管放回2ml离心管中,加50μl的ddh2o,10000 rpm离心1min,洗脱dna置-20℃下保存。
[0087]
(4)基因的测序和序列分析
[0088]
经电泳检测后的已经纯化回收的目的dna片段送至上海生工用 abiprisma377型自动测序仪进行测序。测序结果经过严格核对后,得到如seq id no.1~5所示的dna片段序列;其中,真菌核糖体its rdna 基因的pcr扩增产物(如seq id no.1所示)、核糖体ssu rdna基因的pcr扩增产物(如seq id no.2所示)、核糖体lsu rdna基因的pcr 扩增产物(如seq id no.3所示)、转录因子tef基因的pcr扩增产物 (如seq id no.4所示)、rpb2基因的pcr扩增产物(如seq id no.5 所示)。
[0089]
在ncbi网站上,将测得j21l-26菌株的its的核苷酸序列用blast 在genbank数据库中查找和比对同源或相似的核苷酸序列。对比结果显示,此序列与登录号为kx588111、kx588107、mf161243、mg748584、 ol685330等属于irpex lacteus的菌株的覆盖率达98%以上,相似度达到 99%以上。
[0090]
用j21l-26菌株的ssu基因序列检索genbank数据库,对比结果显示,此序列与登录号为mf190370的irpex lacteu菌株的覆盖率达100%,相似度达到100%。
[0091]
用j21l-26菌株的lsu基因序列检索genbank数据库,对比结果显示,此序列与登录号为mh867969、mh866892、kx752593、kx958065、 kx958063的irpex lacteu菌株的覆盖率达100%,相似性都达到99.7%以上。
[0092]
用j21l-26菌株的tef序列检索genbank数据库,对比结果显示,此序列与登录号为mf136434的irpex lacteu菌株的覆盖率达100%,相似性都达到97.09%。
[0093]
用j21l-26菌株的rpb2序列检索genbank数据库,对比结果显示,与此序列相似度最大的2个登录号分别为ln714665、dq408117,物种是 irpex lacteu,覆盖率达99%,相似性都达到93%以上。
[0094]
通过形态学和dna序列分析,表明菌株j21l-26属于白囊耙齿菌(irpex lacteu)。将该新筛选的菌株命名为白囊耙齿菌(irpex lacteus),株号j21l-26,于2022年5月25日保藏于中国典型培养物保藏中心,保藏号为cctcc no:m2022714。
[0095]
实施例6
[0096]
qpcr检测多孔菌对d.citri n27的抑制效果。
[0097]
提前准备d.citri n27培养液(步骤同实施例3)。
[0098]
(1)枯枝预处理
[0099]
利用小型粉碎机将采集自柑橘园中的枯枝粉碎为粒径约1mm的碎屑,并将碎屑分装于100ml锥形瓶中,每瓶装20g,置于121℃下,进行15min 高温灭菌。
[0100]
(2)菌株接种及培养
[0101]
取d.citri n27发酵产物于50ml离心管,加入灭菌过的钢珠,65hz 下研磨60s。于超净工作台中,往装有枯枝碎屑的锥形瓶内加入研磨液,每个瓶5ml,放置于25℃培养箱中进行黑暗培养。7d后,在超净工作台中往装有碎屑的锥形瓶内加入白囊耙齿菌株j21l-26的菌饼(菌饼准备步骤同实施例3),每个锥形瓶置三个菌饼,三个重复,以三个只含d.citri n27 但未加多孔菌的木屑为空白对照。将锥形瓶放回25℃培养箱中,进行黑暗培养90d。而后,每月定期向锥形瓶中分别加入3ml ddh2o。
[0102]
(3)qpcr标准曲线制作
[0103]
以qpcr检测的特异性引物为扩增引物,以d.citri n27菌株的dna 提取物作为模板,在最适退火温度下进行pcr扩增后,进行切胶回收和回收产物浓度(od
260
)测量。将回收产物分别稀释为原浓度的10-1
~10-12
,而后分别作为模板进行qpcr特异性扩增(操作参照下文qpcr扩增反应),每个浓度三个重复。在qpcr的扩增中,扩增循环数(ct值)与dna拷贝数的log值成线性关系,因此,选择可靠数据组数据,以logx(x为拷贝数,其计算如公式3所示)为自变量,对应的ct值为因变量,在excel 上建立线性回归分析,得到二者关系式y=ax+b及相关系数r2,扩增效率 e=10-1/a-1。
[0104][0105]
式中:c为模板浓度,v为添加体积,na为阿伏伽德罗常数(计算时值取6.02
×
10
23
),n为pcr产物中碱基(a、g、c、t)总个数,m为单个核苷酸的平均分子量;其中,n
·
m的数值可在bioxm上输入产物序列信息后得到。
[0106]
(4)枯枝处理物的取样及其总dna提取
[0107]
用灭菌过的长药匙将锥形瓶中的碎屑分别搅拌均匀。之后,使用分析天平称量碎屑,分别从每个锥形瓶中取样品0.1000g。选择mp公司的土壤dna提取试剂盒spin kit for soil进行dna的提取。向 lysing matrix e管中加入100mg碎屑样品,而后加入978μl磷酸钠缓冲液和122μl mt缓冲液,上下颠倒混匀;20w功率下超声破碎10min后,放入研磨仪中以65hz研磨8min,常温下12000rpm离心10min;后续步骤同说明书。
[0108]
qpcr扩增反应:将纯化的柑橘黑点病菌的pcr产物(以dc qf和 dc qr为引物,如表2所示)按10倍梯度稀释成qpcr快速检测体系的模板,建立柑橘黑点病菌qpcr快速检测体系,以dc qf和dc qr为特异性引物,进行qpcr三步法扩增。引物信息、反应体系及反应条件如下:
[0109]
表2 d.citri qpcr检测的特异性引物
[0110]
引物名称引物序列(5
’‑3’
)片段长度/bpgc含量上游引物dcqfcactgcacctcaaatcatcagcct2450%下游引物dcqrggtggtgacaaggat1553.3%
[0111]
表3 qpcr反应体系(20μl)
[0112]
反应物添加量(单位:μl)sybr green mix10
上游引物dcqf1下游引物dcqr1dna模板1ddh2o7
[0113]
表4 qpcr反应条件(三步法)
[0114][0115][0116]
通过ct值得到对应样品的拷贝数对数值,从而得到1μl待测样品中所含dna拷贝数(quantity unknown,qu),具体计算见公式(4)。基于拷贝数变化的抑制率(inhibition rate,ir)则通过公式(5)计算得出(q
ck
为对照拷贝数,qs为处理拷贝数)。
[0117][0118][0119]
以d.citrin27菌株的dna提取物作为模板,qpcr检测特异性引物为扩增引物进行进行pcr扩增,将其产物进行切胶回收、梯度稀释后作为模板进行qpcr特异性扩增并且制作标准曲线(图11),得到dna拷贝数的对数值和ct值之间对应的线性关系式y=-2.9721x+34.777(r2=0.9817),扩增效率e为1.17。
[0120]
表5 j21l-26菌株对柑橘黑点病菌的抑制率
[0121][0122]
以柑橘枯枝碎屑为基质,将菌株j21l-26和柑橘黑点病菌d.citri n27 进行共培养90d后,基于qpcr检测得到的各处理及空白对照的dna拷贝数,计算得到的抑制率(表5)表明,菌株j21l-26对于柑橘黑点病菌 d.citri n27具有明显的抑制效果,其抑制率均达到99.8%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1