一种心肌细胞移植免疫排斥反应的体外实验模型的制作方法
1.本发明属于细胞技术领域,涉及一种心肌细胞移植免疫排斥反应的体外实验模型。
背景技术:
2.心脏病治疗中一个提前挑战是心脏病发作后导致部分心肌死亡,心脏无法再生肌肉组织,死亡的肌肉组织还会导致周围的肌肉损伤,进而导致致命的心脏扩张。采用注入心肌细胞代替受损的心肌,是心脏病研究专家所探索的一种治疗心脏疾病的新方向。
3.在将心肌细胞应用于临床之前,对其可能产生的免疫排斥是必须进行的关键环节;如果直接将生产的心肌细胞用于动物实验或人体实验,其可能免疫排斥反应将不可预期。
4.因此,在体外进行免疫排斥反应的反应设计,其一是能够降低体内实验的风险性,方便更好的观察心肌细胞本身对心脏系统疾病的治疗效果;其二,能够有效建立临床应用过程中心肌细胞注射的检测指标,以为未来人ipsc来源心肌细胞(icm)的临床应用提供更加全面的临床前研究证据。
技术实现要素:
5.本技术提供一种心肌细胞移植免疫排斥反应的体外实验模型,体外验证模型主要基于pbmc与icm的间接共培养体系设计实现。该间接共培养方法可有效提高icm临床应用前预测免疫排斥反应检测结果的准确性,同时,该方法具有重现性高、实验数据波动小等特点。
6.为实现上述技术目的,本技术采取的技术方案为,一种心肌细胞移植免疫排斥反应的体外实验模型,获取目标对象的pbmc细胞,与待移植的icm细胞;将pbmc与icm在体外进行间接共培养,icm接种在transwell 小室的上室,pbmc接种在transwell 小室的下室,培养过程中,上室的培养液与下室的培养液能相互渗透;检测pbmc中t细胞、b细胞和nk细胞的激活与增殖情况。
7.作为本技术改进的技术方案,将pbmc与icm基于transwell体系进行间接共培养,培养时间介于48-96h。
8.作为本技术改进的技术方案,将pbmc与icm在体外进行间接共培养时,按梯度设计pbmc与icm的数量比,并且实验过程中至少选择2个数量比进行检测。
9.作为本技术改进的技术方案,体外实验模型的建立方式包括初步建立模型与模型验证;其中,初步建立模型包括:将商品化的pbmc与抗体共培养,筛选最大程度激活pbmc时pbmc的用量,并确认为体外实验模型时pbmc的用量;模型验证包括在初步建立模型的基础上将患者的pbmc与icm进行间接共培养,比较间接共培养后pbmc中t细胞、b细胞和nk细胞相对于pbmc单独培养状态下t细胞、b细胞和nk细胞的激活状态与增殖情况。
10.作为本技术改进的技术方案,所述抗体为t cell transact
™ꢀ
human,加入量是
0.5ul。
11.作为本技术改进的技术方案,体外实验模型应用时,还包括阴性对照组和阳性对照组;通过比较pbmc与icm在体外进行间接共培养、阴性对照组和阳性对照组的pbmc中t细胞、b细胞和nk细胞的激活与增殖情况,以观察icm移植免疫反应;其中,所述阴性对照组设计为将pbmc单独培养;所述阳性对照组设计为将pbmc单独培养,并在培养基中加入抗体以激活pbmc。
12.作为本技术改进的技术方案,将pbmc与icm基于transwell体系进行间接共培养时,pbmc培养基采用的是添加有fbs的1640培养基,fbs体积分数为10%;icm 培养基采用的是添加有fbs和b27的1640培养基,fbs体积分数5%,b27体积分数2%。
13.作为本技术改进的技术方案,所述pbmc的接种密度2.5*105/ml。
14.作为本技术改进的技术方案,进行间接共培养时要求所述icm的活率不小于70%,纯度不小于95%。
15.有益效果本技术选择采用pbmc与icm进行体外间接共培养进行心肌细胞移植免疫排斥反应的体外验证。体系设计的技术依据:外周血单个核细胞(pbmc)参与人体的免疫调节作用。外周血单个核细胞主要包括两大类细胞,分别是淋巴细胞和单核细胞,其中淋巴细胞又包括t淋巴细胞,b淋巴细胞和nk细胞。其中t淋巴细胞是机体免疫系统的重要组成占比约为45-70%,t淋巴细胞在经抗原刺激等条件激活后,可分化为多种细胞亚群,从而引起一定的免疫反应。pbmc与icm间接共培养能够模拟心肌细胞移植后的体内微环境,故研究心肌细胞与pbmc之间的间接共培养体外实验,能为未来人ipsc来源心肌细胞(icm)的临床应用提供更加全面的临床前研究证据。
16.本技术采用梯度设计间接共培养pbmc和icm的数量比,能够最大概率的概括pbmc能被激活的可能性,为预测心肌细胞移植产生的免疫排斥给出最大可能性的预测,有效提高验证效率。
17.本技术由于pbmc是贴壁生长、icm是悬浮生长,在间接共培养时既要避免pbmc与icm细胞直接接触以防止二者之间表面蛋白相互作用,又要保证二者之间的培养液能够充分交互。本技术采用transwell培养体系,并将icm接种于上室,将pbmc接种于下室,实现二者的间接共培养。
18.为了避免pbmc与icm间接共培养过程中二者的培养基交互影响细胞的生长,本技术还约束pbmc的培养基与icm培养基,避免带来实验过程中的干扰项。
附图说明
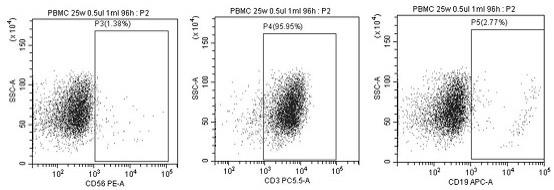
19.图1 绘示抗体用量0.5ul时的流式细胞术测试结果图;图2 绘示抗体用量0.1ul时的流式细胞术测试结果图;图3 绘示pbmc用量为10w时流式细胞术测试结果图;图4 绘示pbmc用量为15w时流式细胞术测试结果图;图5 绘示pbmc用量为20w时流式细胞术测试结果图;图6 绘示pbmc用量为25w时流式细胞术测试结果图;图7 绘示pbmc用量为50w时流式细胞术测试结果图;
图8 绘示患者一的实验组一流式细胞术测试结果图;图9 绘示患者一的实验组二流式细胞术测试结果图;图10 绘示患者一的实验组三流式细胞术测试结果图;图11 绘示患者一的阴性组流式细胞术测试结果图;图12 绘示患者一的阳性组流式细胞术测试结果图;图13 绘示患者二的实验组一流式细胞术测试结果图;图14 绘示患者二的实验组二流式细胞术测试结果图;图15 绘示患者二的阴性组流式细胞术测试结果图;图16 绘示患者二的阳性组流式细胞术测试结果图。
具体实施方式
20.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例对本发明的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于所描述的本发明的实施例,本领域普通技术人员在无需创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。除非另作定义,此处使用的技术术语或者科学术语应当为本发明所属领域内具有一般技能的人士所理解的通常意义。
21.本发明选择采用pbmc与icm进行体外间接共培养进行心肌细胞移植免疫排斥反应的体外验证,并设计具体的验证工艺,有效为心肌细胞(icm)的临床应用提供更加全面的临床前研究证据。
22.本技术技术方案的原理是:基于间接共培养技术模拟体内pbmc与icm所处的微环境,利用二者之间分泌因子对彼此的作用以判断icm分泌因子是否会对pbmc产生刺激。由于外周血单个核细胞主要包括两大类细胞,分别是淋巴细胞和单核细胞,其中淋巴细胞又包括t淋巴细胞,b淋巴细胞和nk细胞。受到抗原刺激后,t淋巴细胞,b淋巴细胞和nk细胞会分别产生对应抗体,故判断间接共培养过程中icm是否对pbmc产生刺激,可分别检测t淋巴细胞,b淋巴细胞和nk细胞的标志物,如:t细胞的标志物为cd3-pc5.5;b细胞标志物为cd19-apc;nk细胞的标志物为cd56-pe。
23.本技术技术方案中pbmc来源为患者外周血分离培养获得;其中外周血的分离与培养均采用现有技术,并非本技术的重点技术,故不做详述,但其不影响本领域技术人员对本案技术方案的理解。
24.本技术技术方案中的心肌细胞(icm)经由ipsc或esc分化而来。其中ipsc分化心肌细胞与esc分化心肌细胞均为现有技术,本技术仅是对其进行应用,故不做详述,但其不影响本领域技术人员对本案技术方案的理解。为了保证icm(心肌细胞)具有最佳活性,优选为所述icm为分化第15天后的细胞。
25.本技术间接共培养采用的是transwell小室的厂家:labselect。transwell小室中,icm接种在transwell小室的上室;pbmc接种在transwell小室的下室。其中,上室的孔径选择为0.4μm,以方便上室与下室之间的培养液能相互渗透。
26.在间接共培养过程中,变量的控制如下:培养环境,细胞的培养条件选择是常规细胞培养的环境如37℃、5%co2的培养箱,
不做变化。
27.(1)设计pbmc与icm细胞的数量比:基于细胞培养的特性,本技术采用梯度设计pbmc与icm的数量比,即pbmc与icm的数量按几何倍数增长进行验证,示例,实验设计多组,各组实验中pbmc与icm比例可设计为1:0.0001、1:0.001、1:0.01、1:0.1
……
或1:0.25、1:0.5、1:1、1:2
……
或1:0.05、1:0.25、1:1.25
……
;也可为递增方式进行验证,示例:各组实验中pbmc与icm比例可设计为1:0.25、1:0.5、1:0.75、1:1、1:1.25
……
实际操作过程中不同来源的pbmc对icm免疫排斥反应并不同,最大范围的验证则是免疫反应能够有效提高实验效率。
28.基于文本简化原则,本技术进行大量实验后,选择其中具有特色的一组数据进行陈述。不同的数量比对应的分泌因子基数不同,pbmc数量过大,其本身具有的淋巴细胞数量较多,若icm细胞分泌的因子会引起免疫排斥反应时,pbmc产生免疫排斥反应的细胞数量较少,不容易观察。若pbmc细胞数量较少,那么icm分泌微量因子将直接引发pbmc产生大量抗体,但该情况并不能真实反应icm注射后体内微环境,不能有效作为免疫排斥反应验证的参考依据。因此,本技术通过分析外周血中淋巴细胞含量,以及结合大量医学实验,设计pbmc与icm的数量比为1:(0.0001-1.25),优选为1:(0.25-1)。
29.更优的是,将pbmc与icm在体外进行间接共培养时,按梯度设计pbmc与icm的数量比,并且实验过程中至少选择2个数量比进行检测。
30.(2)间接共培养时间的要求:为了实现icm对pbmc的最大影响,将pbmc与icm基于transwell体系进行间接共培养,培养不小于48h,优选为48h-96h。
31.(3)间接共培养培养基的要求:为了避免引入更多变量,需要控制pbmc的培养基不会对icm产生影响,同时icm培养基不会对pbmc产生影响,任意能满足该要求的培养基均可。本技术将pbmc与icm基于transwell体系进行间接共培养时,pbmc培养基采用的是添加有fbs的1640培养基,fbs体积分数为10%;icm 培养基采用的是添加有fbs和b27的1640培养基,fbs体积分数5%,b27体积分数2%。有效保证pbmc与icm分别不会受彼此的培养基所影响。
32.(4)接种密度要求:为了保证pbmc与icm均在培养过程中均具有良好的状态,所述pbmc的接种密度为2.5*105/ml,icm的接种密度根据pbmc与icm最佳用量比确定。
33.(5)细胞活性要求:在将pbmc与icm基于transwell体系进行间接共培养包括预处理icm;预处理icm包括:按照间接共培养时所需的心肌细胞密度,将心肌细胞均匀的种在上室,每孔使用0.5ml icm复苏液(可采用任何能够实现心肌细胞复苏的培养液,如:复苏液包括0.5%-10%的dmso、10%-25%的人血白蛋白、0.01-0.05g/ml的羟乙基淀粉以及0.585%-0.805%的氯化钠溶液,或采用cardioeasy
®
心肌复苏培养基);第二天将心肌细胞(icm)复苏液换成心肌细胞维持液(能够保持心肌细胞活性的培养基,如厂家procell,型号cm-h076的人心肌细胞完全培养基),在37℃、5% co2培养箱培养3天使细胞贴壁、展开并恢复搏动,每隔1天换液一次。
34.最终保证进行间接共培养时要求所述icm的活率不小于70%,纯度不小于95%。为了保证icm细胞的活性,体外实验模型中采用的心肌细胞为分化第15天后的icm细胞。
35.验证方式设计一种心肌细胞移植免疫排斥反应的体外实验模型,获取目标对象的pbmc细胞,与待移植的icm细胞;将pbmc与icm在体外进行间接共培养;检测pbmc中t细胞、b细胞和nk细胞的激活与增殖情况。
36.具体是体外实验模型的建立方式包括初步建立模型与模型验证;其中,初步建立模型包括:将商品化的pbmc与抗体共培养,筛选最大程度激活pbmc时pbmc的用量,并确认为体外实验模型时pbmc的用量;模型验证包括在初步建立模型的基础上将患者的pbmc与icm进行间接共培养,比较间接共培养后pbmc中t细胞、b细胞和nk细胞相对于pbmc单独培养状态下t细胞、b细胞和nk细胞的激活状态与增殖情况;所述抗体为tcelltransact
™
human(商品名,表示anti-cd3&anti-cd28抗体微珠,或anti-cd3/cd28磁珠(gmp-b038)),加入量是0.5ul。
37.在具体进行icm移植免疫反应体外实验时:包括阴性对照组和阳性对照组;通过比较pbmc与icm在体外进行间接共培养、阴性对照组和阳性对照组的pbmc中t细胞、b细胞和nk细胞的激活与增殖情况,以观察icm移植免疫反应;其中,所述阴性对照组设计为将pbmc单独培养;所述阳性对照组设计为将pbmc单独培养,并在培养基中加入抗体微珠以激活pbmc;所述抗体(抗体微珠)为tcelltransact
™
human,加入量是0.5ul。
38.实验操作:1.icm接种取一个12孔的细胞小室板,在uppercompartment(上室)加200ul的matrigel胶,均匀铺开,放在37℃、5%co2培养箱预处理1h。
39.取出12孔的细胞小室板,吸走uppercompartment的matrigel胶,按照实验组的心肌细胞密度,将心肌细胞均匀的种在uppercompartment,每孔使用0.5mlicm复苏液;第二天将心肌细胞复苏液换成心肌细胞维持液,在37℃、5%co2培养箱培养3天使细胞贴壁、展开并恢复搏动,每隔1天换液一次,所有操作都需避免损伤pc膜。
40.2.pbmc接种将提前一天复苏的pbmc收集起来后离心400g,7min,用激活前pbmc培养基重悬细胞,轻轻吹打均匀后进行计数,按照每孔250000个细胞,均匀的种在12孔板的lowercompartment(下室)。
41.3.icm与pbmc间接共培养1)将接种12孔板中icm细胞与pbmc进行间接共培养,于37℃、5%co2间接共培养96小时,阳性对照组在pbmc培养基内加入激活pbmc的抗体微珠(anti-cd3&anti-cd28抗体微珠)0.5ul,阴性对照不处理;2)96小时后,移除transwellinsert并收集pbmc,加入500uldpbs轻柔吹打剩余细胞,收集所有细胞后室温400g离心7min;3)配置流式细胞抗体cd3、cd19、cd56,按照1:100稀释,每个样本100ul抗体孵育,4℃孵育30分钟,孵育完成后,离心、去除抗体溶液,dpbs洗涤细胞1遍;4)100uldpbs重悬细胞,转移至流式管中进行流式细胞检测。
42.4.间接共培养后细胞计数体现间接共培养前后pbmc中t、b、nk细胞的细胞数量变化。
实施例
43.设计实验组(pbmc与icm间接共培养组)与阴性对照组(pbmc培养组)、阳性对照组(pbmc培养过程中加抗体组)。
44.细胞的接种方式为:实验采用12孔板transwell体系进行间接共培养,icm接种在上室,pbmc接种在下室。
45.实施例1 筛选抗体用量在商品化的pbmc中,t细胞含量最高,故本实施例主要选择用于激活t细胞的抗体,进行相关验证;nk细胞与b细胞的数据仅用做参考,不具有其他意义。抗体为anti-cd3&anti-cd28抗体微珠。
46.表1 在25w pbmc用量下观察不同抗体用量对pbmc激活状态
序号抗体用量b细胞含量(cd19表达量)nk细胞含量(cd56表达量)t细胞含量(cd3表达量)10.1ul2.39%3.08%72.74%20.5ul2.77%1.38%95.95%
结合表1的数据,图1和图2中流式细胞术的检测结果,得出在抗体用量为0.5ul时已经能够满足激活pbmc中免疫细胞的需求。
47.实施例2 采用pbmc培养过程中加抗体组确定pbmc最佳用量。
48.在商品化的pbmc中,t细胞含量最高,故本实施例主要选择用于激活t细胞的抗体,进行相关验证。
49.表2 在0.5 ul抗体用量时不同pbmc用量下pbmc被激活状态
序号pbmc用量b细胞含量(cd19表达量)nk细胞含量(cd56表达量)t细胞含量(cd3表达量)110w5.95%5.07%73.40%215w3.41%2.88%66.72%320w3.63%2.37%75.55%425w3.37%1.97%94.96%550w2.82%2.88%93.75%
结合表2的检测结果与图3-图7的流式细胞术测试结果,分析pbmc用量为20w-50w,优选为25w。同时,该用量亦为pbmc与icm间接共培养过程中pbmc的最佳用量。
50.实施例3 患者一的pbmc进行实验pbmc中含有t细胞、nk细胞与b细胞,实际移植过程中,如果产生免疫排斥反应则需要验证三种细胞的变化,故本技术在进行实验设计时将对t细胞、b细胞与nk细胞分别通过阴性对照组进行验证。另外,本技术设计阳性对照组,并对t细胞分别进行阴性对照组和阳性对照组的综合验证,以论证间接共培养对于验证免疫排斥反应的合理性。
51.设计实验组(pbmc与icm间接共培养组)与阴性对照组(pbmc培养组)、阳性对照组(pbmc培养过程中加抗体组,本实施例阳性对照组仅用于与实验组进行t细胞变化的对比)。
52.细胞的接种方式为:实验采用12孔板transwell体系进行间接共培养,icm接种在上室,pbmc接种在下室。
53.阴性对照组:以250,000 的细胞接种量将pbmc在下室培养,无icm;阳性对照组:以250,000 的细胞接种量将pbmc在下室培养,无icm;培养基加入anti-cd3&anti-cd28抗体微珠,用量是0.5ul。
54.表3 患者一基于体外实验模型的实验
ꢀ
pbmc细胞量icm细胞量b细胞含量(cd19表达量)nk细胞含量(cd56表达量)t细胞含量(cd3表达量)实验组125w25w2.89%25.16%11.42%实验组225w12.5w2.57%24.72%9.91%实验组325w6.25w3.02%24.43%10.54%阴性对照组25w无1.4%1.52%3.75%阳性对照组25w无1.96%0.63%94.32%
结合表3的检测结果与图8-图12的流式细胞术测试结果,阳性对照组中b细胞和nk细胞数量与阴性对照组中b细胞和nk细胞数量比相差不大。主要因为抗体选用t细胞的激活抗体,培养过程中,t细胞会被激活与增殖;而b细胞与nk细胞会有不同量的死亡,故阳性对照组中b细胞与nk细胞数据将不与阴性对照组、实验组中b细胞与nk细胞数据做比较。阳性对照组中关键数据t细胞含量为94.32%远高于实验组和阴性对照组,说明t细胞被激活。实验组中t细胞含量分别与阴性对照组中t细胞含量、阳性对照组中t细胞含量进行比较,结论是:实验组中t细胞含量略高于阴性对照组中t细胞含量,远低于阳性对照组中t细胞含量。
55.阴性对照组未对任何细胞进行抗体激活,故阴性对照组中b细胞和nk细胞数量与实验组中b细胞和nk细胞数量具有比较性。比较结论是:实验组中b细胞和nk细胞数量相较于阴性对照组中b细胞和nk细胞数量均有增加。
56.综上,该患者在进行pbmc与icm体外间接共培养时,t细胞、b细胞与nk细胞的含量相较于阴性对照组均略有增加;并且实验组中t细胞的含量相对于阳性对照组t细胞的含量明显较低,故根据实验模型的验证结果预估该患者对心肌细胞移植会产生轻度免疫排斥。
57.实施例4 患者二的pbmc进行实验pbmc中含有t细胞、nk细胞与b细胞,实际移植过程中,如果产生免疫排斥反应则需要验证三种细胞的变化,故本技术在进行实验设计时对t细胞、b细胞与nk细胞通过阴性对照组分别进行验证。另外,本技术设计阳性对照组,并对t细胞分别进行阴性对照组和阳性对照组的综合验证,以论证间接共培养对于验证免疫排斥反应的合理性。
58.设计实验组(pbmc与icm间接共培养组)与阴性对照组(pbmc培养组)、阳性对照组(pbmc培养过程中加抗体组)。
59.细胞的接种方式为:实验采用12孔板transwell体系进行间接共培养,icm接种在上室,pbmc接种在下室。
60.阴性对照组:以250,000 的细胞接种量将pbmc在下室培养,无icm;阳性对照组:以250,000 的细胞接种量将pbmc在下室培养,无icm;培养基加入anti-cd3&anti-cd28抗体微珠,用量是0.5ul。
61.表4 患者二基于体外实验模型的实验 pbmc细胞量icm细胞量b细胞含量(cd19表达量)nk细胞含量(cd56表达量)t细胞含量(cd3表达量)实验组125w25w6.68%45.15%12.48%实验组225w2.5w5.94%40.67%13.16%阴性对照组25w无5.79%38.16%14.54%阳性对照组25w无2.71%41.67%55.29%
结合表4的检测结果与图13-图16的流式细胞术测试结果,阳性对照组中b细胞和nk细胞数量相对于阴性对照组中b细胞和nk细胞数量具有微量变化。主要因为抗体选用t细胞的激活抗体,培养过程中,t细胞会被激活与增殖,b细胞与nk细胞会有不同量的死亡,故阳性对照组中b细胞与nk细胞数据将不与阴性对照组、实验组中b细胞与nk细胞数据做比
较。当然也可以另外设计关于b细胞或nk细胞的阳性对照组。
62.阳性对照组中关键数据t细胞含量为55.29%,高于实验组和阴性对照组中t细胞含量,说明阳性对照组中t细胞被激活,可以用于与实验组和阴性对照组进行比较;比较结论是:实验组中t细胞与阴性对照组中t细胞含量相差无几。
63.阴性对照组未对任何细胞进行抗体激活,故阴性对照组中b细胞和nk细胞数量与实验组中b细胞和nk细胞数量具有比较性。比较结论是:实验组中b细胞和nk细胞数量相较于阴性对照组中b细胞和nk细胞数量均仅有微量变化。
64.综上,体外实验模型中,t细胞、b细胞与nk细胞均相对于阴性对照组未发生明显的上升,则根据该体外实验结论,预估该患者对心肌细胞移植(icm移植)不会产生免疫排斥。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1