一种阿奇霉素干混悬剂的微生物限度检测方法与流程
1.本发明属于微生物限度检测技术领域,尤其涉及一种阿奇霉素干混悬剂的微生物限度检测方法。
背景技术:
2.目前,阿奇霉素是氮杂类化合物,属大环内酯类抗生素,《中国药典》收载的剂型有干混悬剂、片剂、胶囊剂、颗粒剂及注射剂。其中干混悬剂为自2000年版药典开始收载的品种,该剂型具有易吞咽、剂量易分装、胃肠道刺激性小、易吸收等特点。阿奇霉素对多种革兰氏阳性菌、阴性菌具有较强抑菌活性,尤其对流感嗜血菌抑菌效果显著,临床上广泛应用于呼吸道、皮肤和泌尿生殖系统等的感染。由于其抑菌性,在已发表的有关阿奇霉素各种剂型的微生物限度文章中,多以离心后的上清液作为供试液进行试验(按照2005、2010年版《中国药典》方法进行验证研究);或用含中和剂的稀释液制备供试品进行薄膜过滤试验(按照2015年版《中国药典》方法进行适用性试验)。对有抑菌活性的药物在进行微生物限度检查时,《中国药典》自2015年版规定可采用(1)增加稀释液或培养基体积、(2)加入适宜的中和剂或灭活剂、(3)薄膜过滤法、(4)联合使用上述方法消除其抑菌活性。较之前版本药典,删除了离心沉淀法,这可更真实地反映药品的微生物污染情况,但对确认强抑菌性药物的微生物限度方法也带来一定难度。在探索阿奇霉素干混悬剂的微生物限度需氧菌和控制菌方法适用性试验时,发现采用薄膜过滤法,过滤速度影响微生物限度方法适用性试验结果,但药典对过滤速度并没有明确规定。
3.通过上述分析,现有技术存在的问题及缺陷为:现有的限度检测方法检测精度不高:药典对薄膜过滤法的滤膜、冲洗量等重要因素作了明确的规定,但对过滤速度并未规定。
技术实现要素:
4.针对现有技术存在的问题,本发明提供了一种阿奇霉素干混悬剂的微生物限度检测方法。
5.本发明是这样实现的,一种阿奇霉素干混悬剂的微生物限度检测方法包括:
6.制备各试验菌菌悬液;并进行不含中和剂供试液的制备;
7.基于制备的不含中和剂供试液利用低速的薄膜过滤法、平皿法以及稀释法进行微生物限度检测。
8.进一步,所述各试验菌菌悬液浓度为≤104cfu/ml和≤102cfu/ml。
9.进一步,所述进行不含中和剂供试液的制备包括:
10.取10g供试品,加ph为7.0的无菌氯化钠-蛋白胨缓冲液至100ml,溶解并混匀,作为1:10供试液;
11.取1:10供试液5ml,加ph为7.0的无菌氯化钠-蛋白胨缓冲液45ml,混匀,作为1:100供试液;
12.取1:100供试液5ml,加ph为7.0的无菌氯化钠-蛋白胨缓冲液20ml,混匀,作为1:500供试液。
13.进一步,所述基于制备的不含中和剂供试液利用低速的薄膜过滤法、平皿法以及稀释法进行微生物限度检测包括:
14.基于制备的不含中和剂供试液采用低速的薄膜过滤法进行需氧菌检测;
15.基于制备的不含中和剂供试液采用平皿法进行霉菌和酵母菌检测;
16.基于制备的不含中和剂供试液采用低速的薄膜过滤法和稀释法联用进行控制菌的检测。
17.进一步,所述基于制备的不含中和剂供试液采用低速的薄膜过滤法进行需氧菌计数包括:
18.在滤杯中加入ph为7.0的无菌氯化钠-蛋白胨缓冲液100ml,取1:500供试液1ml加至滤杯中,再取菌含量不大于102cfu/ml的各需氧菌菌液1ml加入其中,利用薄膜进行过滤,并以ph为7.0的无菌氯化钠-蛋白胨缓冲液为冲洗液冲洗滤膜,每次冲洗100ml,共冲洗4次。
19.进一步,所述过滤速度为50ml/min。
20.进一步,计算供试品试验组的回收率=(试验组平均菌落数-供试品对照组平均菌落数)/菌液对照组平均菌落数,以及计算低速对照组回收率=低速对照组平均菌落数/菌液对照组平均菌落数。
21.进一步,所述基于制备的不含中和剂供试液采用平皿法进行霉菌和酵母菌检测包括:
22.取1:10供试液置于无菌试管中,每个试管加入10ml供试液。取菌含量不大于104cfu/ml的白色念珠菌或黑曲霉菌液0.1ml分别加至各供试液试管中,混匀;取以上含菌供试液2ml置于平皿中,1ml/皿,倒入温度不超过45℃的sda,进行计数检测。
23.进一步:计算供试品试验组的回收率=(试验组平均菌落数-供试品对照组平均菌落数)/菌液对照组平均菌落数。
24.进一步,所述基于制备的不含中和剂供试液采用低速的薄膜过滤法和稀释法联用进行控制菌的检测包括:
25.取100ml ph为7.0的无菌氯化钠-蛋白胨缓冲液5份,向每份缓冲液中分别加入制备的1:10的不含中和剂供试液2ml,共10ml;摇匀后将含药供试液全部加至滤杯中,每份含药供试液加至1个滤杯中;利用薄膜全部过滤,并以ph为7.0的无菌氯化钠-蛋白胨缓冲液为冲洗液冲洗滤膜;将5张滤膜置于同一tsb中;
26.将培养基置于30~35℃培养箱培养24h;取培养物1ml加至100ml麦康凯液体培养基中,置于42~44℃培养箱培养24h;用无菌接种环将麦康凯液体培养基培养物划线接种至麦康凯琼脂培养基平皿上,置于30~35℃培养箱培养24h;进行控制菌的计数检测。
27.进一步,所述冲洗包括:每次冲洗100ml,每张滤膜共冲洗5次,过滤速度为50ml/min。
28.进一步,所述基于制备的不含中和剂供试液采用薄膜过滤法(低速过滤)和稀释法联用进行控制菌的检测还包括:
29.选择增菌培养基体积为700ml,并在加入供试液或滤膜后向培养基中加入不大于102cfu的控制菌。
30.结合上述的所有技术方案,本发明所具备的优点及积极效果为:本发明公开了一种无离心、无中和剂的微生物限度检验方法;建立了阿奇霉素干混悬剂的微生物限度检查方法,检出限低,为控制相关药品质量提供参考;证明薄膜过滤法的冲洗液流速影响微生物的计数回收结果和控制菌的检出,低流速在不影响试验菌回收的情况下,增加了可溶性成分的溶解时间,更有利于滤膜上抑菌药物随冲洗液过滤掉,且流速越低消除作用越强,为完善薄膜过滤实验、增加去除抗菌药物的方法及相关仪器设备的开发提供了依据和新的思路。
31.证明薄膜过滤法的过滤速度影响微生物的计数回收结果和控制菌的检出的难度大,本发明的检测方法为完善薄膜过滤法、增加去除抗菌药物的方法及相关仪器设备的开发提供了依据和新的思路。
附图说明
32.图1是本发明实施例提供的阿奇霉素干混悬剂的微生物限度检测方法流程图。
具体实施方式
33.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
34.针对现有技术存在的问题,本发明提供了一种阿奇霉素干混悬剂的微生物限度检测方法,下面结合附图对本发明作详细的描述。
35.如图1所示,本发明实施例提供的阿奇霉素干混悬剂的微生物限度检测方法包括:
36.s101,制备浓度为≤104cfu/ml和≤102cfu/ml的各试验菌菌悬液;进行不含中和剂供试液的制备;
37.s102,基于制备的不含中和剂供试液利用薄膜过滤法(低速过滤)、平皿法以及稀释法进行微生物限度检测。
38.本发明实施例提供的进行不含中和剂供试液的制备包括:
39.取10g供试品,加ph为7.0的无菌氯化钠-蛋白胨缓冲液至100ml,溶解并混匀,作为1:10供试液;
40.取1:10供试液5ml,加ph为7.0的无菌氯化钠-蛋白胨缓冲液45ml,混匀,作为1:100供试液;
41.取1:100供试液5ml,加ph为7.0的无菌氯化钠-蛋白胨缓冲液20ml,混匀,作为1:500供试液。
42.本发明实施例提供的进行含中和剂供试液的制备包括:
43.取10g供试品,加含3%吐温-80、0.3%卵磷脂的ph7.0无菌氯化钠-蛋白胨缓冲液至100ml,溶解并混匀,作为含中和剂的1:10供试液。
44.本发明实施例提供的基于制备的不含中和剂供试液利用薄膜过滤法(低速过滤)、平皿法以及稀释法进行微生物限度检测包括:
45.基于制备的不含中和剂供试液采用薄膜过滤法(低速过滤)进行需氧菌检测;
46.基于制备的不含中和剂供试液采用平皿法进行霉菌和酵母菌检测;
47.基于制备的不含中和剂供试液采用薄膜过滤法(低速过滤)和稀释法联用进行控制菌的检测。
48.本发明实施例提供的基于制备的不含中和剂供试液采用薄膜过滤法进行需氧菌计数包括:
49.在滤杯中加入100ml ph为7.0的无菌氯化钠-蛋白胨缓冲液,取1:500供试液1ml加至滤杯中,再取菌含量不大于102cfu/ml的各需氧菌菌液1ml加入其中,利用薄膜进行过滤,并以ph为7.0的无菌氯化钠-蛋白胨缓冲液为冲洗液冲洗滤膜,每次冲洗100ml,共冲洗4次。
50.本发明实施例提供的过滤速度为50ml/min。
51.本发明实施例提供的基于制备的不含中和剂供试液采用平皿法进行霉菌和酵母菌检测包括:
52.取1:10供试液置于无菌试管中,每个试管加入10ml供试液,取菌含量不大于104cfu/ml的白色念珠菌或黑曲霉菌液0.1ml分别加入到供试液试管中,混匀;取以上含菌供试液各2ml置于平皿中,1ml/皿,倒入温度不超过45℃的sda,进行计数检测。
53.本发明实施例提供的基于制备的不含中和剂供试液采用薄膜过滤法(低速过滤)和稀释法联用进行控制菌的检测包括:
54.取100ml ph为7.0的无菌氯化钠-蛋白胨缓冲液5份,向每份缓冲液中分别加入制备的1:10的不含中和剂供试液2ml,共10ml;摇匀后将含药供试液全部加至滤杯中,每份含药供试液加至1个滤杯中;利用薄膜全部过滤,并以ph为7.0的无菌氯化钠-蛋白胨缓冲液为冲洗液冲洗滤膜;将5张滤膜置于同一tsb中;
55.将培养基置于30~35℃培养箱培养24h;取培养物1ml加至100ml麦康凯液体培养基中,置于42~44℃培养箱培养24h;用无菌接种环将麦康凯液体培养基培养物划线接种至麦康凯琼脂培养基平皿上,置于30~35℃培养箱培养24h;进行控制菌的计数检测。
56.本发明实施例提供的冲洗包括:每次冲洗100ml,每张滤膜共冲洗5次,过滤速度为50ml/min。
57.本发明实施例提供的基于制备的不含中和剂供试液,采用薄膜过滤法(低速过滤)和稀释法联用进行控制菌的检测还包括:
58.选择增菌培养基体积为700ml,并在加入滤膜后向培养基中加入不大于102cfu的控制菌。
59.下面结合具体实施例对本发明的技术方案作进一步说明。
60.实施例:
61.1材料与仪器
62.1.1供试品
63.阿奇霉素干混悬剂,辉瑞制药有限公司,规格:0.1g,批号:dj4557、de7924、dk1763。
64.1.2仪器
65.shp-160型生化培养箱、gnp-9160e型隔水式培养箱由上海三发科学仪器有限公司生产;ine500型电热恒温培养箱由德国memmert公司生产;hty-302g型微生物限度检验仪由杭州泰林生物技术设备有限公司生产;td型电子天平余姚金诺天平仪器有限公司由生产;rh basic 2型磁力搅拌器由德国ika公司生产。
66.1.3菌种
67.金黄色葡萄球菌[cmcc(b)26 003]、枯草芽孢杆菌[cmcc(b)63 501]、铜绿假单胞菌[cmcc(b)10 104]、白色念珠菌[cmcc(f)98 001]、黑曲霉[cmcc(f)98 003]、大肠埃希菌[cmcc(b)44 102]。所使用工作菌株均为第3代,标准菌种由中国食品药品检定研究院提供。
[0068]
1.4培养基及试剂
[0069]
培养基:胰酪大豆胨琼脂培养基(tsa,批号:20201124),胰酪大豆胨液体培养基(tsb,批号:20201123),沙氏葡萄糖琼脂培养基(sda,批号:20200628),麦康凯液体培养基(批号:20190211)由青岛海博生物科技有限公司生产。沙氏葡萄糖液体培养基(sdb,批号:20190630),麦康凯琼脂培养基(批号:20190723)由青岛日水生物技术有限公司生产。
[0070]
试剂:ph7.0无菌氯化钠-蛋白胨缓冲液(批号:20210112),大豆卵磷脂(批号:20200901)由青岛海博生物科技有限公司生产。吐温-80(批号:20201027)由国药集团化学试剂有限公司生产。
[0071]
方法
[0072]
2.1菌液的制备
[0073]
依据2020年版《中国药典》四部通则中菌液制备方法进行试验,制备浓度为≤104cfu/ml和≤102cfu/ml的各试验菌菌悬液。
[0074]
2.2供试液的制备
[0075]
2.2.1不含中和剂供试液的制备
[0076]
取10g供试品,加ph7.0无菌氯化钠-蛋白胨缓冲液至100ml,溶解并混匀,作为1:10供试液。取1:10供试液5ml,加ph7.0无菌氯化钠-蛋白胨缓冲液45ml,混匀,作为1:100供试液。取1:100供试液5ml,加ph7.0无菌氯化钠-蛋白胨缓冲液20ml,混匀,作为1:500供试液。
[0077]
2.2.2含中和剂供试液的制备
[0078]
取10g供试品,加含3%吐温-80、0.3%卵磷脂的ph7.0无菌氯化钠-蛋白胨缓冲液至100ml,溶解并混匀,作为含中和剂的1:10供试液(用于控制菌试验组2)。
[0079]
2.3微生物计数方法适用性试验
[0080]
2.3.1需氧菌总数方法适用性试验
[0081]
试验组1(前加菌):在滤杯中加入ph7.0无菌氯化钠-蛋白胨缓冲液100ml,取2.2.1项下1:100、1:500供试液各1ml分别加至滤杯中,再取菌含量不大于102cfu/ml的各需氧菌菌液1ml加入其中,按照薄膜过滤法,全部过滤,并以ph7.0无菌氯化钠-蛋白胨缓冲液为冲洗液冲洗滤膜,每次冲洗100ml,共冲洗4次。
[0082]
试验组2(后加菌):在滤杯中加入ph7.0无菌氯化钠-蛋白胨缓冲液100ml,取2.2.1项下1:100、1:500供试液1ml分别加至其中,按照薄膜过滤法,全部过滤,并以ph7.0无菌氯化钠-蛋白胨缓冲液为冲洗液冲洗滤膜,每次冲洗100ml,共冲洗4次。在最后一次冲洗液中加入菌含量不大于102cfu/ml的各需氧菌菌液1ml。
[0083]
分别考察不同过滤流速对阳性菌回收的影响,以上各组试验所有过滤冲洗过程以不同的过滤速度冲洗滤膜,过滤速度分别约为200ml/min(过滤最大流速2.5min过滤500ml)、100ml/min(5min过滤500ml)、50ml/min(10min过滤500ml)。过滤速度通过同时关注时间、冲洗液体积变化,并调节微生物限度仪的开关进行控制。
[0084]
菌液对照组:以ph7.0无菌氯化钠-蛋白胨缓冲液代替供试液,以
⑴
200ml/min(过
滤最大流速)进行过滤,照对应试验组进行试验。
[0085]
供试品对照组:以0.9%无菌氯化钠溶液代替菌液,照试验组进行试验。
[0086]
低速对照组:以ph7.0无菌氯化钠-蛋白胨缓冲液代替供试液,以
⑵
100ml/min或
⑶
50ml/min过滤速度进行过滤,照试验组1(前加菌)进行试验。
[0087]
以上每组进行重复两次的微生物计数试验。用于需氧菌(金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、黑曲霉、白色念珠菌)计数的滤膜置于tsa平皿上。将tsa平皿置于30~35℃培养箱培养,并逐日计数。
[0088]
2.3.2霉菌和酵母菌方法适用性试验
[0089]
试验组:取2.2.1项下1:10供试液置于无菌试管中,每个试管加入10ml供试液,取菌含量不大于104cfu/ml的白色念珠菌或黑曲霉菌液0.1ml分别加至各供试液试管中,混匀。取以上含菌供试液各2ml置于平皿中,1ml/皿,倒入温度不超过45℃的sda。
[0090]
菌液对照组:以ph7.0无菌氯化钠-蛋白胨缓冲液代替供试液,照试验组进行试验。
[0091]
供试品对照组:以0.9%无菌氯化钠溶液代替菌液,照试验组进行试验。
[0092]
以上用于霉菌和酵母菌(白色念珠菌、黑曲霉)计数的平皿置于20~25℃培养箱培养,并逐日计数。
[0093]
2.3.3计算供试品试验组的回收率=(试验组平均菌落数-供试品对照组平均菌落数)/菌液对照组平均菌落数。低速对照组回收率=低速对照组平均菌落数/菌液对照组平均菌落数。
[0094]
2.4控制菌(大肠埃希菌)方法适用性试验
[0095]
试验组1(直接接种法):取2.2.1项下1:10供试液10ml,加至tsb中,置于30~35℃培养箱培养24h。
[0096]
试验组2(直接接种法):取2.2.2项下含中和剂1:10供试液10ml,加至含3%吐温-80、0.3%卵磷脂的tsb中,置于30~35℃培养箱培养24h。
[0097]
试验组3(薄膜过滤法):取100ml ph7.0无菌氯化钠-蛋白胨缓冲液5份,向每份缓冲液中分别加入2.2.1项下1:10供试液2ml,共10ml。摇匀后将含药供试液全部加至滤杯中,每份含药供试液加至1个滤杯中。按照薄膜过滤法,全部过滤,并以ph7.0无菌氯化钠-蛋白胨缓冲液为冲洗液冲洗滤膜,每次冲洗100ml,每张滤膜共冲洗5次。将5张滤膜置于同一tsb中。
[0098]
以上3个试验组考察不同体积增菌培养基对大肠埃希菌适用性试验的影响,增菌培养基体积分别为200ml、500ml、700ml、1000ml,并在加入供试液或滤膜后向培养基中分别加入不大于102cfu的大肠埃希菌。试验组3考察冲洗液不同流速对大肠埃希菌检出的影响,过滤冲洗过程以不同的过滤速度冲洗滤膜,过滤速度分别约为
①
150ml/min(过滤最大流速,240s过滤600ml)、
②
100ml/min、
③
50ml/min。
[0099]
将以上培养基置于30~35℃培养箱培养24h。取以上培养物1ml加至100ml麦康凯液体培养基中,置于42~44℃培养箱培养24h。用无菌接种环将麦康凯液体培养基培养物划线接种至麦康凯琼脂培养基平皿上,置于30~35℃培养箱培养24h。
[0100]
菌液对照组:以ph7.0无菌氯化钠-蛋白胨缓冲液代替供试液,照试验组进行试验。
[0101]
供试品对照组:以0.9%无菌氯化钠溶液代替菌液,照试验组进行试验。
[0102]
阴性对照组:以ph7.0无菌氯化钠-蛋白胨缓冲液代替供试液,以0.9%无菌氯化钠
溶液代替菌液,照试验组进行试验。
[0103]
3结果
[0104]
3.1微生物计数方法适用性试验结果
[0105]
3.1.1金黄色葡萄球菌计数方法适用性试验结果
[0106]
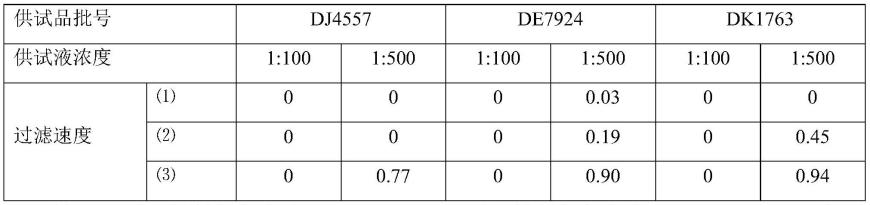
通过预实验结果确定该药对检验菌中的金黄色葡萄球菌的抑菌性最强,因此首先用金黄色葡萄球菌进行试验,确定需氧菌计数方法。表1结果显示,按照薄膜过滤法(试验组1,前加菌),当冲洗液过滤流速为50ml/min时,3批药品1:500供试液的金黄色葡萄球菌回收结果均在0.5~2范围内,1:100供试液金黄色葡萄球菌的回收结果为0;而当冲洗液过滤流速为200ml/min或100ml/min时,1:100和1:500供试液的金黄色葡萄球菌的回收结果均小于0.5。
[0107]
表1薄膜过滤法(前加菌)金黄色葡萄球菌的回收结果
[0108][0109]
注:
⑴
表示过滤速度为200ml/min;
⑵
表示过滤速度为100ml/min;
⑶
表示过滤速度为50ml/min。
[0110]
表2结果显示,按照薄膜过滤法(试验组2,后加菌),当冲洗液过滤速度为50ml/min时,3批供试品1:100供试液金黄色葡萄球菌的回收结果未全部达到0.5,1:500供试液的回收结果均在0.5~2范围内;当冲洗液以200ml/min和100ml/min流速过滤时,3批供试品1:100和1:500供试液对金黄色葡萄球菌的回收结果也未全部达到0.5。
[0111]
表2薄膜过滤法(后加菌)金黄色葡萄球菌的回收结果
[0112][0113]
注:
⑴
表示过滤速度为200ml/min;
⑵
表示过滤速度为100ml/min;
⑶
表示过滤速度为50ml/min。
[0114]
表3结果显示,按照薄膜过滤法(试验组1,前加菌),当冲洗液过滤速度为50ml/min或100ml/min时,低速对照组各试验菌的回收结果均在0.5~2范围内。
[0115]
表3低速对照组(前加菌)的回收结果
[0116][0117][0118]
表1结果表明以不同流速试验时,采用前加菌的方式,1:500供试液在最低流速的回收结果均在0.5~2之间。为得到更高稀释度的试验方法,又采用后加菌的方式进行薄膜过滤试验,表2结果表明虽然后加菌的1:100供试液回收结果较前加菌的回收结果高,但3批次检品并未全部达到0.5。表3表明低流速不影响试验菌回收。因此,根据表1、表2、表3的结果,确定该药需氧菌计数采用薄膜过滤法(试验组1,前加菌),取1:500供试液1ml进行试验,过滤速度为50ml/min。
[0119]
3.1.2其它菌计数方法适用性试验结果
[0120]
表4结果显示,根据确认的需氧菌计数方法对其它需氧菌进行方法适用性试验,其它需氧菌的回收结果均在0.5~2范围内;3批供试品按照平皿法,霉菌和酵母菌的回收结果也均在0.5~2范围内,符合药典要求。
[0121]
表4微生物计数方法适用性试验结果
[0122][0123]
3.2控制菌(大肠埃希菌)的方法适用性试验结果
[0124]
表5结果显示,将10ml不含中和剂或含中和剂的1:10供试液分别加至不同体积的对应增菌培养基中,试验组结果均为阴性。因此,该方法无法消除该药对大肠埃希菌的抑制。
[0125]
表5控制菌方法适用性试验(直接接种法)结果
[0126]
[0127][0128]
表6结果显示,将薄膜过滤法和稀释法联用,当冲洗液的冲洗速度为150ml/min或100ml/min时,各体积培养基试验组结果均为阴性。当冲洗液的冲洗速度为50ml/min时,滤膜分别投至200ml和500ml的tsb中,试验组结果均为阴性;滤膜投至700ml的tsb中,试验组结果为阳性。因此,该药控制菌可采用薄膜过滤法和稀释法联用,增菌培养基体积为700ml,过滤速度为50ml/min。
[0129]
表6控制菌方法适用性试验(薄膜过滤法)结果
[0130][0131]
注:
①
代表过滤速度为150ml/min;
②
代表过滤速度为100ml/min;
③
代表过滤速度为50ml/min。“-”表示阴性;“+”表示阳性。
[0132]
3.3供试品微生物限度检查结果
[0133]
表7结果显示,3批供试品按照以上确认方法分别进行需氧菌、霉菌和酵母菌以及控制菌检验,结果均符合药典规定。
[0134]
表7 3批样品的微生物限度检查结果
[0135][0136][0137]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1