一种基于菌群的Hi-C检测方法
一种基于菌群的hi-c检测方法
技术领域
1.本发明涉及细菌基因检测技术领域,具体为一种基于菌群的hi-c检测方法。
背景技术:
2.过去,研究畜牧养殖环境中细菌耐药性,一般方法是基于培养的细菌分离鉴定的方法。目前,宏基因组方法是研究这种复杂的畜牧养殖环境细菌群落的主要方法。这两种方法都存在不足之处,两种方法都无法确定环境中质粒的宿主细菌,无法明确阐明环境中质粒和耐药基因的传播关系和传播规律。
3.现在迫切需要一种新兴的技术手段来弥补这两种方法的不足,进一步解决细菌研究过程中的问题,一是研究当细菌获得质粒后,质粒与细菌染色体之间的相互作用关系和细菌染色体三维结构的变化及其对基因表达调控活动的影响;二是研究质粒与环境中占比较大的不可培养细菌菌群之间的相互作用关系及宿主关系。
4.hi-c技术是一种基于3c技术,用于检测全基因组的成对染色质相互作用,目前已成为研究基因组结构的基准工具。目前,该技术在我国现已广泛应用于真核生物的研究,但是在动物源微生物领域尚没有低成本的、高效的、成熟的商业化试剂盒。仅少数的商业服务公司能够提供该技术以及国外已有用于宏基因组样本的hi-c建库试剂盒,但是两者费用都较为昂贵,不适用于具有大量研究样本的微生物研究领域。而且之前一些已经报道的方法,普遍具有时间长、成本高、繁琐、安全性低、虚假连接多等特点,这些因素限制了该技术应用于动物源微生物领域的研究。
技术实现要素:
5.为了克服现有技术方案的不足,本发明提供一种基于菌群的hi-c检测方法,能有效的解决背景技术提出的问题。
6.本发明解决其技术问题所采用的技术方案是:一种基于菌群的hi-c检测方法,包括以下检测步骤:步骤s1,菌群收集:对于需培养的菌群样品,将菌群样品接种于50ml bhi肉汤中,在37℃的条件下摇床过夜培养;然后使用50ml灭菌离心管收集培养好的菌液,在4℃条件下以5000rpm离心10分钟,弃掉上清液,收集细菌沉淀;接着往细菌沉淀中加入6ml bhi肉汤,重悬细菌沉淀,以洗涤细菌,再次在4℃条件下,以5000rpm离心10分钟,弃掉上清液,收集细菌沉淀;对于不需培养的宏基因组样品,称取2.5 g样品于50 ml灭菌离心管内,加入5 ml预冷pbs缓冲液,涡旋振荡5分钟,再次加入3 ml 预冷pbs缓冲液,涡旋振荡,充分混匀,在4℃条件下1000 rpm离心30秒,转移上清液到新的50 ml灭菌离心管内,重新向装有样品沉淀的50 ml离心管内加入8 ml预冷pbs缓冲液,涡旋振荡1分钟,在4℃条件下1000 rpm离心30秒,转移上清到上一步装有上清液的50 ml离心管内,重复该步骤4遍,将收集的全部上清液,在4℃条件下5000 rpm离心10分钟,收集细菌沉淀,弃掉上清液,向离心管内加入6 ml预冷pbs缓冲液,使用移液器吹打混匀以洗涤沉淀,在4℃条件下,5000 rpm离心10 分钟弃掉上清
w/v甲醛溶液配制而成。
8.进一步地,在步骤s4中,当细菌较难破裂时,则加入1.5ml裂解液反应5分钟。
9.进一步地,在步骤s5中,配制的限制性反应混合物的成分主要包括depc水、蛋白酶抑制剂、fastdigest hindiii、10
×
fastdigest buffer和细菌裂解产物。
10.进一步地,在步骤s6中,配制的第一混合体系的成分主要包括depc水、10
×
reaction buffer、10 mm dctp、10 mm dgtp、10 mm dttp、biotin-14-datp、klenow fragment,lc和酶切产物。
11.进一步地,在步骤s7中,配制的第二混合体系的成分主要包括depc水、10
×
t4 dna ligase buffer、10% triton x-100、bsa溶液、t4 dna ligase和末端填补产物。
12.进一步地,在步骤s10中,配制的第三混合体系的成分主要包括hi-c文库、10
×
ne buffer、10 mm datp、10 mm dgtp、bsa溶液和t4 dna polymerase。
13.与现有技术相比,本发明的有益效果是:(1)利用菌群hi-c建库测序技术,能够重现样品中的部分质粒与特定细菌菌群之间的宿主关系,为进一步阐明环境中耐药基因的传播规律提供直接的、强有力的证据;(2)使用4碱基快速限制性核酸内切酶,节省时间,相比较于普通的限制性内切酶,快速的限制性核酸内切酶可以短时间内精确完成dna切割,提高了酶切通量,而且无星号活性,获得了更多有效相互作用对,另外,实验下游所用的dna连接酶、dna聚合酶与快速的限制性核酸内切酶的缓冲液中都具有100%兼容性,实验过程中无需更换缓冲液或者进行纯化,从而节省时间与成本,减少了实验噪音;(3)宏基因组样本可直接使用pbs溶液多次洗涤,收集液体,再离心收集菌群沉淀,无需培养,然后进行甲醛交联并适当降低交联时间,宏基因组样品中含有多种类型的细菌与质粒,有需氧菌、厌氧菌、兼性厌氧菌等,有能培养的细菌、难以培养的细菌等,为了尽可能获得样本中的多种细菌与质粒,保证样本环境的完整性。
附图说明
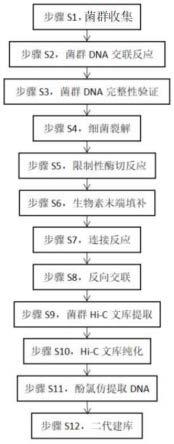
14.图1为本发明检测流程示意图。
具体实施方式
15.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
16.实施例:如图1所示,本发明提供了一种基于菌群的hi-c检测方法,包括以下检测步骤:步骤s1,菌群收集对于需培养的菌群样品,将菌群样品接种于50ml bhi肉汤中,在37℃的条件下摇床过夜培养;然后使用50ml灭菌离心管收集培养好的菌液,在4℃条件下以5000rpm离心10分钟,弃掉上清液,收集细菌沉淀;接着往细菌沉淀中加入6ml bhi肉汤,重悬细菌沉淀,以洗涤细菌,再次在4℃条件下,以5000rpm离心10分钟,弃掉上清液,收集细菌沉淀;对于不需
培养的宏基因组样品,称取2.5 g样品于50 ml灭菌离心管内,加入5 ml预冷pbs缓冲液,涡旋振荡5分钟,再次加入3 ml 预冷pbs缓冲液,涡旋振荡,充分混匀,在4℃条件下1000 rpm离心30秒,转移上清液到新的50 ml灭菌离心管内,重新向装有样品沉淀的50 ml离心管内加入8 ml预冷pbs缓冲液,涡旋振荡1分钟,在4℃条件下1000 rpm离心30秒,转移上清到上一步装有上清液的50 ml离心管内,重复该步骤4遍,将收集的全部上清液,在4℃条件下5000 rpm离心10分钟,收集细菌沉淀,弃掉上清液,向离心管内加入6 ml预冷pbs缓冲液,使用移液器吹打混匀以洗涤沉淀,在4℃条件下,5000 rpm离心10 分钟弃掉上清液,收集细菌沉淀,从两种类型样品中收集到的细菌沉淀可以直接使用进行菌群hi-c文库构建;步骤s2,菌群dna交联反应配制20ml 3%的甲醛溶液,配制3%的甲醛溶液时,应在冰上和避光操作,配制完成后加入到含有细菌沉淀的50ml的离心管中,重悬细菌沉淀,在37℃条件下培养15分钟,每隔2分钟摇晃一下;向交联反应中加入4.5ml 2.5m甘氨酸(终浓度为460mm),充分振荡混合,在37℃条件下摇床下培养5分钟,再在4℃条件下培养15分钟,每隔2分钟摇晃一下;然后在4℃条件下以5000rpm离心8分钟,收集交联细菌;接着加入4ml 1*te缓冲液,重悬细菌,在4℃条件下以5000rpm离心8分钟;再加入3ml 1*te缓冲液,重悬细菌,将固定细菌的菌液平均分装于2ml的ep管内,每管1ml(三个平行),在4℃条件下以5000rpm离心8分钟,丢弃上清液;最后使用液氮迅速将细菌沉淀冻结,放入-80℃冰箱保存。
17.具体地,3%的甲醛溶液由18.4 ml 1*pbs溶液和1.6 /ml 37% w/v甲醛溶液配制而成。
18.步骤s3,菌群dna完整性验证取出上步骤其中一个平行样品,试剂盒提取dna,确保细菌dna完整性。
19.步骤s4,细菌裂解将交联细菌从-80℃冰箱取出,放在冰上融化30分钟;接着向细菌沉淀中加入100μl溶菌酶,在30℃条件下孵育15分钟;最后加入1.5ml depc水补足体积。
20.具体地,当细菌较难破裂时,则加入1.5ml裂解液反应5分钟。
21.步骤s5,限制性酶切反应使用4碱基限制性内切酶进行限制性酶切反应,配制限制性反应混合物;接着将配制好的体系吹打混匀,放于37℃水浴锅孵育3小时;最后放于80℃水浴锅孵育10分钟,以灭活酶。
22.具体地,配制的限制性反应混合物成分主要包括depc水、蛋白酶抑制剂、fastdigest hindiii、10
×
fastdigest buffer和细菌裂解产物,他们各自用量如下所示:
步骤s6,生物素末端填补配制第一混合体系,并吹打混匀,放于30℃水浴锅孵育2小时;然后放于75℃水浴锅孵育10分钟,以灭活酶;接着在4℃的条件下,以15000rpm离心30分钟,收集沉淀,弃掉上清液;最后加入300μl depc水重悬沉淀,立即放于冰上。
23.具体地,配制的第一混合体系的成分主要包括depc水、10
×
reaction buffer、10 mm dctp、10 mm dgtp、10 mm dttp、biotin-14-datp、klenow fragment,lc和酶切产物,配制时,各成分按以下顺序及用量对应加入配制,如下如示:步骤s7,连接反应在新的2.0ml离心管配制第二混合体系,将上一步的每管细菌液加入到配制的混合物中,上下颠倒混匀;然后在25℃条件下孵育4小时,中途摇晃一下;再在65℃条件下孵育10分钟,灭活酶;最后加入10μlrnase,室温孵育5分钟。
24.具体地,配制的第二混合体系的成分主要包括depc水、10
×
t4 dna ligase buffer、10% triton x-100、bsa溶液、t4 dna ligase和末端填补产物,配制时,需要在冰上操作,而且各成分按以下顺序加入配制,如下如示:
步骤s8,反向交联向上一步产物中加入150μl蛋白酶k溶液(20 mg/ml),放于65℃水浴锅孵育3小时;然后加入150μl蛋白酶k溶液,继续放于65℃水浴锅孵育3小时。
25.步骤s9,菌群hi-c文库提取(酚氯仿)加入1.2体积的dna提取液,轻轻上下颠倒混匀,室温静置10分钟,在4℃条件下以14000rpm离心10分钟,用移液枪将上层液体转移到新的15ml离心管内;再次加入1.2体积的dna提取液,轻轻上下颠倒混匀,室温静置10分钟,在4℃条件下以14000rpm离心10分钟,用移液枪将上层液体转移到新的15ml离心管内;接着加入0.1体积的3m乙酸钠、2μl5.0mg/ml糖原,上下颠倒混匀,再加入2体积的冷的100%乙醇,上下颠倒混匀,并在-20℃条件下孵育过夜;然后将孵育过夜的液体分次装于1.5ml离心管内,在4℃条件下以14000rpm离心25分钟,吸走上清液,在离心管底部可以看到白色沉淀;再加入500μl冷的70%的乙醇溶液,洗涤(不要把沉淀悬浮起来);在4℃条件下以14000rpm离心20分钟,去掉上清液,重复两次;在室温风干20分钟,并加入100μl1*te缓冲液,溶解沉淀;最后用hs试剂盒检测dna浓度。
26.步骤s10,hi-c文库纯化配制第三混合体系,并混匀,将每管平均分装于pcr管内,每份50μl,接着利用pcr仪在12℃条件下培养5分钟;然后加入12μledta-2na,利用pcr仪在75℃条件下处培养20分钟,灭活酶。
27.具体地,配制的第三混合体系的成分主要包括hi-c文库、10
×
ne buffer、10 mm datp、10 mm dgtp、bsa溶液和t4 dna polymerase,配制时需要在冰上操作,并且各成分配制如下所示:
步骤s11,酚氯仿提取dna提取后,用30μl 1*te缓冲液溶解沉淀。
28.步骤s12,二代建库(一)酶切反应1、配制酶切pcr体系向16μl 的dna产物中先加入2μl buffer,再加入2μl 酶,吹打混匀。
29.2、pcr程序:37℃ 5分钟3、pcr结束后,将样品插在冰上,马上加入5μl edta,吹打混匀。
30.4、吸取5μl 进行琼脂凝胶电泳实验。
31.5、使用2.2x磁珠纯化。
32.6、使用hs检测dna浓度。
33.(二)末端修复1、将末端缓冲液和末端修复酶(不涡旋,低速离心)从冰箱取出,置于冰上。
34.2、pcr体系配制(50μl)3、pcr程序:
(三)接头反应1、将接头、连接酶、连接缓冲液2-1(buffer2-1)从冰箱取出,置于冰上。从常温中取出增强液,连接缓冲液2-2(buffer2-2)。
35.2、pcr体系配制(80μl):3、pcr程序:(四)链霉亲和素磁珠准备1、配制100ml buffer i:2、将磁珠充分混悬,可置于混合器上涡旋振荡 20 秒,取50μl磁珠到新的离心管中,置于磁力架,磁性分离,弃上清液。
36.3、加入200μl buffer i,充分洗涤磁珠。
37.磁珠洗涤过程:加入buffer到pcr管中,盖上管盖,涡旋振荡磁珠30秒,磁性分离,弃上清。重复以上步骤 1 次。
38.4、加入120μl的buffer i,重悬磁珠。
39.5、将80μl的接头反应产物加入到上述磁珠中,吹打混匀,37℃孵育45分钟。
40.6、置于磁力架上,静置10分钟(磁性分离)。取出上清液到新的离心管内,以备使
用。
41.7、加入 200μl buffer i,充分洗涤磁珠。重复 1 次。
42.8、加入23μl 的depc水,重悬磁珠。
43.(五)文库扩增1、pcr体系:2、pcr程序:3、将pcr管放在磁力架上,静置5分钟。然后转移48μl上清液到新的pcr管,放于冰上,直到再次使用。
44.4、剩余磁珠洗涤(1)向上一步含有磁珠的pcr管中加入50μl的buffer i,吹打混匀。将pcr管放在磁力架上,静置5分钟,然后取出上清液。(重复两次)(2)向上一步含有磁珠的pcr管中加入50μl的te缓冲液,重悬磁珠,保存于4
°
c。(可以继续使用)(六)文库纯化1、吸取48μl 建库磁珠到上述的48μl上清液,吹打混匀。室温静置5分钟。
45.2、置于磁力架5分钟。加入200μl 80%乙醇,静置30秒,弃掉液体。重复一次。
46.3、室温放置5分钟,干燥磁珠,使酒精挥发。
47.4、加入25μl ddh2o,重悬磁珠,吹打混匀,室温静置5分钟。
48.5、放于磁力架,静置5分钟。
49.6、吸取23μl上清液到新的pcr管中,吸取2μl 上清液进行hs检测dna浓度。
50.对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1