三环二氢咪唑并嘧啶酮衍生物、其制备方法、药物组合物和用途与流程
三环二氢咪唑并嘧啶酮衍生物、其制备方法、药物组合物和用途
1.本技术是申请日为2020年11月9日、申请号为202011243331.x、发明名称为“三环二氢咪唑并嘧啶酮衍生物、其制备方法、药物组合物和用途”的中国发明专利申请的分案申请。
技术领域:
2.本发明涉及新的三环二氢咪唑并嘧啶酮化合物、其制备方法及包含该化合物的药物组合物以及它们在治疗由lp-pla2介导的疾病中的用途。
背景技术:
:
3.脂蛋白相关磷脂酶a2(lp-pla2)是参与脂蛋白脂质或磷脂的水解的磷脂酶 a2酶,亦被称为血小板活化因子乙酰水解酶(paf-ah)。lp-pla2随低密度脂蛋白(ldl)移动,并迅速裂解从ldl氧化得到的氧化的磷脂酰胆碱分子。lp-pla2水解氧化的磷脂酰胆碱的sn-2酯得到脂质介体溶血磷脂酰胆碱(lysopc)和氧化的非酯化脂肪酸(nefa)。文献报道lysopc和nefa能引起炎性反应,因此lp-pla2介导了体内的氧化炎性反应。(zalewski a等人,arterioscler.thromb.vasc.biol., 25,5,923-31(2005))
4.文献(wo96/13484、wo96/19451、wo97/02242、wo97/12963、wo97/21675、 wo97/21676、wo97/41098、wo97/41099、wo99/2442、wo00/10980、 wo00/66566、wo00/66567、wo00/68208、wo01/60805、wo02/30904、 wo02/30911、wo03/015786、wo03/016287、wo03/041712、wo03/042179、 wo03/042206、wo03/042218、wo03/086400、wo03/87088、wo08/04886、 us2008/0103156、us2008/0090851、us2008/0090852、wo08/048866、 w005/003118、w006/063811、w006/063813、wo2008/141176、wo2013013503a1、 wo2013014185a1、wo2014114248a1、wo2014114694a1、wo2016011930a1、 jp200188847us2008/0279846a1、us 2010/0239565a1、us 2008/0280829a1)描述了许多的lp-pla2抑制剂和/或其用途,治疗涉及血管内皮功能异常或与其相关的疾病、涉及与lp-pla2活性关联的(例如,与溶血磷脂酰胆碱和氧化的游离脂肪酸的形成相关的)脂质氧化的疾病及涉及活化的单核细胞、巨噬细胞或淋巴细胞的或者与单核细胞、巨噬细胞或淋巴细胞的参与增加相关的疾病。具体疾病的例子包括神经退行性疾病(例如阿兹海默症、帕金森病、亨廷顿病、血管性痴呆)、各种神经精神疾病如精神分裂症和孤独症、外周以及脑动脉粥样硬化、中风、代谢性骨病(例如骨髓异常)、血脂异常、佩吉特病、ii型糖尿病、高血压、心绞痛、心肌梗塞、缺血、再灌注损伤、代谢综合征、胰岛素抵抗和甲状旁腺功能亢进、糖尿病性并发症(例如黄斑水肿、糖尿病性视网膜病变和后葡萄膜炎、糖尿病溃疡和糖尿病肾病)、糖尿病外周神经病变性疼痛、炎性疼痛、神经病理性痛、各类癌症(例如前列腺癌、结肠癌、乳腺癌、肾癌、肺癌和卵巢癌等)、黄斑水肿、伤口愈合、男性勃起障碍、类风湿性关节炎、慢性阻塞性肺病(copd)、败血症、急慢性炎症、牛皮癣和多发性硬化。
5.科学研究结果进一步证明lp-pla2抑制剂可以用于治疗动脉粥样硬化。 wilensky
等人在加速冠状动脉粥样硬化的糖尿病和高胆固醇血症猪模型中证明 lp-pla2抑制剂对于动脉粥样硬化斑块成分的作用(wilensky等人,naturemedicine,10,1015-1016(2008))。临床研究也发现lp-pla2抑制剂能稳定动脉粥样硬化斑块的病人的硬化斑块,阻止斑块进一步发展而发生破裂(serruys等人, circulation 118:1172-1182(2008))。
6.研究表明高lp-pla2活性与高痴呆症(包括阿尔茨海默病(ad)和混合性痴呆)风险相关(van oijen等人,annals of neurology,59,139(2006);fitzpatrick等人,atherosclerosis 235:384-391(2014))。在ad患者中观察到较高的氧化ldl 的水平(kassner等人,current alzheimer research,5,358-366(2008);dildar 等人,alzheimer dis assoc disord,24,april-june(2010);sinem等人,currentalzheimer research,7,463-469(2010))。
7.此外,us2008/0279846描述了lp-pla2抑制剂减少了血脑屏障渗漏和大脑淀粉样蛋白(abeta)负载,可以用于治疗与血脑屏障渗漏相关的疾病,例如阿尔茨海默病和血管性痴呆。在临床研究中,lp-pla2抑制剂对阿尔茨海默病人能起到阻止认知功能进一步恶化的显著效果(maher-edwards等人,alzheimer’s& dementia:translational research&clinical interventions 1,131-140(2015))。
8.神经炎症(包括多种细胞毒性细胞因子的释放)为所有神经退行性疾病(包括多发性硬化、肌萎缩性侧索硬化、帕金森病、阿尔茨海默病等)的共同特征(perry, acta neuropathol,120,277-286(2010))。lp-pla2抑制剂通过抑制lysopc产生来减少多种细胞因子的释放(shi等人,atherosclerosis 191,54-62(2007))。因此,抑制lp-pla2是神经退行性疾病(包括多发性硬化、肌萎缩性侧索硬化、帕金森病等)的潜在治疗方法。
9.lysopc也参与白细胞活化、诱导细胞凋亡和介导血管内皮细胞功能障碍(wilensky等人,current opinion in lipidology,20,415-420,(2009))。因此,据认为lp-pla2抑制剂可以用于通过减少lysopc的产生而治疗与糖尿病相关的组织损伤。高lp-pla2活性与高糖尿病视网膜病变发病风险有相关性(siddiqui 等人,diabetologia,61,1344-1353(2018))。lp-pla2抑制剂可以抑制糖尿病大鼠模型的视网膜病变的主要病理变化(canning等人,p.n.a.s.113,7213-7218 (2016)。临床研究也显示lp-pla2抑制剂可以改善糖尿病视网膜病变病人的视网膜黄斑水肿症状和视力(staurenghi等人,ophthalmology 122,990-996(2015)。这些研究证明lp-pla2抑制剂可以用于糖尿病视网膜病变。
10.研究表明糖尿病病人体内的lp-pla2活性高于正常人(serban等人j.cell. mol.med.6:643-647,(2002);garg等人indian j.med.res.141:107-114,(2015))。而如上所述,lp-pla2的活性介导了氧化炎性反应,推测抑制lp-pla2活性可以用于治疗糖尿病病人由于体内氧化炎性反应引起的各种并发症,如糖尿病肾病、糖尿病周围神经病变和糖尿病皮肤溃烂等。
11.青光眼和年龄相关性黄斑变性(amd)为视网膜神经退行性疾病。炎症在青光眼和amd的发病机制中起重要作用(buschini等人,progress in neurobiology, 95,14-25(2011);tezel,progress in brain research,vol.173,issn0079—6123,第 28章)。因此,lp-pla2抑制剂可以提供对于青光眼和amd的潜在治疗应用。
12.在男性勃起障碍病人中,体内lp-pla2的活性显著高于正常人,并认为高 lp-pla2活性可以预测早期男性勃起障碍(otunctemur等人,andrologia 47: 706-710(2015)),提
示lp-pla2抑制剂可用于治疗男性勃起障碍。
13.在前列腺癌组织中有lp-pla2高表达,降低lp-pla2可以在体外实验中减少前列腺细胞癌变并促进前列腺癌细胞凋亡(vainio等人,oncotarget,2:1176-1190 (2011)),提示lp-pla2抑制剂可以用于治疗前列腺癌。
14.但是,现有技术中仍然对新的lp-pla2抑制剂存在强烈的需求。
技术实现要素:
15.本发明的目的在于提供一种嘧啶酮类化合物及其药物组合物,其可被用作 lp-pla2抑制剂。
16.在第一方面,本发明涉及一种式i所示的化合物、其顺反异构体、其对映异构体、其非对映异构体、其外消旋体、其溶剂合物、其水合物或其药学上可以接受的盐或其前体药物,
[0017][0018]
其中
[0019]
n为0,1或2,且当n为0时,r2为甲基或乙基,当n为1或2时,r2不存在;
[0020]
r1为h,卤素,氰基,c
1-6
烷基,c
1-6
烷氧基,c
3-8
环烷基或3-8元杂环基, r1可以任选被一个或多个以下取代基取代:卤素,氰基,c
1-6
烷氧基,c
3-8
环烷基、3-8元杂环基或6-10元杂芳基;
[0021]
ra独立的为h或d;
[0022]
m为1或2;
[0023]rx
为h,卤素,羟基,羧基,氰基,氨基,c
1-6
烷基,c
1-6
烷氧基,c
3-8
环烷基,3-8元杂环基,6-10元芳基,6-10元杂芳基,-c(o)nrbrc,-s(o)2nrbrc, r
x
可以任选被一个或多个以下取代基取代:卤素,羟基,c
1-6
烷氧基,氰基,c
3-8
环烷基,3-8元杂环基,6-10元芳基或6-10元杂芳基;
[0024]
q为-o-,-s-,-ch
2-或-nr
b-;
[0025]
x为-o-,-ch
2-,-nr
c-,-och
2-或不存在;
[0026]
rb为h,c
1-6
烷基或c
3-8
环烷基或3-8元杂环基;
[0027]
rc为l,l-c(o)-,l-ch
2-或l-s(o)
2-,其中l为h、c
1-6
烷基、c
3-6
环烷基、 3-8元杂环基,6-10元芳基或6-10元杂芳基,l可以任选被一个或多个下基团取代:卤素,羟基,c
1-6
烷氧基,氰基,c
3-8
环烷基,3-8元杂环基,6-10元芳基或6-10元杂芳基;
[0028]
y为-ch
2-,-ch2ch
2-或者不存在;
[0029]
u为-ch
2-,-c(o)-或者不存在;
[0030]
x与u不同时为不存在;
[0031]
y和u可以任选被一个或多个以下取代基取代:卤素,羟基,c
1-6
烷基,c
1-6
烷氧基,氰基,c
3-8
环烷基,3-8元杂环基,6-10元芳基或6-10元杂芳基;
[0032]
a为
[0033]
z为n或cr3;
[0034]
z’为n或cr4;
[0035]
r3,r4,r5,r6独立的为h、氰基、卤素或c
1-3
卤代烷基;
[0036]
v为n或cr9,其中r9为h、氰基、卤素、c
1-3
烷基、c
1-3
卤代烷基或-o-w;
[0037]
w为苯基或5或6元杂芳基,其可以任选被一个或多个下列的取代基取代:卤素,氰基,c
1-6
烷基,c
1-3
烷氧基,c
1-3
卤代烷基和c
1-3
卤代烷氧基。
[0038]
在一些实施方案中,其中n为0;r1为h、氰基、卤素、c
1-6
烷基,c
1-6
烷氧基或c
1-3
卤代烷基;ra为h;rx为h,氰基,氟,二氟甲基,氨基,氨基,r2为甲基或乙基;q为-o-;x为-o-,-ch2或者不存在-;y为-ch
2-;u为-ch
2-,或者不存在;x与u不同时为不存在。
[0039]
进一步地,r1为h和rx为h。
[0040]
在一些实施方案中,其中n=1或2,r2不存在。进一步地,其中r
x
为h。进一步地,其中x为-o-或-ch
2-。
[0041]
在一些实施方案中,其中n为1;r
x
为h;r1为h,氰基,氨基,卤素, c
1-3
烷基,c
1-3
卤代烷基或c
1-6
烷氧基。
[0042]
在一些实施方案中,其中u为-ch
2-;x为-ch
2-或-o-且q为-o-。
[0043]
在一些实施方案中,其中u为-ch
2-;x为-nr
c-,rc为甲基,氧杂环丁基,三氟乙基,苯甲酰基,环丁基,苄基,
[0044]
在一些实施方案中,其中u为-c(o)-;r1和r
x
均为h,y为-ch
2-;x为-nr
c-, rc为l或l-c(o)-,其中l为甲基,三氟乙基,苯甲酰基,氧杂环丁烷,环丁烷,苄基,进一步地,l为甲基。
[0045]
在一些实施方案中,其中n为1;x为-ch
2-;u不存在;r
x
为h,羟基,卤素,氰基,氨基,c
1-3
烷氧基,c
1-3
卤代烷基,3-8元杂环基,r
x
可以任选被一个或多个以下取代基取代:卤素,羟基,c
1-6
烷氧基,氰基,3-8元杂环基, 6-10元芳基或6-10元杂芳基。
[0046]
在一些实施方案中,其中y为-ch
2-;r1为h,氰基,卤素,c
1-3
烷基,c
1-3
卤代烷基,c
1-6
烷氧基;q为-o-。
[0047]
在一些实施方案中,其中r
x
为h,卤素,氰基,氨基,二氟甲基,为h,卤素,氰基,氨基,二氟甲基,
[0048]
在一些实施方案中,其中y为-ch2ch
2-;r
x
为h,卤素,氰基,氨基,二氟甲基,
r1为h,氰基,卤素,c
1-3
烷基,c
1-3
卤代烷基或c
1-6
烷氧基;q为-o-。进一步地,rx为h。
[0049]
在一些实施方案中,其中n为2;u为-ch
2-;x为-ch
2-或-o-;y为-ch2‑ꢀ
或不存在;r
x
为h,卤素,氰基,氨基,二氟甲基,二氟甲基,r1为h,氰基,卤素,c
1-3
烷基,c
1-3
卤代烷基或c
1-6
烷氧基;且q 为-o-。进一步地,rx为h且r1为h。
[0050]
在一些实施方案中,其中m=2;r1为h,氰基或c
1-3
卤代烷基;且r
x
为h。
[0051]
在一些实施方案中,其中m=1,r1为h,氰基,卤素,c
1-3
烷基,c
1-3
卤代烷基或c
1-6
烷氧基;且r
x
为h。
[0052]
在一些实施方案中,其中a为r5,r6,r7,r8,r9独立的为h, f或氰基。
[0053]
在一些实施方案中,其中a为r5,r6,r7和r8独立的为h,f 或氰基;r9为-o-w,w为5或6元杂芳基或苯基,其可以任选由一个或多个下列的取代基取代:c
1-3
卤代烷基、c
1-3
卤代烷氧基、氰基卤素和c
1-6
烷基。
[0054]
在一些实施方案中,其中a为r7和r8独立的为h,f或氰基; r9为-o-w;w为吡啶基、嘧啶基、吡唑基或苯基,其可以任选被一个或多个独立选自以下的取代基取代:卤素、氰基、cf3、-ocf3、chf2和ch3。
[0055]
在一些实施方案中,化合物具有式i’[0056][0057]
其中r1为h,氰基,卤素,c
1-6
烷基,c
1-3
烷氧基或c
1-3
卤代烷基;x为-o-,
ꢀ‑
ch
2-,-nrc-或不存在;rc为l或l-c(o)-,其中l为h、c
1-3
烷基、c
3-6
环烷基, c
3-6
杂环烷基,c1-3卤代烷基、或苄基;y为-ch
2-或者不存在;n,r2,ra,a, m如在上述式(i)中所定义。
[0058]
在一些实施方案中,n为0,r2为甲基或乙基;r1为h;ra为h;m为1; x为-o-或-ch
2-。
[0059]
在一些实施方案中,化合物是下述化合物
[0060][0061]
其中,r1为h,卤素,氰基,c
1-6
烷基,c
1-3
卤代烷基或c
1-6
烷氧基(进一步地,所述卤素为氟或氯,所述c
1-6
烷基是甲基、乙基或异丙基,所述c
1-3
卤代烷基是三氟甲基,且所述c
1-6
烷氧基是甲氧基);r2为甲基或乙基;rc为c
1-6
烷基,3-8 元杂环基,c
1-3
卤代烷基,苯甲酰基,c
3-8
环烷基,苄基或(进一步地,所述c
1-6
烷基是甲基,所述3-8元杂环基是氧杂环丁基,所述c
1-3
卤代烷基是三氟乙基且所述c
3-8
环烷基是环丁基);r
x
为h,氰基,卤素,c
1-3
卤代烷基,氨基,(进一步地,所述卤素为氟且所述 c
1-3
卤代烷基是二氟甲基)。
[0062]
进一步地,化合物是下述化合物
[0063][0064]
其中,r1为h,卤素,氰基,c
1-6
烷基,c
1-3
卤代烷基或c
1-6
烷氧基(进一步地,所述卤素为氟或氯,所述c
1-6
烷基是甲基、乙基或异丙基,所述c
1-3
卤代烷基是三氟甲基,且所述c
1-6
烷氧基是甲氧基);r2为甲基或乙基;rc为c
1-6
烷基,3-8 元杂环基,c
1-3
卤代烷基,苯甲酰基,c
3-8
环烷基,苄基或(进一步地,所述c
1-6
烷基是甲基,所述3-8元杂环基是氧杂环丁基,所述c
1-3
卤代烷基是三氟乙基且所述c
3-8
环烷基是环丁基);r
x
为h,氰基,卤素,c
1-3
卤代烷基,氨基,(进一步地,所述卤素为氟且所述 c
1-3
卤代烷基是二氟甲基)。
[0065]
在一些实施方案中,上述通式(i)化合物中,a选自下述基团:
[0066]
[0067][0068]
在一些实施方案中,上述通式(i)化合物是下述化合物:
[0069]
[0070]
[0071]
[0072]
[0073]
[0074]
[0075]
[0076]
[0077]
[0078]
[0079]
[0080]
[0081][0082]
在第二方面,本发明涉及一种式i’所示的化合物、其顺反异构体、其对映异构体、其非对映异构体、其外消旋体、其溶剂合物、其水合物或其药学上可以接受的盐或其前体药物,
[0083][0084]
其中
[0085]
n为0,1或2,且n为0时,r2为甲基或乙基,n不为0时,r2不存在;
[0086]
r1为h,卤素,c
1-6
烷基或c
3-6
环烷基;
[0087]
ra独立的为h或d;
[0088]
m为1或2;
[0089]
x为-o-,-ch
2-,-nr-或不存在;
[0090]
r为l-c(o)-,l-ch
2-或l-s(o)
2-,其中l为h、c
1-3
烷基、c
3-6
环烷基或苯基;
[0091]
y为-ch
2-或者不存在;
[0092]
a为
[0093]
z为n或cr3;
[0094]
z’为n或cr4;
[0095]
r3,r4,r5,r6独立的为h、cn、卤素或c
1-3
卤代烷基;
[0096]
v为n或cr9,其中r9为h、cn、卤素、c
1-3
烷基、c
1-3
卤代烷基或-o-w;
[0097]
w为5或6元杂芳环或苯基,其可以任选由一个或多个下列的取代基取代: c
1-3
卤代烷基、c
1-3
卤代烷氧基、cn、卤素和c
1-5
烷基。
[0098]
在一些实施方案中,上述通式(i’)化合物中n不为0且具有以下一个或多个特征:
[0099]
(1)r1为h,ra为h;
[0100]
(2)x为o或不存在,y为-ch
2-,n为1;
[0101]
(3)x为-ch
2-,y为-ch
2-或不存在,n为2;
[0102]
(4)m为1。
[0103]
在一些实施方案中,所述通式(i’)化合物中n为0且具有以下一个或多个特征:
[0104]
(1)r1为h,ra为h;
[0105]
(2)r2为甲基;
[0106]
(3)x为不存在,-o-,-ch
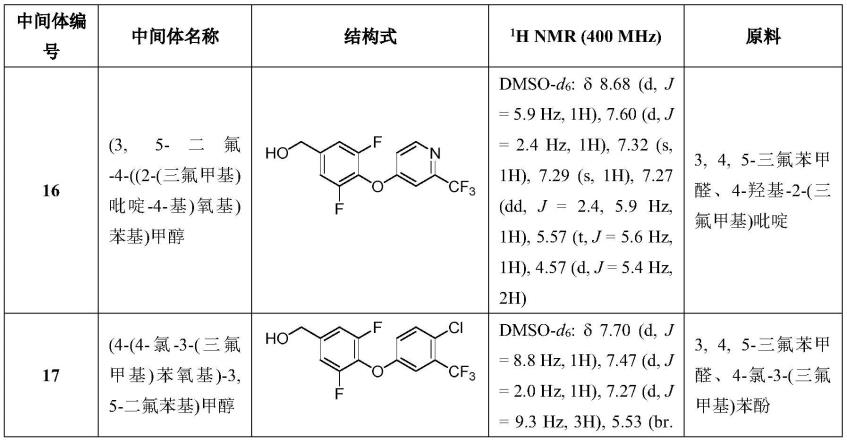
2-;
[0107]
(4)m为1。
[0108]
在一个实施方案中,a为其中r5,r6,r7,r8,r9独立的为h、 f或cn。
[0109]
在一个实施例中,a为其中r5,r6,r7,r8独立的为h、f或 cn;r9为-o-w;w为5或6元杂芳基或苯基,其中所述杂芳基或苯基任选由一个或多个下列的取代基取代:c
1-3
卤代烷基、c
1-3
卤代烷氧基、cn、卤素和c
1-5
烷基。
[0110]
在一个实施例中,a为其中r7,r8独立的为h、f或cn;r9为-o-w;w为吡啶基、嘧啶基、吡唑基和苯基,其中所述吡啶基、嘧啶基、吡唑基或苯基任选由一个或多个下列的取代基取代:卤素,cn,cf3,-ocf3和ch3。
[0111]
在一些实施方案中,a为
[0112][0113]
在一个实施方案中,所述的化合物为以下化合物任一个化合物:
[0114]
[0115]
[0116]
[0117][0118]
上述式的化合物、其盐(例如,药学上可接受的盐)可以立体异构体形式存在(例如,它包含一个或多个不对称碳原子)。所述单个立体异构体(对映异构体和非对映异构体)及它们的混合物均包括在本发明的范围内。
[0119]
本发明还包括上述式的化合物、其盐(例如,药学上可接受的盐)的各种氘代形式。连接到碳原子上的各可用的氢原子可以独立地被氘原子取代。本领域的普通技术人员将了解如何合成上述式的化合物、其盐(例如,药学上可接受的盐)的氘代形式。市售的氘代原料可以用于氘代形式的上述式的化合物、其盐(例如,药学上可接受的盐)的制备中,或可以使用采用氘代试剂(如氘化铝锂)的常规技术来合成这些化合物。
[0120]
除了本文所述化合物的游离碱或游离酸形式,化合物的盐形式也在本发明的范围内。本发明化合物的盐或药学上可接受的盐可以在化合物的最后分离和纯化过程中在原位制备,或通过单独将游离酸或游离碱形式的纯化的化合物分别与合适的碱或酸反应来制备。对于合适的药学上的盐的综述参见berge等人,j.pharm, sci.,66,1-19,1977;p l gould,international journal of pharmaceutics,33 (1986),201-217;和bighley等人,encyclopedia of pharmaceutical technology, marcel dekker inc,new york 1996,volume 13,page 453-497。
[0121]
本文所描述的化合物、其盐(例如,药学上可接受的盐)、氘化形式、其溶剂化物或水合物可以以一种或多种多晶型物形式存在。因此,在另一个方面,本发明提供了本文所定义的化合物、其盐(例如,药学上可接受的盐)的多晶型物,或本文所述的化合物或其盐(例如,药学上可接受的盐)的溶剂化物或水合物的多晶型物。
[0122]
本发明还包括同位素标记的化合物和盐,其等同于上述式的化合物或其盐,但一个或多个原子被原子质量或质量数不同于自然中最经常发现的原子质量或质量数的原子代替。可掺入上述式的化合物或其盐的同位素的实例为氢、碳、氮、氘的同位素,如3h、
11
c、
14
c和
18
f这些同位素标记的上述式的化合物或其盐可用于药物和/或底物组织分布测试。例如
,
11
c和
18
f同位素可用于pet(正电子发射断层摄影术)。pet可用于脑成像。在一些实施方案中,上述式的化合物或其盐为非同位素标记的。
[0123]
因此,本发明的化合物包括上述式的化合物,或其盐,例如其药学上可接受的盐。本发明代表性化合物包括所述具体的化合物。
[0124]
在第三方面,本发明还涉及包含本发明所述的化合物和药学上可接受的赋形剂的药物组合物。
[0125]
在第四方面,本发明还涉及治疗或预防与lp-pla2的活性相关的疾病的方法,包括向有需要的受试者给药治疗有效量的本文所述的本发明的化合物。该疾病可以与以下相关:单核细胞、巨噬细胞或淋巴细胞的参与增加溶血磷脂酰胆碱和氧化的游离脂肪酸的形成与lp-pla2活性关联的脂质的氧化或内皮功能障碍。
[0126]
在一些实施方案中,本发明还提供通过抑制lp-pla2活性治疗或预防疾病的方法。示例性的疾病包括但不限于:神经退行性疾病(例如阿兹海默症、帕金森病、亨廷顿病、血管性痴呆)、各种神经精神疾病如精神分裂症和孤独症、外周以及脑动脉粥样硬化、中风、代谢性骨病(例如骨髓异常)、血脂异常、佩吉特病、ii型糖尿病、高血压、心绞痛、心肌梗塞、缺血、再灌注损伤、代谢综合征、胰岛素抵抗和甲状旁腺功能亢进、糖尿病性并发症(例如黄斑水肿、糖尿病性视网膜病变和后葡萄膜炎、糖尿病溃疡和糖尿病肾病)、糖尿病外周神经病变性疼痛、炎性疼痛、神经病理性痛、各类癌症(例如前列腺癌、结肠癌、乳腺癌、肾癌、肺癌和卵巢癌等)、黄斑水肿、伤口愈合、男性勃起障碍、类风湿性关节炎、慢性阻塞性肺病(copd)、败血症、急慢性炎症、牛皮癣和多发性硬化。该方法包括向有需要的受试者给药治疗有效量的本发明的化合物。本发明并不意图限制于疾病的任何特定阶段(如早期或晚期)。
[0127]
在一些实施中,本发明还提供治疗或预防阿兹海默症的方法。该方法包括向有需要的受试者给药治疗有效量的本发明的化合物。
[0128]
在一些实施中,本发明还提供治疗或预防动脉粥样硬化的方法。该方法包括向有需要的受试者给药治疗有效量的本发明的化合物。
[0129]
在一些实施中,本发明还提供了通过给药本发明的化合物治疗或预防眼部疾病的方法。在一些实施方式中,本发明提供了治疗黄斑水肿的方法,其包括向受试者给药治疗有效量的本发明的化合物。在一些实施方式中,该黄斑水肿与糖尿病性眼病(例如糖尿病性黄斑水肿或糖尿病性视网膜病)有关。在一个实施方式中,该黄斑水肿与后葡萄膜炎有关。
[0130]
在第五方面,本发明还提供了本发明的化合物在制备用于治疗或预防与 lp-pla2相关的疾病的药物中的用途。示例性的疾病包括但不限于:神经退行性疾病(例如阿兹海默症、帕金森病、亨廷顿病、血管性痴呆)、各种神经精神疾病如精神分裂症和孤独症、外周以及脑动脉粥样硬化、中风、代谢性骨病(例如骨髓异常)、血脂异常、佩吉特病、ii型糖尿病、高血压、心绞痛、心肌梗塞、缺血、再灌注损伤、代谢综合征、胰岛素抵抗和甲状旁腺功能亢进、糖尿病性并发症(例如黄斑水肿、糖尿病性视网膜病变和后葡萄膜炎、糖尿病溃疡和糖尿病肾病)、糖尿病外周神经病变性疼痛、炎性疼痛、神经病理性痛、各类癌症(例如前列腺癌、结肠癌、乳腺癌、肾癌、肺癌和卵巢癌等)、黄斑水肿、伤口愈合、男性勃起障碍、类风湿性关节炎、慢性阻塞性肺病(copd)、败血症、急慢性炎症、牛皮癣和多发性硬化。该方法包括向有需要的受试者给药治疗有效量的本发明的化合物。本发明并不意图限制于疾病的任何特
定阶段(如早期或晚期)。
[0131]
在第六方面,本发明还提供了本发明化合物,其用于本文所述的疾病的治疗或预防。
[0132]
本文使用的“和/或”是指包括一个或多个关联的列举项目的任何和所有可能的组合。可以进一步理解,本说明书中使用的术语“包含”和/或“包括”指明所指的特征、整体、步骤、操作、元素和/或组分的存在,但不排除一个或多个其他特征、整体、步骤、操作、元素、组分和/或其组合的存在或加入。
[0133]
一般而言,本文使用的命名和本文所描述的有机化学、药物化学、生物学的实验操作是本领域公知的,而且在本领域中普遍采用。除非另有定义,本文使用的所有技术和科学术语一般具有本公开所属领域的普通技术人员通常理解的相同含义。在本文使用的术语存在多个定义的情况下,除非另有说明,以本部分的定义为准。
[0134]
发明详述
[0135]
定义
[0136]
如本文使用的,除非另有所述,术语“疾病”是指机体或一些器官的状态的任何改变,其中断或干扰功能的执行和/或引起患病的人或与其接触的人的症状(如不适、功能障碍、不良应激乃至死亡)。
[0137]
如本文使用的,除非另有所述,“糖尿病视网膜病变”是指糖尿病导致的慢性进展性视网膜微血管渗漏和梗阻的结果。“糖尿病性黄斑水肿”是指由于糖尿病引起的黄斑中心凹一个视盘直径范围内的细胞外液积聚所致的视网膜增厚或硬性渗出沉积。
[0138]
如本文使用的,除非另有所述,“神经退行性疾病”是指特征为神经组织和/ 或神经组织功能的逐步的、进行性损失的不同种类的中枢神经系统障碍。神经退行性疾病为一类神经系统疾病,其中神经系统疾病的特征为神经组织的逐步的、进行性损失和/或改变的神经功能,通常为由于逐步的、进行性的神经组织损失而导致神经功能的降低。在一些实施方式中,本文所述神经退行性疾病包括其中存在有缺陷的血脑屏障(例如渗透性血脑屏障)的神经退行性疾病。其中存在缺陷性血脑屏障的神经退行性疾病的例子包括但不限于,阿兹海默症、亨廷顿病、帕金森病和血管性痴呆等。
[0139]
如本文使用的,除非另有所述,“血管性痴呆”也被称为“多发性梗塞性痴呆",其是指一组由不同的机制(其都导致脑中的血管损害)引起的综合征。例如,血管性痴呆的主要亚型为血管性轻度认知功能障碍、多发性梗塞性痴呆、由于重大的单梗塞(影响丘脑、大脑前动脉、顶叶或扣带回)导致的血管性痴呆、由于出血性损害导致的血管性痴呆、小血管疾病(包括,例如由于腔隙性损害和宾斯旺格病(binswanger disease)导致的血管性痴呆)及混合型痴呆。
[0140]
如本文使用的,除非另有所述,“神经病理性痛”是为由神经系统原发性损害和功能障碍所激发或引起的疼痛。
[0141]
如本文使用的,除非另有所述,“炎性疼痛”是局部急性炎症或是慢性炎症刺激神经所致的疼痛。
[0142]
如本文使用的,除非另有所述,“糖尿病外周神经病变性疼痛”是指糖尿病并发的神经损伤而引起的疼痛,糖尿病中的神经损伤至少部分是由于血流减少和高血糖引起的。
[0143]
如本文使用的,除非另有所述,“血脑屏障”或"bbb"在本文可互换使用,用于指存
在于穿过脑组织的血管中的可渗透屏障,其严格地限制和密切地调节物质在血液和脑组织之间的交换。血脑屏障组分包括形成所有血管的最内层衬里的内皮细胞、作为bbb的结构性关联物的相邻内皮细胞之间的紧密连接物、内皮细胞的基底膜和覆盖几乎所有暴露的血管外表面的附近星形胶质细胞的扩大的足突。
[0144]
如本文使用的,除非另有所述,“代谢性骨病”是指特征为骨组织的逐步和进行性损失的不同种类的骨疾病。本文所述的代谢性骨病为其中存在扩散性骨密度下降和/或骨强度降低的状况的骨代谢疾病。这类疾病通过组织学外观来表征。示例性的代谢性骨病包括但不限于,特征为矿物质和骨基质减少的骨质疏松症和特征为矿物质减少但具有完整的骨基质的骨软化症。
[0145]
如本文使用的,除非另有所述,“骨质减少疾病”或“骨质减少”可以在本文中互换使用,涉及具有下降的钙化和/或骨密度的状况,为用来表示在其中观察到钙化和/或骨密度下降的所有骨骼系统的描述性术语。骨质减少也是指由于类骨质(osteoid)合成不足导致的骨质减少。
[0146]
如本文使用的,除非另有所述,“骨质疏松症”是指其中矿物质和/或骨基质减少和/或骨基质减少的病症。
[0147]
如本文使用的,除非另有所述,“烷基”是具有指定碳原子数的一价、饱和经链。例如,c
1-3
烷基是指具有1至3个碳原子的烷基。c
1-5
烷基是指具有1至 5个碳原子的烷基。c
1-6
烷基是指具有1至6个碳原子的烷基。烷基可为直链或支链的。在一些实施方案中,支链的烷基可具有一个、两个或三个支链。示例性烷基包括,但不限于,甲基、甲基乙基、乙基、丙基(正丙基和异丙基)、丁基(正丁基、异丁基和叔丁基)、戊基、己基。
[0148]
如本文使用的,除非另有所述,“烷氧基”取代基为式“r-o
‑”
的基团,其中r为如上定义的烷基。例如,c
1-3
烷氧基是指包含1至3个碳的这种烷氧基取代基。示例性烷氧基取代基包括但不限于,甲氧基、乙氧基、正丙氧基、正丁氧基、正戊氧基、正已基氧基、异丙氧基、异丁氧基、仲丁氧基、叔丁氧基、异戊氧基和新戊氧基。
[0149]
如本文使用的,“环烷基”是指单价饱和的环状烃基包括桥环及螺环,优选具有3-8个环碳原子(c
3-8
环烷基)、3-7个环碳原子(c
3-7
环烷基)或3-6个环碳原子(c
3-6
环烷基),例如环丙基、环丁基、环戊基或[1,1,1]螺桨烷,以及下文中特别示例的那些基团。除非另有所述,“c
3-6
环烷基”为通过从3、4、5或6元单环环烷烃去除一个氢原子得到的一价基团。示例性环烷基包括,但不限于,环丙基、环丁基、环戊基和环己基。
[0150]
如本文使用的,除非另有所述,“芳基”表示包含一个或多个芳环的烃基,如苯基或萘基等。
[0151]
如本文使用的,在一些实施方案中,“杂芳基”为从单环5或6元杂芳环去除一个氢原子得到的一价基团,该环由环-碳原子和选自氮、氧和硫的环-杂原子组成,且该环为芳族的。例如,杂芳基为由5或6个环原子组成的单环杂芳基,其中1至3个为环-杂原子。示例性杂芳基包括,但不限于,呋喃基、噻吩基、吡咯基、噁唑基、噻唑基、咪唑基、吡唑基、异噁唑基、异噻唑基、噁二唑基、三唑基、噻二唑基、吡啶基、哒嗪基、嘧啶基、吡嗪基、三嗪基、氮杂基、氧氮杂基、硫氮杂基和二氮杂基。在另一些实施方案中,“杂芳基”表示在各环中具有至多7个原子的稳定单环、双环、或三环,其中至少一个环是芳族的并且至少一个环含有1至4个选自o、n和s的杂原子。在该定义的范围内的杂芳基包括但不限于吖啶基、咔唑基、
噌啉基、喹喔啉基、喹唑啉基、吡唑基、吲哚基、异吲哚基、1h,3h-1-氧代异吲哚基、苯并三唑基、呋喃基、噻吩基、吡啶并吗啉基、吡啶并哌啶基、吡啶并吡咯烷基、苯并噻吩基、苯并呋喃基、苯并二噁烷、苯并二氧杂苯、喹啉基、异喹啉基、噁唑基、异噁唑基、苯并噁唑基、咪唑基、吡嗪基、哒嗪基、吡啶基、嘧啶基、吡咯基、四氢喹啉基、噻唑基、异噻唑基、1,2,3-三唑基、1,2,4-三唑基、1,2,4-噁二唑基、1,2,4-噻二唑基、1,3, 5-三嗪基、1,2,4-三嗪基、1,2,4,5-四嗪基、四唑基、呫吨基、吩嗪基、吩噻嗪基、吩噁嗪基、氮杂卓基、氧杂卓基和硫杂卓基。特别的杂芳基具有5或6元环,例如呋喃基、吡啶基、哒嗪基、嘧啶基、吡嗪基、噻吩基、异唑基、噁唑基、二唑基、咪唑基、吡咯基、吡唑基、三唑基、四唑基、噻唑基、异噻唑基、噻二唑基,吡啶并吗啉基、吡啶并哌啶基、吡啶并吡咯烷基。如本文所用,在一些实施方案中,“杂环基”为从3、4、5或6—元饱和单环杂环去除一个氢原子得到的一价基团,该环由环—碳原子和选自氮、氧和硫的环-杂原子组成。示例性单环饱和杂环基取代基包括,但不限于,吡咯烷基、二氧杂环戊烷基、咪唑烷基、吡唑烷基、哌啶基、二噁烷基、吗啉代、二噻烷基、硫吗啉代和哌嗪基。在另一些实施方案中,“杂环”或“杂环基”是指1至4个碳原子已被独立地选自n、 n(r)、s、s(o)、s(o)和o的杂原子代替的环烃。杂环可以是饱和或不饱和的,但不是芳族的。杂环基也可以是含有1、2或3个环,包括桥环及螺环结构。适合的杂环基的实例包括但不限于:氮杂环丁烷、氧杂环丁烷、四氢呋喃基、四氢噻吩基、吡咯烷基、2-氧代吡咯烷基、吡咯啉基、吡喃基、二氧戊环基、哌啶基、 2-氧代哌啶基、吡唑啉基、咪唑啉基、噻唑啉基、二硫杂环戊二烯基、氧杂硫杂环戊二烯基、二噁烷基、二噁烯基、二噁唑基、噁噻唑基(oxathiozolyl)、噁唑酮基、哌嗪基、吗啉代、硫代吗啉基、3-氧代吗啉基、二噻烷基、三噻烷基和噁嗪基。
[0152]
如本文使用的,除非另有所述,“桥环化合物”指一个或多个原子(即c、o、 n或s)连接两个不相邻的碳原子或氮原子。优选的桥环包括但不限于:一个碳原子、两个碳原子、一个氮原子、两个氮原子和一个碳-氮基。值得注意的是,一个桥总是将单环转换成三环。桥环中,环上的取代基也可以出现在桥上。
[0153]“螺环化合物”术语是指两个单环共用一个碳原子的多环化合物,共用的碳原子称为螺原子。
[0154]
如本文使用的,除非另有所述,“卤素”是指氟(f)、氯(cl)、溴(br)或碘(i)。卤代是指卤素基团:氟(-f)、氯(-cl)、溴(-br)、或碘(-i)。
[0155]
如本文使用的,除非另有所述,“卤代烷基”为取代有一个或多个卤素取代基的烷基,该卤素取代基可相同或不同。例如,c
1-3
卤代烷基是指包含1至3个碳的卤代烷基取代基。示例性卤代烷基取代基包括,但不限于,单氟甲基、二氟甲基、三氟甲基、1-氯-2-氟乙基、三氟丙基、3-氟丙基和2-氟乙基。
[0156]
如本文使用的,除非另有所述,当环上两个取代基连同它们的互相连接的原子一起结合形成另一环时,该环可为螺环稠合或单边稠合的。螺环-稠合的环体系由两个环组成,该两个环仅具有一个共同的碳原子。单边-稠合的环体系由两个环组成,该两个环仅共享两个原子和一个键。
[0157]
如本文使用的,除非另有所述,“任选取代的”表示基团或环可为未取代的,或该基团或环可取代有一个或多个本文定义的取代基。
[0158]
如本文使用的,除非另有所述,“4、5或6元饱和环,该环任选包含一个选自n或o的杂原子”是指4、5或6元饱和碳环且一个碳原子环成员可任选被一个选自n或o的杂原子代
替,例如、环丁基、环戊烷基、环己烷基、氮杂环丁烷基(azitidinyl)、吡咯烷基、哌啶基、氧杂环丁烷基、四氢呋喃基和四氢-2h-吡喃基。
[0159]
如本文使用的,除非另有所述,涉及疾病的“治疗”、“治”或“处理”是指:(1)减轻疾病或减轻疾病的一种或多种生物学表现,(2)干扰(a)导致或造成疾病的生物学级联中的一个或多个点或(b)疾病的一种或多种生物学表现,(3)缓和与疾病相关的一种或多种症状或效应,和/或(4)减缓疾病的进展或疾病的一种或多种生物学表现,和/或(5)减少疾病严重性或疾病生物表现的可能性。
[0160]
如本文使用的,除非另有所述,“预防”是指预防性给药药物以减少疾病或其生物表现的发生的可能性或延迟该发生。
[0161]
如本文使用的,除非另有所述,“受试者”是指哺乳动物受试者(例如,狗、猫、马、牛、绵羊、山羊、猴等),和尤其是人类受试者。
[0162]
如本文使用的,除非另有所述,“药学上可接受的盐”是指保留所述主题化合物所需的生物活性,并显示出最低的不希望的毒理效应的盐。这些药学上可接受的盐可以在化合物的最后分离和纯化过程中原位制备,或通过单独地将游离酸或游离碱形式的纯化化合物分别与合适的碱或酸反应来制备。
[0163]
如本文使用的,除非另有所述,术语“治疗有效量”是指相比于未接受该量的相应受试者,导致治疗或预防疾病的量,但该量在合理医学判断的范围内足够低以避免严重副作用(以合理的益处/风险比)。化合物的治疗有效量将随着选择的具体化合物(例如考虑到化合物的效力、功效和半衰期):选择的给药途径;治疗的疾病;治疗的疾病的严重性;治疗患者的年龄、体型、体重和身体状况:治疗患者的医疗史;治疗的持续时间;并行治疗的性质;所需治疗效果等因素而改变,但仍可通过本领域技术人员以常规方式确定。
[0164]
化合物合成
[0165]
本领域的技术人员可以理解,如果本文描述的取代基与本文描述的合成方法不相容,该取代基可以用在反应条件下稳定的合适的保护基进行保护。保护基可以在反应顺序中合适的点脱除,以得到所需的中间体或目标化合物。合适的保护基和使用这类合适保护基对不同的取代基进行保护和去保护的方法对于本领域技术人员是公知的;这方面的例子可以在i.greene和p.wuts,protecting groups inchemical synthesis(第三版),johnwiley&sons,ny(1999)中找到。在一些情况下,可以具体地选择在使用的反应条件下具有反应性的取代基。在这些情况下,反应条件转化所选择的取代基成为可用作中间化合物的另一种取代基或者为目标化合物中的需要的取代基的另一种取代基。
[0166]
一般方案:
[0167]
一般方案提供式1.5及2.5化合物的一般合成路线,其中r1,r2,r
x
,u,x,y,m, n,q,a如式(i)所定义
[0168][0169]
步骤(i)可作为snar反应,使用合适的试剂,例如三乙胺在合适的溶剂例如乙腈中在合适的温度如室温将化合物1.1与1.2反应生成化合物1.3。步骤(ii)可以通过将化合物1.3与合适试剂如三乙胺和甲磺酰氯或二氯亚砜在合适的温度如0℃或室温将羟基转化为甲磺酸酯或氯代化合物后,不经纯化进一步在碱例如碳酸钾和合适溶剂例如乙腈中回流反应关环得到化合物1.4。步骤(iii)将1.4与对应的醇或胺hq-(ch2)
m-a(q为-o-或-nr
b-)在合适的碱如nah或dipea条件下在合适的溶剂如乙腈或1,4-二氧六环中反应得到最终产物1.5。化合物2.5从醇2.1 和r1取代的三氯嘧啶开始制备获得。反应条件和反应物的变化对于本领域技术人员式显而易见的。当q为-ch
2-时,参看实施例170合成具体方案。
[0170]
另外,一般方案提供式1.5及2.5化合物的一般合成路线,其中r1,r2,x,y, m,n,a如式(i’)所定义
[0171][0172]
步骤(i)可作为snar反应,使用合适的试剂,例如三乙胺在合适的溶剂例如乙腈中在合适的温度如室温将化合物1.1与1.2反应生成化合物1.3。步骤(ii)可以通过将化合物1.3与合适试剂如三乙胺和甲磺酰氯或二氯亚砜在合适的温度如0℃或室温将羟基转化为甲磺酸酯或氯代化合物后,不经纯化进一步在碱例如碳酸钾和合适溶剂例如乙腈中回流反应关环得到化合物1.4。步骤(iii)将1.4与对应的醇 ho-(ch2)
m-a在合适的碱如nah条件下在合适的溶剂如乙腈中反应得到最终产物1.5。化合物2.5从醇2.1和r1取代的三氯嘧啶开始制备获得。反应条件和反应物的变化对于本领域技术人员式显而易见的。
[0173]
用途
[0174]
本发明化合物是lp-pla2抑制剂。因此,这些化合物可用于治疗,例如治疗或预防与lp-pla2的活性有关的疾病,其包括使用治疗有效量的lp-pla2抑制剂治疗需要该治疗的受试者。因此,本发明的一方面涉及治疗或预防与lp-pla2活性有关的疾病的方法。本领域技术人员可以理解,特定的疾病或其治疗可以涉及与lp-pla2活性有关的一种或多种潜在机制,包括一种或多种本文中描述的机制。
[0175]
在一些实施方案中,本发明提供本发明的化合物在制备用于治疗或预防以下公开的专利申请公开任意疾病的药物中的用途:wo96/13484,wo96/19451, wo97/02242,wo97/12963,wo97/21675,wo97/21676,wo97/41098, wo97/41099,wo99/24420,wo00/10980,wo00/66566,wo00/66567, wo00/68208,wo01/60805,wo02/30904,wo02/30911,wo03/015786, wo03/016287,wo03/041712,wo03/042179,wo03/042206,wo03/042218, wo03/086400,wo03/87088,wo08/048867,us2008/0103156,us2008/0090851, us2008/0090852、wo08/048866、wo05/003118(ca 2530816al)、wo06/063811、 wo06/063813、wo2008/141176、wo2013013503a1、wo2013014185a1、 wo2014114248a1、wo2014114694a1、wo2016011930a1、jp 200188847、us 2008/0279846a1、us 2010/0239565 a1、和us 2008/0280829 a1.
[0176]
在一些实施方案中,本发明提供本发明的化合物在制备用于治疗眼病的药物中的用途。本发明中适用的眼病可能与血视网膜内屏障(ibrb)的破坏有关。示例性的眼病涉及糖尿病性眼病,其包括黄斑水肿、糖尿病性视网膜病、后葡萄膜炎、视网膜静脉闭塞等。更多的眼病包括但不限于,视网膜中央静脉阻塞、视网膜分枝静脉阻塞、伊-加综合征(白内障后和手术后)、色素性视网膜炎、平坦部炎、鸟枪弹样视网膜脉络膜病变、视网膜外层膜、脉络膜肿瘤、囊性黄斑水肿、旁中心凹毛细血管扩张、牵引性黄斑病、玻璃体黄斑牵引综合征、视网膜剥离、视神经视网膜炎、特发性黄斑水肿等。使用lp-pla2抑制剂治疗眼病的更详细内容提供在wo2012/080497中,将其引入本文作为参考。
[0177]
此外,本发明一些实施方案提供本发明的化合物在制备用于治疗或预防受试者的糖尿病性黄斑水肿的药物中的用途。在一些实施方案中,本发明提供了本发明的化合物在用于治疗受试者的糖尿病性黄斑水肿的用途。
[0178]
在一些实施方案中,本发明提供本发明的化合物在制备用于治疗或预防患有黄斑水肿或具有患黄斑水肿风险的受试者的药物中的用途。在一些实施方案中,本发明提供本发明的化合物在制备用于治疗患有黄斑水肿或具有患黄斑水肿风险的受试者的药物中的用途。在另一些实施方案中,所述黄斑水肿与糖尿病性眼病有关,例如糖尿病黄斑水肿或糖尿病性视网膜病。在另一些实施方案中,所述黄斑水肿与后葡萄膜炎有关。
[0179]
在一些实施方案中,本发明提供本发明的化合物在制备用于治疗或预防青光眼或黄斑变性的药物中的用途。在一些实施方案中,本发明提供本发明的化合物在制备用于治疗青光眼或黄斑变性的药物中的用途。
[0180]
在一些实施方案中,本发明提供本发明的化合物在制备用于治疗或预防需要此治疗的受试者中的与血视网膜内屏障破坏有关的疾病的药物中的用途。在一些实施方案中,本发明提供本发明的化合物在制备用于治疗在需要此治疗的受试者中的与血视网膜内屏障破坏有关的疾病的药物中的用途。
[0181]
在一些实施方案中,本发明提供本发明的化合物在制备用于治疗或预防以下任意疾病的药物中的用途,该疾病涉及内皮机能障碍,例如,动脉粥样硬化(例如,外周血管动脉粥样硬化和脑血管动脉粥样硬化)、糖尿病、高血压、心绞痛、局部缺血和再灌注后的病症。
[0182]
在一些实施方案中,本发明提供本发明的化合物在制备用于治疗或预防以下任意疾病的药物中的用途,该疾病涉及与酶活性相关联的脂质氧化,例如,除了例如动脉粥样硬化和糖尿病等病症外的其他病症,例如类风湿性关节炎、中风、脑的炎性病症(例如阿兹海默症)、各种神经精神病症(如精神分裂症、孤独症)、心肌梗死、局部缺血、再灌注损伤、败血
症以及急性和慢性炎症。
[0183]
在一些实施方案中,本发明提供本发明的化合物在制备用于降低患有冠心病的患者中心血管事件(例如心脏病发作、心肌梗塞或中风)的几率的药物中的用途。
[0184]
在一些实施方案中,本发明提供本发明的化合物在制备用于治疗或预防以下疾病的药物中的用途,该疾病涉及活化的单核细胞、巨噬细胞或淋巴细胞,因为所有这些细胞种类表达lp-pla2,包括涉及活化的巨噬细胞(如m1、枝状和/ 或其它产生氧化应激的巨噬细胞)的疾病。示例性的病症包括但不限于牛皮癫、类风湿性关节炎、伤口愈合、慢性阻塞性肺病(copd)、肝硬化、特应性皮炎、肺气肿、慢性胰腺炎、慢性胃炎、主动脉瘤、动脉粥样硬化、多发性硬化、阿兹海默症和自身免疫疾病如狼疮。
[0185]
在其它实施方案中,本发明提供本发明的化合物在制备以下药物中的用途,该药物用于急性冠状动脉事件(例如由动脉粥样硬化引起的)的初级或次级预防;预防再狭窄的辅助治疗;或延迟糖尿病或高血压性肾功能不全的发展。预防包括治疗具有这类病症风险的受试者。
[0186]
在一些实施方案中,本发明提供在需要此治疗的受试者中治疗或预防与异常血脑屏障(bbb)功能、炎症和/或小神经胶质活化有关的神经系统病症的方法。在一些实施方案中,本发明提供在需要此治疗的受试者中治疗或预防与异常血脑屏障(bbb)功能、炎症和/或小神经胶质活化有关的神经系统病症的方法。所述方法包括将治疗有效量的本发明化合物给药至受试者。在另一些实施方案中,所述异常bbb是渗透性bbb。在另一些实施方案中,所述疾病是神经退行性疾病。这类神经退行性疾病例如是但不限于,血管性痴呆、阿兹海默症、帕金森病和亨廷顿舞蹈病。在一些实施方案中,本发明提供治疗或预防受试者的与血脑屏障(bbb)泄漏有关的疾病的方法。在一些实施方案中,本发明提供了治疗受试者的与血脑屏障(bbb)泄漏有关的疾病的方法。示例性的疾病包括但不限于,脑出血、脑淀粉样血管病。在一些实施方案中,所述神经退行性疾病是阿兹海默症。在具体实施方案中,所述神经退行性疾病是血管性痴呆。在一些实施方案中,所述神经退行性疾病是多发性硬化症(ms)。
[0187]
在一些实施方案中,本发明化合物可用于治疗或预防受试者的神经退行性疾病。所述方法包括将本发明化合物(例如为包含本发明化合物的药物组合物的形式)给药于需要此治疗的受试者。在一些实施方案中,本发明化合物可用于治疗受试者的神经退行性疾病。示例性的神经退行性疾病包括但不限于,阿兹海默症、血管性痴呆、帕金森病和亨廷顿舞蹈病。在一具体实施方案中,本发明所述神经退行性疾病与异常的血脑屏障有关。在一些实施方案中,被给药抑制lp-pla2活性的药剂的受试者是人。
[0188]
在一些实施方案中,本发明提供治疗或预防患有血管性痴呆或具有患血管性痴呆风险的受试者的方法。所述方法包括将本发明化合物(例如包含治疗有效量的本发明化合物的药物组合物)给药至受试者。在一些实施方案中,本发明提供治疗患有血管性痴呆或具有患血管性痴呆风险的受试者的方法。在一具体实施方案中,所述血管性痴呆与阿兹海默症有关。
[0189]
在一些实施方案中,本发明涉及通过将治疗有效量的本发明化合物给药于需要此治疗的受试者以治疗或预防代谢性骨病的方法。在一些实施方案中,本发明涉及通过将治疗有效量的本发明化合物给药至需要此治疗的受试者以治疗代谢性骨病的方法。示例性的代谢性骨病包括与骨质和骨密度损失有关的疾病,包括但不限于骨质疏松症和骨质减少疾
病。示例性的骨质疏松症和骨质减少疾病包括但不限于,骨髓异常、血脂异常、佩吉特氏病、ii型糖尿病、代谢综合征、胰岛素抵抗、甲状旁腺功能亢进和相关疾病。在另一些实施方案中,需要此治疗的受试者是人。
[0190]
认为预防本文描述的骨质疏松症和/或骨质减少疾病的方法可能受到抑制 lp-pla2的表达和/或抑制lp-pla2的蛋白活性的影响。因此,本发明的一些实施方案提供通过阻断酶活性来抑制lp-pla2的方法。在另一些实施方案中,提供了通过降低和/或下调lp-pla2rna的表达从而抑制lp-pla2的方法。在另一些实施方案中,预防和/或降低骨质损失和i或骨密度损失导致预防或减少与代谢性骨病例如骨质疏松症和/或骨质减少疾病有关的症状。
[0191]
在具体实施方案中,所述方法还包括将用于治疗代谢性骨病的其他治疗剂给药于需要治疗的受试者。例如,当所述代谢性骨病是骨质疏松症时,可以使用其他治疗剂,例如双磷酸盐类(bisphosphates)(例如,阿仑磷酸盐、伊班磷酸盐、利塞磷酸盐、降血钙素、雷洛昔芬)、选择性雌激素调节剂(serm)、雌激素疗法、激素替代疗法(et/hrt)和特立帕肤。
[0192]
在一些实施方案中,全身性炎性疾病例如幼年型类风湿关节炎、炎性肠病、川崎病、多发性硬化、结节病、多动脉炎、牛皮癣性关节炎、反应性关节炎、系统性红斑狼疮、伏-小柳-原田综合征、莱姆病、贝赫切特病、强直性脊柱炎、慢性肉芽肿性疾病、起止点炎(enthesitis)可能是影响视网膜的后葡萄膜炎的根本原因,且其可导致黄斑水肿。本发明涉及通过给药治疗有效量的本发明化合物治疗或预防后葡萄膜炎或这些全身炎性疾病中的任一种的方法。在一些实施方案中,本发明提供了通过给药治疗有效量的本发明化合物治疗后葡萄膜炎或这些全身炎性疾病中的任一种的方法。
[0193]
与lp-pla2活性相关的疾病的治疗和/或预防可在单一疗法或在双重或多重组合治疗中使用本发明化合物来获得。例如本发明化合物可用于与抗高血脂剂、抗动脉粥样硬化剂、抗糖尿病剂、抗心绞痛剂、抗炎剂或抗高血压剂或用于降低脂蛋白(a)(lp(a))的药剂结合来治疗或预防本发明描述的疾病。上述药剂的例子包括但不限于,胆固醇合成抑制剂,例如他汀类:抗氧化剂,例如丙丁酚;胰岛素致敏剂;钙通道拮抗剂和抗炎药,例如非甾体抗炎药(nsaid)。用于降低lp(a)的药剂包括wo 97/02037、wo 98/28310、wo 98/28311和wo98/28312中所述的氨基磷酸醋。在一些实施方案中,本发明化合物可与一个或多个他汀-起使用。他汀类是众所周知的胆固醇降低剂,包括阿托伐他汀、辛伐他汀、普伐他汀、西立伐他汀、氟伐他汀、洛伐他汀和瑞舒伐他汀。在一些实施方案中,本发明化合物可与抗糖尿病药或胰岛素致敏剂一起使用。在一些实施方案中,本发明化合物可与pparγ激活剂,例如gi262570(glaxosmithkline)和格列酮类(gli tazone)化合物例如罗格列酮、曲格列酮和吡格列酮一起使用。该药剂可以例如本领域已知的治疗有效量或以比本领域已知的可提供有效治疗的给药量更小或更多的量给药。
[0194]
组合治疗包括以分开的剂型或在单一剂型中一起给药治疗药剂。组合治疗可包括同时给药或分开给药治疗药剂,其可为基本上同时或基本上分开给药。典型地,组合治疗包括给予每个药剂使得每个药剂的治疗有效量在至少一段重叠的时间内存在于受试者的体内。
[0195]
使用方法
[0196]
本发明化合物的治疗有效量将取决于许多因素,例如包括预期接受者的年龄和体
重、需要治疗的精确病症及其严重性、制剂性质和给药途径,且将最终取决于开具处方的医生的判断。然而,用于治疗文中所述疾病的本发明化合物的治疗有效量将通常在0.1到100毫克/kg接受者体重/天的范围,更通常在1到10毫克 /kg体重/天的范围。因此,例如,对于70kg的成年哺乳动物,每天的实际量通常为70到700毫克,且该量可以单剂量/天或多个亚剂量每天,如二、三、四、五或六剂量每天给予。或给药可以间断地进行,例如每隔一天一次、一周一次或一月一次。预期类似剂量可适用于治疗上述其他病症。
[0197]
本发明药物组合物可以包含一种或多个本发明化合物。在一些实施方式中,所述药物组合物可以包含一种以上的本发明化合物。例如,在一些实施方式中,所述药物组合物可以包含两种或两种以上的本发明化合物。此外,所述药物组合物还可以任选包含一种或多种另外的药物活性化合物。
[0198]
如本发明所使用的“药学上可接受的赋形剂”是指参与赋予所述药物组合物形态或一致性的药学上可接受的原料、组分或载体。当混合时,各赋形剂可与所述药物组合物的其他成分相容,从而避免在给药至受试者时显著降低本发明化合物效力的相互作用以及避免将导致药学上不可接受的药物成分的相互作用。
[0199]
可将本发明化合物和一种或多种药学上可接受的赋形剂配制成适于通过所需给药途径给药至受试者的剂型。例如,剂型包括适于以下给药途径的那些:(1)口服给药(包括含服或舌下),例如片剂、胶囊、嚢片、药丸、锭剂、粉末、糖浆、酿剂、混悬液、溶液、乳剂、小袋和扁囊剂;(2)肠胃外给药(包括皮下、肌内、静脉内或真皮内),例如无菌溶液、混悬液和用于重构的粉末;(3)透皮给药,例如透皮贴片;(4)直肠给药,例如栓剂;(5)经鼻吸入,例如干粉、气雾剂、混悬液和溶液;和(6)局部给药(包括含服、舌下或透皮),例如霜剂、膏剂、洗液、溶液、糊剂、喷雾剂、泡沫和凝胶。这类组合物可通过制药领域任何已知方法制备,例如通过使上述式的化合物与载体或赋形剂结合。
[0200]
适于口服给药的药物组合物可作为离散单元存在,例如胶囊或片剂;粉末或颗粒;水性或非水性液体形式的溶液或混悬液;可食用泡沫(foams或whips);或水包油液体乳剂或油包水液体乳剂。
[0201]
合适的药学上可接受的赋形剂可根据所选的具体剂型变化。此外,可根据它们在组合物中所起的特定功能来选择适当的药学上可接受的赋形剂。例如,可因为一些药学上可接受的赋形剂具有促进产生均一剂型的能力而选择它们。可因为一些药学上可接受的赋形剂具有促进产生稳定剂型的能力而选择它们。可因为一些药学上可接受的赋形剂在给药受试者时促进本发明一种或多种化合物从一个器官或机体的一部分递送或转运到另一个器官或机体的一部分的能力而选择它们。可因为一些药学上可接受的赋形剂增加患者顺应性的能力而选择它们。
[0202]
合适的药学上可接受的赋形剂包括以下类型的赋形剂:稀释剂、填充剂、粘合剂、崩解剂、润滑剂、助流剂、成粒剂、包衣剂、润湿剂、溶剂、共溶剂、悬浮剂、乳化剂、增甜剂、调味剂、掩味剂、着色剂、抗结块剂、保湿剂、螯合剂、增塑剂、增粘剂、抗氧化剂、防腐剂、稳定剂、表面活性剂和缓冲剂。本领域技术人员应理解一些药物上可接受赋形剂可以提供一种以上的功能,并且取决于该赋形剂存在于制剂中的多少以及还有什么其他成分存在于该制剂中而可提供其他的功能。
[0203]
技术熟练人员拥有本领域知识和技术,从而能够选择适当量的适当的药物上可接
受赋形剂用于本发明。此外,技术熟练人员可获得描述药学上可接受的赋形剂并可用于选择适当的药学上可接受的赋形剂的许多资源。例子包括remington 药物科学(remington's pharmaceutical sciences,mack出版公司)、药物添加剂手册(the hand book of pharmaceutical additives,gower出版有限公司)和药物赋形剂手册(handbook of pharmaceutical excipients,美国药物协会和药物出版社)。
[0204]
使用本领域技术人员已知的技术和方法制备本发明药物组合物。常用于本领域的一些方法描述在remington药物科学(mack出版社)中。
[0205]
一个方面,本发明涉及包含治疗有效量的本发明化合物和桸释剂或填充剂的固体口服剂型,例如片剂或胶囊。合适的稀释剂和填充剂包括乳糖、催糖、葡萄糖、甘露醇、山梨醇、淀粉(例如玉米淀粉、马铃薯淀粉和预胶化淀粉)、纤维素及其衍生物(例如微晶纤维素)、硫酸钙和磷酸氢钙。口服固体剂型还可包括粘合剂。合适的粘合剂包括淀粉(例如玉米淀粉、马铃薯淀粉和预胶化淀粉)、明胶、阿拉伯胶、藻酸钠、藻酸、黄胶、瓜尔胶、聚维酮和纤维素及其衍生物(例如微晶纤维素)。口服固体剂型还可以包括含崩解剂。合适的崩解剂包括交聚维酮、淀粉羟基乙酸钠、交联羧甲纤维素(croscarmelose)、藻酸和羧甲基纤维素钠。口服固体剂型还可以包含润滑剂。适当的润滑剂包括硬脂酸、硬脂酸镁、硬脂酸钙和滑石。
[0206]
在具体实施方式中,本发明涉及含0.01mg至1000mg一种或多种文中所述的上述式的化合物或其药学上可接受的盐以及0.01g至5g的一种或多种药学上可接受的赋形剂的药物组合物。
[0207]
中间体1
[0208]
(1s,4r)-4-(羟甲基)-2-氧杂-5-氮杂双环[2.2.1]庚烷-5-羧酸叔丁酯
[0209][0210]
(1s,4s)-5-叔丁氧基羰基-2-氧杂-5-氮杂双环[2.2.1]庚烷-4-羧酸甲酯(0.88g,3.4 mmol,chemistry letters,2017,566-568)加入到无水四氢呋喃(30ml)中,冷却到 0℃,缓慢加入硼氢化锂(222mg,10.2mmol),室温搅拌过夜。反应液冷却到0℃,加入十水硫酸钠淬灭。反应液倒入二氯甲烷中,加入无水硫酸钠干燥,过滤,滤饼用二氯甲烷/甲醇(20/1)洗涤,将滤液浓缩得到标题化合物粗品(1.5g)。
[0211]
lc-ms:m/z[m+h-tbu]
+
=174.
[0212]
((1s,4r)-2-氧杂-5-氮杂双环[2.2.1]庚-4-基)甲醇盐酸盐
[0213][0214]
(1s,4r)-4-(羟甲基)-2-氧杂-5-氮杂双环[2.2.1]庚烷-5-羧酸叔丁酯(1.5g粗品)溶解在混合溶剂二氯甲烷(5ml)和甲醇(5ml)中,加入氯化氢乙酸乙酯溶液(4.0m,5 ml),反应混合物40-50℃搅拌过夜。反应液浓缩到标题化合物粗品(900mg)。 lc-ms:m/z[m+h]
+
=130.
[0215]
((1s,4r)-5-(2,6-二氯嘧啶-4-基)-2-氧杂-5-氮杂双环[2.2.1]庚-4-基)甲醇
[0216][0217]
((1s,4r)-2-氧杂-5-氮杂双环[2.2.1]庚-4-基)甲醇盐酸盐(0.9g,5.4mmol)溶解在二氯甲烷(50ml)中,冷却到0℃,依次加入三乙胺(1.1g,1.5ml,10.8mmol)和2,4, 6-三氯嘧啶(1.2g,5.76mmol),室温搅拌4小时。饱和碳酸氢钠溶液淬灭反应,二氯甲烷萃取,有机相浓缩,硅胶柱层析纯化得到标题化合物(0.36g,三步收率 38%)。
[0218]
lc-ms:m/z[m+h]
+
=276.
[0219]
(3s,11ar)-7-氯-3,4-二氢-1h,9h,11h-3,11a-甲桥嘧啶并[6',1':2,3]咪唑并[5,1-c][1,4]恶嗪-9-酮
[0220][0221]
((1s,4r)-5-(2,6-二氯嘧啶-4-基)-2-氧杂-5-氮杂双环[2.2.1]庚-4-基)甲醇(360mg, 1.3mmol)和三乙胺(395mg,3.9mmol)加入到无水四氢呋喃(10ml)中,冷却到 0℃。滴加甲基磺酰氯(229mg,2.0mmol),0℃搅拌30分钟。将反应液浓缩并加入碳酸钾(898mg,6.5mmol)和乙腈(15ml),80℃搅拌过夜。反应液浓缩,制备薄层色谱分离(二氯甲烷/甲醇=20/1)得标题化合物(230mg,74%)。
[0222]
lc-ms:m/z[m+h]
+
=240.
[0223]1h nmr(400mhz,cdcl3)δ5.60(s,1h),4.78(br.s,1h),4.49(d,j=13.2hz,1h), 4.09-3.88(m,3h),3.61(d,j=9.8hz,1h),3.32(d,j=9.8hz,1h),2.10(d,j= 10.8hz,1h),1.84(d,j=10.3hz,1h).
[0224]
中间体2
[0225]
(1r,4s)-4-(羟甲基)-2-氧杂-5-氮杂双环[2.2.1]庚烷-5-羧酸叔丁酯
[0226][0227]
(1r,4r)-5-叔丁氧基羰基-2-氧杂-5-氮杂双环[2.2.1]庚烷-4-羧酸甲酯(430mg,1.67 mmol,chemistry letters,2017,566-568)加入到无水四氢呋喃(10ml)中,冷却到 0℃,缓慢加入硼氢化锂(430mg,1.67mmol),室温搅拌过夜。反应液冷却到0℃,加水淬灭。用乙酸乙酯稀释反应液并加入无水硫酸钠干燥,过滤,滤饼用乙醇洗涤,将滤液浓缩。加入二氯甲烷溶解残留物,过滤,将滤液浓缩得到标题化合物粗品(380mg,99%)。
[0228]
lc-ms:m/z[m+h-tbu]
+
=174.
[0229]
((1r,4s)-2-氧杂-5-氮杂双环[2.2.1]庚-4-基)甲醇
[0230][0231]
(1r,4s)-4-(羟甲基)-2-氧杂-5-氮杂双环[2.2.1]庚烷-5-羧酸叔丁酯(380mg,1.67 mmol)加入到二氯甲烷(10ml)和三氟乙酸(5ml)中,室温搅拌过夜。反应液浓缩,柱层析纯化(二氯甲烷/甲醇=20/1~2/1)得到标题化合物粗品(800mg)。
[0232]
lc-ms:m/z[m+h]
+
=130.
[0233]
((1r,4s)-5-(2,6-二氯嘧啶-4-基)-2-氧杂-5-氮杂双环[2.2.1]庚-4-基)甲醇
[0234][0235]
2,4,6-三氯嘧啶(1055mg,5.76mmol)加到乙腈(30ml)中,冷却到0℃。滴加((1r, 4s)-2-氧杂-5-氮杂双环[2.2.1]庚-4-基)甲醇(700mg,2.88mmol)和三乙胺(872mg, 8.64mmol)的乙腈(30ml)溶液,0℃搅拌2小时。反应液倒入水中,乙酸乙酯萃取,有机相浓缩,硅胶柱层析纯化(石油醚/乙酸乙酯=10/1~4/1)得标题化合物(120mg,15%)。
[0236]
lc-ms:m/z[m+h]
+
=276.
[0237]
(3r,11as)-7-氯-3,4-二氢-1h,9h,11h-3,11a-甲桥嘧啶并[6',1':2,3]咪唑并[5,1-c][1,4]恶嗪-9-酮
[0238][0239]
((1r,4s)-5-(2,6-二氯嘧啶-4-基)-2-氧杂-5-氮杂双环[2.2.1]庚-4-基)甲醇(110mg, 0.40mmol)和三乙胺(121mg,1.20mmol)加到无水四氢呋喃(3ml)中,冷却到 0℃。滴加入甲基磺酰氯(69mg,0.60mmol),0℃搅拌10分钟。将反应液浓缩并加入碳酸钾(166mg,1.20mmol)和乙腈(2ml)。90℃搅拌5小时。反应液浓缩,制备薄层色谱分离(二氯甲烷/甲醇=20/1)得标题化合物(50mg,52%)。
[0240]
lc-ms:m/z[m+h]
+
=240.
[0241]1h nmr(400mhz,cdcl3)δ5.60(s,1h),4.78(br.s,1h),4.49(d,j=12.7hz,1h), 4.07-3.98(m,3h),3.60(d,j=10.3hz,1h),3.32(d,j=9.8hz,1h),2.10(d,j= 9.8hz,1h),1.87(d,j=10.3hz,1h).
[0242]
中间体3
[0243]
(2-(2,6-二氯嘧啶-4-基)-2-氮杂双环[2.1.1]己-1-基)甲醇
[0244]
[0245]
将(2-氮杂双环[2.1.1]己-1-基)甲醇(3.5g,30.98mmol,journal of organic chemistry, 2018,83,14350-14361)溶入乙腈(100ml)中,加入碳酸钠(12.6g,93mmol),反应液冷却至0℃以下,滴加2,4,6-三氯嘧啶(28.3g,154.9mmol),反应液室温下搅拌过夜,反应液经硅藻土过滤,滤液浓缩,硅胶层析柱分离纯化得到白色固体标题化合物(5.7g,71%)。
[0246]
lc-ms:m/z[m+h]
+
=260.
[0247]
3-氯-7,8-二氢-1h,6h,9h-7,8a-甲桥吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-1-酮
[0248][0249]
将(2-(2,6-二氯嘧啶-4-基)-2-氮杂双环[2.1.1]己-1-基)甲醇(5.1g,19.6mmol)溶入二氯甲烷(100ml)中,加入二氯亚砜(7g,58.8mmol),室温下搅拌1小时,反应液浓缩后,残留物溶入乙腈中(100ml),加入碳酸钾(8.11g,58.8mmol),85℃搅拌过夜,反应液硅藻土过滤,滤液浓缩,层析柱分离纯化得到标题化合物(3.9g, 89%)。
[0250]
lc-ms:m/z[m+h]
+
=224.
[0251]1h nmr(400mhz,dmso-d6)δ5.93(s,1h),3.92(s,2h),3.40(s,2h),2.93(br.s, 1h),2.06(br.s,2h),1.66-1.61(m,2h).
[0252]
中间体4
[0253]
(7-(2,6-二氯嘧啶-4-基)-7-氮杂双环[2.2.1]庚-1-基)甲醇
[0254][0255]
1-(羟甲基)-7-氮杂双环[2.2.1]庚烷-7-羧酸叔丁酯(4.3g,18.9mmol,tetrahedronletters,2010,51,6741
–
6744)溶解在混合溶剂二氯甲烷(20ml)和甲醇(20ml)中,加入氯化氢乙酸乙酯溶液(4.0m,20ml),40-50℃搅拌过夜。反应液浓缩。将残留物溶解在二氯甲烷(80ml)中,冷却到0℃,依次加入三乙胺(5.7g,7.8ml, 56.7mmol)和2,4,6-三氯嘧啶(6.9g,4.3ml,37.8mmol),室温搅拌4小时。饱和碳酸氢钠溶液淬灭反应,二氯甲烷萃取,有机相浓缩,硅胶柱层析纯化得到标题化合物(1.13g,21%)。
[0256]
lc-ms:m/z[m+h]
+
=274.
[0257]
3-氯-7,8-二氢-1h,6h,9h-6,8a-乙桥吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-1-酮
[0258][0259]
(7-(2,6-二氯嘧啶-4-基)-7-氮杂双环[2.2.1]庚-1-基)甲醇(360mg,1.3mmol)溶解在二氯甲烷(30ml)中,冷却到0℃。滴加氯化亚砜(4.56g,38.35mmol),室温搅拌 1小时。
反应液浓缩,将残留物、碳酸钾(3.18g,23.01mmol)加入到乙腈(30ml)中,80℃搅拌过夜。将反应液用硅藻土过滤,滤饼经乙酸乙酯洗涤数次,合并滤液浓缩得标题化合物(0.76g,94%)。
[0260]
lc-ms:m/z[m+h]
+
=238.
[0261]1h nmr(400mhz,cdcl3)δ5.68(s,1h),4.19(t,j=4.6hz,1h),4.03(s,2h), 2.10(dd,j=4.6,10.5hz,2h),1.87-1.76(m,6h)..
[0262]
中间体5
[0263]
(2-(2,6-二氯嘧啶-4-基)-2-氮杂双环[2.2.2]辛-1-基)甲醇
[0264][0265]
2,4,6-三氯嘧啶(584mg,3.19mmol)加到乙腈(5ml)中,冷却到0℃。滴加(2-氮杂双环[2.2.2]辛-1-基)甲醇(300mg,2.12mmol,j.org.chem.,2007,72,3112
‑ꢀ
3115)和三乙胺(429mg,4.25mmol)的乙腈(5ml)溶液,0℃搅拌2小时。反应液倒入水中,乙酸乙酯萃取,有机相浓缩,硅胶柱层析纯化(石油醚/乙酸乙酯= 10/1~4/1)得标题化合物(198mg,32%)。
[0266]
lc-ms:m/z[m+h]
+
=288.
[0267]
3-氯-6,7,8,9-四氢-1h,10h-7,9a-乙桥吡啶并[1',2':3,4]咪唑并[1,2-c]嘧啶-1-酮
[0268][0269]
(2-(2,6-二氯嘧啶-4-基)-2-氮杂双环[2.2.2]辛-1-基)甲醇(198mg,0.69mmol)加入二氯甲烷(5ml)中,冷却到0℃。滴加氯化亚砜(409mg,3.44mmol),室温搅拌 30分钟。将反应液浓缩并加入碳酸钾(379mg,2.75mmol)和乙腈(5ml)。90℃搅拌过夜。反应液浓缩,制备薄层色谱分离(二氯甲烷/甲醇=20/1)得标题化合物(170mg,98%)。
[0270]
lc-ms:m/z[m+h]
+
=252.
[0271]
中间体6
[0272]
苄基脯氨酸甲酯
[0273][0274]
将1-boc-2-吡咯烷甲酸甲酯(25g,109.04mmol)加入氯化氢乙酸乙酯溶液(4.0m, 100ml)中,室温搅拌4小时。反应液浓缩,将残留物、溴化苄(22.38g,130.85 mmol)、无水碳酸钾(30.1g,218.08mmol)加入到乙腈(100ml)中,升温至回流搅拌过夜。反应液倒入水中,乙酸乙酯萃取,合并有机相浓缩,硅胶柱层析纯化(石油醚/乙酸乙酯=200/1~80/1)得到标题化合物(18g,75%)。
[0275]
lc-ms:m/z[m+h]
+
=220.
[0276]
1-苄基-2-甲基吡咯烷-2-羧酸甲酯
[0277][0278]
苄基脯氨酸甲酯(8g,36.48mmol)加到四氢呋喃(100ml)中,氩气保护下冷却到-20℃。将碘甲烷(15.5g,109.44mmol)加入反应液,降温至-50℃,控温
ꢀ‑
50℃~-40℃滴加二异丙基氨基锂的四氢呋喃溶液(2.0m,63.84ml,127.68 mmol),滴加结束,控温-50℃~-40℃搅拌3小时。向反应液中加入甲醇(50ml)淬灭后,将反应液倒入水中,乙酸乙酯萃取,有机相浓缩,硅胶柱层析纯化(石油醚/乙酸乙酯=200/1~100/1)得到标题化合物(5g,59%)。
[0279]
lc-ms:m/z[m+h]
+
=234.
[0280]
(1-苄基-2-甲基吡咯烷-2-基)甲醇
[0281][0282]
氢化铝锂(1.63g,42.90mmol)加入无水四氢呋喃(25ml)中,氩气保护下降温至 0℃。滴加1-苄基-2-甲基吡咯烷-2-羧酸甲酯(5g,21.45mmol)的无水四氢呋喃(25 ml)溶液,室温搅拌过夜。向反应液中加入十水合硫酸钠(20g)淬灭反应,室温搅拌30分钟。反应液过滤,滤液浓缩得标题化合物粗品(3.8g,86%)。
[0283]
lc-ms:m/z[m+h]
+
=206.
[0284]
(2-甲基吡咯烷-2-基)甲醇
[0285][0286]
(1-苄基-2-甲基吡咯烷-2-基)甲醇(3.8g,18.52mmol)和pd/c(10%,400mg)加入甲醇(40ml)中。50℃常压氢化过夜。反应液过滤,滤液浓缩得标题化合物粗品(2.16 g,101%)。
[0287]
lc-ms:m/z[m+h]
+
=116.
[0288]
(1-(2,6-二氯嘧啶-4-基)-2-甲基吡咯烷-2-基)甲醇
[0289][0290]
2,4,6-三氯嘧啶(5.16g,28.15mmol)和三乙胺(3.8g,37.54mmol)加到乙腈(80ml)中。将反应液降温至0℃后加入(2-甲基吡咯烷-2-基)甲醇(2.16g,18.77mmol), 0℃搅拌2小时。反应液倒入水中,乙酸乙酯萃取,有机相浓缩,硅胶柱层析纯化(石油醚/乙酸乙酯=5/1~2/1)得标题化合物(2g,41%)。
[0291]
lc-ms:m/z[m+h]
+
=262.
[0292]
3-氯-8a-甲基-7,8,8a,9-四氢-1h,6h-吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-1-酮
[0293][0294]
(1-(2,6-二氯嘧啶-4-基)-2-甲基吡咯烷-2-基)甲醇(2g,7.67mmol)加到二氯甲烷(30 ml)中,冷却到0℃。滴加氯化亚砜(4.56g,38.35mmol),室温搅拌30分钟。反应液浓缩,将浓缩后的残留物、碳酸钾(3.18g,23.01mmol)加到乙腈(30ml)中。 90℃搅拌过夜。反应液倒入水(100ml)中,分别用乙酸乙酯、二氯甲烷萃取,合并有机相浓缩得标题化合物(1.5g,88%)。
[0295]1h nmr(400mhz,dmso-d6)δ5.96(s,1h),4.06(d,j=12.2hz,1h),3.79(d,j= 12.2hz,1h),3.48-3.35(m,2h),2.10-1.89(m,2h),1.87-1.68(m,2h),1.32(s, 3h).
[0296]
中间体7
[0297]
1-苄基-2-乙基吡咯烷-2-羧酸甲酯
[0298][0299]
苄基脯氨酸甲酯(8g,36.48mmol)加入到四氢呋喃(100ml)中,氩气保护下冷却到
ꢀ‑
20℃。将碘乙烷(17.1g,109.45mmol)加入反应液,冷却到-50℃,控温
ꢀ‑
50℃~-40℃滴加二异丙基氨基锂的四氢呋喃溶液(2.0m,63.84ml,127.68 mmol),滴加结束,控温-50℃~-40℃搅拌3小时。向反应液中加入甲醇淬灭后,反应液倒入水中,用乙酸乙酯萃取,合并有机相浓缩,硅胶柱层析纯化(石油醚/ 乙酸乙酯=200/1~100/1)得到标题化合物(4.9g,54%)。
[0300]
lc-ms:m/z[m+h]
+
=248.
[0301]
(1-苄基-2-乙基吡咯烷-2-基)甲醇
[0302][0303]
将氢化铝锂(1.51g,39.66mmol)加入无水四氢呋喃(25ml)中,氩气保护下冷却到 0℃。滴加1-苄基-2-乙基吡咯烷-2-羧酸甲酯(4.9g,19.83mmol)的无水四氢呋喃(25ml)溶液。室温搅拌过夜。向反应液中加入十水合硫酸钠(5g)淬灭反应,室温搅拌30分钟。反应液过滤,滤液浓缩得标题化合物粗品(3.5g,81%)。
[0304]
lc-ms:m/z[m+h]
+
=220.
[0305]
(2-乙基吡咯烷-2-基)甲醇
[0306][0307]
(1-苄基-2-乙基吡咯烷-2-基)甲醇(3.5g,15.97mmol)、pd/c(10%,350mg)加入甲
醇(50ml)中。50℃常压氢化过夜。反应液过滤,滤液浓缩得标题化合物粗品(2.1 g,100%)。
[0308]
lc-ms:m/z[m+h]
+
=130.
[0309]
(1-(2,6-二氯嘧啶-4-基)-2-乙基吡咯烷-2-基)甲醇
[0310][0311]
2,4,6-三氯嘧啶(3.5g,19.16mmol)、三乙胺(3.23g,31.94mmol)加入到乙腈(80 ml)中,冷却到0℃。将(2-乙基吡咯烷-2-基)甲醇(2.1g,15.97mmol)加入反应液, 0℃搅拌2小时。反应液倒入水中,用乙酸乙酯萃取,有机相浓缩,柱层析纯化(石油醚/乙酸乙酯=5/1~2/1)得标题化合物(1.5g,28%)。
[0312]
lc-ms:m/z[m+h]
+
=276.
[0313]
3-氯-8a-乙基-7,8,8a,9-四氢-1h,6h-吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-1-酮
[0314][0315]
(1-(2,6-二氯嘧啶-4-基)-2-乙基吡咯烷-2-基)甲醇(1.5g,5.45mmol)加入到二氯甲烷(30ml)中,冷却到0℃。滴加氯化亚砜(3.24g,27.27mmol),室温搅拌30分钟。反应液浓缩,将浓缩后的残留物、碳酸钾(2.26g,16.35mmol)加到乙腈(30ml)中,90℃搅拌过夜。反应液倒入水(30ml)中,分别用乙酸乙酯、二氯甲烷萃取,合并有机相浓缩,制备薄层色谱分离(二氯甲烷/甲醇=20/1)得标题化合物(260 mg,20%)。
[0316]
lc-ms:m/z[m+h]
+
=240.
[0317]
中间体8
[0318]
n-boc-2-甲基哌啶-2-甲酸甲酯
[0319][0320]
n-boc-哌啶-2-甲酸甲酯(10.0g,41.15mmol)和碘甲烷(16.2g,123.4mmol)加到四氢呋喃(60ml)中,冷却到0℃,滴加入二异丙基氨基锂的四氢呋喃溶液(61.7 ml,2.0m,123.4mmol)。搅拌3小时后,将反应液倒入饱和氯化铵溶液中,乙酸乙酯萃取,有机相浓缩,柱层析纯化(石油醚/乙酸乙酯=20/1)得标题化合物(10.0 g,95%)。
[0321]
lc-ms:m/z[m+h-boc]
+
=158.
[0322]
(2-甲基哌啶-2-基)甲醇
[0323][0324]
n-boc-2-甲基哌啶-2-甲酸甲酯(5.0g,19.45mmol)溶于二氯甲烷(15ml)中,加入
氯化氢乙酸乙酯溶液(30ml),20分钟后浓缩反应液。加入二氯甲烷(20ml)及碳酸钠固体调节ph到7-8。过滤、滤液浓缩得到2-甲基哌啶-2-甲酸甲酯的粗品,将其溶于四氢呋喃(20ml)中。该溶液0℃滴加到氢化铝锂的四氢呋喃溶液(30 ml,23.3mmol)中,0℃搅拌2小时后,十水硫酸钠淬灭反应,室温搅拌30分钟后过滤,滤液浓缩得到标题化合物(1.8g,72%)。
[0325]
lc-ms:m/z[m+h]
+
=130.
[0326]
(1-(2,6-二氯嘧啶-4-基)-2-甲基哌啶-2-基)甲醇
[0327][0328]
2,4,6-三氯嘧啶(3.8g,20.93mmol)加到乙腈(60ml)中,冷却到0℃。加入碳酸钠(2.95g,27.90mmol)搅拌10分钟后,滴加(2-甲基哌啶-2-基)甲醇(1.8g,13.95 mmol)的乙腈溶液(20ml),室温搅拌过夜。过滤,滤液浓缩,硅胶柱层析纯化(石油醚/乙酸乙酯=10/1~5/1)得到标题化合物(1.8g,47%)。
[0329]
lc-ms:m/z[m+h]
+
=276.
[0330]
3-氯-9a-甲基6,7,8,9,9a,10-六氢-1h-吡啶并[1',2':3,4]咪唑并[1,2-c]嘧啶-1-酮
[0331][0332]
(1-(2,6-二氯嘧啶-4-基)-2-甲基哌啶-2-基)甲醇(1.8g,6.54mmol)加入到二氯甲烷(20ml)中,室温下滴加氯化亚砜(1.56g,13.0mmol),室温搅拌10分钟后,将反应液浓缩并加入碳酸钾(2.7g,19.62mmol)和乙腈(40ml)。85℃搅拌过夜。反应液过滤,滤液浓缩,柱层析纯化(二氯甲烷/甲醇=20/1)得标题化合物(1.2g, 77%)。
[0333]
lc-ms:m/z[m+h]
+
=240.
[0334]1h nmr(400mhz,cdcl3)δ5.47(s,1h),3.91-3.78(m,2h),3.40(dd,j=3.2, 13.5hz,1h),3.25-3.07(m,1h),1.98-1.56(m,7h),1.51(dd,j=4.2,9.0hz,2h). 中间体9
[0335]
n-boc-2-乙基哌啶-2-甲酸甲酯
[0336][0337]
n-boc-哌啶-2-甲酸甲酯(5.1g,20.98mmol)和碘乙烷(3.2ml,41.0mmol)加入到四氢呋喃(60ml)中,冷却到0℃,加入二异丙基氨基锂的四氢呋喃溶液(21.0ml, 2.0m,42.0mmol)。0℃搅拌0.5小时后,将反应液倒入饱和氯化铵溶液(100ml),乙酸乙酯萃取,有机相浓缩,柱层析纯化(石油醚/乙酸乙酯=20/1~10/1)得到标题化合物粗品(4.0g,70%)。
[0338]
lc-ms:m/z[m+h-boc]
+
=172.
[0339]
2-乙基-2-羟甲基哌啶-1-甲酸叔丁酯
[0340][0341]
n-boc-2-乙基哌啶-2-甲酸甲酯(3.0g,11.0mmol)溶于四氢呋喃(30ml)中,0℃下分批加入氢化铝锂(970mg,25.5mmol),该温度下搅拌15分钟后,加入十水硫酸钠淬灭反应,混合物室温搅拌30分钟后,过滤,滤液浓缩,柱层析纯化(石油醚 /乙酸乙酯=10/1)得到标题化合物(300mg,11%)。
[0342]
lc-ms:m/z[m+h-boc]
+
=144.
[0343]
(1-(2,6-二氯嘧啶-4-基)-2-乙基哌啶-2-基)甲醇
[0344][0345]
2-乙基-2-羟甲基哌啶-1-甲酸叔丁酯(400mg,1.65mmol)加到二氯甲烷(3ml)中,氯化氢乙酸乙酯溶液加入(4.0m,6ml)中,室温搅拌10分钟后,浓缩得到(2
‑ꢀ
乙基哌啶-2-基)甲醇(320mg)。依次将(2-乙基哌啶-2-基)甲醇(320mg,1.10mmol)和2,4,6-三氯嘧啶(600mg,3.33mmol)加到乙腈(16ml)中,冷却到0℃。分别加入碳酸钠(530mg,5.01mmol)和上述所得的(2-乙基哌啶-2-基)甲醇,反应混合物室温搅拌过夜。过滤,滤液浓缩,制备薄层色谱分离(石油醚/乙酸乙酯=5/1)得到标题化合物(200mg,41%)。
[0346]
lc-ms:m/z[m+h]
+
=290.
[0347]
3-氯-9a-乙基6,7,8,9,9a,10-六氢-1h-吡啶并[1',2':3,4]咪唑并[1,2-c]嘧啶-1-酮
[0348][0349]
(1-(2,6-二氯嘧啶-4-基)-2-乙基哌啶-2-基)甲醇(50mg,0.17mmol)加入到二氯甲烷(6ml)中,室温下滴加入氯化亚砜(40mg,0.34mmol),加毕反应液室温搅拌5分钟。反应液浓缩并加入碳酸钾(70mg,0.51mmol)和乙腈(6ml),85℃搅拌过夜。反应液过滤,滤液浓缩,制备薄层色谱分离(二氯甲烷/甲醇=10/1)得到标题化合物(30mg,77%)。
[0350]
lc-ms:m/z[m+h]
+
=254.
[0351]1h nmr(400mhz,cdcl3):δ5.49(s,1h),3.95(d,j=12.2hz,1h),3.75(d,j= 12.2hz,1h),3.41(d,j=13.7hz,1h),3.13(t,j=13.0hz,1h),1.70-2.05(m,6h), 1.52(d,j=12.7hz,2h),0.89(t,j=7.3hz,3h);
[0352]
中间体10
[0353]
n-boc-吗啉-3-甲酸甲酯
[0354][0355]
将n-boc-吗啉-3-甲酸(10g,43.3mmol)溶入二氯甲烷(200ml)和甲醇(20ml)中,分批加入三甲基硅重氮甲烷(43ml,2.0m正己烷溶液,86.7mmol),加完后室温搅拌1小时,将反应液直接浓缩得到标题化合物粗品(11.4g)。
[0356]
lc-ms:m/z[m+h-boc]
+
=146.
[0357]
n-boc-3-甲基吗啉-3-甲酸甲酯
[0358][0359]
n-boc-吗啉-3-甲酸甲酯(11g,44.9mmol)溶在四氢呋喃(120ml)中,氩气保护条件下,加入碘甲烷(10.5g,67.3mmol),将反应液温度冷却至0℃以下,滴加双(三甲基硅基)氨基钠的四氢呋喃溶液(2.0m,45ml,89.8mmol),加完后室温搅拌3 小时,向反应液滴入甲醇淬灭,将反应液倒入水中,乙酸乙酯萃取合并有机相,干燥,过滤,滤液浓缩,层析柱分离得到标题化合物(8.6g,74%)。
[0360]
lc-ms:m/z[m+h-boc]
+
=160.
[0361]
3-羟甲基-3-甲基吗啉-4-羧酸叔丁酯
[0362][0363]
将n-boc-3-甲基吗啉-3-甲酸甲酯(1g,3.86mmol)溶入四氢呋喃(10ml)中,反应液冷却至0℃以下,分批加入氢化锂铝(220mg,5.8mmol),室温下搅拌30分钟。反应液用十水硫酸钠淬灭,室温搅拌0.5小时,无水硫酸钠干燥,过滤,滤液浓缩,柱层析纯化得到标题化合物(550mg,61%)。
[0364]
lc-ms:m/z[m+h-boc]
+
=132.
[0365]
(3-甲基吗啉-3-基)甲醇盐酸盐
[0366][0367]
将3-羟甲基-3-甲基吗啉-4-羧酸叔丁酯(3.2g,13.85mmol)溶入二氯甲烷(50ml)中,氩气保护,加入氯化氢乙酸乙酯溶液(4.0m,50ml),室温搅拌1小时,反应液浓缩得到标题化合物粗品(1.7g)。
[0368]
lc-ms:m/z[m+h]
+
=132.
[0369]
(4-(2,6-二氯嘧啶-4-基)-3-甲基吗啉-3-基)甲醇
[0370][0371]
将(3-甲基吗啉-3-基)甲醇盐酸盐(1.5g,11.45mmol)溶在乙腈(50ml)中,加入碳酸钠(3.64g,34.35mmol),反应液冷却至0℃以下,滴加2,4,6-三氯嘧啶(10.5g,57.2 5mmol),50℃搅拌过夜,经硅藻土过滤,滤液浓缩,柱层析纯化得到标题化合物(2.1g,66%)。
[0372]
lc-ms:m/z[m+h]
+
=278.
[0373]
7-氯-11a-甲基-3,4,11,11a-四氢-1h,9h-嘧啶并[6',1':2,3]咪唑并[5,1-c][1,4]恶嗪-9-酮
[0374][0375]
将(4-(2,6-二氯嘧啶-4-基)-3-甲基吗啉-3-基)甲醇(1.6g,5.76mmol)溶入二氯甲烷(50ml)中,加入二氯亚砜(2.05g,17.3mmol),室温下搅拌1小时,反应液浓缩缩,将浓缩后的残留物溶入乙腈(50ml)中,加入碳酸钾(2.1g,15.2mmol),85℃搅拌过夜,反应液经硅藻土过滤,滤液浓缩,硅胶柱层析纯化得到标题化合物(1.2 g,98%)。
[0376]
lc-ms:m/z[m+h]
+
=242.
[0377]1h nmr(400mhz,dmso-d6)δ5.99(s,1h),3.79(d,j=7.3hz,1h),3.73(s,2h), 3.66-3.58(m,2h),3.57-3.50(m,1h),3.47-3.39(m,2h),1.47(s,3h);
[0378]
中间体11
[0379]
((1s,4r)-2-氧杂-5-氮杂双环[2.2.1]庚-4-基)甲烷-d2-醇
[0380][0381]
(1s,4s)-5-叔丁氧基羰基-2-氧杂-5-氮杂双环[2.2.1]庚烷-4-羧酸甲酯(470mg,1.83 mmol,chemistry letters,2017,566-568)加入氯化氢乙酸乙酯溶液(4.0m,10ml)中,反应混合物室温搅拌5小时。反应液浓缩后加入乙腈(20ml)和碳酸钠(1g),室温搅拌1小时。反应液过滤,浓缩。向残留物中加入无水四氢呋喃(15ml)和氘代氢化铝锂(138.9mg,3.66mmol),室温搅拌过夜。反应液加入十水硫酸钠淬灭,过滤,将滤液浓缩得到标题化合物粗品(200mg)。
[0382]
lc-ms:m/z[m+h]
+
=132.
[0383]
(((1s,4r)-5-(2,6-二氯嘧啶-4-基)-2-氧杂-5-氮杂双环[2.2.1]庚-4-基)甲烷-d2-醇
[0384][0385]
三乙胺(307mg,3.04mmol)和2,4,6-三氯嘧啶(335.6mg,1.83mmol)加入乙腈(20 ml)中,冷却到0℃。((1s,4r)-2-氧杂-5-氮杂双环[2.2.1]庚-4-基)甲烷-d2-醇(200 mg,1.52mmol)缓慢加入反应体系,反应液室温搅拌过夜。反应液浓缩,硅胶柱层析纯化得到标题化合物(130mg,31%)。
[0386]
lc-ms:m/z[m+h]
+
=278.
[0387]
(3s,11ar)-7-氯-3,4-二氢-1h,9h,11h-3,11a-甲桥嘧啶并[6',1':2,3]咪唑[5,1-c][1,4]恶嗪-9-酮-11,11-d2
[0388][0389]
((1s,4r)-5-(2,6-二氯嘧啶-4-基)-2-氧杂-5-氮杂双环[2.2.1]庚-4-基)甲烷-d2-醇(130 mg,0.47mmol)加入到二氯甲烷(10ml)中,冷却到0℃。滴加入二氯亚砜(279.6 mg,2.35mmol),0℃搅拌30分钟。将反应液浓缩并加入碳酸钾(194.6mg,1.41 mmol)和乙腈(15ml),回流搅拌过夜。反应液用水稀释,二氯甲烷萃取。有机相用饱和食盐水洗涤,无水硫酸钠干燥,浓缩。残留物用制备薄层色谱分离(二氯甲烷/甲醇=20/1)得标题化合物(63mg,74%)。
[0390]
lc-ms:m/z[m+h]
+
=242.
[0391]
中间体12
[0392]
((1s,4r)-5-(2,6-二氯-5-氟嘧啶-4-基)-2-氧杂-5-氮杂双环[2.2.1]庚基-4-基)甲醇
[0393][0394]
2,4,6-三氯-5-氟嘧啶(872mg,4.4mmol)和三乙胺(795mg,7.9mmol)加入到四氢呋喃(10ml)中,冷却到0℃。将((1s,4r)-2-氧杂-5-氮杂双环[2.2.1]庚-4-基)甲醇(650mg,4.0mmol)加入反应液,0℃搅拌2小时。反应液浓缩,硅胶柱层析纯化(石油醚/乙酸乙酯=5/1~2/1)得到标题化合物(700mg,60%)。
[0395]
lc-ms:m/z[m+h]
+
=294.
[0396]
(3s,11ar)-7-氯-6-氟-3,4-二氢-1h,9h,11h-3,11a-甲桥嘧啶并[6',1':2,3]咪唑[5,1-c][1,4]恶嗪-9-酮
[0397][0398]
((1s,4r)-5-(2,6-二氯-5-氟嘧啶-4-基)-2-氧杂-5-氮杂双环[2.2.1]庚基-4-基)甲醇(700mg,2.4mmol)加入到氯化亚砜(10ml)中,室温搅拌30分钟。将反应液浓缩并加入碳酸钾(660mg,4.8mmol)和乙腈(20ml)。80℃搅拌过夜。反应液浓缩,制备薄层色谱分离得标题化合物(560mg,91%)。
[0399]
lc-ms:m/z[m+h]
+
=258.
[0400]1h nmr(400mhz,cdcl3)δ4.80(br.s,1h),4.53(d,j=12.7hz,1h),4.15-4.06 (m,1h),4.05-3.95(m,2h),3.80(d,j=10.3hz,1h),3.67(d,j=10.8hz,1h), 2.22-2.13(m,1h),2.12-2.05(m,1h).
[0401]
中间体13
[0402]
((1s,4r)-5-(2,5,6-三氯嘧啶-4-基)-2-氧杂-5-氮杂双环[2.2.1]庚基-4-基)甲醇
[0403][0404]
全氯嘧啶(333mg,1.71mmol)溶解在乙腈(16ml)中,依次加入碳酸钠固体(362 mg,3.42mmol)和((1s,4r)-2-氧杂-5-氮杂双环[2.2.1]庚-4-基)甲醇盐酸盐(200mg, 1.14mmol),室温搅拌过夜。过滤,滤液浓缩,制备薄层色谱纯化(石油醚/乙酸乙酯=4/1)得到标题化合物(280mg)。
[0405]
lc-ms:m/z[m+h]
+
=310.
[0406]
(3s,11ar)-6,7-二氯-3,4-二氢-1h,9h,11h-3,11a-甲桥嘧啶并[6',1':2,3]咪唑并[5,1-c][1,4]恶嗪-9-酮
[0407][0408]
((1s,4r)-5-(2,5,6-三氯嘧啶-4-基)-2-氧杂-5-氮杂双环[2.2.1]庚基-4-基)甲醇(280 mg,0.9mmol)和氯化亚砜(650mg,4.5mmol)加入到二氯甲烷(8ml)中,搅拌30 分钟。反应液浓缩并加入碳酸钾(620mg,4.8mmol)和乙腈(16ml),90℃搅拌过夜。反应液过滤,滤液浓缩,制备薄层色谱分离纯化(二氯甲烷/甲醇=25/1)得到标题化合物(160mg,65%)。
[0409]
lc-ms:m/z[m+h]
+
=274.
[0410]1h nmr(400mhz,cdcl3)δ4.78(br.s,1h),4.51(d,j=13.2hz,1h),4.08(d,j= 7.3hz,1h),3.95-4.04(m,2h),3.89(s,2h),1.96-2.29(m,2h).
[0411]
中间体14
[0412]
((1s,4r)-5-(2,6-二氯-5-甲基嘧啶)-4-基-2-氧杂-5-氮杂双环[2.2.1]庚基-4-基)甲醇
[0413][0414]
2,4,6-三氯-5-甲基嘧啶(113mg,0.4mmol)溶解在乙腈(8ml)中,分别加入碳酸钠固体(130mg,1.2mmol)和((1s,4r)-2-氧杂-5-氮杂双环[2.2.1]庚-4-基)甲醇盐酸盐(70mg,0.6mmol),室温搅拌过夜。过滤,滤液浓缩,制备薄层色谱(石油醚/乙酸乙酯=4/1)纯化得到标题化合物(80mg)。
[0415]
lc-ms:m/z[m+h]
+
=290.
[0416]
(3s,11ar)-7-氯-6-甲基-3,4-二氢-1h,9h,11h-3,11a-甲桥嘧啶并[6',1':2,3]咪唑并[5,1-c][1,4]恶嗪-9-酮
[0417][0418]
((1s,4r)-5-(2,6-二氯-5-甲基嘧啶)-4-基-2-氧杂-5-氮杂双环[2.2.1]庚基-4-基)甲醇(80mg,0.27mmol)和氯化亚砜(160mg,1.35mmol)加入到二氯甲烷(3ml)中,搅拌30分钟。将反应液浓缩并加入碳酸钾(112mg,0.81mmol)和乙腈(12ml),90℃搅拌过夜。反应液过滤,滤液浓缩,制备薄层色谱分离(二氯甲烷/甲醇=25/1)得到标题化合物(20mg,29%)。
[0419]
lc-ms:m/z[m+h]
+
=254.
[0420]
中间体15
[0421]
5-甲酰基-2-(3-(三氟甲基)苯氧基)苄腈
[0422][0423]
将2-氟-5-甲酰基苄腈(15.0g,0.1mol),3-(三氟甲基)苯酚(16.0g,0.1mol)和碳酸钾(13.8g,0.1mol)加到n,n-二甲基甲酰胺(100.0ml)中,在105℃反应8小时,反应液倒入水中,用二氯甲烷萃取,有机相浓缩,浓缩残留物乙醇打浆得标题化合物(22.1g,75.5%)。
[0424]1h nmr(400mhz,dmso-d6)δ9.96(s,1h),8.49(s,1h),8.14(br.s,1h),7.88(br. s,2h),7.47(br.s,2h),7.19(br.s,1h).
[0425]
5-(羟甲基)-2-(3-(三氟甲基)苯氧基)苄腈
[0426][0427]
将5-甲酰基-2-(3-(三氟甲基)苯氧基)苄腈(24.3g,83.44mmol)加到甲醇(250.0ml)中,分批加入硼氢化钠(4.86g,127.9mmol),室温反应0.5小时,反应液倒入水中,用二氯甲烷萃取,有机相浓缩得到标题化合物(24.2g,99%)。
[0428]1h nmr(400mhz,dmso-d6)δ7.80(s,1h),7.73-7.53(m,3h),7.52-7.27(m, 2h),7.09(s,1h),5.41(s,1h),4.51(s,2h).
[0429]
参考下表,除了采用“原料”一栏所述原料替代相应的原料以外,参照中间体15 的制备方法制备以下中间体。
[0430]
[0431]
[0432]
[0433][0434]
中间体34
[0435]
4-(苄氧基)-2-(三氟甲氧基)吡啶
[0436][0437]
将4-(苄氧基)吡啶-2-醇(1.91g,9.48mmol)和1-三氟甲基-1,2-苯碘酰-3(h)-酮(1g, 3.16mmol)加入到硝基甲烷(25ml)中,在100℃搅拌过夜。反应液浓缩,残留物柱层析纯化(石油醚/乙酸乙酯=10/1)得到标题化合物(530mg,47%)。
[0438]
lc-ms:m/z[m+h]
+
=270.
[0439]
2-(三氟甲氧基)吡啶-4-醇
[0440][0441]
将4-(苄氧基)-2-(三氟甲氧基)吡啶(530mg,1.97mmol)和pd/c(10%,125mg)加到甲醇(20ml)中,在60℃,3.0bar压力的氢气氛下搅拌过夜。反应液过滤,滤液浓缩得到粗品标题化合物(330mg,94%)。
[0442]
lc-ms:m/z[m+h]
+
=180.
[0443]
(3,5-二氟-4-((2-(三氟甲氧基)吡啶-4-基)氧基)苯基)甲醇
[0444][0445]
将3,4,5-三氟苯甲醛(294.4mg,1.84mol),2-(三氟甲氧基)吡啶-4-醇(330mg,1.84 mol)和碳酸钾(330.6mg,2.39mol)加到n,n-二甲基甲酰胺(10ml)中,在120℃搅拌2小时,反应液倒入水中,用乙酸乙酯萃取,有机相浓缩得到3,5-二氟
ꢀ‑
4-((2-(三氟甲氧基)吡啶-4-基)氧基)苯甲醛粗品,将该粗品加入到乙醇(250.0ml)中,加入硼氢化钠(69.61mg,1.84mmol)室温搅拌1小时。反应用水淬灭,乙酸乙酯萃取,有机相干燥浓缩得到标题化合物(400mg,68%)。
[0446]
lc-ms:m/z[m+h]
+
=322.
[0447]1h nmr(400mhz,dmso-d6)δ8.30(d,j=5.9hz,1h),7.29(d,j=9.3hz,2h), 7.07(d,j=3.9hz,1h),6.95(s,1h),5.56(br.s,1h),4.56(d,j=4.9hz,2h). 中间体35
[0448]
4-((2-(三氟甲基)吡啶-4-基)氧基)苯甲醛
[0449][0450]
将2-(三氟甲基)吡啶-4-醇(1.0g,5.6mmol),4-氟苯甲醛(0.7g,5.5mmol)和碳酸钾(1.7g,12.0mmol)加到n,n-二甲基甲酰胺(10.0ml)中,120℃搅拌14h,反应液倒入水中,用乙酸乙酯萃取,有机相浓缩,硅胶柱纯化得到标题化合物(0.8g, 54%)。
[0451]
lc-ms:m/z[m+h]
+
=268.
[0452]
2-(三氟甲基)-4-(4-乙烯基苯氧基)吡啶
[0453][0454]
将4-((2-(三氟甲基)吡啶-4-基)氧基)苯甲醛(0.8g,2.9mmol),甲基三苯基溴化磷(1.28g,3.6mmol)加入到四氢呋喃(20ml)中,体系中加入氢化钠(173mg,7.2 mmol,60%),氩气保护下搅拌16h。反应液倒入冰水中,用二氯甲烷萃取,有机相浓缩,柱层析纯化得到标题化合物(0.2g,26%)。
[0455]
lc-ms:m/z[m+h]
+
=266.
[0456]
2-(4-((2-(三氟甲基)吡啶-4-基)氧基)苯基)乙-1-醇
[0457][0458]
0℃下,2-(三氟甲基)-4-(4-乙烯基苯氧基)吡啶(0.2g,0.75mmol)溶解到四氢呋喃(2ml)中,加入9-硼双环[3.3.1]壬烷的四氢呋喃溶液(0.5m,15ml,7.5mmol),自然升温至室温搅拌16h。反应液中加入水(1ml),双氧水(30%,5ml),氢氧化钠水溶液(3.0m,10ml),50℃反应2h。反应液加水稀释,二氯甲烷萃取,合并有机相浓缩,制备薄层色谱分离得到标题化合物(116mg,55%)。
[0459]
lc-ms:m/z[m+h]
+
=284.
[0460]1h nmr(400mhz,dmso-d6)δ8.61(d,j=5.4hz,1h),7.38(br.s,2h),7.35(br.s, 1h),7.16(d,j=8.3hz,2h),7.12(d,j=3.4hz,1h),4.67(t,j=4.9hz,1h),3.71
‑ꢀ
3.55(m,2h),2.77(t,j=6.6hz,2h).
[0461]
参考下表,除了采用“原料”一栏所述原料替代相应的原料以外,参照中间体35 的制备方法制备以下中间体。
[0462][0463][0464]
参考下表,除了采用“原料”一栏所述原料替代相应的原料以外,参照中间体13 的制备方法制备以下中间体。
[0465][0466]
参考下表,除了采用“原料”一栏所述原料替代相应的原料以外,参照中间体15 的制备方法制备以下中间体。
[0467]
[0468]
[0469][0470]
参考下表,除了采用“原料”一栏所述原料替代相应的原料以外,参照中间体34 的制备方法制备以下中间体。
[0471][0472]
参考下表,除了采用“原料”一栏所述原料替代相应的原料以外,参照中间体35 的制备方法制备以下中间体。
[0473][0474]
中间体63
[0475]
2,4-二氯-6-((1s,4r)-4-((羟甲基)-2-氧杂-5-氮杂双环[2.2.1]庚基-5-基)嘧啶-5-腈
[0476][0477]
2,4,6-三氯嘧啶-5-腈(400mg,1.94mmol)溶解在乙腈(12ml)中,依次加入碳酸钠固体(318mg,3.0mmol)和((1s,4r)-2-氧杂-5-氮杂双环[2.2.1]庚-4-基)甲醇盐酸盐(166mg,1.0mmol),室温搅拌过夜。过滤,滤液浓缩,制备薄层色谱(石油醚/乙酸乙酯=4/1)
纯化得到标题化合物(40mg,13%)。
[0478]
lc-ms:m/z[m+h]
+
=301.
[0479]
(3s,11ar)-7-氯-9-氧代-3,4-二氢-1h,9h,11h-3,11a-甲桥嘧啶[6',1':2,3]咪唑[5,1-c][1,4]恶嗪-6-腈
[0480][0481]
2,4-二氯-6-((1s,4r)-4-((羟甲基)-2-氧杂-5-氮杂双环[2.2.1]庚基-5-基)嘧啶-5-腈(40mg,0.12mmol)和氯化亚砜(0.2ml)加入到二氯甲烷(3ml)中,室温搅拌20分钟。将反应液浓缩并加入碳酸钠(40mg,0.37mmol)和乙腈(6ml),85℃搅拌过夜。反应液过滤,滤液浓缩,制备薄层色谱分离(二氯甲烷/甲醇=25/1)得到标题化合物(30mg,91%)。
[0482]
lc-ms:m/z[m+h]
+
=265.
[0483]
参考下表,除了采用“原料”一栏所述原料替代相应的原料以外,参照中间体63 的制备方法制备以下中间体。
[0484][0485]
中间体65
[0486]
(2-(2,6-二氯-5-甲氧基嘧啶-4-基)-2-氮杂双环[2.1.1]己-1-基)甲醇
[0487][0488]
(2-氮杂双环[2.1.1]己-1-基)甲醇(500mg,4.42mmol,journal of organic chemistry, 2018,83,14350-14361)溶解在乙腈(10ml)中,加入碳酸钠(3.64g,34.35mmol),反应液冷却至0℃,加入2,4,6-三氯-5-甲氧基嘧啶(1.4g,6.46mmol),反应液室温下反应过夜,将反应液垫硅藻土过滤,滤液浓缩,硅胶层析柱分离纯化得到白色固体标题化合物(1.1g,72%)。
[0489]
lc-ms:m/z[m+h]
+
=290.
[0490]
3-氯-4-甲氧基-7,8-二氢-1h,6h,9h-7,8a-甲桥吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-1-酮
[0491][0492]
(2-(2,6-二氯-5-甲氧基嘧啶-4-基)-2-氮杂双环[2.1.1]己-1-基)甲醇(1.1g,3.79mmol)溶入二氯甲烷(10ml)中,加入二氯亚砜(1.35g,11.38mmol),室温下反应4小时,反应液浓缩后溶于乙腈(10ml)中,加入碳酸钾(1.5g,10.9mmol),85℃下搅拌过夜,将反应液冷却至室温,垫硅藻土过滤,将滤液浓缩层析柱分离纯化得到固体标题化合物(230mg,25%)。
[0493]
lc-ms:m/z[m+h]
+
=254.
[0494]1h nmr(400mhz,cdcl3)δ4.03(s,2h),3.74(s,3h),3.67(s,2h),3.07(br.s,1h), 2.13(br.s,2h),1.75(d,j=4.4hz,2h).
[0495]
中间体66
[0496]
(3-氧杂-8-氮杂双环[3.2.1]辛烷-1-基)甲醇盐酸盐
[0497][0498]
将1-(羟甲基)-3-氧杂-8-氮杂双环[3.2.1]辛烷-8-羧酸叔丁酯(200mg,0.82mmol, tetrahedron letters,2016,57,599
–
602)溶入二氯甲烷(5ml)中,氩气保护下,加入氯化氢的乙酸乙酯溶液(4.0m,50ml),室温搅拌3小时。反应液浓缩得到标题化合物粗品(140mg)。
[0499]
lc-ms:m/z[m+h]
+
=144.
[0500]
(8-(2,6-二氯嘧啶-4-基)-3-氧杂-8-氮杂双环[3.2.1]辛-1-基)甲醇
[0501][0502]
将(3-氧杂-8-氮杂双环[3.2.1]辛烷-1-基)甲醇盐酸盐(140mg,0.98mmol)溶在乙腈(10ml)中,搅拌下加入碳酸钠(311mg,2.94mmol)。将反应液冷却至0℃以下,滴加2,4,6-三氯嘧啶(537mg,2.94mmol),50℃搅拌过夜。将反应液冷却至室温后经硅藻土过滤,滤液浓缩,硅胶柱层析纯化得到标题化合物(190mg,67%)。 lc-ms:m/z[m+h]
+
=290.
[0503]
7-氯-3,4-二氢-1h,9h,11h-4,11a-乙桥嘧啶并[6',1':2,3]咪唑并[5,1-c][1,4]恶嗪-9-酮
[0504][0505]
将(8-(2,6-二氯嘧啶-4-基)-3-氧杂-8-氮杂双环[3.2.1]辛-1-基)甲醇(110mg,
0.59 mmol)溶入二氯甲烷(2ml)中,搅拌下滴入二氯亚砜(209mg,1.76mmol),室温搅拌3小时。反应液浓缩,向残留物中依次加入乙腈(10ml)、碳酸钾(243mg,1.76 mmol),85℃搅拌过夜。将反应液冷却至室温后经硅藻土过滤,滤液浓缩,硅胶层析柱纯化得到标题化合物(85mg,57%)。
[0506]
lc-ms:m/z[m+h]
+
=254.
[0507]1h nmr(400mhz,cdcl3)δ5.69(s,1h),4.27(d,j=12.2hz,1h),4.05(d,j=6.4 hz,1h),3.95(d,j=10.3hz,1h),3.75(br.s,4h),2.41-2.26(m,1h),2.20-2.05 (m,1h),1.94(td,j=6.2,12.0hz,1h),1.82-1.68(m,1h).
[0508]
中间体67
[0509]
(1r,4s)-1-(羟甲基)-2-氮杂双环[2.2.1]庚烷-2-羧酸苄酯
[0510][0511]
2-苄基-1-甲基(1r,4s)-2-氮杂双环[2.2.1]庚烷-1,2-二羧酸酯(300mg,1.04mmol, tetrahedron,2009,1433
–
1436)加入到无水四氢呋喃(10ml)和甲醇(1ml)的混合溶剂中,缓慢加入硼氢化钠(117.8mg,3.11mmol),室温搅拌2小时后。加入硼氢化锂(67.74mg,3.11mmol),室温搅拌过夜。反应液用饱和氯化铵水溶液淬灭,乙酸乙酯萃取。有机相浓缩,硅胶柱层析纯化(石油醚/乙酸乙酯=7/1~1/1)得到标题化合物(230mg,85%)。
[0512]
lc-ms:m/z[m+h]
+
=262.
[0513]
((1r,4s)-2-氮杂双环[2.2.1]庚基-1-基)甲醇
[0514][0515]
将(1r,4s)-1-(羟甲基)-2-氮杂双环[2.2.1]庚烷-2-羧酸苄酯(230mg,0.88mmol)和 pd/c(10%,25mg)加入甲醇(1ml)中,室温下常压氢化2小时。反应液过滤,滤液浓缩得到标题化合物粗品(230mg)。
[0516]
lc-ms:m/z[m+h]
+
=128.
[0517]
((1r,4s)-2-(2,6-二氯嘧啶-4-基)-2-氮杂双环[2.2.1]庚基-1-基)甲醇
[0518][0519]
将((1r,4s)-2-氮杂双环[2.2.1]庚基-1-基)甲醇(125mg,粗品)加入乙腈(10ml)中。搅拌下冷却至0℃,依次将三乙胺(197.96mg,1.96mmol)和2,4,6-三氯嘧啶(215.7mg,1.18mmol)加入反应液,室温搅拌过夜。反应液浓缩,制备薄层分离(石油醚/乙酸乙酯=2/1)得到标题化合物(140mg,两步收率58%)。
[0520]
lc-ms:m/z[m+h]
+
=274.
[0521]
(7s,9ar)-3-氯-6,7,8,9-四氢-1h,10h-7,9a-甲桥吡啶并[1',2':3,4]咪唑并[1,2-c]嘧啶-1-酮
[0522][0523]
((1r,4s)-2-(2,6-二氯嘧啶-4-基)-2-氮杂双环[2.2.1]庚基-1-基)甲醇(140mg,0.51 mmol)加入到二氯甲烷(5ml)中,冷却到0℃。滴加二氯亚砜(303.77mg,0.19ml, 2.0mmol),0℃搅拌1小时。反应液浓缩,依次向残留物中加入碳酸钾(422.28mg, 3.06mmol)和乙腈(10ml),回流搅拌过夜。反应液加水淬灭,二氯甲烷萃取,有机相浓缩,制备薄层色谱分离(二氯甲烷/甲醇=25/1)得标题化合物(110mg, 91%)。
[0524]
lc-ms:m/z[m+h]
+
=238.
[0525]1h nmr(400mhz,cdcl3)δ5.54(s,1h),4.37(d,j=12.7hz,1h),3.92(d,j= 12.7hz,1h),3.21(s,2h),2.77(br.s,1h),2.04-1.86(m,3h),1.69-1.54(m,3h). 中间体68
[0526]
(2-苄基-4-氟-2-氮杂双环[2.1.1]己-1-基)甲醇
[0527][0528]
将2-苯甲酰基-4-氟-2-氮杂双环[2.1.1]己烷-1-羧酸甲酯(880mg,3.35mmol, journal of organic chemistry,2017,8831-8841)溶入四氢呋喃(10ml)中,冷却至 0℃,分批加入氢化锂铝(381mg,10.04mmol),加料结束,50℃搅拌3小时。向反应液中加入十水硫酸钠淬灭。过滤,滤液浓缩,硅胶层析柱纯化得到标题化合物(370mg,50%)。
[0529]
lc-ms:m/z[m+h]
+
=222.
[0530]
(4-氟-2-氮杂双环[2.1.1]己-1-基)甲醇
[0531][0532]
将(2-苄基-4-氟-2-氮杂双环[2.1.1]己-1-基)甲醇(370mg,1.67mmol)溶在甲醇(100 ml)中,加入pd/c(10%,74mg),50℃常压氢化过夜。反应液过滤,滤液浓缩得到粗品标题化合物(220mg,100%)。
[0533]
lc-ms:m/z[m+h]
+
=132.
[0534]
(2-(2,6-二氯嘧啶-4-基)-4-氟-2-氮杂双环[2.1.1]己-1-基)甲醇
[0535][0536]
将(4-氟-2-氮杂双环[2.1.1]己-1-基)甲醇(210mg,1.59mmol)、4,6-二氯-2-甲氧基嘧啶(427mg,2.39mmol)和碳酸钠固体(674mg,6.36mmol)加入异丙醇(10ml)中, 85℃搅拌3天。反应液过滤,滤液浓缩,硅胶层析柱纯化得到标题化合物(432mg, 99%)。
[0537]
lc-ms:m/z[m+h]
+
=275.
[0538]
3-氯-7-氟-7,8-二氢-1h,6h,9h-7,8a-甲基吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-1-酮
[0539][0540]
将(2-(2,6-二氯嘧啶-4-基)-4-氟-2-氮杂双环[2.1.1]己-1-基)甲醇(332mg,1.21mmol)加入二氯甲烷(5ml)中,搅拌下滴入二氯亚砜(288mg,2.42mmol),室温搅拌1 小时。反应液浓缩,将残留物加入水中,搅拌下用15%氢氧化钠水溶液调节ph =14,室温搅拌10分钟。二氯甲烷萃取,有机相浓缩,硅胶层析柱纯化得到标题化合物(213mg,73%)。
[0541]
lc-ms:m/z[m+h]
+
=242.
[0542]
中间体69
[0543]
(5-氯甲基-2-氧代-3-氧杂双环[3.1.1]庚-1-基)氨基甲酸叔丁酯
[0544][0545]
将5-氯甲基-2-氧代-3-氧杂双环[3.1.1]庚烷-1-羧酸(4.0g,19.5mmol,tetrahedron letters,2014,466
–
468)加入甲苯(60ml)中,搅拌下依次加入三乙胺(3.9g,39.0 mmol)和叠氮磷酸二苯酯(8.0g,29.2mmol),室温搅拌2小时。反应液浓缩,硅胶柱层析纯化(石油醚/乙酸乙酯=10/1)得到黄色油状物(3.8g)。将油状物加入叔丁醇(80ml)中,搅拌下加入二碳酸二叔丁酯(21.9g,97.5mmol),90℃搅拌过夜。浓缩反应液,柱层析纯化(石油醚/乙酸乙酯=10/1)得到标题化合物(2.8g,52%)。 lc-ms:m/z[m+h-boc]
+
=176.
[0546]
2-(叔丁氧羰基)-4-羟甲基-2-氮杂双环[2.1.1]己烷-1-羧酸
[0547][0548]
将(5-氯甲基-2-氧代-3-氧杂双环[3.1.1]庚-1-基)氨基甲酸叔丁酯(4.5g,16.3mmol)加入二氯甲烷(20ml)中,搅拌下加入氯化氢的乙酸乙酯溶液(4.0m,40ml),室温
搅拌1.5小时。反应液浓缩,向残留物中加入氢氧化钠水溶液(0.6m,140ml),95℃搅拌0.5小时。将反应液冷却至室温后用盐酸(6.0m)调节ph=7。反应液浓缩,向残留物中加入四氢呋喃(40ml)和氢氧化钠水溶液(5%,35ml),搅拌下加入二碳酸二叔丁酯(10.6g,48.9mmol),室温搅拌过夜。反应液浓缩,残留物倒入水中,用浓盐酸将反应液ph调节至2,乙酸乙酯萃取,有机相浓缩,硅胶柱层析纯化(二氯甲烷/甲醇=50/1~10/1)得到标题化合物(1.6g,38%)。
[0549]
lc-ms:m/z[m+h-boc]
+
=158.
[0550]
2-叔丁氧羰基-4-羟甲基-2-氮杂双环[2.1.1]己烷-1-羧酸甲酯
[0551][0552]
将2-(叔丁氧羰基)-4-羟甲基-2-氮杂双环[2.1.1]己烷-1-羧酸(1.6g,6.22mmol)和碳酸钾固体(2.57g,18.66mmol)加入n,n-二甲基甲酰胺(30ml)中,氩气保护下室温搅搅拌15分钟。将碘甲烷(2.65g,18.66mmol)加入反应液中,室温搅拌过夜。反应液倒入水中,乙酸乙酯提取,有机相浓缩,硅胶柱层析纯化(二氯甲烷/甲醇=50/1~10/1)得到标题化合物(1.1g,65%)。
[0553]
lc-ms:m/z[m+h-boc]
+
=172.
[0554]
2-叔丁氧羰基-4-甲氧甲基-2-氮杂双环[2.1.1]己烷-1-羧酸甲酯
[0555][0556]
将2-叔丁氧羰基-4-羟甲基-2-氮杂双环[2.1.1]己烷-1-羧酸甲酯(400mg,1.47mmol)加入n,n-二甲基甲酰胺(16ml)中,室温搅拌下加入氢化钠(60%,177mg,4.43 mmol),室温搅拌15分钟后加入碘甲烷(630mg,4.43mmol),室温搅拌3小时。反应液倒入水中,乙酸乙酯萃取,有机相浓缩,硅胶柱层析纯化(石油醚/乙酸乙酯=10/1~3/1)得到标题化合物(290mg,69%)。
[0557]
lc-ms:m/z[m+h-boc]
+
=186.
[0558]
(4-(甲氧基甲基)-2-氮杂双环[2.1.1]己-1-基)甲醇
[0559][0560]
将2-叔丁氧羰基-4-甲氧甲基-2-氮杂双环[2.1.1]己烷-1-羧酸甲酯(290mg,1.02 mmol)加入二氯甲烷(2ml)中,搅拌下加入氯化氢的乙酸乙酯溶液(4.0m,6ml),室温搅拌0.5小时。反应液浓缩,向残留物中加入四氢呋喃(6ml)和氢化铝锂(76 mg,2.0mmol),室温搅拌1小时。向反应液中加入十水硫酸钠淬灭,室温搅拌 0.5小时,过滤,滤液浓缩得到标题化合物(155mg,97%)。
[0561]
lc-ms:m/z[m+h]
+
=158.
[0562]
(2-(6-氯-2-甲氧基嘧啶-4-基)-4-(甲氧基甲基)-2-氮杂双环[2.1.1]己-1-基)
甲醇
[0563][0564]
将(4-(甲氧基甲基)-2-氮杂双环[2.1.1]己-1-基)甲醇(155mg,1.0mmol)、4,6-二氯
ꢀ‑
2-甲氧基嘧啶(267mg,1.5mmol)和碳酸钠固体(318mg,3.0mmol)加入异丙醇(10 ml)中,回流搅拌过夜。反应液冷却至室温,过滤,滤液浓缩。制备薄层色谱分离(二氯甲烷/甲醇=50/1)得到标题化合物(260mg,87%)。
[0565]
lc-ms:m/z[m+h]
+
=300.
[0566]
3-氯-7-(甲氧基甲基)-7,8-二氢-1h,6h,9h-7,8a-甲桥吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-1-酮
[0567][0568]
将(2-(6-氯-2-甲氧基嘧啶-4-基)-4-(甲氧基甲基)-2-氮杂双环[2.1.1]己-1-基)甲醇(260mg,0.87mmol)加入二氯甲烷(4ml)中,搅拌下滴入氯化亚砜(154mg,1.3 mmol),室温搅拌0.5小时。反应液浓缩,向残留物中依次加入水(4ml)和氢氧化钠水溶液(1.0m,4ml),室温搅拌0.5小时。二氯甲烷萃取,合并有机相,有机相浓缩得到标题化合物(180mg,78%)。
[0569]
lc-ms:m/z[m+h]
+
=268.
[0570]
中间体70
[0571]
2-叔丁氧羰基-4-甲酰基-2-氮杂双环[2.1.1]己烷-1-羧酸甲酯
[0572][0573]
将2-叔丁氧羰基-4-(羟甲基)-2-氮杂双环[2.1.1]己烷-1-羧酸甲酯(400mg,1.47 mmol)加入二氯甲烷(20ml)中,搅拌下加入戴斯-马丁试剂(1.23g,2.94mmol),室温搅拌过夜。过滤,将滤液倒入饱和碳酸氢钠溶液中,二氯甲烷萃取,有机相浓缩,硅胶柱层析纯化(二氯甲烷/甲醇=50/1)得到标题化合物(250mg,63%)。 lc-ms:m/z[m+h-boc]
+
=170.
[0574]
2-叔丁氧羰基-4-(二氟甲基)-2-氮杂双环[2.1.1]己烷-1-羧酸甲酯
[0575]
[0576]
将2-(叔丁氧羰基)-4-甲酰基-2-氮杂双环[2.1.1]己烷-1-羧酸甲酯(250mg,0.86 mmol)加入二氯甲烷(12ml)中,冷却至0℃,加入二乙胺基三氟化硫(741mg,4.6 mmol),0℃搅拌2小时,室温搅拌过夜。反应液倒入饱和碳酸氢钠溶液中,二氯甲烷萃取,有机相浓缩,硅胶柱层析纯化(石油醚/乙酸乙酯=5/1)得到标题化合物(150mg,56%)。
[0577]
lc-ms:m/z[m+h-boc]
+
=192.
[0578]
(4-(二氟甲基)-2-氮杂双环[2.1.1]己-1-基)甲醇
[0579][0580]
将2-(叔丁氧羰基)-4-(二氟甲基)-2-氮杂双环[2.1.1]己烷-1-羧酸甲酯(150mg,0.51 mmol)加入二氯甲烷(4ml)中,搅拌下加入氯化氢的乙酸乙酯溶液(4.0m,6ml),室温搅拌0.5小时。反应液浓缩,向残留物中依次加入四氢呋喃(6ml)和氢化铝锂(286mg,0.75mmol),室温搅拌1小时。反应液加入十水硫酸钠淬灭,室温搅拌0.5小时。过滤,浓缩滤液得到标题化合物粗品(100mg)。
[0581]
lc-ms:m/z[m+h]
+
=164.
[0582]
2-(6-氯-2-甲氧基嘧啶-4-基)-1-(二氟甲基)-4-(甲氧基甲基)-2-氮杂双环[2.1.1]己烷
[0583][0584]
将(4-(二氟甲基)-2-氮杂双环[2.1.1]己-1-基)甲醇(100mg,0.61mmol)、4,6-二氯-2
‑ꢀ
甲氧基嘧啶(163mg,0.92mmol)和碳酸钠固体(190mg,1.83mmol)加入异丙醇(10 ml)中,回流搅拌过夜。反应液冷却至室温,过滤,滤液浓缩,制备薄层色谱分离(石油醚/乙酸乙酯=2/1)得到标题化合物(60mg,两步收率:38%)。
[0585]
lc-ms:m/z[m+h]
+
=306.
[0586]
3-氯-7-(二氟甲基)-7,8-二氢-1h,6h,9h-7,8a-甲桥吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-1-酮
[0587][0588]
将2-(6-氯-2-甲氧基嘧啶-4-基)-1-(二氟甲基)-4-(甲氧基甲基)-2-氮杂双环[2.1.1]己烷(60mg,0.20mmol)加入二氯甲烷(4ml)中,搅拌下滴入氯化亚砜(47mg,0.40 mmol),室温搅拌0.5小时。反应液浓缩,向残留物中依次加入水(2ml)和氢氧化钠水溶液(1.0m,0.5ml),室温搅拌0.5小时。反应液用二氯甲烷萃取,有机相浓缩得到标题化合物
(45mg,82%)。
[0589]
lc-ms:m/z[m+h]
+
=274.
[0590]
中间体71
[0591]
2-(叔丁氧羰基)-4-(((甲磺酰基)氧基)甲基)-2-氮杂双环[2.1.1]己烷-1-羧酸甲酯
[0592][0593]
将2-(叔丁氧羰基)-4-(羟甲基)-2-氮杂双环[2.1.1]己烷-1-羧酸甲酯(270mg,1.0 mmol)和三乙胺(300mg,3.0mmol)加入二氯甲烷(10ml)中,冷却至0℃,滴入甲基磺酰氯(3434mg,3.0mmol),室温搅拌过夜。反应液倒入饱和碳酸氢钠溶液中,二氯甲烷萃取,有机相浓缩,制备薄层色谱纯化(二氯甲烷/甲醇=20/1)得到标题化合物(180mg,52%)。
[0594]
lc-ms:m/z[m+h-boc]
+
=250
[0595]
2-(叔丁氧羰基)-4-(吗啉代甲基)-2-氮杂双环[2.1.1]己烷-1-羧酸甲酯
[0596][0597]
将2-(叔丁氧羰基)-4-(((甲磺酰基)氧基)甲基)-2-氮杂双环[2.1.1]己烷-1-羧酸甲酯(180mg,0.52mmol)、吗啉(226mg,2.6mmol)、碳酸钾固体(215mg,1.56mmol)、碘化钾(17mg,0.1mmol)加入乙腈(12ml)中,85℃搅拌过夜。反应液冷却至室温,过滤,滤液浓缩,薄层制备色谱纯化(二氯甲烷/甲醇=20/1)得到标题化合物(140 mg,80%)。
[0598]
lc-ms:m/z[m+h]
+
=341
[0599]
(4-(吗啉代甲基)-2-氮杂双环[2.1.1]己-1-基)甲醇
[0600][0601]
将2-(叔丁氧羰基)-4-(吗啉代甲基)-2-氮杂双环[2.1.1]己烷-1-羧酸甲酯(140mg, 0.41mmol)加入二氯甲烷(3ml)中,搅拌下加入氯化氢的乙酸乙酯(4.0m,3ml),室温搅拌0.5小时。反应液浓缩,向残留物中依次加入四氢呋喃(6ml)和氢化铝锂(31mg,0.82mmol),室温搅拌0.5小时。向反应液中加入十水硫酸钠固体淬灭,室温搅拌0.5小时。过滤,滤液浓缩得到标题化合物粗品(80mg)。
[0602]
lc-ms:m/z[m+h]
+
=213.
[0603]
(2-(6-氯-2-甲氧基嘧啶-4-基)-4-(吗啉代甲基)-2-氮杂双环[2.1.1]己-1-基)甲醇
[0604][0605]
将(4-(吗啉代甲基)-2-氮杂双环[2.1.1]己-1-基)甲醇(80mg,0.38mmol)、4,6-二氯
ꢀ‑
2-甲氧基嘧啶(135mg,0.76mmol)和碳酸钠固体(120mg,1.14mmol)加入异丙醇(12ml)中,回流搅拌过夜。反应液冷却至室温,过滤,滤液浓缩,制备薄层色谱分离(石油醚/乙酸乙酯=2/1)得到标题化合物(80mg,两步收率:55%)。 lc-ms:m/z[m+h]
+
=355.
[0606]
3-氯-7-(吗啉代甲基)-7,8-二氢-1h,6h,9h-7,8a-甲桥吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-1-酮
[0607][0608]
将(2-(6-氯-2-甲氧基嘧啶-4-基)-4-(吗啉代甲基)-2-氮杂双环[2.1.1]己-1-基)甲醇(80 mg,0.23mmol)加入二氯甲烷(3ml)中,搅拌下滴入氯化亚砜(81mg,0.69mmol),室温搅拌0.5小时。反应液浓缩,向残留物中依次加入水(3ml)和氢氧化钠水溶液(1.0m,3ml),室温搅拌0.5小时。二氯甲烷萃取,有机相浓缩得到标题化合物(45mg,61%)。
[0609]
lc-ms:m/z[m+h]
+
=323.
[0610]
中间体72
[0611]
2-(叔丁氧羰基)-4-((((叔丁基二甲基甲硅烷基)氧基)甲基)-2-氮杂双环[2.1.1]己烷-1-羧酸甲酯
[0612][0613]
将2-(叔丁氧羰基)-4-(羟甲基)-2-氮杂双环[2.1.1]己烷-1-羧酸甲酯(1.0g,3.69 mmol)加入二氯甲烷(10ml)中,搅拌下依次加入咪唑(0.5g,7.35mmol)和叔丁基二甲基氯硅烷(0.66g,4.37mmol),室温搅拌2小时。反应液中倒入饱和氯化铵水溶液中,乙酸乙酯提取,有机相浓缩,硅胶柱层析纯化(石油醚/乙酸乙酯=5/1)得到标题化合物(1.2g,84%)。
[0614]
lc-ms:m/z[m+h-boc]
+
=286.
[0615]
4-((((叔丁基二甲基甲硅烷基)氧基)甲基)-1-(羟甲基)-2-氮杂双环[2.1.1]己烷-2-羧酸叔丁酯
[0616][0617]
将2-(叔丁氧羰基)-4-((((叔丁基二甲基甲硅烷基)氧基)甲基)-2-氮杂双环[2.1.1]己烷-1-羧酸甲酯(1.2g,3.11mmol)加入甲醇(15ml)中,反应液升温至65℃,分批次加入硼氢化钠(1.18g,31.16mmol),65℃搅拌0.5小时。反应液冷却至室温,反应液用饱和氯化铵水溶液淬灭,乙酸乙酯萃取,有机相浓缩,硅胶柱层析纯化(石油醚/乙酸乙酯=5/1)得到标题化合物(1g,90%)。
[0618]
lc-ms:m/z[m+h-boc]
+
=258.
[0619]
1-((苄氧基)甲基)-4-((((叔丁基二甲基甲硅烷基)氧基)甲基)-2-氮杂双环[2.1.1]己烷-2-羧酸叔丁酯
[0620][0621]
将4-((((叔丁基二甲基甲硅烷基)氧基)甲基)-1-(羟甲基)-2-氮杂双环[2.1.1]己烷-2
‑ꢀ
羧酸叔丁酯(1.0g,2.80mmol)加入n,n-二甲基甲酰胺(16ml)中,氩气保护下降温至0℃,搅拌下加入氢化钠(60%,224mg,5.60mmol),室温搅拌10分钟后加入溴化苄(718mg,4.20mmol),室温搅拌过夜。反应液倒入水中,乙酸乙酯萃取,有机相浓缩得到标题化合物(1.2g,96%)。
[0622]
lc-ms:m/z[m+h-boc]
+
=348.
[0623]
1-((苄氧基)甲基)-4-(羟甲基)-2-氮杂双环[2.1.1]己烷-2-羧酸叔丁酯
[0624][0625]
将1-((苄氧基)甲基)-4-((((叔丁基二甲基甲硅烷基)氧基)甲基)-2-氮杂双环[2.1.1] 己烷-2-羧酸叔丁酯(1.2g,2.68mmol)加入四氢呋喃(10ml)中,搅拌下加入四丁基氟化铵的四氢呋喃溶液(1.0m,4ml),室温搅拌2小时。反应液倒入饱和氯化铵水溶液中,乙酸乙酯萃取,有机相浓缩,硅胶柱层析纯化(二氯甲烷/甲醇=20/1)得到标题化合物(600mg,67%)。
[0626]
lc-ms:m/z[m+h-boc]
+
=234.
[0627]
1-((苄氧基)甲基)-2-(叔丁氧基羰基)-2-氮杂双环[2.1.1]己烷-4-羧酸
[0628][0629]
室温下将1-((苄氧基)甲基)-4-(羟甲基)-2-氮杂双环[2.1.1]己烷-2-羧酸叔丁酯(600 mg,1.80mmol)溶于丙酮(6ml)中,缓慢滴入琼斯试剂(2.0m,2ml)中,室温搅拌 0.5小时。向反应液中加入异丙醇(6ml),室温搅拌10分钟,过滤,滤液浓缩。将残留物溶于水中,用饱和碳酸氢钠溶液调节ph为弱碱性,再用盐酸(6.0m)调节ph=2,乙酸乙酯萃取,有机相浓缩,制备薄层色谱纯化得到标题化合物粗品(400mg,64%)。
[0630]
lc-ms:m/z[m+h-boc]
+
=248.
[0631]
2-(叔丁氧羰基)-1-((苄氧基)甲基)-2-氮杂双环[2.1.1]己烷-4-羧酸甲酯
[0632][0633]
将1-((苄氧基)甲基)-2-(叔丁氧基羰基)-2-氮杂双环[2.1.1]己烷-4-羧酸(400mg, 1.15mmol)和碳酸钾固体(476mg,3.45mmol)加入n,n-二甲基甲酰胺(5ml)中,室温搅拌10分钟后加入碘甲烷(326mg,2.30mmol),室温搅拌过夜。反应液倒入水中,乙酸乙酯萃取,有机相浓缩。薄层制备色谱纯化(石油醚/乙酸乙酯=5/1)得到标题化合物(230mg,56%)。
[0634]
lc-ms:m/z[m+h-boc]
+
=262.
[0635]
2-(叔丁氧羰基)-1-(羟甲基)-2-氮杂双环[2.1.1]己烷-4-羧酸甲酯
[0636][0637]
将2-(叔丁氧羰基)-1-((苄氧基)甲基)-2-氮杂双环[2.1.1]己烷-4-羧酸甲酯(230mg, 0.64mmol)和pd/c(10%,25mg)加入甲醇(10ml)中,室温常压氢化过夜。过滤,滤液浓缩得到标题化合物(150mg,96%)。
[0638]
lc-ms:m/z[m+h-boc]
+
=172.
[0639]
2-(2,6-二氯嘧啶-4-基)-1-(羟甲基)-2-氮杂双环[2.1.1]己烷-4-羧酸甲酯
[0640][0641]
将2-(叔丁氧羰基)-1-(羟甲基)-2-氮杂双环[2.1.1]己烷-4-羧酸甲酯(80mg,
0.29 mmol)加入氯化氢的二氧六环溶液(4.0m,6ml)中,50℃搅拌30分钟。反应液浓缩,向残留物中依次加入4,6-二氯-2-甲氧基嘧啶(103mg,0.58mmol)、碳酸钠固体(92mg,0.87mmol)和乙腈(6ml),85℃搅拌过夜。反应液冷却至室温,过滤。滤液浓缩,制备薄层色谱纯化(二氯甲烷/甲醇=30/1)得到标题化合物(60mg, 66%)。
[0642]
lc-ms:m/z[m+h]
+
=314.
[0643]
3-氯-1-氧代-1h,6h,9h-7,8a-甲桥吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-7(8h)-羧酸甲酯
[0644][0645]
将2-(2,6-二氯嘧啶-4-基)-1-(羟甲基)-2-氮杂双环[2.1.1]己烷-4-羧酸甲酯(60mg, 0.87mmol)加入二氯甲烷(3ml)中,随后滴入氯化亚砜(154mg,1.3mmol),室温搅拌0.5小时。反应液浓缩。向残留物中依次加入水(4ml)和氢氧化钠水溶液(1.0 m,2ml),室温搅拌0.5小时。二氯甲烷萃取,有机相浓缩得到标题化合物(30mg, 56%)。
[0646]
lc-ms:m/z[m+h]
+
=282.
[0647]
3-((3-氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苄基)氧基)-1-氧代-1h,6h,9h-7,8a-甲桥吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-7(8h)-羧酸甲酯
[0648][0649]
将3-氯-1-氧代-1h,6h,9h-7,8a-甲桥吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-7(8h)
‑ꢀ
羧酸甲酯(30mg,0.106mmol)、(3-氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苯基)甲醇(45mg,0.156mmol)和碳酸铯(103mg,0.318mmol)加入甲苯(6ml)中,130℃搅拌4小时。反应液冷却至室温,过滤,滤液浓缩。制备薄层色谱纯化(二氯甲烷/ 甲醇=20/1)得到标题化合物(20mg,35%)。
[0650]
lc-ms:m/z[m+h]
+
=533.
[0651]
3-((3-氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苄基)氧基)-1-氧代-1h,6h,9h-7,8a-甲基吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-7(8h)-羧酸
[0652][0653]
将3-((3-氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苄基)氧基)-1-氧代-1h,6h,9h-7,8a
‑ꢀ
甲桥吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-7(8h)-羧酸甲酯(1.1g,2.07mmol)加
入乙腈(10ml)和氢氧化钠水溶液(1.0m,20ml)中,室温搅拌1小时。用盐酸水溶液(1.0m)调节反应液ph=3-4。二氯甲烷提取,有机相浓缩得到标题化合物(1.07 g,100%)。
[0654]
lc-ms:m/z[m+h]
+
=519.
[0655]
(3-((3-氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苄基)氧基)-1-氧代-1h,6h,9h-7,8a-甲基吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-7(8h)-基)氨基甲酸叔丁酯
[0656][0657]
将3-((3-氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苄基)氧基)-1-氧代-1h,6h,9h-7,8a
‑ꢀ
甲基吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-7(8h)-羧酸(1.07g,2.07mmol)和三乙胺(418mg,4.14mmol)加入二氯甲烷(20ml)中,冷却至0℃加入叠氮磷酸二苯酯(628mg,2.28mmol),室温搅拌4小时。反应液浓缩,向残留物中依次加入二碳酸二叔丁酯(1.35g,6.21mmol)和叔丁醇(20ml),90℃搅拌过夜。反应液浓缩,柱层析纯化(二氯甲烷/甲醇=200/1~50/1)得到标题化合物(350mg,29%)。
[0658]
lc-ms:m/z[m+h]
+
=590.
[0659]
中间体73
[0660]
4-氨基甲酰基-1-(羟甲基)-2-氮杂双环[2.1.1]己烷-2-羧酸叔丁酯
[0661][0662]
将4-甲氧羰基-1-(羟甲基)-2-氮杂双环[2.1.1]己烷-2-羧酸叔丁酯(200mg,0.74 mmol)加入甲醇(3ml)和氨水(6ml)中,室温搅拌3小时。反应液浓缩得到标题化合物(120mg,63%)。
[0663]
lc-ms:m/z[m+h-boc]
+
=157.
[0664]
4-氰基-1-(羟甲基)-2-氮杂双环[2.1.1]己烷-2-羧酸叔丁酯
[0665][0666]
将4-氨基甲酰基-1-(羟甲基)-2-氮杂双环[2.1.1]己烷-2-羧酸叔丁酯(220mg,0.86 mmol)加入二氯甲烷(16ml)中,搅拌下依次加入三乙胺(434mg,4.30mmol)和三氟乙酸酐(722mg,3.44mmol),室温搅拌1小时。反应液倒入乙酸乙酯中,有机相依次用饱和氯化铵溶液和饱和碳酸钠溶液洗涤,有机相浓缩,制备薄层色谱纯化(石油醚/乙酸乙酯=5/1)得到标题化合物(100mg,49%)。
[0667]
lc-ms:m/z[m+h-boc]
+
=139.
[0668]
2-(6-氯-2-甲氧基嘧啶-4-基)-1-(羟甲基)-2-氮杂双环[2.1.1]己烷-4-腈
[0669][0670]
将4-氰基-1-(羟甲基)-2-氮杂双环[2.1.1]己烷-2-羧酸叔丁酯(100mg,0.42mmol)加入二氯甲烷(4ml)中,搅拌下加入盐酸/二氧六环(4.0m,3ml),50℃搅拌30分钟。反应液浓缩,向残留物中依次加入4,6-二氯-2-甲氧基嘧啶(146mg,0.82 mmol)、碳酸钠固体(133mg,1.26mmol)和乙腈(8ml),90℃搅拌过夜。反应液冷却至室温,过滤,滤液浓缩,制备薄层色谱纯化(石油醚/乙酸乙酯=4/1)得到标题化合物(20mg,17%)。
[0671]
lc-ms:m/z[m+h]
+
=281.
[0672]
3-氯-1-氧代-1h,6h,9h-7,8a-甲桥吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-7(8h)-腈
[0673][0674]
将2-(6-氯-2-甲氧基嘧啶-4-基)-1-(羟甲基)-2-氮杂双环[2.1.1]己烷-4-腈(20mg, 0.07mmol)加入二氯甲烷(2ml)中,搅拌下加入氯化亚砜(42mg,0.35mmol),室温搅拌0.5小时。反应液浓缩,将残留物中加入水中,用碳酸钾固体调节ph=10,室温搅拌0.5小时。反应液用二氯甲烷提取,有机相浓缩得到标题化合物(12mg, 69%)。
[0675]
lc-ms:m/z[m+h]
+
=249.
[0676]
中间体74
[0677]
4-(苄基氨基甲酰基)-1-((苄氧基)甲基)-2-氮杂双环[2.1.1]己烷-2-羧酸叔丁酯
[0678][0679]
将1-((苄氧基)甲基)-2-(叔丁氧基羰基)-2-氮杂双环[2.1.1]己烷-4-羧酸(750mg, 2.16mol)、苄胺(347.4mg,3.24mmol)、hatu(1.64g,4.32mmol)和三乙胺(873mg, 8.64mmol)加入二氯甲烷(20ml)中,室温搅拌2小时。反应液浓缩,柱层析纯化(二氯甲烷/甲醇=20/1)得到标题化合物(800mg,85%)。
[0680]
lc-ms:m/z[m+h]
+
=437.
[0681]
4-(苄基氨基甲酰基)-1-(羟甲基)-2-氮杂双环[2.1.1]己烷-2-羧酸叔丁酯
[0682]
[0683]
4-(苄基氨基甲酰基)-1-((苄氧基)甲基)-2-氮杂双环[2.1.1]己烷-2-羧酸叔丁酯(800 mg,1.83mmol)和pd/c(10%,80mg)加入到甲醇(10ml)中,反应液60℃常压氢化过夜。反应液过滤,滤液浓缩标题化合物粗品(480mg)。
[0684]
lc-ms:m/z[m+h-tbu]
+
=291.
[0685]
n-苄基-2-(2,6-二氯嘧啶-4-基)-1-(羟甲基)-2-氮杂双环[2.1.1]己烷-4-羧酰胺
[0686][0687]
将4-(苄基氨基甲酰基)-1-(羟甲基)-2-氮杂双环[2.1.1]己烷-2-羧酸叔丁酯(480mg, 1.39mmol)加入盐酸/二氧六环(4.0m,5ml)中,室温搅拌1小时。反应液浓缩,向残留物中依次加入2,4,6-三氯嘧啶(254.5mg,1.39mmol)、碳酸钠固体(294.7 mg,2.78mmol)和乙腈(10ml),室温搅拌2小时。反应液倒入水中,乙酸乙酯萃取,有机相浓缩,柱层析纯化(石油醚/乙酸乙酯=1/1)得到标题化合物(150mg, 两步收率:27%)。
[0688]
lc-ms:m/z[m+h]
+
=393.
[0689]
n-苄基-3-氯-1-氧代-1h,6h,9h-7,8a-甲基吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-7(8h)-羧酰胺
[0690][0691]
将n-苄基-2-(2,6-二氯嘧啶-4-基)-1-(羟甲基)-2-氮杂双环[2.1.1]己烷-4-羧酰胺(150 mg,0.38mmol)加入二氯甲烷(6ml)中,搅拌下滴入二氯亚砜(2ml),室温搅拌 30分钟。反应液浓缩,向残留物依次加入碳酸钾(263.4mg,1.91mmol)和乙腈(15 ml),回流搅拌过夜。反应液倒入水中,二氯甲烷萃取,有机相浓缩,柱层析纯化(二氯甲烷/甲醇=20/1)得到标题化合物(25mg,18%)。
[0692]
lc-ms:m/z[m+h]
+
=357.
[0693]
中间体75
[0694]
1-(叔丁氧羰基)-(4r)-4-((三甲基甲硅烷基)氧基)吡咯烷-2-羧酸甲酯
[0695][0696]
1-(叔丁氧羰基)-(4r)-4-羟基吡咯烷-2-二羧酸甲酯(5g,20.39mmol)和三乙胺(2.88 g,28.55mmol)加到二氯甲烷(50ml)中。氩气保护下降温至0℃,滴加三甲基氯硅烷
(2.88g,26.51mmol),室温搅拌过夜。反应液倒入二氯甲烷中,有机相依次用水、饱和碳酸氢钠溶液洗涤。有机相浓缩得到标题化合物(6.34g,98%)。 lc-ms:m/z[m+h-tbu]
+
=262.
[0697]
1-(叔丁氧羰基)-(4r)-2-((苄氧基)甲基)-4-((三甲基甲硅烷基)氧基)吡咯烷-2-羧酸甲酯
[0698][0699]
1-(叔丁氧羰基)-(4r)-4-((三甲基甲硅烷基)氧基)吡咯烷-2-羧酸甲酯(6.5g,20.5 mmol)和苄基氯甲基醚(6.4g,41mmol)溶入四氢呋喃(100ml)中。氩气保护下降温至0℃滴加二异丙基氨基锂的四氢呋喃溶液(2.0m,20ml,40mmol)。室温搅拌3小时。反应液用甲醇淬灭后倒入水中,乙酸乙酯萃取。有机相浓缩,硅胶柱层析纯化得到标题化合物(3.6g,40%)。
[0700]
lc-ms:m/z[m+h]
+
=438.
[0701]
1-(叔丁氧羰基)-(4r)-2-((苄氧基)甲基)-4-羟基吡咯烷-2-羧酸甲酯
[0702][0703]
将1-(叔丁氧羰基)-(4r)-2-((苄氧基)甲基)-4-((三甲基甲硅烷基)氧基)吡咯烷-2-羧酸甲酯(3g,6.86mmol)加入的柠檬酸甲醇溶液(10%,10ml)中,室温搅拌3小时。反应液过滤,滤液浓缩得到标题化合物(2.3g,89%)。
[0704]
lc-ms:m/z[m+h]
+
=366.
[0705]
1-(叔丁氧羰基)-(4r)-2-((苄氧基)甲基)-4-((甲基磺酰基)氧基)吡咯烷-2-羧酸甲酯
[0706][0707]
依次将1-(叔丁氧羰基)-(4r)-2-((苄氧基)甲基)-4-羟基吡咯烷-2-羧酸甲酯(2.3g, 6.3mmol)和三乙胺(1.28g,12.6mmol)加入二氯甲烷(15ml)中。反应液降温至 0℃,将甲磺酸酐(2.2g,10.1mmol)溶于二氯甲烷(15ml)中滴入反应液,室温搅拌过夜。将反应液倒入饱和碳酸氢钠溶液中,二氯甲烷萃取。有机相浓缩得到标题化合物(2.6g,100%)。
[0708]
lc-ms:m/z[m+h]
+
=444.
[0709]
1-(叔丁氧羰基)-(4s)-4-(苄氨基)-2-((苄氧基)甲基)吡咯烷-2-羧酸甲酯
[0710][0711]
1-(叔丁氧羰基)-(4r)-2-((苄氧基)甲基)-4-((甲基磺酰基)氧基)吡咯烷-2-羧酸甲酯(2.6g,5.87mmol)溶于苄胺(5ml)中,85℃搅拌过夜。硅胶柱层析纯化得到标题化合物(2.32g,87%)。
[0712]
lc-ms:m/z[m+h-boc]
+
=355.
[0713]
(1r,4s)-5-苄基-1-((苄氧基)甲基)-6-氧代-2,5-二氮杂双环[2.2.1]庚烷-2-羧酸叔丁酯
[0714][0715]
将1-(叔丁氧羰基)-(4s)-4-(苄氨基)-2-((苄氧基)甲基)吡咯烷-2-羧酸甲酯(519mg, 114mmol)和氢氧化锂(54.8mg,2.28mmol)加入水(2ml)和甲醇(10ml)中,30℃搅拌2天。反应液浓缩,向残留物中依次加入hatu(865mg,2.28mmol)、三乙胺(460mg,4.56mmol)和n,n-二甲基甲酰胺(35ml),室温搅拌过夜。反应液倒入乙酸乙酯中,依次用水、饱和食盐水洗涤,无水硫酸钠干燥。有机相浓缩。硅胶柱层析纯化(石油醚/乙酸乙酯=20/1),得到标题化合物(150mg,31%)。 lc-ms:m/z[m+h-boc]
+
=323.
[0716]
(1s,4r)-2-苄基-4-(羟甲基)-2,5-二氮杂双环[2.2.1]庚三-3-酮
[0717][0718]
将(1r,4s)-5-苄基-1-((苄氧基)甲基)-6-氧代-2,5-二氮杂双环[2.2.1]庚烷-2-羧酸叔丁酯(150mg,0.36mmol)和pd/c(10%,20mg)加入甲醇(10ml)中,40℃常压氢化过夜。反应液过滤并浓缩。向残留物加入氯化氢二氧六环溶液(4.0m,5ml),室温搅拌2小时。反应液浓缩得到标题化合物粗品直接用于下一步。
[0719]
lc-ms:m/z[m+h]
+
=233.
[0720]
(1s,4r)-2-苄基-5-(2,6-二氯嘧啶-4-基)-4-(羟甲基)-2,5-二氮杂双环[2.2.1]庚-3-酮
[0721][0722]
将(1s,4r)-2-苄基-4-(羟甲基)-2,5-二氮杂双环[2.2.1]庚三-3-酮(粗品)溶解在乙腈(10ml)中,冷却到0℃。依次加入三乙胺(71mg,0.71mmol)和2,4,6-三氯嘧啶(98mg,0.53mmol),室温搅拌过夜。反应液浓缩,制备薄层分离(石油醚/乙酸乙酯=2/1)得到标题化合物(40mg,两步收率30%)。
[0723]
lc-ms:m/z[m+h]
+
=379.
[0724]
(3s,11ar)-2-苄基-7-氯-3,4-二氢-9h,11h-3,11a-甲基吡嗪并[1',2':3,4]咪唑并[1,2-c]嘧啶-1,9(2h)-二酮
[0725][0726]
将(1s,4r)-2-苄基-5-(2,6-二氯嘧啶-4-基)-4-(羟甲基)-2,5-二氮杂双环[2.2.1]庚-3
‑ꢀ
酮(40mg,0.11mmol)加入二氯甲烷(5ml)中。冷却到0℃后滴加二氯亚砜(0.5 ml),0℃搅拌0.5小时。将反应液浓缩并加入碳酸钾(45.54mg,0.33mmol)和乙腈(5ml),回流搅拌过夜。反应液倒入水中,二氯甲烷萃取,有机相浓缩,制备薄层色谱分离(二氯甲烷/甲醇=25/1)得标题化合物(15mg,40%)。
[0727]
lc-ms:m/z[m+h]
+
=343.
[0728]
中间体76
[0729]
1-(叔丁氧羰基)-(4s)-2-((苄氧基)甲基)-4-((3,5-二甲氧基苄基)氨基)吡咯烷-2-羧酸甲酯
[0730][0731]
将1-(叔丁氧羰基)-(4r)-2-((苄氧基)甲基)-4-((甲基磺酰基)氧基)吡咯烷-2-羧酸甲酯(100g,0.23mol)加入2,4-二甲氧基苄胺(200ml)中,90℃搅拌过夜。将反应液直接经柱层析纯化得到标题化合物(75.8g,64%)。
[0732]
lc-ms:m/z[m+h]
+
=515.
[0733]
(1r,4s)-1-((苄氧基)甲基)-5-(3,5-二甲氧基苄基)-6-氧代-2,5-二氮杂双环
[2.2.1]庚烷-2-羧酸叔丁酯
[0734][0735]
1-(叔丁氧羰基)-(4s)-2-((苄氧基)甲基)-4-((3,5-二甲氧基苄基)氨基)吡咯烷-2-羧酸甲酯(75.8g,0.148mol)和氢氧化钠(17.76g,0.444mol)加入到水(28ml)和甲醇(280ml)的混合溶剂中,40℃搅拌过夜。反应液浓缩至干,向残留物中依次加入 hatu(112.26g,0.296mol)、三乙胺(59.8g,0.592mol)和n,n-二甲基甲酰胺(90 ml),室温搅拌过夜。反应液倒入水中,乙酸乙酯萃取,有机相浓缩,硅胶柱层析纯化(石油醚/乙酸乙酯=5/1)得到标题化合物(23g,32%)。
[0736]
lc-ms:m/z[m+h-boc]
+
=383.
[0737]
(1r,4s)-1-((苄氧基)甲基)-6-氧代-2,5-二氮杂双环[2.2.1]庚烷-2-羧酸叔丁酯
[0738][0739]
将(1r,4s)-1-((苄氧基)甲基)-5-(3,5-二甲氧基苄基)-6-氧代-2,5-二氮杂双环[2.2.1] 庚烷-2-羧酸叔丁酯(21g,0.044mol)和ddq(29.63g,0.13mol)加入二氯甲烷(100 ml)和水(5ml)中,室温搅拌过夜。反应液倒入水中,二氯甲烷萃取。有机相浓缩,硅胶柱层析纯化(石油醚/乙酸乙酯=1/1)得到标题化合物(5.6g,38%)。lc-ms:m/z[m+h-boc]
+
=233.
[0740]
(1r,4s)-1-((苄氧基)甲基)-5-甲基-6-氧代-2,5-二氮杂双环[2.2.1]庚烷-2-羧酸叔丁酯
[0741][0742]
(1r,4s)-1-((苄氧基)甲基)-6-氧代-2,5-二氮杂双环[2.2.1]庚烷-2-羧酸叔丁酯(1.8g, 5.42mmol)加入四氢呋喃(20ml)中,氩气保护下冷却到0℃。搅拌下将钠氢(325 mg,8.12mmol)加入反应液,0℃搅拌30分钟。将碘甲烷(1.15g,8.12mmol)滴入反应液,室温搅拌过夜。反应液倒入水中,乙酸乙酯萃取。有机相浓缩,硅胶柱层析纯化(二氯甲烷/甲醇=15/1)得到标题化合物(800mg,43%)。
[0743]
lc-ms:m/z[m+h]
+
=247.
[0744]
(1r,4s)-1-(羟甲基)-5-甲基-6-氧代-2,5-二氮杂双环[2.2.1]庚烷-2-羧酸叔丁酯
[0745][0746]
(1r,4s)-1-((苄氧基)甲基)-5-甲基-6-氧代-2,5-二氮杂双环[2.2.1]庚烷-2-羧酸叔丁酯(800mg,2.3mmol)和pd/c(10%,80mg)加入到甲醇(8ml)中,反应液60℃常压氢化过夜。反应液过滤,滤液浓缩标题化合物粗品(700mg)。
[0747]
lc-ms:m/z[m+h]
+
=257.
[0748]
(1s,4r)-5-(6-氯-2-甲氧基嘧啶-4-基)-4-(羟甲基)-2-甲基-2,5-二氮杂双环[2.2.1]庚-3-酮
[0749][0750]
(1r,4s)-1-(羟甲基)-5-甲基-6-氧代-2,5-二氮杂双环[2.2.1]庚烷-2-羧酸叔丁酯(700 mg,2.7mmol)加入三氟乙酸(5ml)和二氯甲烷(5ml)中,室温搅拌2小时。反应液浓缩,向残留物中依次加入4,6-二氯-2-甲氧基嘧啶(489.4mg,2.7mmol)、碳酸钠固体(1.43g,13.5mmol)和乙腈(15ml),回流搅拌3天。反应液倒入水中,乙酸乙酯萃取,有机相浓缩。硅胶柱层析(石油醚/乙酸乙酯=2/1)纯化得到标题化合物(520mg,两步收率75%)。
[0751]
lc-ms:m/z[m+h]
+
=299.
[0752]
(3r,10ar)-6-氯-2-甲基-2,3,4,4a-四氢-10h-3,10a-甲氧基吡啶并[4',3':3,4]吡咯并[1,2-c]嘧啶-1,8-二酮
[0753][0754]
(1s,4r)-5-(6-氯-2-甲氧基嘧啶-4-基)-4-(羟甲基)-2-甲基-2,5-二氮杂双环[2.2.1]庚
ꢀ‑
3-酮(420mg,1.4mmol)加入二氯甲烷(7ml)中,将二氯亚砜(836mg,7.0mmol)缓慢滴入体系中。室温搅拌1小时。反应液浓缩,将残留物加入饱和碳酸氢钠水溶液中,二氯甲烷萃取,有机相浓缩得标题化合物(220mg,59%)。
[0755]
lc-ms:m/z[m+h]
+
=267.
[0756]
中间体77
[0757]
(1r,4s)-1-((苄氧基)甲基)-5-((1-甲基-1h-吡唑-3-基)甲基)-6-氧代-2,5-二氮杂双环[2.2.1]庚烷-2-羧酸叔丁酯
[0758][0759]
将(1r,4s)-1-((苄氧基)甲基)-6-氧代-2,5-二氮杂双环[2.2.1]庚烷-2-羧酸叔丁酯(1g, 3mmol)和3-(氯甲基)-1-甲基-1h-吡唑(600mg,4.5mmol)加入四氢呋喃(20ml)中。搅拌下将钠氢(200mg,4.5mmol)加入反应液,50℃搅拌3天。反应液倒入水中,乙酸乙酯萃取,有机相浓缩,柱层析纯化(石油醚/乙酸乙酯=1/1)得到标题化合物(800mg,62%)。
[0760]
lc-ms:m/z[m+h-boc]
+
=327.
[0761]
(1r,4s)-1-(羟甲基)-5-((1-甲基-1h-吡唑-3-基)甲基)-6-氧代-2,5-二氮杂双环[2.2.1]庚烷-2-羧酸叔丁酯
[0762][0763]
将(1r,4s)-1-((苄氧基)甲基)-5-((1-甲基-1h-吡唑-3-基)甲基)-6-氧代-2,5-二氮杂双环[2.2.1]庚烷-2-羧酸叔丁酯(800mg,1.88mmol)和pd/c(10%,180mg)加入到甲醇(15ml)中,反应液60℃常压氢化过夜。反应液过滤,滤液浓缩得到标题化合物粗品(600mg)。
[0764]
lc-ms:m/z[m+h-boc]
+
=237.
[0765]
(1s,4r)-5-(6-氯-2-甲氧基嘧啶-4-基)-4-(羟甲基)-2-((1-甲基-1h-吡唑-3-基)甲基)-2,5-二氮杂双环[2.2.1]庚-3-酮
[0766][0767]
将(1r,4s)-1-(羟甲基)-5-((1-甲基-1h-吡唑-3-基)甲基)-6-氧代-2,5-二氮杂双环 [2.2.1]庚烷-2-羧酸叔丁酯(300mg,1.88mmol)加入盐酸/乙酸乙酯(4.0m,6ml)和乙酸乙酯(5ml)中,室温搅拌3小时。反应液浓缩,向残留物中依次加入4,6
‑ꢀ
二氯-2-甲氧基嘧啶(159.3mg,0.89mmol)、碳酸钠固体(471.7mg,4.45mmol)和乙腈(15ml),回流搅拌3天。反应液倒入水中,乙酸乙酯萃取,有机相浓缩。柱层析(石油醚/乙酸乙酯=1/1)纯化得到标题化合物(220mg,两步收率:65%)。 lc-ms:m/z[m+h]
+
=379.
[0768]
(3r,10ar)-6-氯-2-((1-甲基-1h-吡唑-4-基)甲基)-2,3,4,4a-四氢-10h-3,10a-甲氨基吡啶[4',3':3,4]吡咯并[1,2-c]嘧啶-1,8-二酮
[0769][0770]
(1s,4r)-5-(6-氯-2-甲氧基嘧啶-4-基)-4-(羟甲基)-2-((1-甲基-1h-吡唑-3-基)甲基)-2, 5-二氮杂双环[2.2.1]庚-3-酮(220mg,1.4mmol)加入二氯甲烷(10ml)中,将甲磺酰氯(99.65mg,0.87mmol)缓慢滴入体系中。室温搅拌2小时。反应液浓缩,将残留物加入饱和碳酸氢钠水溶液中,二氯甲烷萃取,有机相浓缩得标题化合物(120 mg,60%)。
[0771]
lc-ms:m/z[m+h]
+
=347.
[0772]
中间体78
[0773]
(1r,4s)-1-((苄氧基)甲基)-5-(双环[1.1.1]戊-1-基甲基)-6-氧代-2,5-二氮杂双环[2.2.1]庚烷-2-羧酸叔丁酯
[0774][0775]
将(1r,4s)-1-((苄氧基)甲基)-6-氧代-2,5-二氮杂双环[2.2.1]庚烷-2-羧酸叔丁酯(1g, 3mmol)和1-(氯甲基)双环[1.1.1]戊烷(1.05g,9.0mmol)加入四氢呋喃(20ml)中。搅拌下将钠氢(600mg,15mmol)加入反应液,闷罐中50℃搅拌3天。反应液倒入水中,乙酸乙酯萃取。有机相浓缩,柱层析纯化(石油醚/乙酸乙酯=5/1)得到标题化合物(780mg,63%)。
[0776]
lc-ms:m/z[m+h-boc]
+
=313.
[0777]
(1r,4s)-5-(双环[1.1.1]戊-1-基甲基)-1-(羟甲基)-6-氧代-2,5-二氮杂双环[2.2.1]庚烷-2-羧酸叔丁酯
[0778][0779]
将(1r,4s)-1-((苄氧基)甲基)-5-(双环[1.1.1]戊-1-基甲基)-6-氧代-2,5-二氮杂双环 [2.2.1]庚烷-2-羧酸叔丁酯(780mg,1.9mmol)和pd/c(10%,200mg)加入到甲醇(20ml)中,反应液氢化(70℃,0.5mpa)过夜。反应液过滤,滤液浓缩得到标题化合物粗品(430mg)。
[0780]
lc-ms:m/z[m+h-tbu]
+
=267.
[0781]
(1s,4r)-2-(双环[1.1.1]戊基-1-基甲基)-5-(2,6-二氯嘧啶-4-基)-4-(羟甲基)-2,5-二氮杂双环[2.2.1]庚烷-3-酮
[0782][0783]
将(1r,4s)-5-(双环[1.1.1]戊-1-基甲基)-1-(羟甲基)-6-氧代-2,5-二氮杂双环[2.2.1]庚烷-2-羧酸叔丁酯(480mg,1.88mmol)加入盐酸/二氧六环(4.0m,5ml)和二氯甲烷(5ml)中,室温搅拌30分钟。反应液浓缩,向残留物中依次加入2,4,6-三氯嘧啶(372.2mg,1.44mmol)、碳酸钠固体(458mg,4.32mmol)和乙腈(15ml),室温搅拌过夜。反应液过滤,滤液浓缩,柱层析纯化(石油醚/乙酸乙酯=1/1)得到标题化合物(175mg,两步收率:33%)。
[0784]
lc-ms:m/z[m+h]
+
=369.
[0785]
(3s,11ar)-2-(双环[1.1.1]戊基-1-基甲基)-7-氯-3,4-二氢-9h,11h-3,11a-甲基吡嗪并[1',2':3,4]咪唑并[1,2-c]嘧啶-1,9(2h)-二酮
[0786][0787]
将(1s,4r)-2-(双环[1.1.1]戊基-1-基甲基)-5-(2,6-二氯嘧啶-4-基)-4-(羟甲基)-2,5
‑ꢀ
二氮杂双环[2.2.1]庚烷-3-酮(50mg,1.4mmol)加入二氯甲烷(6ml)中,搅拌下滴入二氯亚砜(2ml),室温搅拌30分钟。反应液浓缩,向残留物依次加入碳酸钠(43.2mg,0.41mmol)和乙腈(10ml),回流搅拌过夜。反应液倒入水中,二氯甲烷萃取,有机相浓缩,柱层析纯化(二氯甲烷/甲醇=20/1)得标题化合物(42mg, 93%)。
[0788]
lc-ms:m/z[m+h]
+
=333.
[0789]
中间体79
[0790]
(1s,4s)-2-苄基-5-(叔丁氧羰基)-2,5-二氮杂双环[2.2.1]庚烷-1-羧酸
[0791][0792]
将(1s,4s)-5-苄基-4-氰基-2,5-二氮杂双环[2.2.1]庚烷-2-羧酸叔丁酯(6.3g,20 mmol,synthesis,2015,1123-1130)、氢氧化钠水溶液(1.0m,50ml)和固体氢氧化钠(8.3g,207mmol)加入甲醇(150ml)中,100℃搅拌过夜。反应液浓缩除去甲醇,将残留物用盐酸水溶液(1.0m)调节ph=3.8~4.4。二氯甲烷提取,有机相浓缩得标题化合物(5.4g,81%)。
[0793]
lc-ms:m/z[m+h]
+
=333.
[0794]
(1s,4s)-5-苄基-4-(羟甲基)-2,5-二氮杂双环[2.2.1]庚烷-2-羧酸叔丁酯
[0795]
3,4-二氢-9h,11h-3,11a-甲基吡嗪并[1',2':3,4]咪唑并[1,2-c]嘧啶-2(1h)-羧酸叔丁酯
[0811][0812]
将(3s,11ar)-7-氯-9-氧代-3,4-二氢-9h,11h-3,11氨基吡嗪并[1',2':3,4]咪唑并[1, 2-c]嘧啶-2(1h)-羧酸叔丁酯(1.1g,3.4mmol)、(3-氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苯基)甲醇(1.2g,4.4mmol)和碳酸铯固体(3.3g,10mmol)加入甲苯(11ml)中, 120℃搅拌过夜。反应液过滤,滤液浓缩,硅胶柱层析纯化得标题化合物(1.3g, 65%)。
[0813]
lc-ms:m/z[m+h]
+
=590.
[0814]1h nmr(400mhz,cdcl3)δ8.58(d,j=5.4hz,1h),7.33(d,j=11.2hz,1h), 7.27-7.16(m,3h),6.96(d,j=4.9hz,1h),5.44(d,j=4.9hz,2h),5.15-5.06(m, 1h),4.43(d,j=12.7hz,1h),4.02-3.90(m,1h),3.66-3.47(m,4h),3.23(d,j= 9.8hz,1h),1.96(d,j=10.3hz,1h),1.71(d,j=9.8hz,1h),1.49(br.s,9h). 中间体80
[0815]
2-氟-4-(2-羟乙基)苯酚
[0816][0817]
将2-(3-氟-4-羟基苯基)乙酸(2g,11.6mmol)加入四氢呋喃(10ml)中,搅拌下加入硼烷二甲硫醚(3.5ml,34.8mmol),室温搅拌3小时,反应液浓缩加水稀释,乙酸乙酯萃取,有机相浓缩得到标题化合物粗品(2.2g,120%)。
[0818]
lcms:m/z[m+h]
+
=157.
[0819]
2-(3-氟-4-(((2-(三氟甲基)吡啶-4-基)氧基)苯基)乙-1-醇
[0820][0821]
将2-氟-4-(2-羟乙基)苯酚(2.1g,13.29mmol)、4-氯-2-(三氟甲基)吡啶(2.35g,13.29 mmol)和碳酸钾(3.67g,26.58mmol)加入到n,n-二甲基甲酰胺(20ml)中,120℃搅拌3小时。反应液倒入水中,乙酸乙酯萃取,有机相浓缩,硅胶层析柱分离得到标题化合物(1.63g,40.6%)。
[0822]
lcms:m/z[m+h]
+
=302.
[0823]
中间体81
[0824]
4-溴-2-(二氟甲基)吡啶
[0825][0826]
将4-溴吡啶甲醛(10g,53.76mmol)加入二氯甲烷(100ml)中,降温至0℃。搅拌下将二乙胺基三氟化硫(17.3g,107.52mmol)滴入反应液,室温搅拌过夜。将反应液缓慢滴入水中,二氯甲烷萃取,有机相浓缩得到标题化合物粗品直接用于下一步反应。
[0827]
lc-ms:m/z[m+h]
+
=208.
[0828]
2-(二氟甲基)-4-甲氧基吡啶
[0829][0830]
将4-溴-2-(二氟甲基)吡啶(11.18g,53.76mmol)、甲醇钠(5.81g,107.52mmol)加入甲醇(100ml)中。90℃搅拌过夜。反应液降温至室温并倒入水(300ml)中,乙酸乙酯提取。有机相浓缩得到标题化合物粗品直接用于下一步反应。
[0831]
lc-ms:m/z[m+h]
+
=160.
[0832]
2-(二氟甲基)吡啶-4-醇
[0833][0834]
将2-(二氟甲基)-4-甲氧基吡啶(9.54g,59.95mmol)加入氢溴酸(40%水溶液,58 ml)中。90℃搅拌2天。反应液浓缩,将残留物加水稀释,搅拌下加入碳酸氢钠固体直到体系没有气泡产生为止,乙酸乙酯提取,有机相浓缩,柱层析纯化(石油醚/乙酸乙酯=10/1~1/1)得到标题化合物(2.5g,三步总收率26%)。
[0835]
lc-ms:m/z[m+h]
+
=146.
[0836]
4-((2-(二氟甲基)吡啶-4-基)氧基)苯甲醛
[0837][0838]
将4-氟苯甲醛(200mg,1.6mmol)、2-(二氟甲基)碳酸-4-醇(289mg,1.8mmol)和碳酸钾固体(441mg,3.2mmol)加入到n,n-二甲基甲酰胺(5ml)中,100℃搅拌过夜。制备薄层色谱分离得到标题化合物(180mg,45%)。
[0839]
lc-ms:m/z[m+h]
+
=250.
[0840]
(4-((2-(二氟甲基)吡啶-4-基)氧基)苯基)甲醇
[0841][0842]
将4-((2-(二氟甲基)吡啶-4-基)氧基)苯甲醛(180mg,0.7mmol)加入无水乙醇(5ml)中,搅拌下加入硼氢化钠(41mg,1mmol),室温搅拌2小时。反应液倒入水中,二氯甲烷萃取,有机相浓缩得到标题化合物(100mg,62%)。
[0843]
lc-ms:m/z[m+h]
+
=252.
[0844]
参考下表,除了采用“原料”一栏所述原料替代相应的原料以外,参照中间体81 的制备方法制备以下中间体。
[0845][0846][0847]
中间体84:
[0848]
4-(4-溴苯氧基)-2-(三氟甲基)吡啶
[0849][0850]
将4-溴酚(9.4g,54.53mmol)、4-氯-2-(三氟甲基)吡啶(9g,49.58mmol)和碳酸钾(13.7g,99.16mmol)加入n,n-二甲基甲酰胺(100ml)中,在120℃搅拌2小时,反应液倒入水中,乙酸乙酯萃取,有机相浓缩,硅胶柱层析纯化(石油醚/乙酸乙酯=10/1)得标题化合物(4.3g,25%).
[0851]
lcms:m/z[m+h]
+
=318.
[0852]
2-(三氟甲基)-4-(4-((三甲基甲硅烷基)乙炔基)苯氧基)吡啶
[0853][0854]
将4-(4-溴苯氧基)-2-(三氟甲基)吡啶(4.3g,13.52mmol)、乙炔基三甲基硅烷(3.32 g,33.8mmol)、四三苯基磷钯(1.56g,1.352mmol)和碘化亚铜(275mg,1.352mmol)加入二异丙基乙胺(15ml)和甲苯(30ml)的混合溶剂中,反应在80℃闷罐下过夜。反应液过滤,滤液倒入水中,乙酸乙酯萃取,有机相浓缩,硅胶柱层析纯化(石油醚/乙酸乙酯=100/1~20/1)得到标题化合物(1.5g,33%).
[0855]
lcms:m/z[m+h]
+
=336.
[0856]
4-(4-乙炔基苯氧基)-2-(三氟甲基)吡啶
[0857][0858]
将2-(三氟甲基)-4-(4-((三甲基甲硅烷基)乙炔基)苯氧基)吡啶(1g,2.98mmol)和碳酸钾(822.9mg,5.96mmol)加到甲醇(10ml)中,室温搅拌过夜。反应液加水淬灭,乙酸乙酯萃取,有机相浓缩得到标题化合物(750mg,96%).
[0859]
lcms:m/z[m+h]
+
=264.
[0860]
中间体85:
[0861]
(3,4-二氟苄基)氨基甲酸叔丁酯
[0862][0863]
将(3,4-二氟苯基)甲胺(1.0g,6.99mmol)、二碳酸二叔丁酯(2.3g,10.5mmol)和三乙胺(1.4g,14.0mmol)加入二氯甲烷(10ml)中,室温搅拌过夜。反应液浓缩,硅胶柱层析纯化得标题化合物(1.6g,94%)。
[0864]
lcms:m/z[m+h-boc]
+
=144.
[0865]
1-(3,4-二氟苯基)-n-甲基甲胺
[0866][0867]
将(3,4-二氟苄基)氨基甲酸叔丁酯(300mg,1.2mmol)、四氢铝锂(47mg,1.2 mmol),加入四氢呋喃(3ml)中,升温至回流搅拌1小时。反应液加十水硫酸钠淬灭,过滤,滤液浓缩得标题化合物(170mg,88%)。
[0868]1h nmr(400mhz,dmso-d6)δ7.63(t,j=9.5hz,1h),7.56-7.45(m,1h),7.37 (br.s,1h),4.15(br.s,1h),3.88(s,2h),2.52(s,3h).
实施例
[0869]
实施例1
[0870]
方法a
[0871]
(3s,11ar)-7-((3,5-二氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苄基)氧基)-3,5-二氟苄基)氧基)-3,4-二氢-1h,9h,11h-3,11a-甲桥嘧啶并[6'-,1':2,3]咪唑并[5,1-c][1,4]恶嗪-9-酮
[0872][0873]
将(3,5-二氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苯基)甲醇(51mg,0.167mmol)溶解在无水四氢呋喃(4ml)中,室温下加入六甲基二硅基胺基锂(0.167ml,1.0m四氢呋喃溶液,0.167mmol),混合物搅拌15分钟。加入(3s,11ar)-7-氯-3,4-二氢-1h, 9h,11h-3,11a-甲桥嘧啶并[6',1':2,3]咪唑并[5,1-c][1,4]恶嗪-9-酮(20mg,0.083 mmol),反应混合物120℃搅拌16小时。反应用甲醇淬灭,制备薄层色谱分离得到标题化合物(10.7mg,25%)。
[0874]
lc-ms:m/z[m+h]
+
=509.
[0875]1h nmr(400mhz,dmso-d6)δ8.68(d,j=4.4hz,1h),7.65(br.s,1h),7.45(d,j =8.8hz,2h),7.30(br.s,1h),5.34(br.s,2h),5.31(br.s,1h),4.68(br.s,1h),4.29 (d,j=
11.7hz,1h),3.99-3.76(m,3h),3.32-3.22(m,2h),1.90(d,j=9.3hz, 1h),1.79(d,j=9.8hz,1h).
[0876]
实施例2
[0877]
方法b 5-(((1-氧代-7,8-二氢-1h,6h,9h-6,8a-乙桥吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-3-基)氧基)甲基)-2-(3-(三氟甲基)苯氧基)苄腈
[0878][0879]
将5-(羟甲基)-2-(3-(三氟甲基)苯氧基)苄腈(233mg,0.80mmol)溶于乙腈中(12 ml),降温至0℃,加入氢化钠(42mg,1.06mmol,60%)和3-氯-7,8-二氢-1h,6h, 9h-6,8a-乙桥吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-1-酮(125mg,0.53mmol),搅拌 0.5小时。反应用饱和氯化铵溶液淬灭,乙酸乙酯萃取。有机相用饱和食盐水洗涤,无水硫酸钠干燥。有机相浓缩,薄层制备色谱分离(二氯甲烷/甲醇=25/1)得到标题化合物(128mg,49%)。
[0880]
lc-ms:m/z[m+h]
+
=495.
[0881]1h nmr(400mhz,dmso-d6)δ7.98(s,1h),7.79-7.40(m,5h),7.10(d,j=8.8 hz,1h),5.44(s,1h),5.27(s,2h),4.27(br.s,1h),3.88(s,2h),1.92(d,j=7.8hz, 2h),1.81-1.55(m,6h).
[0882]
下表所列的实施例4-168通过类似于实施例1-2所述的步骤制备,起始于相应的中间体:
[0883]
[0884]
[0885]
[0886]
[0887]
[0888]
[0889]
[0890]
[0891]
[0892]
[0893]
[0894]
[0895]
[0896]
[0897]
[0898]
[0899]
[0900]
[0901]
[0902]
[0903]
[0904]
[0905]
[0906]
[0907]
[0908]
[0909]
[0910]
[0911]
[0912]
[0913]
[0914]
[0915]
[0916][0917]
[0918]
实施例169
[0919]
方法c
[0920]
3-(3,5-二氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苯乙氧基)-7,8-二氢-1h,6h,9h-7,8a-甲氨基吡咯[1',2':3,4]咪唑并[1,2-c]嘧啶-1-酮
[0921][0922]
将3-氯-7,8-二氢-1h,6h,9h-7,8a-甲基吡咯并[1',2':3,4]咪唑[1,2-c]嘧啶-1-酮(80mg,0.359mmol),2-(3,5-二氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苯基)乙-1-醇(137mg,0.43mmol)和碳酸铯(233mg,0.718mmol)加入甲苯(10ml)中,120℃搅拌16小时。反应液浓缩,薄层色谱纯化得到标题化合物(68mg,37%)。
[0923]
lc-ms:m/z[m+h]
+
=507.
[0924]1h nmr(400mhz,cdcl3)δ8.58(d,j=5.4hz,1h),7.24(br.s.,1h),6.96(d,j= 8.3hz,3h),5.04(s,1h),4.57(t,j=5.9hz,2h),3.96(s,2h),3.31(s,2h),3.03(t,j =6.4hz,3h),2.04(br.s.,2h),1.81(br.s.,2h).
[0925]
实施例170
[0926]
方法d
[0927]
(3s,11ar)-6-甲氧基-7-((4-((2-(三氟甲基)吡啶-4-基)氧基)苯基)乙炔基)-3,4-二氢-1h,9h,11h-3,11a-甲桥嘧啶并[6',1':2,3]咪唑[5,1-c][1,4]恶嗪-9-酮
[0928][0929]
将4-(4-乙炔基苯氧基)-2-(三氟甲基)吡啶(195.66mg,0.74mmol)溶于无水四氢呋喃(10ml)中,氩气保护下降温至-50℃,滴入正丁基锂的四氢呋喃溶液(2m,0.74 ml,1.44mmol),反应液搅拌15分钟后升温至0℃加入氯化锌(150.96mg,1.11 mmol),反应液搅拌30分钟后,加入(3s,11ar)-7-氯-6-甲氧基-3,4-二氢-1h,9h, 11h-3,11a-甲桥嘧啶并[6',1':2,3]咪唑[5,1-c][1,4]恶嗪-9-酮(200mg,0.742 mmol)、pd2(dba)3(67.76mg,0.074mmol)和2-二环己基磷-2,4,6-三异丙基联苯(70.6mg,0.148mmol),反应液升温到120℃搅拌2小时。反应液加水稀释,用乙酸乙酯萃取。有机相浓缩。制备薄层色谱纯化(二氯甲烷/甲醇=20/1)得到标题化合物(25mg,7%)。
[0930]
lcms:m/z[m+h]
+
=497.
[0931]
(3s,11ar)-6-甲氧基-7-(4-((2-(三氟甲基)吡啶-4-基)氧基)苯乙基)-3,4-二氢-1h,9h,11h-3,11a-甲桥嘧啶并[6',1':2,3]咪唑[5,1-c][1,4]恶嗪-9-酮
[0932][0933]
将(3s,11ar)-6-甲氧基-7-((4-((2-(三氟甲基)吡啶-4-基)氧基)苯基)乙炔基)-3,4-二氢-1h,9h,11h-3,11a-甲桥嘧啶并[6',1':2,3]咪唑[5,1-c][1,4]恶嗪-9-酮(25mg, 0.05mmol)和pd/c(10%,5mg)加入到甲醇(5ml)中,室温常压氢化1小时。反应液过滤,滤液浓缩。制备薄层色谱纯化(二氯甲烷/甲醇=20/1)得到标题化合物(8 mg,32%)。
[0934]
lcms:m/z[m+h]
+
=501.
[0935]1h nmr(400mhz,cdcl3)δ8.55(d,j=5.4hz,1h),7.34(d,j=7.8hz,2h),7.19 (s,1h),7.02(d,j=8.3hz,2h),6.96(d,j=3.9hz,1h),4.74(br.s.,1h),4.52(d,j =12.7hz,1h),4.09-3.96(m,3h),3.72(s,2h),3.57(s,3h),3.18-3.03(m,2h), 2.98-2.84(m,2h),2.09(d,j=9.8hz,1h),1.86(d,j=9.8hz,1h).
[0936]
实施例171
[0937]
方法e
[0938]
(3s,11as)-7-((3-氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苄基)氧基)-2-甲基-1,2,3,4-四氢-9h,11h-3,11a-甲吡嗪[1',2':3,4]咪唑[1,2-c]嘧啶-9-酮
[0939][0940]
将(3s,11ar)-7-(((3-氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苄基)氧基)-9-氧代-3,4-二氢-9h,11h-3,11a-甲基吡嗪并[1',2':3,4]咪唑并[1,2-c]嘧啶-2(1h)-羧酸叔丁酯(36mg,0.06mmol)和三氟乙酸(8.4mg,0.07mmol)加入二氯甲烷(1ml)中,室温搅拌1小时。反应液浓缩,向残留物中加入甲醛水溶液(37%,5mg,0.06mmol)、氰基硼氢化钠(12mg,0.18mmol)和甲醇(1ml),室温搅拌1小时。反应液浓缩,制备薄层色谱纯化得(13mg,41%)。
[0941]
lcms:m/z[m+h]
+
=504.
[0942]1h nmr(400mhz,cdcl3)δ8.59(br.s.,1h),7.27(br.s.,4h),6.97(br.s.,1h), 5.45(br.s.,2h),5.11(br.s.,1h),4.37(br.s.,1h),3.84(br.s.,1h),3.75-3.57(m, 2h),3.19(d,j=1.5hz,1h),2.73(br.s.,1h),2.50(br.s.,3h),2.00(br.s.,1h),0.87 (br.s.,2h).
[0943]
实施例172
[0944]
方法f
[0945]
(3s,11as)-7-(((3-氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苄基)氧基)-2-(氧杂环丁-3-基)-1,2,3,4-四氢-9h,11h-3,11a-甲基吡嗪并[1',2':3,4]咪唑并[1,2-c]嘧啶-9-酮
[0946][0947]
将(3s,11ar)-7-(((3-氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苄基)氧基)-9-氧代-3,4-二氢-9h,11h-3,11a-甲基吡嗪并[1',2':3,4]咪唑并[1,2-c]嘧啶-2(1h)-羧酸叔丁酯(80mg,0.14mmol)加入氯化氢乙酸乙酯溶液(4.0m,1ml)和二氯甲烷(11ml)中,室温搅拌1小时。反应液浓缩,向残留物中加入氧杂环丁酮(20mg,0.28mmol)、氰基硼氢化钠(17mg,0.28mmol)和甲醇(1ml),室温搅拌1小时。反应液浓缩,制备薄层色谱纯化得(60mg,81%)。
[0948]
lcms:m/z[m+h]
+
=546.
[0949]
1h nmr(400mhz,cdcl3)δ8.57(d,j=5.4hz,1h),7.32(d,j=10.8hz,1h), 7.27-7.16(m,3h),6.96(d,j=4.4hz,1h),5.49-5.38(m,2h),5.09(s,1h),4.75(t, j=6.4hz,2h),4.62(t,j=5.6hz,1h),4.56(t,j=5.9hz,1h),4.40(d,j=12.2hz, 1h),4.04(t,j=5.9hz,1h),3.89(d,j=12.2hz,1h),3.62(br.s.,1h),3.43(d,j= 9.8hz,1h),3.16(d,j=9.3hz,1h),3.10(d,j=9.8hz,1h),3.00(d,j=9.3hz, 1h),1.97(d,j=9.8hz,1h),1.62(d,j=9.8hz,1h).
[0950]
实施例173
[0951]
方法g
[0952]
(3s,11as)-7-(((3-氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苄基)氧基)-2-(2,2,2-三氟乙基)-1,2,3,4-四氢-9h,11h-3,11a-甲基吡嗪并[1',2':3,4]咪唑并[1,2-c]嘧啶-9-酮
[0953][0954]
将(3s,11ar)-7-(((3-氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苄基)氧基)-9-氧代-3,4-二氢-9h,11h-3,11a-甲基吡嗪并[1',2':3,4]咪唑并[1,2-c]嘧啶-2(1h)-羧酸叔丁酯(80mg,0.14mmol)加入氯化氢乙酸乙酯溶液(4.0m,1ml)和二氯甲烷(1ml)中,室温搅拌1小时。反应液浓缩,向残留物中加入2,2,2-三氟乙基三氟甲磺酸盐(49 mg,0.21mmol)、三乙胺(140mg,1.4mmol)和甲苯(1ml),80℃搅拌过夜。反应液倒入饱和氯化铵溶液中,二氯甲烷萃取,有机相浓缩,制备薄层色谱纯化得(25 mg,32%)。
[0955]
lcms:m/z[m+h]
+
=572.
[0956]1h nmr(400mhz,cdcl3)δ8.58(d,j=5.4hz,1h),7.33(d,j=10.8hz,1h), 7.25-7.16(m,3h),6.96(br.s.,1h),5.49-5.41(m,2h),5.11(s,1h),4.40(d,j=12.2hz,1h),3.88(d,j=12.7hz,1h),3.78(br.s.,1h),3.61(d,j=10.3hz,1h), 3.44(d,j=9.3hz,1h),3.26-3.13(m,3h),2.90(d,j=9.3hz,1h),2.04(d,j=9.3 hz,1h),1.67(d,j=9.8hz,
1h).
[0957]
实施例174
[0958]
方法h
[0959]
(3s,11as)-2-苯甲酰基-7-(((3-氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苄基)氧基)-1,2,3,4-四氢-9h,11h-3,11a-甲基吡嗪并[1',2':3,4]咪唑[1,2-c]嘧啶-9-酮
[0960][0961]
将(3s,11ar)-7-(((3-氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苄基)氧基)-9-氧代-3,4-二氢-9h,11h-3,11a-甲基吡嗪并[1',2':3,4]咪唑并[1,2-c]嘧啶-2(1h)-羧酸叔丁酯(80mg,0.14mmol)加入氯化氢乙酸乙酯溶液(4.0m,1ml)和二氯甲烷(1ml)中,室温搅拌1小时。反应液浓缩,向残留物中加三乙胺(42mg,0.42mmol)、苯甲酰氯(29.4mg,0.21mmol)和二氯甲烷(1ml),室温搅拌过夜。反应液倒入饱和氯化铵溶液中,二氯甲烷萃取,有机相浓缩,制备薄层色谱纯化得(52mg,65%)。 lcms:m/z[m+h]
+
=594.
[0962]1h nmr(400mhz,cdcl3)δ8.57(d,j=5.4hz,1h),8.08(d,j=7.3hz,1h),7.55 (d,j=5.4hz,2h),7.50-7.44(m,1h),7.32(d,j=10.8hz,1h),7.27-7.14(m, 4h),6.95(d,j=3.9hz,1h),5.46-5.38(m,2h),5.14(d,j=7.3hz,1h),4.61(br. s.,1h),4.51-4.42(m,1h),4.08(d,j=12.2hz,1h),3.96(d,j=10.8hz,1h),3.82 (d,j=9.3hz,1h),3.69-3.58(m,1h),3.32(d,j=10.3hz,1h),2.12-2.03(m, 1h),1.86-1.75(m,1h).
[0963]
实施例175
[0964]
方法i
[0965]
(3s,11ar)-7-((3,4-二氟苄基)氨基)-6-甲氧基-3,4-二氢-1h,9h,11h-3,11a-甲氨基嘧啶[6',1':2,3]咪唑[5,1-c][1,4]恶嗪-9-酮
[0966][0967]
将(3s,11ar)-7-氯-6-甲氧基-3,4-二氢-1h,9h,11h-3,11a-甲氨基嘧啶[6',1':2,3] 咪唑[5,1-c][1,4]恶嗪-9-酮(100mg,0.37mmol)、(3,4-二氟苯基)甲胺(110mg, 0.74mmol)和二异丙基乙胺(480mg,3.7mmol)加入1,4-二氧六环(1ml)中, 120℃搅拌过夜。反应液倒入二氯甲烷中,饱和氯化铵水溶液洗涤,有机相浓缩,制备薄层色谱纯化得标题化合物(120mg,86%)。
[0968]
lcms:m/z[m+h]
+
=377.
[0969]1h nmr(400mhz,cdcl3)δ7.20-7.03(m,3h),5.52(br.s.,1h),4.79-4.68(m, 2h),4.66-4.57(m,1h),4.42(d,j=12.2hz,1h),4.04-3.95(m,2h),3.86(d,j= 12.2hz,1h),3.70-3.65(m,1h),3.64-3.59(m,4h),2.02(d,j=9.8hz,1h),1.82 (d,j=10.3hz,1h).
[0970]
下表所列的实施例176-200通过类似于实施例169-175所述的步骤制备,起始于相应的中间体:
[0971]
[0972]
[0973]
[0974]
[0975]
[0976][0977]
[0978]
实施例201
[0979]
3-((3-氟-4-((2-三氟甲基吡啶-4-基)氧基)苄基)氧基)-7-(2-羟丙-2-基)-7,8-二氢-1h, 6h,9h-7,8a-甲桥吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-1-酮
[0980][0981]
将3-((3-氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苄基)氧基)-1-氧代-1h,6h,9h-7,8a
‑ꢀ
甲桥吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-7(8h)-羧酸甲酯(20mg,0.038mmol)加入四氢呋喃(4ml)中。氩气保护下降温至0℃,加入甲基氯化镁的四氢呋喃溶液(3.0m,0.13ml)。室温搅拌2小时。反应液用饱和氯化铵溶液淬灭,乙酸乙酯萃取,有机相浓缩。制备薄层色谱纯化(二氯甲烷/甲醇=10/1)得到标题化合物(1mg, 5%)。
[0982]
lc-ms:m/z[m+h]
+
=533.
[0983]1h nmr(400mhz,cdcl3)δ8.58(d,j=5.4hz,1h),7.34(d,j=10.8hz,1h), 7.30-7.28(m,1h),7.24(br.s.,1h),7.22-7.15(m,1h),6.96(d,j=5.4hz,1h), 5.45(s,2h),5.17(br.s.,1h),4.03(s,2h),3.82-3.74(m,1h),3.35(d,j=3.9hz, 2h),2.07-1.99(m,2h),1.76(br.s.,2h),1.44(s,3h),1.31(s,3h).
[0984]
实施例202
[0985]
7-氨基-3-((3-氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苄基)氧基)-7,8-二氢-1h,6h, 9h-7,8a-甲桥吡咯并[1',2':3,4]咪唑[1,2-c]嘧啶-1-酮
[0986][0987]
将(3-((3-氟-4-((2-(三氟甲基)吡啶-4-基)氧基)苄基)氧基)-1-氧代-1h,6h,9h-7,8a
‑ꢀ
甲基吡咯并[1',2':3,4]咪唑并[1,2-c]嘧啶-7(8h)-基)氨基甲酸叔丁酯(90mg,0.15 mmol)加入乙酸乙酯(4ml)中。搅拌下加入氯化氢的乙酸乙酯溶液(4.0m,2ml)。室温搅拌10分钟。用碳酸钠固体调节反应液ph=8,过滤,滤液浓缩。制备薄层色谱纯化(二氯甲烷/甲醇=10/1)得到标题化合物(6mg,7%)。
[0988]
lc-ms:m/z[m+h]
+
=490.
[0989]1h nmr(400mhz,cdcl3)δ8.58(d,j=5.9hz,1h),7.34(d,j=11.2hz,2h), 7.25-7.15(m,2h),6.96(d,j=3.4hz,1h),5.44(s,2h),5.15(s,1h),4.04(s,2h), 3.25(s,2h),1.97(s,4h).
[0990]
生物测试和数据
[0991]
本发明的化合物为lp-pla2抑制剂,可用于治疗和预防lp-pla2介导的疾病。本发明的化合物的生物活性可使用用于确定化合物作为lp-pla2抑制剂的活性的任何合适的测试,以及组织和体内模型进行测定。
[0992]
各化合物的生物活性数据以至少一个实验或多个实验的平均值报告。应理解本发
明描述的数据可根据实施实验的人所使用的具体条件和方法而存在合理的变化。
[0993]
脂蛋白-相关磷脂酶a2(lp-pla2)人血浆测定。
[0994]
人血浆测定利用paf(磷脂酰胆碱)的硫酯类似物,其中水解导致形成包含游离巯基的磷脂。通过与cpm(7-二乙基氨基-3-(4
’‑
马来酰亚胺基苯基)-4-甲基香豆素)反应来连续测定巯基的量,该cpm为一种在巯基的michael加成后荧光增加的马来酰亚胺。该测定可以检测在人血浆的lp-pla2的活性,如通过lp-pla2抑制剂的特异性抑制所确定。
[0995]
thio-paf测定作为淬灭的75μl测定进行。通过在96孔微量板上在纯dmso 中制备所述各个化合物的1:3(体积)系列稀释液来准备化合物源板。通过rainin 多道移液器将化合物源板上的3μl化合物转移入预先添加57μl测定缓冲液的 96孔微量板中,将源板上的化合物进行20倍稀释。上述测试缓冲液含有由50mmhepes,ph 7.4、150mm nacl、1mm chaps组成。通过rainin多道移液器将进行20倍稀释后的化合物转移1μl入预先添加等分和解冻的40μl混合人血浆的96孔greiner 655076(黑色)微量板中。板在酶标板振荡器振荡20秒混匀。室温下30分钟的预孵育后,通过rainin多道移液器将10μl的底物溶液添加到 96孔greiner 655076(黑色)微量板中,所述底物溶液含有由50mm hepes,ph7.4、150mm nacl、1mm chaps组成的测定缓冲液中的2.5mm 2-thio-paf[来自乙醇母液]、32μm cpm[来自dmso母液]和3.2mm nem(n-乙基马来酰亚胺)[每次实验在dmso中新制备]。2分钟后,用25μl的5%三氟乙酸(tfa)水溶液淬灭反应。板以2000rpm离心1分钟。使用biotek synergy h1(h1mf)酶标仪以ex:380/em:485读板。使用graphpad prism 6.0和excel进行ic
50
数据、曲线和qc分析。
[0996]
实施例测定活性
[0997]
[0998]
[0999][1000]
活性数据对比(一)
[1001][1002]
由对比数据可知,本专利中化合物相比于现有技术中化合物能够具有显著更高的活性。
[1003]
本技术还包括下述具体实施方案:
[1004]
1.一种式i所示的化合物、其顺反异构体、其对映异构体、其非对映异构体、其外消旋体、其溶剂合物、其水合物或其药学上可以接受的盐或其前体药物,
[1005][1006]
其中
[1007]
n为0,1或2;且当n为0时,r2为甲基或乙基;当n为1或2时,r2不存在;
[1008]
r1为h,卤素,氰基,c
1-6
烷基,c
1-6
烷氧基,c
3-8
环烷基或3-8元杂环基,r1可以任选被一个或多个以下取代基取代:卤素,氰基,c
1-6
烷氧基,c
3-8
环烷基、3-8元杂环基或6-10元杂芳基;
[1009]
ra独立的为h或d;
[1010]
m为1或2;
[1011]rx
为h,卤素,羟基,羧基,氰基,氨基,c
1-6
烷基,c
1-6
烷氧基,c
3-8
环烷基,3-8元杂环
基,6-10元芳基,6-10元杂芳基,-c(o)nrbrc或-s(o)2nrbrc, r
x
可以任选被一个或多个以下取代基取代:卤素,羟基,c
1-6
烷氧基,氰基,c
3-8
环烷基,3-8元杂环基,6-10元芳基或6-10元杂芳基;
[1012]
q为-o-,-s-,-ch
2-或-nr
b-;
[1013]
x为-o-,-ch
2-,-nr
c-,-och
2-或不存在;
[1014]
rb为h,c
1-6
烷基或c
3-8
环烷基或3-8元杂环基;
[1015]
rc为l,l-c(o)-,l-ch
2-或l-s(o)
2-,其中l为h、c
1-6
烷基、c
3-6
环烷基、3-8元杂环基,6-10元芳基或6-10元杂芳基,l可以任选被一个或多个下基团取代:卤素,羟基,c
1-6
烷氧基,氰基,c
3-8
环烷基,3-8元杂环基,6-10元芳基或6-10元杂芳基;
[1016]
y为-ch
2-,-ch2ch
2-或者不存在;
[1017]
u为-ch
2-,-c(o)-或者不存在;
[1018]
x与u不同时为不存在;
[1019]
y和u可以任选被一个或多个以下取代基取代:卤素,羟基,c
1-6
烷基,c
1-6
烷氧基,氰基,c
3-8
环烷基,3-8元杂环基,6-10元芳基或6-10元杂芳基;
[1020]
a为
[1021]
z为n或cr3;
[1022]
z’为n或cr4;
[1023]
r3,r4,r5,r6各自独立的为h、氰基、卤素或c
1-3
卤代烷基;
[1024]
v为n或cr9,其中r9为h、氰基、卤素、c
1-3
烷基、c
1-3
卤代烷基或-o-w; w为苯基或5或6元杂芳基,其可以任选被一个或多个下列的取代基取代:卤素,氰基,c
1-6
烷基,c
1-3
烷氧基,c
1-3
卤代烷基和c
1-3
卤代烷氧基。
[1025]
2.如具体实施方案1所述的化合物,所述化合物具有式i’[1026][1027]
其中
[1028]
r1为h,氰基,卤素,c
1-6
烷基,c
1-3
烷氧基或c
1-3
卤代烷基;
[1029]
x为-o-,-ch
2-,-nrc-或不存在;
[1030]
rc为l或l-c(o)-,其中l为h、c
1-3
烷基、c
3-6
环烷基,c
3-6
杂环烷基, c1-3卤代烷基、或苄基;
[1031]
y为-ch
2-或者不存在;
[1032]
n,r2,ra,a和m如在具体实施方案1中所定义。
[1033]
3.如具体实施方案2所述的化合物,其中
[1034]
n为0,r2为甲基或乙基;
[1035]
r1为h;
[1036]
ra为h;
[1037]
m为1;
[1038]
x为-o-或-ch
2-。
[1039]
4.如具体实施方案1所述的化合物,其中
[1040]
n为0;
[1041]
r1为h、氰基、卤素、c
1-6
烷基,c
1-6
烷氧基或c
1-3
卤代烷基;
[1042]
ra为h;
[1043]
rx为h,氰基,氟,二氟甲基,氨基,
[1044]
r2为甲基或乙基;
[1045]
q为-o-;
[1046]
x为-o-,-ch2或者不存在-;
[1047]
y为-ch
2-;
[1048]
u为-ch
2-,或者不存在;
[1049]
x与u不同时为不存在。
[1050]
5.如具体实施方案l所述的化合物,其中n=1或2;且r2不存在。
[1051]
6.如具体实施方案4所述的化合物,其中r
x
为h。
[1052]
7.如具体实施方案6所述的化合物,其中x为-o-或-ch
2-。
[1053]
8.如具体实施方案5所述的化合物,其中n为1;r
x
为h;r1为h,氰基,氨基,卤素,c
1-3
烷基,c
1-3
卤代烷基或c
1-6
烷氧基。
[1054]
9.如具体实施方案8所述的化合物,其中u为-ch
2-;x为-ch
2-或-o-;且q 为-o-。
[1055]
10.如具体实施方案8所述的化合物,其中u为-ch
2-;x为-nr
c-;rc为甲基,氧杂环丁基,三氟乙基,苯甲酰基,环丁基,苄基,
[1056]
11.如具体实施方案8所述的化合物,其中u为-c(o)-;r1和r
x
均为h;y为-ch
2-; x为-nr
c-;rc为l或l-c(o)-,其中l为甲基,三氟乙基,苯甲酰基,氧杂环丁烷,环丁烷,苄基,
[1057]
12.如具体实施方案5所述的化合物,其中n为1;x为-ch
2-;u不存在;r
x
为h,羟基,卤素,氰基,氨基,c
1-3
烷氧基,c
1-3
卤代烷基或3-8元杂环基, r
x
可以任选被一个或多个以下取代基取代:卤素,羟基,c
1-6
烷氧基,氰基,3-8 元杂环基,6-10元芳基或6-10元杂芳基。
[1058]
13.如具体实施方案12所述的化合物,其中y为-ch
2-;r1为h,氰基,卤素, c
1-3
烷基,c
1-3
卤代烷基或c
1-6
烷氧基;且q为-o-。
[1059]
14.如具体实施方案13所述的化合物,其中r
x
为h,卤素,氰基,氨基,二氟甲基,
[1060]
15.如具体实施方案12所述的化合物,其中y为-ch2ch
2-;r
x
为h,卤素,氰基,氨基,
二氟甲基,r1为h,氰基,卤素,c
1-3
烷基,c
1-3
卤代烷基或c
1-6
烷氧基且q为-o-。
[1061]
16.如具体实施方案5所述的化合物,其中n为2;u为-ch
2-;x为-ch
2-或-o-; y为-ch
2-或不存在;r
x
为h,卤素,氰基,氨基,二氟甲基,甲基,r1为h,氰基,卤素,c
1-3
烷基,c
1-3
卤代烷基或c
1-6
烷氧基;且q为-o-。
[1062]
17.如具体实施方案1-2、4-10、12-16中任一项所述的化合物,其中m=2;r1为h,氰基或c
1-3
卤代烷基;且r
x
为h。
[1063]
18.如具体实施方案1-2、4-10、12-16中任一项所述的化合物,其中m=1;r1为h,氰基,卤素,c
1-3
烷基,c
1-3
卤代烷基或c
1-6
烷氧基;r
x
为h。
[1064]
19.如具体实施方案l至18中任一项所述的化合物,其中a为且r5,r6,r7,r8,r9各自独立的为h,f或氰基。
[1065]
20.如具体实施方案l至18中任一项所述的化合物或其药学上可接受的盐或其前体药物,其中a为
[1066]
r5,r6,r7和r8各自独立的为h,f或氰基;r9为-o-w;w为5或 6元杂芳基或苯基,其可以任选由一个或多个下列的取代基取代:c
1-3
卤代烷基、 c
1-3
卤代烷氧基、氰基卤素和c
1-6
烷基。
[1067]
21.如具体实施方案l至18中任一项所述的化合物,其中a为r7和r8各自独立的为h,f或氰基;r9为-o-w;且w为吡啶基、嘧啶基、吡唑基或苯基,其可以任选被一个或多个独立选自以下的取代基取代:卤素、氰基、cf3、-ocf3、chf2和ch3。
[1068]
22.如具体实施方案1至21中任一项所述的化合物,所述化合物是下述化合物
[1069]
其中,r1为h,卤素,氰基,c
1-6
烷基,c
1-3
卤代烷基或c
1-6
烷氧基;rc为c
1-6
烷基,3-8元杂环基,c
1-3
卤代烷基,苯甲酰基,c
3-8
环烷基,苄基或 r
x
为h,氰基,卤素,c
1-3
卤代烷基,氨基, 23.如具体实施方案22所述的化合物,其中r1为h,氟,氯、氰基,甲基,乙基,异丙基,三氟甲基或甲氧基;r2为甲基或乙基;rc为甲基,氧杂环丁基,三氟乙基,苯甲酰基,环丁基,苄基或r
x
为h,氰基,氟,二氟甲基,氨基,
[1070]
24.如具体实施方案l至18以及22至23中任一项所述的化合物,其中a选自下述基团:
[1071]
[1072][1073]
25.如具体实施方案1至24任一项所述的化合物,所述化合物是下述化合物:
[1074]
[1075]
[1076]
[1077]
[1078]
[1079]
[1080]
[1081]
[1082]
[1083]
[1084]
[1085]
[1086][1087]
26.组合物,其特征在于包含如具体实施方案1至25中任一项所述的、其顺反异构体、其对映异构体、其非对映异构体、其外消旋体、其溶剂合物、其水合物或其药学上可以接受的盐或其前体药物和药学上可接受的赋形剂。
[1088]
27.如具体实施方案1至25中任一项所述的化合物或具体实施方案26所述的组合物在制备用于治疗或预防与lp-pla2相关的疾病的药物中的用途。
[1089]
28.如具体实施方案1至25中任一项所述的化合物或具体实施方案26所述的组合物在制备治疗或预防下列疾病的药物中的用途:糖尿病并发症、阿兹海默症或动脉粥样硬化。
[1090]
29.一种治疗或预防糖尿病并发症、神经炎症相关疾病或动脉粥样硬化的方法,其特征在于向患者施用有效剂量的如具体实施方案1至25中任一项所述的化合物或具体实施方案26所述的组合物。
[1091]
30.如具体实施方案29所述的方法,其特征在于所述糖尿病并发症为糖尿病视网膜病变/糖尿病黄斑水肿,糖尿病肾病,糖尿病神经病变,糖尿病外周神经病变性疼痛或糖尿病足。
[1092]
31.如具体实施方案29所述的方法,其特征在于神经炎症相关疾病为阿兹海默症、多发性硬化、肌萎缩性侧索硬化或帕金森病。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1