乌饭树叶多糖及其制备方法、应用
1.本发明涉及一种乌饭树叶多糖vblp-0.5-2及制备方法,属于天然植物活性多糖的提取分离技术领域。本发明还涉及上述多糖的应用。
背景技术:
2.美拉德反应是食品加热或贮存过程中,还原糖中羰基(来源于糖或油脂氧化酸败产生的醛和酮)和蛋白质的氨基或游离氨基酸经缩合、聚合反应生成类黑色素的反应。晚期糖基化末端产物(advanced glycation end products,ages)是美拉德反应的产物之一。
3.在食品加工工业,常通过糖基化反应提高蛋白质的功能特性(如起泡性、乳化性、抗氧化性等),改善食品的风味、色泽和口感,但食品体系或食品蛋白在糖基化过程中也会形成对人体有害的ages,降低氨基酸的营养价值。研究发现,长期摄入富含ages的食物,会导致ages在机体中的积累,加速血管中胶原蛋白的交联,促进活性氧和活性碳自由基的形成,增强胰岛素抵抗,促进促炎症反应等,从而增加阿尔茨海默病、糖尿病、炎症、心血管疾病、视网膜病变等系列慢性疾病的发病率。添加ages抑制剂降低食品在热加工过程中的形成是提高食品安全,促进人体健康的有效方法之一。ages抑制剂包括合成和天然化合物两类,其中植物来源的天然ages抑制剂因其种类多、效果较好、副作用小等优点已成为国内外的研究热点。研究发现石榴皮提取物、欧洲布什蔓越莓汁提取物、咖啡酸、儿茶素、鞣花单宁等植物提取物和多酚类化合物可有效降低饼干焙烤过程中呋喃和丙烯酰胺的形成;添加白藜芦醇、表儿茶素和迷迭香酸,可使饼干中荧光性ages的形成量降低。
4.uht奶经过超高温瞬时灭菌后,具有常温贮存时间长、销售方便的优点,但是uht奶加工过程中会产生对人体有害的产物ages,如何降低uht奶加工过程中产生的ages是急需解决的问题,但是针对uht奶在生产过程中ages的控制鲜见报道。
5.乌饭树(vaccinium bracteatum thunb.)又名南烛,古称染菽,属杜鹃花科常绿灌木,是一种药食兼用的传统植物资源。乌饭树叶含花青素、类黄酮化合物、有机酸、多糖、脂溶性成分、微量元素等成分,具有抗肿瘤、抗炎、抗凝血、降血糖等药理活性。乌饭树叶多糖(polysaccharides from vaccinium bracteatum thunb.leaves,vblp)的研究主要体现在提取、特性、应用及生物活性的研究等方面。邓梅忠研究了水提取-超声萃取乌饭树树叶多糖工艺及在卷烟中的应用,结果表明乌饭树树叶多糖能改善烟气质,改善余味。程素娇等人利用响应面分析法优化乌饭树树叶多糖的提取工艺。利用回归分析优化得到了最佳提取工艺,多糖纯度达到38.2%。徐啟馨采用连续分级提取了乌饭树树叶多糖,测定了乌饭树树叶多糖的组成成分和基本特性,研究了乌饭树树叶多糖的流变学特性和乳化活性,分析了乌饭树树叶多糖的抗氧化活性,并对乌饭树树叶多糖四种组分的上述性质进行了比较。王立等人研究表明乌饭树叶多糖降血糖机理主要通过促进胰岛素分泌、修复糖尿病小鼠受损胰岛β细胞和提高糖尿病小鼠抗氧化能力实现。方斌等人研究发现乌饭树叶多糖可降低2型糖尿病小鼠血糖、血脂、炎症因子,促进胰岛素释放,调节nf-κb、pparγ蛋白表达,改善胰岛素抵抗。公开号为cn105777927a的专利文献公开了乌饭树叶多糖的分离纯化方法,但是仅仅
是对乌饭树叶多糖的初步分离纯化,并缺少对其结构特征进行表征,迄今,尚未发现乌饭树叶多糖的抗糖化作用的报道。
技术实现要素:
6.本发明的目的是提供一种天然成分中具有抗糖化活性成分的乌饭树叶多糖vblp-0.5-2、制备方法及其应用。
7.为达到上述目的,本发明的技术方案是:
8.乌饭树叶多糖vblp-0.5-2,其结构特征为:相对分子质量为81563da,其单糖组成为葡萄糖、半乳糖、木糖、鼠李糖,摩尔比为2.13:1.56:1:1.27。
9.乌饭树叶多糖vblp-0.5-2的制备方法,其包括如下步骤:
10.(1)粗多糖的提取
11.乌饭树叶清洗干净,粉碎,按照料液比为1:20(g/ml)加入水,在80℃条件下提取40min,提取结束后离心得上清液,50℃减压浓缩,向浓缩液加入四倍体积无水乙醇,4℃静置24h沉淀多糖,10000r/min离心5min,收集得到沉淀,沉淀冷冻干燥后得到乌饭树叶粗多糖;
12.(2)粗多糖的纯化
13.将粗多糖配制成浓度为10mg/ml的溶液,加入sevage试剂脱蛋白3次,然后再通过透析袋(截留分子量为3500da)透析24h,透析液冷冻干燥得到纯化多糖;
14.(3)乌饭树叶多糖组分的分离
15.将乌饭树叶纯化多糖配置成浓度为15mg/ml的溶液,然后上样至deae-cellulose离子交换柱,依次用浓度为去离子水、0.1、0.3、0.5、0.7mol/l的nacl溶液洗脱,流速为1ml/min,自动收集,每管5ml,苯酚-硫酸法检测od
490
,绘制洗脱曲线,选择性收集峰面积最大的主峰所对应的洗脱液,即合并0.5mol/lnacl溶液所对应的洗脱液,用去离子水对洗脱液透析3次,冷冻干燥得乌饭树叶多糖组分vblp-0.5;
16.将乌饭树叶多糖组分vblp-0.5配置成浓度为10mg/ml的溶液,上样至sephadexg-100凝胶色谱柱,用浓度为0.2mol/l的nacl溶液洗脱,流速为1ml/min,自动收集,每管5ml,苯酚-硫酸法检测od
490
,绘制洗脱曲线;根据洗脱曲线,得到两个洗脱峰vblp-0.5-1和vblp-0.5-2,选择性收集峰面积最大的主峰vblp-0.5-2所对应的洗脱液,用去离子水对洗脱液透析24h,冷冻干燥得到本发明所述的乌饭树叶多糖组分vblp-0.5-2。
17.本发明的乌饭树叶多糖vblp-0.5-2具有显著的抗氧化和抗糖基化的作用,可应用于抗氧化剂及uht奶生产过程中晚期糖基化末端产物抑制剂产品的制备。
18.乌饭树叶多糖vblp-0.5-2在制备抗氧化剂及晚期糖基化末端产物抑制剂中的应用。
19.乌饭树叶多糖vblp-0.5-2作为uht奶生产过程中晚期糖基化末端产物抑制剂的应用。
20.本发明的有益技术效果:
21.(1)本发明的乌饭树叶多糖组分vblp-0.5-2为天然提取物,具有良好的安全性。
22.(2)本发明的乌饭树叶多糖组分vblp-0.5-2兼具了显著的抗氧化与抗糖化作用。
23.(3)本发明的乌饭树叶多糖组分vblp-0.5-2可以作为晚期糖基化末端产物抑制剂
应用于uht奶生产领域。
附图说明
24.下面结合附图和具体实施方式对本发明作进一步详细的说明。
25.图1为乌饭树叶纯化多糖的deae-cellulose洗脱曲线图。
26.图2为乌饭树叶多糖组分vblp-0.5的sephadexg-100洗脱曲线。
27.图3为乌饭树叶多糖组分vblp-0.5-2单糖组成的高效液相色谱图。
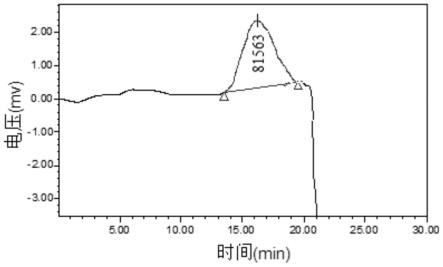
28.图4为乌饭树叶多糖组分vblp-0.5-2的分子量分布图。
29.图5为乌饭树叶多糖组分vblp-0.5-2的紫外扫描图。
30.图6为乌饭树叶多糖组分vblp-0.5-2的红外光谱图。
31.图7为乌饭树叶多糖组分vblp-0.5-2对dpph自由基的清除作用图。
32.图8为乌饭树叶多糖组分vblp-0.5-2对羟基自由基的清除作用图。
33.图9为乌饭树叶多糖组分vblp-0.5-2对超氧阴离子自由基的清除作用图。
34.图10为乌饭树叶多糖组分vblp-0.5-2在模拟体系的抗糖化作用图。
35.图11为uht奶的制备流程图。
具体实施方式
36.本发明实施例采用新鲜乌饭树叶。
37.本发明实施例中所用的试剂:1,1-二苯基-2-苦苯肼/dpph(上海楷洋生物技术有限公司);硫酸亚铁、双氧水、水杨酸、tris-hcl缓冲溶液(50mmol/l,ph8.2)、邻苯三酚、葡萄糖、苯酚、浓硫酸、乙醇等均为分析纯。
38.本发明中所用的仪器与设备:hh-w4外循环四孔水浴锅;re-52a型旋转蒸发仪;立式循环水多用真空泵;zncl-bs智能数显磁力搅拌器;1700pc紫外可见分光光度计;nicolet nexus傅里叶红外光谱仪;uv2102 pcs紫外扫描仪;gc-14a气相色谱仪;cr22gⅱ高速冷冻离心机;alpha 1-2ld plus真空冷冻干燥机。所有实验做三次平行,数据表达为均值
±
sd,数据的统计分析采用t-检验或anova分析,p《0.05认为存在统计学差异。
39.另外,在下述的实施例中,如无特别说明,本发明中选用的所有试剂、原料和仪器都为本领域熟知选用的,但不限制本发明的实施,其他本领域熟知的一些试剂和设备都可适用于本发明以下实施方式的实施。
40.乌饭树叶粗多糖的提取与纯化:
41.乌饭树叶清洗干净,粉碎,按照料液比为1:20(g/ml)加入水,在80℃条件下提取40min,提取结束后离心得上清液,50℃减压浓缩,向浓缩液加入四倍体积无水乙醇,4℃静置24h沉淀多糖,10000r/min离心5min,收集得到沉淀,沉淀冷冻干燥后得到乌饭树叶粗多糖。将粗多糖配制成浓度为10mg/ml的溶液,加入sevage试剂(正丁醇:三氯甲烷=1:4)脱蛋白3次,然后再通过透析袋(截留分子量为3500da)透析24h,透析液冷冻干燥得到纯化多糖。
42.乌饭树叶多糖组分的分离:
43.将乌饭树叶纯化多糖配置成浓度为15mg/ml的溶液,然后上样至deae-52离子交换柱,依次用浓度为去离子水、0.1、0.3、0.5、0.7mol/l的nacl溶液洗脱,流速为1ml/min,自动收集,每管5ml,苯酚-硫酸法检测od
490
,绘制洗脱曲线,选择性收集峰面积最大的主峰所对
应的洗脱液,即合并0.5mol/l nacl溶液所对应的洗脱液,用去离子水对洗脱液透析3次,冷冻干燥得乌饭树叶多糖组分vblp-0.5(附图1)。
44.将乌饭树叶多糖组分vblp-0.5配置成浓度为10mg/ml的溶液,上样至sephadexg-100凝胶色谱柱,用浓度为0.2mol/l的nacl溶液洗脱,流速为1ml/min,自动收集,每管5ml,苯酚-硫酸法检测od
490
,绘制洗脱曲线;根据洗脱曲线,得到两个洗脱峰vblp-0.5-1和vblp-0.5-2,选择性收集峰面积最大的主峰vblp-0.5-2所对应的洗脱液,用去离子水对洗脱液透析24h,冷冻干燥得到本发明所述的乌饭树叶多糖组分vblp-0.5-2(附图2)。
45.乌饭树叶多糖组分vblp-0.5-2的结构特征:
46.单糖组成测定:取vblp-0.5-2样品10mg于具塞管中,加入2mol/l的三氟乙酸(tfa)溶液2ml真空封管后于121℃水解1h,水解液除尽过量的tfa后,真空干燥。采用糖腈乙酸酯衍生化法,加10mg盐酸羟胺、适量肌醇(内标)和0.5ml吡啶,90℃加热30min后,取出冷却至室温,加入0.5ml醋酸酐,90℃下继续反应30min进行乙酰化。反应产物直接进行气相色谱(gc)分析,根据单糖保留时间定性判断单糖种类,根据峰面积的比值确定各单糖间的比例关系。
47.色谱条件:采用ov1701弹性石英毛细管柱(φ0.32mm
×
30m),载气为n2,流速1.5ml/min,fid氢焰检测器,气化室温度260℃,检测器温度250℃,采用程序升温:起始温度150℃,停留lmin,以10℃/min升温至190℃,停留lmin,以3℃/min升温至240℃,停留20min。
48.相对分子质量测定:将相对分子质量为6100、26290、84000、158000和291000的标准dextran相继进样,hplc记录保留时间tr,以tr为横坐标,lgm为纵坐标绘制标准曲线,求得回归方程。待测样品vblp-3b进样20μl,根据所得tr,通过回归方程计算多糖的相对分子质量。色谱柱:waters ullrallydrogeltm linear(φ7.8mm
×
300mm),检测器:waters2410示差折光检测器,以0.lmol/l的nano3为流动相,流速0.9ml/min,柱温45℃。
49.紫外光谱测定:vblp-0.5-2的紫外光谱测定采用上海精密仪器有限公司的uv2102 pcs紫外扫描仪进行测定,扫描范围为190nm-900nm。
50.红外光谱测定:取vblp-0.5-2 1mg和100mgkbr混合研磨压片,采用thermo electron公司的nicolet nexus傅里叶红外光谱仪进行测定,扫描范围4000-400cm-1
,分辩率为4cm-1
。
51.如图3所示,vblp-0.5-2单糖组成为葡萄糖、半乳糖、木糖、鼠李糖,摩尔比为2.13:1.56:1:1.27。
52.如图4所示,vblp-0.5-2相对分子质量为81563da。
53.如图5所示,从vblp-0.5-2的紫外光谱图中,可以观察到280nm左右不存在吸收峰,表明vblp-3b经过纯化后不含有蛋白质。
54.如图6所示,从vblp-0.5-2的红外光谱图中,可以观察到3410cm-1
附近存在一个宽峰,这是由-oh的伸缩振动引起的;1600cm-1
附近的强峰是典型的羰基所特有的吸收峰,1400cm-1
附近的峰表明存在羧基。
55.乌饭树叶多糖vblp-0.5-2的抗氧化活性:
56.dpph自由基清除能力测定:配置0.1mmol/l的dpph乙醇溶液,避光保存备用。在试管中分别加入不同浓度的vblp-0.5-2溶液(0.2、0.4、0.6、0.8、1.0mg/ml)2.0ml以及2.0ml dpph溶液,摇匀、室温下避光反应30min,于517nm处进行吸光度测定,2ml蒸馏水分别代替多
糖组分溶液及2ml dpph乙醇溶液(0.1mmol/l)反应作为空白参比,测定od
517
值,以蒸馏水作参比调零,以维生素c作为对照。在计算清除率的基础上计算ic
50
(50%inhibiting concentration),dpph自由基清除率计算公式如下:
57.清除率(%)=[1-(a
2-a1)/a3]
×
100
[0058]
式中:a1为蒸馏水替代多糖样品吸光度值;a2为不同浓度多糖样品的吸光度值;a3为蒸馏水替代dpph的吸光度值;
[0059]
羟基自由基清除能力的测定:配置9.0mmol/l的feso4溶液,9.0mmol/l的水杨酸乙醇溶液以及8.8mmol/l的h2o2溶液备用。分别向各试管中加入1ml的feso4、1ml的水杨酸乙醇溶液,混匀后加入不同浓度的vblp-0.5-2溶液(0.2、0.4、0.6、0.8、1.0mg/ml)1.0ml,再加入1.0ml h2o2启动反应。混匀后于37℃水浴加热反应30min,测定0d
510
值,以维生素c作为对照。在计算清除率的基础上计算ic
50
,羟基自由基的清除率计算公式如下:
[0060]
清除率(%)=[1-(a
2-a1)/a3]
×
100
[0061]
式中:a1为以蒸馏水代替水杨酸的吸光度值;a2为不同浓度多糖样品的吸光度值;a3为以蒸馏水代替不同浓度多糖样品的吸光度值。
[0062]
超氧阴离子自由基清除能力测定:配置50mmol/l tris-hcl缓冲液(ph8.2),7mmol/l邻苯三酚溶液,10mol/l hcl溶液备用。向试管中加入4.5ml tris-hcl缓冲液,1ml不同浓度的vblp-0.5-2溶液(0.2、0.4、0.6、0.8、1.0mg/ml)以及3.2ml蒸馏水,混匀后于25℃水浴20min。随后加入0.3ml邻苯三酚溶液(7mmol/l),摇匀,25℃水浴加热3min后立即滴入1滴hcl(10mol/l)溶液终止反应,测定0d
325
值,以维生素c作为对照。在计算清除率的基础上计算ic
50
,超氧阴离子自由基清除率计算公式如下:
[0063]
清除率=(1-a/a0)
×
100
[0064]
式中:a为不同浓度多糖样品的吸光度值;a0为以蒸馏水代替不同浓度多糖样品的吸光度值。
[0065]
乌饭树叶多糖vblp-0.5-2的抗氧化活性见附图7-9,随着vblp-0.5-2浓度的提高,对dpph自由基、羟基自由基和超氧阴离子自由的清除作用逐步增加,并呈现剂量依赖效应,与维生素c相比,在一定的浓度范围内低于维生素c抗氧化活性。vblp-0.5-2对dpph自由基、羟基自由基和超氧阴离子自由的清除ic
50
值分别为0.53
±
0.003mg/ml、0.59
±
0.012mg/ml、0.54
±
0.002mg/ml,说明vblp-0.5-2具有较强的抗氧化作用。
[0066]
乌饭树叶多糖vblp-0.5-2在模拟体系的抗糖化作用:
[0067]
配制20mg/ml牛血清蛋白(bsa)溶液、0.5mol/l葡萄糖溶液(glucose,glu),按照体积比1:1混合过无菌滤膜,然后取3ml bsa-glu混合液,分别加入6ml磷酸缓冲溶液(0.2mol/l)及1ml不同浓度的vblp-0.5-2多糖溶液(0.2、0.4、0.6、0.8和1mg/ml),摇匀后避光37℃恒温分别孵育6d,以氨基胍(aminoguanidine,ag)代替样品做对照组,磷酸缓冲溶液代替样品做空白对照,测定ages在激发波长370nm,发射波长440nm处的荧光值,vblp-0.5-2多糖对ages的相对抑制率按下列公式计算:
[0068]
抑制率(%)=[f
c-(f
s-f
s1-f
s2
)]/fc×
100
[0069]
式中:f
c-空白组荧光值;f
s-样品组荧光值;f
s1-反应体系由缓冲溶液代替glu样品的荧光值;f
s2-反应体系由缓冲溶液代替bsa样品的荧光值。
[0070]
如附图10所示,vblp-0.5-2对bsa-glu体系中糖基化终末产物ages的抑制作用仅
稍低于氨基胍,表现出很强的抗糖基化能力。在测定范围内,vblp-0.5-2对ages相对抑制率呈线性增长,当vblp-0.5-2质量浓度达到1.0mg/ml时,抑制率达到(70.6
±
2.18)%,展示出良好的抑制效果。
[0071]
乌饭树叶多糖vblp-0.5-2在uht奶生产过程中的抗糖化作用:
[0072]
1.uht奶的制备,制备流程如图11所示。
[0073]
2.荧光性ages含量的测定
[0074]
将4mluht奶和8ml甲醇混匀后在-80℃的条件下保存1h,然后离心(10000r/min)30min,取0.3ml上清液,在λex/λem=340nm/465nm波长处测定荧光值。以磷酸盐缓冲溶液作为对照,每组样品重复3次。
[0075]
3.乌饭树叶多糖vblp-0.5-2对uht奶生产过程中荧光性ages的影响
[0076]
原料奶经过检验后过滤、冷却、贮存,然后加入0.3%的复配稳定剂(蔗糖脂肪酸酯和单甘油脂肪酸酯)和2%的蔗糖,充分混匀后,然后加入质量分数分别为4、6和8%的乌饭树叶多糖vblp-0.5-2,经过过滤均质,然后在137℃条件下进行uht杀菌,杀菌时间4s,然后取uht奶样品测定荧光性ages含量,以磷酸盐缓冲溶液代替乌饭树叶多糖vblp-0.5-2添加到uht奶作为对照组,每组样品重复3次。
[0077]
乌饭树叶多糖vblp-0.5-2对uht奶生产过程中荧光性ages的影响如表1所示,从表1可以看出,与对照组相比,随着乌饭树叶多糖vblp-0.5-2添加量的增加,uht奶中荧光性ages生成量显著减少(p<0.05或p<0.01)。乌饭树叶多糖vblp-0.5-2能够抑制uht奶生产过程中荧光性ages的生成,可能是因为vblp-0.5-2能够结合中间产物1,2-二羰基化合物,从而阻断由1,2-二羰基化合物介导生成ages的路径,另外可能是因为乌饭树叶多糖vblp-0.5-2具有抗氧化作用,从而通过抗氧化作用阻断由自由基引发的合成ages的路径。表1乌饭树叶多糖vblp-0.5-2对uht奶生产过程中荧光性ages的影响注:不同小写字母表示不同组别之间存在显著性差异(p<0.05或p<0.01)。
[0078]
以上结果综合表明,乌饭树叶多糖vblp-0.5-2具有明显的抗糖化作用,可以作为晚期糖基化末端产物抑制剂应用于uht奶的生产过程。
[0079]
上述实施例不以任何方式限制本发明,凡是采用等同替换或等效变换的方式获得的技术方案均落在本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1