一种副拟杆菌属菌株及其培养方法和应用
1.本发明属于肠道微生物技术领域,尤其一种副拟杆菌属菌株 f1-28及其培养方法和在制备治疗炎症性肠病的药物及保健食品中的应用。
背景技术:
2.炎症性肠病(ibd)是以慢性复发性非特异性组织炎症为特征的肠道炎症性疾病,主要临床表现为长期反复性发作的腹痛、腹泻、粘液脓血便(pmid: 29018271)。炎症性肠病包括溃疡性结直肠炎(uc)和克罗恩病(cd),目前全球范围内约有680万人炎症性肠病患者(pmid: 31648971)。炎症性肠病的发生发展与多种因素有关(pmid: 29018271;pmid: 32235316)。近年研究发现,肠道菌群紊乱可以引起或加剧炎症性肠病,因此,药物可以通过靶向肠道菌群,改善菌群紊乱达到治疗或缓解疾病的效果(pmid: 29285689;pmid: 32076145;pmid: 29285689)。活体生物药(live biotherapeutic products,lbps)作为一类肠道来源的“新一代益生菌”,在靶向调节肠道菌群紊乱治疗炎症性肠病方面展现出良好的应用前景(pmid: 28440276;pmid: 30014799)。前期研究发现,人体肠道来源的卵形拟杆菌(bacteroides ovatus)v975可以治疗葡聚糖硫酸钠引起的炎症性肠病(pmid: 19736360)。上述研究为进一步从肠道中挖掘开发新一代具有治疗炎症性肠病作用的益生菌奠定了基础。
3.副拟杆菌属(parabacteroides sp.)细菌是人体肠道内的重要共生菌,其多为严格厌氧的革兰氏阴性菌(pmid: 32071723)。前期研究发现,肠道来源的金氏副拟杆菌(parabacteroides goldsteinii)具有良好的抗炎作用,其可以治疗慢性阻塞性肺病和肥胖症(pmid: 33687943;pmid: 30007918)。此外,肠道来源的狄氏副拟杆菌(parabacteroides distasonis)可以降低小鼠的肠道炎症反应,具有良好的抗炎症性肠病作用(pmid: 32947881)。肠道来源副拟杆菌属细菌具有多种生物学功能,为进一步的活体生物药研究开发奠定了基础。然而,虽然目前关于肠道来源副拟杆菌属细菌的研究受到广泛关注,但是肠道内细菌种类丰富多样,是否存在其它具有特定生物学功能的副拟杆菌属细菌目前仍未可知。
技术实现要素:
4.本发明的提供一种副拟杆菌属菌株及其培养方法和应用,具体为副拟杆菌属菌株 f1-28(parabacteroidessp.f1-28)在制备治疗炎症性肠病的药物及保健食品中的应用,所述副拟杆菌属菌株 f1-28(parabacteroidessp.f1-28)具有良好的抗炎作用,为人体肠道细菌作为活体生物药及大健康功能食品的进一步研究开发提供了新思路。
5.本发明的技术方案如下:一种副拟杆菌属菌株,所述副拟杆菌属菌株为副拟杆菌属菌株 f1-28(parabacteroidessp.f1-28),该菌株源分离自人体粪便,该菌株保藏于中国典型培养物保藏中心,保藏编号为cctcc no:m 2022645。
6.上述的副拟杆菌属菌株的培养方法,包括以下步骤:1)将所述副拟杆菌属菌株 f1-28活化培养获得种子液;2)将步骤1)所述种子液接种至发酵培养基中进行厌氧发酵培养30~60h。
7.上述的一种副拟杆菌属菌株的培养方法,所述发酵培养基以水为溶剂,包括以下浓度的组分:褐藻胶6~10g/l、胰蛋白胨2~4g/l、蛋白胨2~4g/l、酵母提取物2~4g/l、粘液素0.4~0.6g/l、3号胆盐0.3~0.5g/l、l-半胱氨酸盐酸盐0.7~0.9g/l、血红素0.04~0.06g/l、吐温80 0.8~1.2ml/l、氯化钠4~5g/l、氯化钾2~3g/l、氯化镁4~5g/l、氯化钙0.1~0.3g/l、磷酸二氢钾0.3~0.5g/l和微量元素1~3ml/l,所述发酵培养基的ph值为6.4~6.5。
8.优选的,上述的一种副拟杆菌属菌株的培养方法,所述褐藻胶的分子量为80~120 kda。
9.优选的,上述的一种副拟杆菌属菌株的培养方法,步骤2)中所述种子液的接种量为1%~10%,v/v。
10.一种副拟杆菌属菌株在制备治疗炎症性肠病药物中的应用。
11.优选的,上述的一种副拟杆菌属菌株在制备治疗炎症性肠病药物中的应用,所述炎症性肠病由葡聚糖硫酸钠诱导产生。
12.优选的,上述的一种副拟杆菌属菌株在制备治疗炎症性肠病药物中的应用,所述治疗炎症性肠病药物的剂型为液体制剂或固体制剂,所述治疗炎症性肠病药物中副拟杆菌属菌株 f1-28的活菌浓度为(1~20)
×
10 7 cfu/ml或(1~100)
×
10 8 cfu/g。
13.一种副拟杆菌属菌株在制备保健食品中的应用。
14.优选的,上述的一种副拟杆菌属菌株在制备保健食品中的应用,副拟杆菌属菌株 f1-28在固态或液态食品中的活菌浓度为(1~20)
×
10 7 cfu/ml或(1~100)
×
10 8 cfu/g。
15.本发明的有益效果为:与现有技术相比,本发明具有以下有益效果:本发明提供的副拟杆菌属菌株 f1-28,该菌株能够避免结直肠黏膜的完整性受到破坏,并对已有的肠道粘膜损伤进行保护,进而改善便稀和便血情况,避免因结直肠损伤造成体重快速下降,最终实现对于炎症性肠病的治疗。
16.副拟杆菌属(parabacteroides sp.)细菌f1-28具有良好的抗炎作用,其可以通过保护结直肠黏膜免受破坏进而降低炎症性肠病小鼠的组织学及炎症评分,具有良好的治疗炎症性肠病的作用,为人体肠道细菌作为活体生物药及大健康功能食品的进一步研究开发提供了新思路。
附图说明
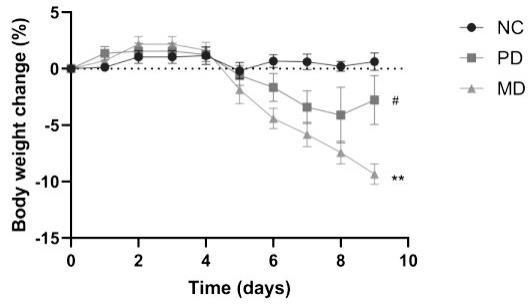
17.图1为小鼠体重变化率,nc:自然生长对照组;md:葡聚糖硫酸钠(dss)喂养疾病模型组;pd:副拟杆菌属(parabacteroides sp.)细菌f1-28灌胃治疗组,*表示与nc组相比有显著差异(p《0.05);**表示与nc组相比有极显著差异(p《0.01);#表示与md组相比有显著差异(p《0.05);##表示与md组相比有极显著差异(p《0.01);运用student t-test进行统计学检验,数据展示方式为mean
ꢀ±ꢀ
sem;图2为各组小鼠结直肠长度对比图,*表示与nc组相比有显著差异(p《0.05);**表示与nc组相比有极显著差异(p《0.01);#表示与md组相比有显著差异(p《0.05);##表示与md
组相比有极显著差异(p《0.01)。运用student t-test进行统计学检验,数据展示方式为mean
ꢀ±ꢀ
sem;图3为各组小鼠结直肠组织形态对比图;图4为各组小鼠疾病活动指数(disease activity index,dai)对比图,total:总评分;stool consistence:粪便粘稠度评分;occult/gross bleeding:隐匿性或总出血量评分;body weight:体重评分;*表示与nc组相比有显著差异(p《0.05);**表示与nc组相比有极显著差异(p《0.01);#表示与md组相比有显著差异(p《0.05);##表示与md组相比有极显著差异(p《0.01)。按照文献(pmid: 34973740)方法进行评分,运用student t-test进行统计学检验,数据展示方式为mean
ꢀ±ꢀ
sem;图5为各组小鼠结直肠he染色图,bar=100μm;图6为各组小鼠结直肠组织损伤评分图,*表示与nc组相比有显著差异(p《0.05);**表示与nc组相比有极显著差异(p《0.01);#表示与md组相比有显著差异(p《0.05);##表示与md组相比有极显著差异(p《0.01)。按照文献(pmid: 34973740)方法进行评分,运用student t-test进行统计学检验,数据展示方式为mean
ꢀ±ꢀ
sem;图7为各组小鼠结直肠组织的巨噬细胞(f4/80)和中性粒细胞(mpo)染色图,bar=50 μm。
具体实施方式
18.生物保藏说明本发明提供的副拟杆菌属菌株 f1-28,保藏编号:cctcc no:m 2022645;分类命名:副拟杆菌属;拉丁文学名:parabacteroides sp. f1-28;该菌株保藏于中国典型培养物保藏中心,保藏日期为2022年5月16日,保藏地址为湖北省武汉市武昌区八一路299号武汉大学校内,中国典型培养物保藏中心。
19.本发明中副拟杆菌属菌株 f1-28来源于人体粪便样本,16s rdna的序列如序列表所示。
20.副拟杆菌属菌株 f1-28的培养方法,包括以下步骤:1)将所述副拟杆菌属菌株 f1-28活化培养获得种子液;2)将所述种子液接种至发酵培养基中进行厌氧发酵培养30~60h。
21.在本发明中,将所述副拟杆菌属菌株 f1-28活化培养获得种子液,本发明对所述活化培养的方法没有特殊限定,采用本领域常规的活化方法即可。在本发明中,所述种子液为对数生长期的菌液。本发明在获得所述种子液后,将所述种子液接种至发酵培养基中进行厌氧发酵培养30~60h。在本发明中,所述厌氧发酵培养优选的在厌氧培养箱(co2: h2: n2=1: 1: 8)中进行,所述种子液的接种量优选为1%~10%(v/v),进一步优选为4%~6%,更进一步优选为5%。在本发明中,所述厌氧发酵培养的温度优选为36~38℃,进一步优选为37℃;所述厌氧发酵培养的时间优选为45~55h,进一步优选为48h。
22.上述的发酵培养基,以水为溶剂,优选的包括以下浓度的组分:褐藻胶6~10g/l、胰蛋白胨2~4g/l、蛋白胨2~4g/l、酵母提取物2~4g/l、粘液素0.4~0.6g/l、3号胆盐0.3~0.5g/l、l-半胱氨酸盐酸盐0.7~0.9g/l、血红素0.04~0.06g/l、吐温80 0.8~1.2ml/l、氯化钠4~5g/l、氯化钾2~3g/l、氯化镁4~5g/l、氯化钙0.1~0.3g/l、磷酸二氢钾0.3~0.5g/l、微量元素
1~3ml/l,进一步优选的包括以下浓度的组分:褐藻胶8g/l、胰蛋白胨3g/l、蛋白胨3g/l、酵母提取物3g/l、粘液素0.5g/l、3号胆盐0.4g/l、l-半胱氨酸盐酸盐0.8g/l、血红素0.05g/l、吐温801ml/l、氯化钠4.5g/l、氯化钾2.5g/l、氯化镁4.5g/l、氯化钙0.2g/l、磷酸二氢钾0.4g/l、微量元素2ml/l,所述发酵培养基的ph值优选为6.4~6.5。在本发明中,所述褐藻胶的分子量优选为80~120 kda,进一步优选为90~110 kda,更进一步优选为100kda。在本发明中,所述微量元素包括以下浓度的组分:mgso4·
7h2o 3.0 g/l、cacl2·
2h2o 0.1 g/l、mnc12·
4h2o 0.32 g/l、feso4·
7h2o 0.1 g/l、coso4·
7h2o 0.18 g/l、znso4·
7h2o 0.18 g/l、cuso4·
5h2o 0.01 g/l、nicl2·
6h2o 0.092 g/l。在本发明中,所述发酵培养基优选的置于厌氧培养瓶中充氮气灭菌后使用。
23.副拟杆菌属菌株 f1-28在制备治疗炎症性肠病的药物中的应用,该炎症性肠病为由葡聚糖硫酸钠诱导产生,所述炎症性肠病也包括由其它因素诱导产生,该药物剂型优选为液体制剂,所述副拟杆菌属菌株 f1-28的活菌浓度优选为(1~20)
×
10 7 cfu/ml。所述药物的溶剂优选为pbs溶液。在本发明中,所述药物优选的灌胃服用,所述药物的用量优选为(1~100)
×
10 8 cfu/kg。
24.副拟杆菌属菌株 f1-28在制备保健食品中的应用,本发明对所述保健食品的剂型没有特殊限定,采用本领域常规的保健食品剂型均可,例如固体制剂或液体制剂。在本发明中,当所述保健食品为固体菌剂时,所述保健食品通过将 副拟杆菌属菌株 f1-28的菌液冷冻干燥制备获得。在本发明中,所述保健食品还包括食品上可接受的辅料,本发明对所述辅料的种类和用量没有特殊限定。
25.下面结合具体的实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
26.实施例1副拟杆菌属菌株 f1-28的分离鉴定。
27.(1)培养基的配制配制vi液体培养基,具体成分如下:褐藻胶8 g/l、胰蛋白胨3 g/l、蛋白胨3 g/l、酵母提取物3 g/l、粘液素0.5 g/l、3号胆盐0.4 g/l、l-半胱氨酸盐酸盐0.8 g/l、血红素0.05 g/l、吐温80 1 ml/l、氯化钠 4.5 g/l、氯化钾 2.5 g/l、氯化镁 4.5 g/l、氯化钙 0.2 g/l、磷酸二氢钾 0.4 g/l、微量元素2 ml/l,溶剂为蒸馏水,ph值为6.4,将培养基灌注至特制厌氧小瓶,充入氮气后封口,高温灭菌。
28.(2)粪便的前处理取1名志愿者新鲜粪便,用pbs(ph=7.0)配成20%(wt/vol)的悬浮液,充分混匀,后用直径为2 mm的金属筛过滤,除去大的食物颗粒,得到粪便pbs溶液。
29.(3)接种培养所得粪便pbs溶液接种至高温灭菌后的厌氧小瓶中,37
ꢀ°
c,富集培养,24 h后采用10倍稀释涂布法涂布平板,涂布量为100 μl,平板为vi液体培养基加终浓度2 wt%琼脂。平板置于厌氧工作站37
ꢀ°
c培养72 h后,于厌氧工作站中挑取单菌落至厌氧小瓶液体培养基中进行传代培养和纯化。
30.(4)16s rdna序列分析dna的提取:将步骤(3)得到的菌株 f1-28采用德国qiagen公司粪便分析试剂盒
(cat no. 51604)提取dna。将所得的dna进行16s rdna全长扩增。具体扩增的实验条件和引物序列如下:引物序列:27f(5
’‑
cagagtttgatcctggct-3’),1492r(5
’‑
aggaggtgatccagccgca-3’)扩增体系:反应体系25 μl,dna模板l00 ng, 10
ꢀ×ꢀ
pcr buffer 2.5 μl, dntp mix (10mm )0.5 μl,10 μl上下游引物各0.5 μl,taq酶(5 u/μl)0.2 μl,加去离子水补足至25 μl。
31.扩增条件:预变性94
ꢀ°
c 保持5 min,循环94
ꢀ°
c 下35 s,55
ꢀ°
c下 35 s,72
ꢀ°
c 保持1 min,运行35个循环,延伸8 min。
32.pcr产物纯化后送至生工生物工程有限公司(上海,中国)进行dna测序,如seqid no. f1-28所示,将测序结果提交ncbi数据库中进行blast比对。比对结果显示该菌株与狄氏副拟杆菌(parabacteroides distasonis)atcc 8503菌株同源性较强,为96.80%。但是,该同源性数值小于97%,提示该菌株为副拟杆菌属(parabacteroides sp.)新种,故将菌株f1-28鉴定为副拟杆菌属新种 (parabacteroides sp.),命名为f1-28。序列为:gggctcggtaggacttccgcatgcaagtcgaggggcagcacagggtagcagtaccgggcggcgaccggcgcacgggtgagtaacgcgtatgcaacttacctatcagagggggataacccggcgaaagtcggactaataccgcatgaagcaggggccccgcatggggatatttgctaaagattcatcgctgatagataggcatgcgttccattaggcagttggcggggtaacggcccaccaaaccgacgatggataggggttctgagaggaaggtcccccacattggtactgagacacggaccaaactcctacgggaggcagcagtgaggaatattggtcaatgggcgtaagcctgaaccagccaagtcgcgtgagggatgaaggttctatggatcgtaaacctcttttataagggaataaagtgcgggacgtgtcccgttttgtatgtaccttatgaataaggatcggctaactccgtgccagcagccgcggtaatacggaggatccgagcgttatccggatttattgggtttaaagggtgcgtaggcggccttttaagtcagcggtgaaagtctgtggctcaaccatagaattgccgttgaaactggggggcttgagtatgtttgaggcaggcggaatgcgtggtgtagcggtgaaatgcttagatatcacgcagaaccccgattgcgaaggcagcctgccaagccatgactgacgctgatgcacgaaagcgtggggatcaaacaggattagataccctggtagtccacgcagtaaacgatgatcactagctgtttgcgatacacagtaagcggcacagcgaaagcgttaagtgatccacctggggagtacgccggcaacggtgaaactcaaaggaattgacgggggcccgcacaagcggaggaacatgtggtttaattcgatgatacgcgaggaaccttacccgggtttgaacgcattcggaccgaggtggaaacaccttttctagcaatagccgtttgcgaggtgctgcatggttgtcgtcagctcgtgccgtgaggtgtcggcttaagtgccataacgagcgcaacccttgccactagttactaacaggtaaagctgaggactctggtgggactgccagcgtaagctgcgaggaaggcggggatgacgtcaaatcagcacggcccttacatccggggcgacacacgtgttacaatggcgtggacaaagggaggccacctggcgacagggagcgaatccccaaaccacgtctcagttcggatcggagtctgcaacccgactccgtgaagctggattcgctagtaatcgcgcatcagccatggcgcggtgaatacgttcccgggccttgtacacaccgcccgtcaagccatgggagccgggggtacctgaagtccgtaacatggaagcatcgcactcccatagaagtttcccgccc实施例2副拟杆菌属菌株 f1-28在治疗炎症性肠病中的应用1、实验材料:实验动物36只c57bl/6小鼠(六周龄,雄性)购自维通利华实验动物科技有限公司(中国北京)(证书编号 scxk(京)2016-0011)。
33.实验主要设备:显微镜(奥林巴斯ckx41sf)。
34.实验菌株来源:按照实例1制备获得的 副拟杆菌属菌株 f1-28。
35.2、实验方法:(1)实验动物分组及模型建立将24只雄性c57bl/6小鼠随机分为3组,即正常对照组(nc,n=8)、模型对照组(md,n=8)和 副拟杆菌属菌株 f1-28给药组(pd,n=8)。
36.所有小鼠都饲养在温度为23℃的环境中,光照周期为 12 小时,昼夜交替,自由采食标准饲料和水。经过两周的适应期后,开始造模同时给药。其中nc组正常饮水+pbs(150 μl)灌胃8天;md组饮用2wt% 葡聚糖硫酸钠(dss)7天+pbs(150 μl)灌胃8天;pd组饮用2wt% 葡聚糖硫酸钠7天+灌胃150μl浓度为1.47
×
10
8 cfu/ml的 副拟杆菌属菌株 f1-28菌悬液8天。第9天,处死所有小鼠。
37.收集结直肠和盲肠用于进一步实验。md组小鼠体重降低百分百较其他组小鼠显著,肠切片的病理评分高于其他组,肠水肿程度也高于其他组则说明该模型建立成功。。
38.(2)病理组织学检查处死小鼠后,取下端结肠0.5cm,用4%多聚甲醛溶液固定。然后,石蜡包埋前用无水乙醇洗涤,5μm切片,苏木精伊红染色,以检查结肠上皮层的损伤情况。切片样品在显微镜(奥林巴斯ckx41sf)下观察。
39.3、实验结果与分析步骤1,每日称量小鼠体重,计算绘制体重变化图。结果如表1和图1所示。
40.表1 小鼠体重变化图组别体重变化率(%)显著性nc0.78
±
0.63 md-9.35
±
0.90**pd-2.77
±
2.18#nc组在实验期间体重相对稳定,md组小鼠在2wt%dss诱导的前4天,体重略有上升。第4天后,经dss诱导的各组小鼠体重呈现下降趋势,摄食量和饮水量降低,同时出现粪便变软,稀便甚至便血现象。停止dss诱导后,md组小鼠体重持续下降,最低下降约10%。nc组小鼠的体重变化率与md组小鼠的体重变化率相比具有显著差异(p《0.01)。与md组小鼠相比,pd组小鼠的体重下降趋势得到明显抑制。实验结束时,md组小鼠的体重变化率与pd组小鼠的体重变化率相比具有显著差异(p《0.05)。上述研究结果表明 副拟杆菌属菌株 f1-28可以显著延缓炎症性肠病小鼠的体重损失。而pd组小鼠的体重变化率与nc组小鼠的体重变化率相比没有明显区别(p》0.05),提示pd组小鼠的体重得到明显恢复,开始接近正常小鼠的生长状态。
41.步骤2,解剖小鼠后取整段盲肠与结直肠,进行拍照组合并测量其长度,并进行统计学分析。
42.表2 各组小鼠结直肠长度对比图组别结直肠长度(cm)显著性nc9.43
±
0.11 md7.81
±
0.27**
pd8.78
±
0.32#如图2、图3和表2所示,与nc组小鼠相比,md组小鼠的结直肠长度显著降低(p《0.01),提示炎症性肠病小鼠的结直肠受到严重损伤。与md组小鼠相比,pd组小鼠的结直肠长度显著增加(p《0.05),表明副拟杆菌属菌株f1-28治疗可以缓解炎症性肠病小鼠的结直肠损伤。步骤3,结合步骤1中的小鼠体重变化,以及每日观察检测的粪便硬度及便血情况,测定小鼠的疾病活动指数(diseaseactivityindex,dai)并绘制图像。
43.表3各组小鼠疾病活动指数(diseaseactivityindex,dai)对比
组别总评分显著性 隐匿性或总出血量评分显著性粪便粘稠度评分显著性体重评分显著性nc0.5
±
0.33 0 0.25
±
0.16 0.25
±
0.16 md7.75
±
0.88**2.5
±
0.63**2.88
±
0.30**2.38
±
0.18**pd2.88
±
1.20##0.75
±
0.37#1
±
0.46##1.13
±
0.48#
如图4和表3所示,nc组小鼠的dai保持在0-1左右,小鼠体重几乎未出现下降,并且粪便硬度正常,无便稀和便血情况。与nc组小鼠相比,md组小鼠的dai明显增加,其体重下降幅度较大,粪便较软,便稀便血情况严重,各项评分指标与nc组相比均存在极显著差异(p《0.01)。与md组小鼠相比,pd组小鼠体重下降趋势得到显著抑制,便稀便血状况得到有效改善,同时粪便开始逐渐成型,各项评分指标与md组相比均存在显著(p《0.05)或极显著差异(p《0.01)。上述研究结果表明副拟杆菌属菌株f1-28治疗可以显著改善dss引起的肠道损伤,缓解由炎症性肠病引起的各种疾病症状。
44.步骤4,取小鼠结直肠远端约0.5cm长度的肠组织固定在4%多聚甲醛溶液中。无水乙醇洗涤后进行石蜡包埋,将肠组织切片(5μm)后进行苏木精伊红(he)染色,在置于显微镜下观察并采集图像。
45.如图5所示,he染色结果表明,nc组小鼠具有正常的肠道组织结构,其结直肠部位隐窝清晰,肠道上皮细胞明显且完整。与nc组小鼠相比,md组炎症性肠病小鼠结直肠组织受到明显损伤,同时可见炎症性细胞浸润,杯状细胞缺失和隐窝损坏等现象。与md组小鼠相比,pd组小鼠结直肠肠道黏膜损伤得到明显修复,肠道组织完整性较好,无明显的炎症性细胞浸润或粘膜损坏现象。
46.步骤5,根据步骤4所得实验结果对小鼠的结直肠黏膜损伤进行评分。
47.表4各组小鼠结直肠组织损伤评分图组别结直肠组织损伤评分显著性nc0.14
±
0.14 md2.57
±
0.20**pd1.14
±
0.14##**
ꢀꢀꢀ
如图6和表4所示,nc组小鼠结直肠组织损伤评分较低(数值为0-0.5),说明小鼠结直肠组织几乎无损伤。与nc组小鼠相比,md组小鼠结直肠组织损伤严重,组织损伤评分(数值为2-3)显著升高(p《0.01)。与md组小鼠相比,pd组小鼠的结直肠组织损伤评分显著降低(p《0.01),评分数值在1左右,表明副拟杆菌属(parabacteroidessp.)细菌f1-28治疗可以显著降低小鼠结直肠组织损伤,保护肠黏膜表皮部位免受dss的破坏。
48.步骤6,将小鼠结直肠远端约0.5cm长度的结直肠组织,固定在4%多聚甲醛固定溶液中,石蜡包埋前用无水乙醇洗涤,将包埋在石蜡中的结直肠组织切片并放在盐渍化的载
玻片上。脱蜡和再水化后,用 dapi 和针对f4/80以及mpo的荧光标记抗体进行染色。实验流程:异源双标:(1)石蜡切片脱蜡至水(2)抗原修复:将组织切片放于盛满edta的抗原修复缓冲液(ph=8.0)中进行抗原修复。(3)画圈:切片稍甩干后用组化笔在组织周围画圈。(4)血清封闭:在圈内滴加bsa孵育30min。(5)加一抗:轻轻甩掉封闭液,在切片上滴加pbs按一定比例配好的一抗,两种一抗按一定的稀释比例混合,滴加到组织上,切片平放于湿盒内4
°
c孵育过夜(湿盒内加少量水防止抗体蒸发)。(6)加二抗:玻片置于pbs (ph=7.4)中在脱色摇床上晃动洗涤3次,每次5min,切片稍甩干后在圈内滴加与一抗相应种属标记的按一定比例配好的二抗覆盖组织,室温孵育50min(两种二抗,按照1:300的比例混合孵育)。(7)dapi复染细胞核:切片稍甩干后在圈内滴加dapi染液,避光室温孵育10min。(8)自发范光淬灭:切片稍用干后,在黑内加加入自发荧光淬灭剂5min,流水冲洗10min。(9)封片:玻片置干pbs (ph=7.4)中在脱色摇床上晃动洗涤3次,每次5min。切片稍甩干后用抗荧光淬灭封片剂封片。(10)镜检拍照:切片詈干扫描仪下采集图像。dapi染出来的细胞核在紫外的激发下为蓝色,阳性表达为相应荧光素标记的红光(cy5,标记中性粒细胞的mpo),绿光(cy3,标记巨噬细胞的f4/80)。dapi和抗体均购自中国武汉赛维生物科技有限公司,正置荧光显微镜购自日本尼康(nikon eclipse c1),成像系统日本尼康(nikon ds-u3)。
49.如图7所示,nc组结直肠组织染色正常,未见明显的炎症细胞浸润现象。与nc组相比,md组小鼠结直肠部位肠道黏膜损伤严重,可见明显的炎症细胞包括巨噬细胞和中性粒细胞浸润现象。与md组小鼠相比,pd组小鼠结直肠部位肠道黏膜损伤得到有效缓解,同时粘膜炎症的两个生物标志物巨噬细胞和中性粒细胞对粘膜的浸润也明显减少。上述研究结果表明 副拟杆菌属菌株 f1-28治疗可以显著降低炎症性肠病小鼠的结直肠炎症反应,降低炎症细胞的浸润,缓解肠黏膜损伤。
50.与正常组小鼠相比,本研究中炎症性肠病模型小鼠体重和结直肠长度显著降低,结直肠组织的正常形态受到破坏且黏膜损伤严重,并伴随大量炎症性细胞的浸润和便稀便血现象。给予 副拟杆菌属菌株 f1-28治疗后,小鼠体重和结直肠长度的降低得到明显逆转,便稀便血现象得到显著改善,同时小鼠肠黏膜完整性增加,炎症性细胞的浸润降低,并且与炎症性肠病相关的各项疾病评分均得到有效改善。综上所述, 副拟杆菌属菌株 f1-28具有良好的治疗炎症性肠病的作用,其能够通过多种方式降低炎症性肠病小鼠的结直肠炎症反应,保护结直肠黏膜免受损伤,最终实现对炎症性肠病的治疗作用。
51.序列表《110》 中国海洋大学《120》 一种副拟杆菌属菌株及其培养方法和应用《160》 1《170》 siposequencelisting 1.0《210》 1《211》 1438《212》 dna《213》 副拟杆菌属菌株 f1-28(parabacteroides sp. f1-28)《400》 1gggctcggta ggacttccgc atgcaagtcg aggggcagca cagggtagca gtaccgggcg
ꢀꢀꢀꢀꢀꢀꢀ
60gcgaccggcg cacgggtgag taacgcgtat gcaacttacc tatcagaggg ggataacccg
ꢀꢀꢀꢀꢀꢀꢀ
120gcgaaagtcg gactaatacc gcatgaagca ggggccccgc atggggatat ttgctaaaga
ꢀꢀꢀꢀꢀꢀꢀ
180ttcatcgctg atagataggc atgcgttcca ttaggcagtt ggcggggtaa cggcccacca
ꢀꢀꢀꢀꢀꢀꢀ
240aaccgacgat ggataggggt tctgagagga aggtccccca cattggtact gagacacgga
ꢀꢀꢀꢀꢀꢀꢀ
300ccaaactcct acgggaggca gcagtgagga atattggtca atgggcgtaa gcctgaacca
ꢀꢀꢀꢀꢀꢀꢀ
360
gccaagtcgc gtgagggatg aaggttctat ggatcgtaaa cctcttttat aagggaataa
ꢀꢀꢀꢀꢀꢀꢀ
420agtgcgggac gtgtcccgtt ttgtatgtac cttatgaata aggatcggct aactccgtgc
ꢀꢀꢀꢀꢀꢀꢀ
480cagcagccgc ggtaatacgg aggatccgag cgttatccgg atttattggg tttaaagggt
ꢀꢀꢀꢀꢀꢀꢀ
540gcgtaggcgg ccttttaagt cagcggtgaa agtctgtggc tcaaccatag aattgccgtt
ꢀꢀꢀꢀꢀꢀꢀ
600gaaactgggg ggcttgagta tgtttgaggc aggcggaatg cgtggtgtag cggtgaaatg
ꢀꢀꢀꢀꢀꢀꢀ
660cttagatatc acgcagaacc ccgattgcga aggcagcctg ccaagccatg actgacgctg
ꢀꢀꢀꢀꢀꢀꢀ
720atgcacgaaa gcgtggggat caaacaggat tagataccct ggtagtccac gcagtaaacg
ꢀꢀꢀꢀꢀꢀꢀ
780atgatcacta gctgtttgcg atacacagta agcggcacag cgaaagcgtt aagtgatcca
ꢀꢀꢀꢀꢀꢀꢀ
840cctggggagt acgccggcaa cggtgaaact caaaggaatt gacgggggcc cgcacaagcg
ꢀꢀꢀꢀꢀꢀꢀ
900gaggaacatg tggtttaatt cgatgatacg cgaggaacct tacccgggtt tgaacgcatt
ꢀꢀꢀꢀꢀꢀꢀ
960cggaccgagg tggaaacacc ttttctagca atagccgttt gcgaggtgct gcatggttgt
ꢀꢀꢀꢀꢀꢀ
1020cgtcagctcg tgccgtgagg tgtcggctta agtgccataa cgagcgcaac ccttgccact
ꢀꢀꢀꢀꢀꢀ
1080agttactaac aggtaaagct gaggactctg gtgggactgc cagcgtaagc tgcgaggaag
ꢀꢀꢀꢀꢀꢀ
1140gcggggatga cgtcaaatca gcacggccct tacatccggg gcgacacacg tgttacaatg
ꢀꢀꢀꢀꢀꢀ
1200gcgtggacaa agggaggcca cctggcgaca gggagcgaat ccccaaacca cgtctcagtt
ꢀꢀꢀꢀꢀꢀ
1260cggatcggag tctgcaaccc gactccgtga agctggattc gctagtaatc gcgcatcagc
ꢀꢀꢀꢀꢀꢀ
1320catggcgcgg tgaatacgtt cccgggcctt gtacacaccg cccgtcaagc catgggagcc
ꢀꢀꢀꢀꢀꢀ
1380gggggtacct gaagtccgta acatggaagc atcgcactcc catagaagtt tcccgccc
ꢀꢀꢀꢀꢀꢀꢀꢀ
1438
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1