基于PEDVORF3重组蛋白制备的多克隆抗体及建立的间接ELISA检测方法
基于pedv orf3重组蛋白制备的多克隆抗体及建立的间接elisa检测方法
技术领域
1.本发明属于动物抗体技术领域,尤其涉及一种基于pedv orf3重组蛋白制备的多克隆抗体及建立的间接elisa检测方法。
背景技术:
2.由猪流行性腹泻病毒(porcine epidemic diarrhea virus,pedv)引起的猪流行性腹泻(porcine epidemic diarrhea,ped)是对各个年龄阶段的猪都会产生影响的猪肠道疾病。该病以急性、高传染性和接触性为主要特征,感染该病的猪会出现呕吐、带水样腹泻、脱水及食欲不振等临床症状,发病率接近100%,死亡率超过50%,给我国生猪养殖行业造成巨大危害,带来了比较严重的经济损失。
3.临床上在对pedv血清样品进行检测时,酶联免疫吸附试验(enzyme linked immunosorbent assay,elisa)是较为常用的诊断方法之一。该技术利用抗原抗体特异性结合与酶的特异性,可以快速对大批量样品进行检测,操作简单,适用于基层及实验室的检测。目前,基于pedv s、m、n蛋白的elisa检测方法均有报道,已较为成熟,但基于orf3蛋白的elisa检测方法相对较少。
4.orf3基因位于pedv基因组s与e基因之间,约675bp,编码225aa。编码的orf3蛋白包含4个跨膜结构域,通常以四聚体的形式存在,形成离子通道来促进病毒释放到细胞外,多个跨膜结构域的存在也使得难以对orf3蛋白进行原核表达,需要进行改造,减少其跨膜结构域,最终实现orf3蛋白的原核表达。
技术实现要素:
5.本发明要解决的技术问题是提供一种基于pedv orf3重组蛋白制备的多克隆抗体及建立的间接elisa检测方法,改造后的重组蛋白不包含跨膜结构域,据此制备的抗体具有较高的抗体效价以及较好的特异性,构建的间接elisa检测方法特异性强、重复性好、灵敏度高。
6.为解决上述技术问题,本发明采用以下技术方案:
7.pedv orf3重组蛋白,由序列表seq.id.no.1的基因碱基序列编码或者具有seq.id.no.2的氨基酸序列。
8.上述pedv orf3重组蛋白的制备方法,按以下步骤进行:
9.《1》改造基因的扩增与重组表达载体的构建
10.以17gxcz-1orf3d为模板通过两对特异性引物扩增出改造后的orf3重组基因片段,并连接至pmd18t;将获得的目的片段与原核表达载体pet32a分别进行双酶切,回收纯化后通过t4连接酶进行构建,获得重组表达载体pet32a-orf3;将获得的表达载体转化至dh-5α感受态细胞中,挑选单一菌落进行质粒的提取,并对重组质粒进行双酶切鉴定以验证是否重组成功;
11.《2》重组质粒的诱导表达及验证
12.将验证成功的重组质粒pet32a-orf3转化至bl21感受态细胞中,挑选单一菌落在lb(amp+)中进行菌液的培养,同时转化pet32a空载质粒作为对照,收集菌体进行超声破碎,通过sds-page来检测orf3重组蛋白的表达情况。
13.上述pedv orf3重组蛋白的制备方法,按以下操作进行:
14.病毒cdna的获取:反转录总体系为25μl,其中oligo dt 1μl、5
×
buffer 5μl、dntp mix 2μl、反转录酶0.5μl、rnasin 0.5μl、rna 16μl;反转录程序为42℃ 1h;
15.目的片段a的扩增:pcr反应总体系为50μl,其中2
×
taq master mix 25μl、orf3-1f与orf3-2r各1μl、ddh2o 17μl、cdna 6μl,程序为95℃ 2min;95℃ 15s,55℃ 30s,72℃ 30s,共35个循环;72℃ 10min,4℃保存;
16.目的片段b的扩增:pcr反应总体系为50μl,其中2
×
taq master mix 25μl、orf3-1r与orf3-2f各1μl、ddh2o 17μl、cdna 6μl;程序与扩增片段a程序相同;
17.改造基因的扩增:分别对目的片段a和b进行胶回收,获得胶回收产物a和b,用引物orf3-1f与orf3-1r对混合的胶回收产物a和b进行扩增,获得改造基因片段;pcr反应总体系为50μl,其中2
×
taq master mix 25μl、orf3-1f与orf3-1r各1μl、ddh2o 17μl、胶回收产物a 3μl、胶回收产物b 3μl;程序与上述程序相同,获得改造基因;其中,所用的特异性引物分别具有序列表中seq.id.no.3至6的碱基序列;
18.t4连接酶的总体系为10μl,其中t4 dna连接酶1μl、双酶切重组质粒pmd18t-orf3反应液回收产物7μl、双酶切空载质粒pet32a反应液回收产物1μl、t4 dna连接酶buffer 1μl,16℃金属浴中连接16h;
19.对重组质粒进行诱导表达:取2ml培养好的菌液加入200ml lb(amp+)中,37℃水平摇床进行扩增,待菌液d
562nm
值为0.6时,加入iptg 240μl在16℃水平摇床诱导16h。
20.上述pedv orf3重组蛋白的兔多克隆抗体。
21.上述兔多克隆抗体的制备方法,使用上述pedv orf3重组蛋白与弗氏佐剂乳化后免疫兔子获得多克隆抗体血清。
22.上述兔多克隆抗体的制备方法,按以下步骤进行:选取一只重约2kg的新西兰大白兔,首次免疫将pedv orf3重组蛋白1mg与等体积的弗氏完全佐剂充分乳化,首次免疫后第14天、21天、28天和35天分别进行加强免疫,加强免疫改用pedv orf3重组蛋白0.5mg与等体积弗氏不完全佐剂充分乳化,免疫完成后第七天进行心脏采血,分离血清备用。
23.基于pedv orf3重组蛋白间接elisa抗体检测试剂盒,包括包被酶标板,包被酶标板以上述pedv orf3重组蛋白作为包被抗原。
24.上述间接elisa抗体检测试剂盒,还包括阳性血清、阴性血清,hrp-兔抗猪igg,包被液、洗涤液、封闭液、显色液和终止液。
25.非诊断目的的基于pedv orf3重组蛋白间接elisa检测方法,其特征在于按以下步骤进行:
26.包被:将pedv orf3重组蛋白作为抗原包被在酶标板上,包被结束后用洗涤液清洗未结合蛋白与杂质;
27.封闭:加入封闭液,封闭完成后弃掉封闭液,并用洗涤液清洗掉杂质;
28.检样:加入待检样品,孵育完成后弃液,用洗涤液进行清洗;
29.加入酶标抗体:加入hrp-兔抗猪igg,孵育完成后弃液,用洗涤液进行清洗;
30.终止:加入显色剂,避光显色后加入终止液,使用酶标仪测定d
450nm
值。
31.上述间接elisa检测方法,包被中每孔加入pedv orf3重组蛋白的量为100ng,包被条件为37℃,1h;封闭中封闭液为1%bsa,每孔加入100μl,封闭时间为2h;加入酶标抗体中酶标抗体稀释度为1:1 000,每孔加入100μl,孵育条件为37℃,40min;检样和加入酶标抗体中孵育时间均为40min;显色时间为15min。
32.由于pedv orf3蛋白为跨膜的离子通道蛋白,难以在体外进行原核表达。发明人通过对其进行分析和改造,获得了一种pedv orf3重组蛋白,由序列表seq.id.no.1的基因碱基序列编码或者具有seq.id.no.2的氨基酸序列。设计的orf3重组基因可以正常编码蛋白,且所编码的蛋白没有跨膜结构域。研究表明,本发明重组pedv orf3重组蛋白具有较好的抗原性与免疫原性,基于该蛋白制备的抗体具有较高的抗体效价以及较好的特异性。据此,发明人还建立了相应间接elisa检测方法,该法具有特异性强、重复性好、灵敏度高等特点,可准确鉴别出pedv,同时具备简单、快速、经济实惠等优点且结果准确等优点,为ped的诊断提供一种新的选择和可靠方法,也为监测pedv对猪群的感染提供技术支持。临床应用前景较好。
附图说明
33.图1是orf3蛋白核苷酸序列对比图。
34.图2是orf3蛋白跨膜结构域预测图,图中:a:17gxcz-1orf3c orf3蛋白跨膜域;b:17gxcz-1orf3d orf3蛋白跨膜域;c:重组pet32a-orf3蛋白跨膜域。
35.图3是orf3重组基因扩增pcr鉴定结果图,图中:m.dna标准dl 2 000;a.重组orf3基因前段;b.重组orf3基因后段;c.重组orf3基因全长。
36.图4是orf3重组基因酶切鉴定结果图,图中:m1.dna标准dl 5 000;m2.dna标准dl 2 000;1.重组orf3基因(288bp);2.pet32a空载质粒(5 900bp)。
37.图5是orf3蛋白可溶性分析图,图中:m.蛋白mark(14~100kda);1.空载对照;2.orf3重组蛋白诱导上清样品;3.orf3重组蛋白诱导沉淀样品。
38.图6是orf3蛋白纯化结果图,图中:m.蛋白mark(14~100kda);1~5.纯化的orf3重组蛋白样品;6.空载对照。
39.图7是westren-blot验证结果图,图中:m1.蛋白mark(10~180kda);1.orf3重组蛋白wb验证。
40.图8是多克隆抗体的wb验证结果图,图中:m2.蛋白mark(14~100kda);1.兔多克隆抗体wb验证。
41.图9是多克隆抗体的ifa验证结果图。
42.图10是多克隆抗体效价的测定结果图。
43.图11是间接elisa方法的特异性试验结果图。
44.图12是间接elisa方法的敏感性试验结果图。
具体实施方式
45.以下实施例所用实验材料如下:
46.《1》毒株、质粒与血清样品
47.pedv orf3基因完整株17gxcz-1orf3c(ncbi登录号:mt547180.1)和pedv orf3基因截短株17gxcz-1orf3d(ncbi登录号:mt547179.1)均由申请人实验室保存,已发表至《genetic diversity of porcine epidemic diarrhea virus with a naturally occurring truncated orf3 gene found in guangxi,china》一文。
48.pet32a空载质粒购买于赛默飞世尔科技(中国)有限公司。
49.待检测的1129份血清样品来自2019~2021年广西不同地区24个规模化猪场。
50.猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,prrsv)、猪δ冠状病毒(porcine deltacorona virus,pdcov)、猪轮状病毒(porcine rotavirus,porv)、伪狂犬病毒(pseudorabies virus,prv)、猪肠病毒g型(procine enterovirus g,evg)、猪瘟病毒(classic swine fever virus,csfv)、口蹄疫病毒(foot-and-mouth disease virus,fmdv)、猪圆环病毒2型(porcine circovirus 2,pcv-2)、非洲猪瘟病毒(african swine fever virus,asfv)的阳性血清样品由申请人实验室保存。
51.《2》主要实验器材
52.scientz-iie系列触摸式超声波细胞粉碎仪购自宁波新芝生物科技股份有限公司;floid
tm
细胞成像工作站购买于赛默飞世尔科技(中国)有限公司;酶标仪购买于博美生物科技有限公司。
53.《3》实验试剂
54.内切酶bamh
ꢀⅰ
与xho
ꢀⅰ
购自诺唯赞生物科技股份有限公司;his-tag抗体(小鼠单抗)和辣根过氧化物酶标记山羊抗鼠igg(h+l)购自碧云天生物技术有限公司;酶标板购自莱恩生物科技有限公司;羊抗兔igg-fitc、羊抗兔igg-hrp、羊抗猪igg-hrp、4',6-联脒-2-苯基吲哚二盐酸盐(dapi)、包被液、终止液均购自北京索莱宝科技有限公司;pedv抗体检测试剂盒购自加拿大biovet inc.公司。
55.实施例1本发明重组pedv orf3重组蛋白的制备
56.一、实验方法
57.1.1重组质粒pet32a-orf3的构建
58.1.1.1序列分析与改造
59.pedv orf3蛋白为跨膜蛋白,难以对其进行原核表达,因此通过使用在线分析软件(http://www.detaibio.com/tools/transmembrane.html)对pedv广西株17gxcz-1orf3c与17gxcz-1orf3d的orf3蛋白的氨基酸序列进行跨膜结构域分析,并依据分析结果对17gxcz-1orf3d orf3蛋白的核苷酸序列进行改造,使得所设计的重组orf3蛋白核苷酸序列可以正常编码蛋白,且所编码的蛋白没有跨膜结构域。
60.1.1.2引物合成
61.参考17gxcz-1orf3d核苷酸序列,针对两相同部分的序列分别设计引物如下,分别对应序列表seq.id.no.3~seq.id.no.6的碱基序列。
62.orf3-1f,5'-cgcggatccatgtttcttggactttttcaataca-3'(下划线部为内切酶bamh
ꢀⅰ
的酶切位点);
63.orf3-2r,5'-gctcaacagtaaagaagtaaataaaaacactggtgaaaa-3';
64.orf3-2f,5'-acttctttactgttgagcttcttgatggcaaga-3';
65.orf3-1r,5'-ccgctcgagttcactaattgtagcatactcgtct-3'(下划线部分为内切酶xho
ꢀⅰ
的酶切位点)。
66.1.1.3目的片段的扩增
67.按照axy prep body fluid viral dna miniprep mix的方法对17gxcz-1orf3c进行病毒总rna的提取,并将rna反转录为cdna,分别用引物orf3-1f与orf3-2r和引物orf3-2f和orf3-1r对所获得的cdna进行扩增,获得扩增产物片段a和片段b。pcr反应体系为:2
×
taq master mix 25μl、orf3-1f与orf3-2r各1μl、ddh2o 17μl、cdna 6μl,总体系50μl。反应程序如下:95℃ 2min;95℃ 15s,55℃ 30s,72℃ 30s,共35个循环;72℃ 10min,4℃保存。
68.分别对片段a和b进行胶回收,获得胶回收产物a和b。用引物orf3-1f与orf3-1r对混合的胶回收产物a和b进行扩增,获得目的片段。pcr反应体系为:2
×
taq master mix 25μl、orf3-1f与orf3-1r各1μl、ddh2o 17μl、胶回收产物a 3μl和胶回收产物b 3μl,总体系50μl,程序同上。
69.1.1.4重组质粒的构建
70.将所获得的目的片段进行胶回收,克隆至pmd-18t载体上,抽提质粒送至广州华大基因科技有限公司进行测序。用内切酶bamh
ꢀⅰ
和xho
ꢀⅰ
分别将空载质粒pet32a和测序正确的重组质粒pmd18t-orf3在37℃恒温水浴锅中双酶切16h,双酶切体系为:重组(空载)质粒33μl、内切酶bamh
ꢀⅰꢀ
7μl、内切酶xho
ꢀⅰꢀ
7μl、10
×
buffer 10μl、ddh2o 43μl,总体系100μl。
71.使用omega cycle-pure kit(100)对双酶切产物进行反应液回收,用t4 dna连接酶在16℃金属浴中连接16h,连接体系为:t4 dna连接酶1μl、双酶切重组质粒pmd18t-orf3反应液回收产物7μl、双酶切空载质粒pet32a反应液回收产物1μl、t4 dna连接酶buffer 1μl,总体系10μl。将连接产物转化至dh-5α感受态细胞中,涂在la平板进行过夜培养,再将单个菌落挑至lb培养液中过夜培养,抽提质粒。双酶切鉴定,体系为:重组pet32a-orf3质粒5μl、内切酶bamh
ꢀⅰꢀ
0.3μl、内切酶xho
ꢀⅰꢀ
0.3μl、10
×
buffer 1μl、ddh2o 3.4μl,总体系10μl。最后送至广州华大基因科技有限公司进行测序,通过在线分析软件对重组的orf3蛋白的氨基酸序列进行跨膜结构域分析。
72.1.2 pet32a-orf3蛋白的原核表达与纯化
73.1.2.1 pet32a-orf3重组质粒的原核表达与表达形式的鉴定
74.将双酶切和测序结果均正确的重组质粒pet32a-orf3转化至bl21感受态细胞中并涂板挑斑培养。取培养好的菌液加入200ml lb中,37℃水平摇床进行扩增,待扩增的菌液d
562nm
为0.6时,加入iptg 240μl继续在16℃水平摇床诱导16h。诱导结束后,4℃8 000转离心15min,弃去上清,收集菌体沉淀,用pbs洗涤3次后,再用10ml的pbs重悬菌体,然后放于冰上进行超声波破碎裂解。超声功率400w,工作3s,休息5s,总时间2min,3个循环,将菌液冰浴5min后继续,如此反复直至菌体澄清透明为止。将破碎完全的破碎液4℃ 8 000转离心15min,上清倒入10ml离心管中,沉淀用10ml的pbs重悬,取40μl上清和沉淀样品至离心管中,加入10μl 2
×
sds loading buffer,100℃煮10min,进行sds-page电泳鉴定。
75.1.2.2 pet32a-orf3重组蛋白的纯化及western-blotting验证
76.采用his-tagged protein purification kit对上述沉淀样品进行纯化,纯化结束后对样品进行sds-page电泳。取纯化后的蛋白进行sds-page电泳,电泳结束后对蛋白进行免疫印迹(western-blotting,wb)验证,具体操作步骤如下:将pvdf膜置于甲醇溶液中浸
泡5min,将滤纸、pvdf膜与凝胶在膜转移缓冲液中浸泡10min,放在转膜仪中;设置转膜仪电流为5v,30ma恒定电流,转膜时间为1h;用洗涤液洗涤三次,每次5min,5%脱脂奶粉37℃水平摇床封闭2h;用洗涤液洗涤三次,每次5min,一抗(his-tag小鼠单抗)4℃孵育16h;用洗涤液洗涤三次,每次5min,二抗(辣根过氧化物酶标记山羊抗鼠igg)37℃孵育1h;用洗涤液洗涤三次,每次5min,显色液,避光显色30s,在蛋白成像分析仪中观察结果。
77.二、实验结果
78.2.1改造的orf3重组蛋白的跨膜结构域分析
79.对17gxcz-1orf3c株、17gxcz-1orf3d株以及改造的orf3蛋白的核苷酸序列进行对比,结果如图1所示,并对其氨基酸序列进行跨膜域预测分析,结果如图2所示,17gxcz-1orf3c株(图2-a)的orf3蛋白存在5个跨膜域,17gxcz-1orf3d株(图2-b)的orf3蛋白存在1个跨膜域,影响对其进行正常的原核表达。改造后的orf3重组蛋白(图2-c)不存在跨膜域,同时可以正常的编码翻译,为重组蛋白的成功表达奠定基础。
80.2.2目的片段的扩增结果
81.用引物orf3-1f与orf3-2r扩增出orf3重组基因的前段(图3片段a),大小为190bp;用引物orf3-2f和orf3-1r扩增出orf3重组基因的后段(图3片段b),大小为134bp;对片段a和b进行胶回收,用引物orf3-1f与orf3-1r对混合的胶回收产物a和b进行扩增,获得orf3重组基因(图3片段c),大小为288bp。结果显示,三个片段均在目的大小附近有清晰的条带。
82.2.3重组质粒pet32a-orf3的鉴定
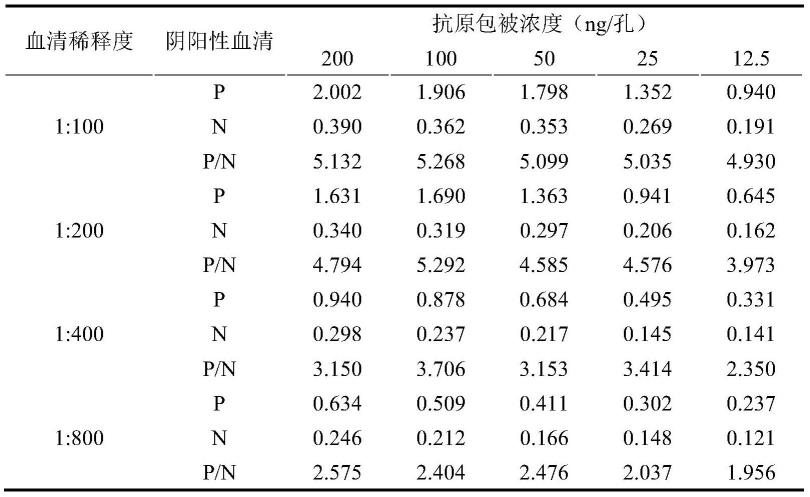
83.使用内切酶bamh
ꢀⅰ
和xho
ꢀⅰ
对pet-32a-orf3重组质粒进行鉴定(图4),目的片段大小为288bp,在目的片段附近有清晰的条带。
84.2.4 pet32a-orf3重组蛋白表达形式的鉴定
85.对获得的蛋白样品进行超声破碎后进行sds-page电泳,结果显示(图5)空载对照于20.4kda处有清晰的条带,orf3重组蛋白诱导上清样品无特异性条带,orf3重组蛋白诱导沉淀样品于29.5kda附近有清晰的条带,证明重组orf3蛋白以包涵体形式进行了表达。
86.2.5 pet32a-orf3重组蛋白表达形式的鉴定
87.使用his-tagged protein purification kit对以包涵体形式表达的pet32a-orf3重组蛋白进行纯化。纯化后的样品使用sds-page电泳进行鉴定,结果显示(图6),空载对照在20.4kda处有明显的条带,对照成立;样品在29.5kda处有明显的条带,条带单一清晰且浓厚,没有明显的杂带。
88.2.6 pet32a-orf3重组蛋白western-blotting验证
89.对纯化后的蛋白进行wb验证,以his-tag抗体(小鼠单抗)为一抗,辣根过氧化物酶标记山羊抗鼠igg(h+l)为二抗,结果显示(图7)。目的片段大小为29.5kda,在目的片段处有一清晰的条带,验证结果表明纯化后的pet32a-orf3重组蛋白可以很好地与his标签进行特异性结合。
90.实施例2本发明抗改造的pedv orf3重组蛋白兔多克隆抗体的制备及应用
91.一、实验方法
92.1.1抗改造的orf3重组蛋白多克隆抗体的制备
93.对一只重2.1kg的新西兰大白兔进行耳缘静脉采血2ml,析出血清作为阴性对照。首次免疫将重组蛋白1mg与等体积的弗氏完全佐剂充分乳化,首次免疫后第14天、21天、28
天和35天分别进行加强免疫,加强免疫改用重组蛋白0.5mg与等体积弗氏不完全佐剂充分乳化,免疫完成后第七天进行心脏采血,分离血清,-20℃冰箱备用。
94.1.2多克隆抗体的wb验证
95.对重组orf3重组蛋白进行sds-page电泳,同时将pvdf膜置于甲醇溶液中浸泡5min,将滤纸、pvdf膜与凝胶在膜转移缓冲液中浸泡10min,放在转膜仪中1h;用洗涤液洗涤三次,每次5min,5%脱脂奶粉37℃水平摇床封闭2h;用洗涤液洗涤三次,每次5min,一抗(制备的兔多克隆抗体)4℃孵育16h;用洗涤液洗涤三次,每次5min,二抗(羊抗兔igg-hrp)37℃孵育1h;用洗涤液洗涤三次,每次5min,显色液,避光显色30s,在蛋白成像分析仪中观察结果。
96.1.3兔抗orf3重组蛋白多克隆抗体间接免疫荧光试验
97.对制备的兔抗orf3重组蛋白多克隆抗体进行间接免疫荧光试验(immunofluorescence assay,ifa),来验证抗体是否能与抗原结合,具体操作步骤如下:将vero细胞接种于96孔细胞培养板37℃培养箱进行培养;将pedv 17gxcz-1orf3c与17gxcz-1orf3d病毒液分别进行10倍稀释,稀释至10-6
;待细胞涨至80%左右时,进行接毒,最后两排只加培养基作为阴性对照,置于37℃培养箱培养36h;出现明显细胞病变后,用100μl dpbs-t润洗细胞3次,每次5min,用100μl-20℃预冷的冰甲醇固定细胞,-20℃冰箱固定30min;弃掉冰甲醇,用100μl dpbs-t润洗细胞3次,每次5min,每孔加100μl 1%bsa,室温封闭1h;弃掉1%bsa,用100μl dpbs-t润洗细胞3次,每次5min,每孔加1:100稀释的一抗(兔抗orf3蛋白多克隆抗体)100μl,4℃孵育16h;弃掉一抗,用100μl dpbs-t润洗细胞3次,每次5min,每孔加1:100稀释后的二抗(fitc山羊抗兔igg)100μl,37℃避光孵育1h;弃掉二抗,用100μl dpbs-t润洗细胞3次,每次5min,每孔加dapi 100μl,37℃避光孵育15min;弃掉dapi,用100μl dpbs-t润洗细胞3次,每次5min,每孔加dpbs-t 50μl润着,避光置于荧光显微镜下观察结果。
98.1.4间接elisa方法检测多克隆抗体效价
99.使用优化过的间接elisa方法对制备的兔抗orf3多克隆抗体进行抗体效价的测定,具体操作步骤如下:使用蛋白包被液将测定浓度的重组蛋白pet32a-orf3进行稀释,使用elisa酶标板以200ng/孔的蛋白浓度4℃放置16h进行包被;弃包被液,使用pbst洗涤3次,每次洗涤5min,每孔加入100μl 1%含牛血清蛋白(bovine serum albumin,bsa),37℃封闭2h;弃封闭液,使用pbst洗涤3次,每次洗涤5min,每孔加入100μl不同稀释度(1:500、1:1 000、1:2 000、1:4 000、1:8 000、1:16 000、1:32 000、1:64 000、1:128 000、1:256 000、1:512 000、1:1 024 000、1:2 048 000)的兔抗orf3多克隆抗体,同时设置同等稀释倍数的兔阴性血清作为对照,37℃孵育1h;弃一抗,使用pbst洗涤3次,每次洗涤5min,每孔加入1:5 000稀释后的二抗(山羊抗兔hrp标记抗体)100μl,37℃孵育1h;弃二抗,使用pbst洗涤3次,每次洗涤5min,每孔加入100μl tmb底物溶液进行反应,37℃放置10min;加入100μl终止液终止反应,设置酶标仪波长450nm处读取各个稀释度的d
450nm
值,保存数据。
100.二、实验结果
101.2.1兔抗orf3蛋白多克隆抗体western-blotting验证
102.对获得的兔多克隆抗体进行wb验证,以该多克隆抗体为一抗,羊抗兔igg-hrp为二抗,目的片段大小为29.5kda,结果显示(图8)在目的片段处有一清晰的条带,验证结果表明
制备的多克隆抗体可以很好地与纯化的pet32a-orf3重组蛋白进行特异性结合。
103.2.2兔抗orf3重组蛋白多克隆抗体的间接免疫荧光试验结果
104.将制备的多克隆抗体分别孵育到17gxcz-1orf3c和17gxcz-1orf3d感染的vero中,进行ifa,结果显示(图9)被感染17gxcz-1orf3c和17gxcz-1orf3d的vero细胞中均出现了特异性绿色荧光信号,且信号较为明显,而感染17gxcz-1orf3c和17gxcz-1orf3d孵育阴性血清的vero细胞以及vero细胞直接孵育多克隆抗体和阴性血清的对照组均没有发现绿色荧光。验证结果表明,本研究所制备的兔抗orf3重组蛋白多克隆抗体不仅可识别pedv orf3基因截短毒株,同时还可以识别pedv orf3基因完整毒株。
105.2.3兔抗orf3多克隆抗体效价测定
106.对制备的多克隆抗体进行抗体效价的检测,结果显示(图10),孵育多克隆抗体孔的d
450nm
值与孵育阴性血清孔的d
450nm
值的比值(p/n值)在抗体稀释度为1:512 000时为2.509,大于2.0。因此该抗体的效价为1:512 000,表明在非变性条件下,重组orf3重组蛋白具有良好的免疫原性,可以诱导新西兰大白兔产生良好的免疫应答。
107.实施例3本发明elisa检测方法的建立
108.一、实验方法
109.1.1基于pedv orf3重组蛋白建立的间接elisa检测方法
110.用pedv抗体检测试剂盒对收集到的猪血清样品进行检测,筛选出pedv阳性血清以及阴性血清。使用elisa酶标板以200ng/孔对重组蛋白pet32a-orf3进行包被,4℃包被16h;弃包被液,使用pbst洗涤3次,每次洗涤5min,每孔加入100μl 1%脱脂奶粉,37℃封闭2h;弃封闭液,使用pbst洗涤3次,每次洗涤5min,每孔加入100μl筛选出的阳性血清与阴性血清,两个重复,37℃孵育1h;弃一抗,使用pbst洗涤3次,每次洗涤5min,每孔加入1:5 000稀释后的二抗(山羊抗猪hrp标记抗体)100μl,37℃孵育1h;弃二抗,使用pbst洗涤3次,每次洗涤5min,每孔加入100μl tmb底物溶液进行反应,37℃放置10min;加入100μl终止液终止反应,设置酶标仪波长450nm处读取各个稀释度的d
450nm
值,保存数据。
111.1.2间接elisa检测方法各条件的优化
112.1.2.1最佳抗原包被浓度与待检血清稀释度的优化
113.设置抗原包被浓度分别为200ng/孔、100ng/孔、50ng/孔、25ng/孔、12.5ng/孔、6.25ng/孔;设置待检血清稀释度分别为1:100、1:200、1:400、1:800;其他条件不变,读取d
450nm
值,保存数据。
114.1.2.2最佳抗原包被条件与二抗稀释度的优化
115.设置抗原包被条件分别为37℃4h、37℃2h、37℃1h、4℃过夜;设置二抗稀释度分别为1:1 000、1:2 000、1:4 000、1:8 000;其他条件不变,读取d
450nm
值,保存数据。
116.1.2.3最佳待检血清与二抗孵育时间的优化
117.设置待检血清孵育时间分别为20min、40min、60min;设置二抗孵育时间分别为20min、40min、60min;其他条件不变,读取d
450nm
值,保存数据。
118.1.2.4最佳封闭液及封闭时间的优化
119.设置封闭液分别为1%脱脂乳、5%脱脂乳、1%bsa、5%bsa;设置封闭时间分别为1h、1.5h、2h、2.5h;其他条件不变,读取d
450nm
值,保存数据。
120.1.2.5最佳显色时间的优化
121.设置显色时间分别为1min、5min、10min、15min、20min、25min,其他条件不变,读取d
450nm
值,保存数据。
122.1.2.6判定检测pedv抗体间接elisa方法的临界值
123.对15份pedv阴性血清样品按照优化过的条件进行elisa,读取d
450nm
值,保存数据。
124.1.2.7检测pedv抗体间接elisa方法的重复性试验
125.对阴阳性血清分别设置三组板间重复与板内重复,按照优化过的条件进行elisa,读取d
450nm
值,保存数据。
126.1.2.8检测pedv抗体间接elisa方法的特异性试验
127.对实验室保存的evg、porv、fmdv、prrsv、pdcov、pcv、csfv、asfv、prv等病毒的阳性血清样品以及pedv阳性血清样品按照优化过的条件进行elisa,读取d
450nm
值,保存数据。
128.1.2.9检测pedv抗体间接elisa方法的敏感性试验
129.选取3份检测为pedv阳性血清样品,按1:100、1:200、1:400、1:800、1:1600的稀释度进行稀释,并对稀释后的血清按照优化过后的条件进行elisa,读取d
450nm
值,保存数据。
130.1.2.10检测pedv抗体间接elisa方法的符合率试验
131.同时用pedv抗体检测试剂盒和所建立的方法对30份样品进行初步检测,读取d
450nm
值,对结果进行判定,并进行统计与分析。
132.1.2.11检测pedv间接elisa方法的初步应用
133.用所建立的方法对2019~2021年实验室从24个猪场收集到的共1129份血清样品进行检测,获得d
450nm
值后依据临界值判定阴阳性,并对每一年各个猪场的样品进行统计与分析。
134.二、实验结果
135.2.1最佳抗原包被浓度与待检血清稀释度的优化结果
136.通过方阵法确定最佳抗原包被浓度及待检血清稀释度,结果如表1所示,当抗原包被浓度为100ng/孔,待检血清稀释度为1:200时,p/n值最大为5.292。
137.表1最佳抗原包被浓度及待检血清稀释度的确定
138.139.2.2最佳抗原包被条件与二抗稀释度的优化结果
140.通过方阵法确定最佳抗原包被条件及二抗稀释度,结果如表2所示,当抗原包被条件为37℃ 1h,二抗稀释度为1:1 000时,p/n值最大为6.198。
141.表4-2最佳抗原包被条件与二抗稀释度的确定
[0142][0143][0144]
2.3最佳待检血清与二抗孵育时间的优化结果
[0145]
通过方阵法确定最佳待检血清与二抗孵育时间,结果如表3所示,当待检血清与二抗孵育时间均为40min时,p/n值最大为5.557。
[0146]
表3最佳待检血清与二抗孵育时间的确定
[0147][0148]
2.4最佳封闭液及封闭时间的优化结果
[0149]
通过方阵法确定最佳封闭液及封闭时间,结果如表4所示,当封闭液为1%bsa,封闭时间为2h时,p/n值最大为7.234。
[0150]
表4最佳封闭液及封闭时间的确定
[0151][0152][0153]
2.5最佳显色时间的优化结果
[0154]
设置不同的显色时间,结果如表5所示,当显色时间为15min时,p/n值最大为6.977。
[0155]
表5最佳显色时间的确定
[0156][0157]
2.6检测pedv间接elisa方法临界值的确定
[0158]
取15份阴性血清按照已优化完成的方法测定d
450nm
值,结果如表6所示。获得这15份样品的平均值标准差sd=0.067,则因此当d
450nm
值《0.351时,判定结果为阴性;当d
450nm
值》0.418时,判定结果为阳性;当0.418》d
450nm
》0.351时,判定结果为可疑,重复检测两次可疑则判为阴性。
[0159]
表6间接elisa方法临界值的确定
[0160][0161]
2.7检测pedv间接elisa方法重复性试验结果
[0162]
板间重复和板内重复的结果如表7所示,其中cv值最高为0.078,小于0.1,说明所建立的方法重复性好。
[0163]
表7重复性试验
[0164][0165][0166]
2.8检测pedv间接elisa方法特异性试验结果
[0167]
使用所建立的方法分别对evg、porv、fmdv、prrsv、pdcov、pcv、csfv、asfv、prv阳性血清样品进行检测,每组设置三个重复,结果显示(图11),除pedv检测d450nm值的结果高于阳性临界值外,其余病毒阳性血清样品的检测结果均低于阳性临界值,说明所建立的方法特异性强。
[0168]
2.9检测pedv间接elisa方法敏感性试验结果
[0169]
敏感性试验结果显示(图12),对临床阳性血清的稀释度到达1:800时,仍然检测该样品为阳性,d450nm》0.418表明该方法的敏感性较高。
[0170]
2.10检测pedv间接elisa方法符合率试验结果
[0171]
用所建立的方法与pedv抗体检测试剂盒同时对30份猪血清样品进行检测,结果如表8所示,其中有28份判定的结果一致,符合率为93.33%,表明所建立的间接elisa方法可以进行临床样品的检测及应用。
[0172]
表8间接elisa方法与试剂盒对比结果
[0173][0174]
2.11临床样品的检测结果
[0175]
用所建立的间接elisa方法对收集到的1 129份临床样品进行检测,结果显示(表9),有2个猪场的阳性率为100%(猪场1和9);有6个猪场的阳性率在80%~100%之间(猪场4、11、13、15、16和23);有8个猪场的阳性率在50%~80%之间(猪场2、3、5、6、7、8、14和17);有8个猪场的阳性率不到50%(猪场10、12、18、19、20、21、22和24)。
[0176]
表9临床样品检测
[0177][0178]
本研究共从广西不同地区24各猪场获得1129份血清样品,结果显示(表10),检测出阳性的猪场共有20个,猪场阳性率为83.33%,共检测出阳性样品731份,样品阳性率为67.75%。其中,2019年共从12个猪场获得397份样品,检测出阳性的猪场有10个,猪场阳性率为83.33%,检测出阳性的样品有267份,样品阳性率为67.25%;2020年共从5个猪场获得399份样品,5个猪场均检测出阳性,猪场阳性率为100%,检测出阳性的样品有305份,样品阳性率为76.44%;2021年共从7个猪场获得333份样品,检测出阳性的猪场有5个,猪场阳性率为71.43%,检测出阳性的样品有159份,样品阳性率为47.75%。
[0179]
表10检测信息统计
[0180][0181]
综上,本发明提供的重组orf3重组蛋白抗原性好,以此蛋白为基础建立的间接elisa方法可以准确检测pedv,且特异性强、灵敏度高、重复性好,操作简单方便快捷,临床应用前景良好。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1