抗炎舒缓的苦参生物碱、其制备方法及应用与流程
1.本发明涉及抗炎舒缓的苦参生物碱、其制备方法以及苦参生物碱或其组合物在抗炎、舒缓、止痒类化妆品或药品中的应用。
背景技术:
2.皮肤瘙痒症最常见的皮肤疾患,抗组胺药是临床上治疗皮肤瘙痒症的常用药,其抗炎治疗也可取得较好的治疗效果,但其副作用等极大的限制了其应用。中医药治疗皮肤病经验丰富,可控制反复发作性皮肤病,减轻或避免化学药的副作用。
3.苦参为豆科植物苦参的干燥根,具有清热、抗菌等功效,苦参提取物和苦参碱常用作杀菌剂等农药。
4.例如,中国专利201310476873.5公开了一种高效、低毒、低残留、由丁子香酚和苦参生物碱组成的复配杀菌剂,尤其用于防治葡萄霜霉病。其中,植物源化合物丁子香酚与苦参碱有效成分以1:40~40:1进行二元复配的复配剂,抑制葡萄霜霉病菌活性高,并且相对用量少,对作物的安全性好。
5.中国专利201310632926.8公开了一种含苦参碱和鱼藤酮的农药组合物及其应用,该专利含苦参碱和鱼藤酮的农药组合物,其活性组分由0.3~1.5重量份的苦参碱和1~5重量份的鱼藤酮组成,其对蓟马和其他缨翅目昆虫虫害防治效果优异,且植物很难对其产生抗性,成分简单、成本低廉、防治效果好。
6.中国专利201110215809.2公开了一种含有氧化苦参碱和新烟碱类物质的杀虫组合物,该新烟碱类物质为吡虫啉、啶虫脒、烯啶虫胺、噻虫嗪、噻虫啉、呋虫胺或噻虫胺,其可产生较高的协同增效,减少和延缓有害生物产生抗药性,可用于防治水稻、蔬菜和果树等的多种同翅目、缨翅目等害虫。
7.苦参也是常用的传统中药,含有多种化学成分并具有广泛的生物活性。近年来,人们也在研究和关注苦参碱在其它方面的应用。
8.例如,中国专利201910433332.1公开了一种抗炎舒敏修复组合物及其制备方法和应用,该组合物由仙人掌提取物、燕麦麸皮提取物、苦参提取物、麦冬根提取物、芍药根提取物、黄芩根提取物、丁二醇、戊二醇和水组成。
9.中国专利申请202111508063.4公开了一种抗炎舒敏修护组合物,其包括以下活性成分:仙人掌提取物;燕麦麸皮提取物;苦参提取物;麦冬根提取物;芍药根提取物;黄芩根提取物;鸭皂树提取物。
10.中国专利申请202210107975.9公开了一种抗敏止痒修复植物提取物,是由苦参、蛇床子、甘草、洋甘菊、积雪草、黄连、黄柏、花椒、盐肤木、樟树经粉碎、提取、多级膜分离纯化而得,其主要活性成分为:苦参碱、氧化苦参碱、积雪草苷、甘草酸、α-红没药醇、蛇床子素、小檗碱、没食子酸和右旋龙脑。该申请强调活性成分间的合理复配、协同增效。
11.上述现有技术中的抗炎舒敏组合物是由多种植物提取物组成的,所含的活性成分也较多。然而,成分越多,所带来的副作用也难以预计。准确确定各活性成分特有的生物活
性和药理作用,是准确确定化妆品或药品中合理成分的关键。
12.虽然近年来国内外对苦参作了较多的研究,然而,苦参生物碱类化合物是否具有抗炎、舒缓、止痒的功效未见报道。
13.因此,有必要对苦参生物碱类化合物进行有区别的分离、富集,以开发具有抗炎、舒缓、止痒的苦参生物碱类化合物或其组合物应用于化妆品或药品具有重要的应用价值。
技术实现要素:
14.本发明的发明目的之一是提供通过活性追踪法植被的苦参生物碱;本发明的另一发明目的是提供制备苦参生物碱;本发明的再一发明目的是提供上述苦参生物碱或其组合物在制备消炎、舒缓、止痒类化妆品或药品中的应用。
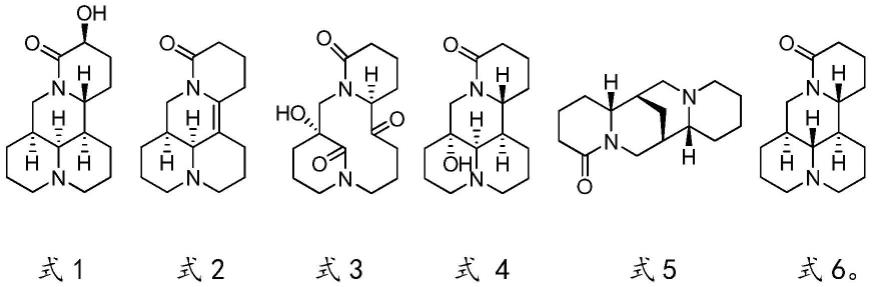
15.一方面,为了实现上述的发明目的,本发明提供了如下述结构式中式1-式6之一所示的苦参生物碱:
[0016][0017]
在本发明中,上述的苦参生物碱可以通过活性追踪方式从苦参中分离获得。
[0018]
在本发明中,将式1所示的苦参生物碱命名为苦参生物碱-1,简写为ksa-1,其结构式如式1所示:
[0019][0020]
在本发明中,将式2所示的苦参生物碱命名为苦参生物碱-2,简写为ksa-2,其结构式如式2所示:
[0021]
[0022]
在本发明中,将式3所示的苦参生物碱命名为苦参生物碱-3,简写为ksa-3,其结构式如式3所示:
[0023][0024]
在本发明中,将式4所示的苦参生物碱命名为苦参生物碱-4,简写为ksa-4,其结构式如式4所示:
[0025][0026]
在本发明中,将式5所示的苦参生物碱命名为苦参生物碱-5,简写为ksa-5,其结构式如式5所示:
[0027][0028]
在本发明中,将式6所示的苦参生物碱命名为苦参生物碱-6,简写为ksa-6,其结构式如式6所示:
[0029][0030]
另一方面,为了实现上述的发明目的,本发明还提供了一种制备上述苦参生物碱的制备方法,该制备方法包括如下的过程制备:
[0031]
(1)将苦参根粉碎;
[0032]
(2)粉碎后的苦参根用乙醇-水进行渗漉提取;
[0033]
(3)合并减压浓缩步骤(2)所得的提取液,得到浸膏;
[0034]
(4)用水溶解步骤(3)所得的浸膏,得到混悬液,用hcl调节ph至弱酸性;
[0035]
(5)步骤(4)所得的混悬液中加入氯仿使分层;
[0036]
(6)将步骤(5)所得的水层用nh3·
h2o调ph至弱碱性,再用氯仿萃取,得到浸膏(苦参提取物);
[0037]
(7)步骤(6)所得的浸膏经硅胶柱色谱分离,用氯仿-甲醇进行梯度洗脱,获得若干个馏分;
[0038]
(8)构建2,4-二硝基氯苯暴露人永生化角质形成细胞(hacat)的损伤模型,评价步骤(7)所得各馏分的活性;
[0039]
(9)取步骤(8)中活性最佳的馏分经大孔树脂分离,进一步用乙醇-水进行梯度洗脱,进一步得到不同部位的若干个馏分;
[0040]
(10)根据构建的2,4-二硝基氯苯暴露人永生化角质形成细胞(hacat)损伤模型,评价步骤(9)所得各馏分的活性;
[0041]
(11)取步骤(10)中活性最佳部位的馏分,经反复硅胶色谱柱、氯仿-甲醇梯度洗脱,再经ods柱色谱及hplc分离纯化,得到如式1、式2、式3、式4、式5以及式6所示的苦参生物碱。
[0042]
在本发明的制备方法中,步骤(1)所使用的苦参根可以是新鲜的、半干的或干燥的,优选所使用的苦参根是新鲜的。
[0043]
在本发明的制备方法中,步骤(2)中所采用的乙醇-水为30%-75%的乙醇,优选为35%-50%的乙醇,例如40%的乙醇。此处,所说的乙醇浓度为体积浓度,例如40%的乙醇是指乙醇与水的体积比为40:60。
[0044]
在本发明的制备方法中,步骤(4)中所采用的弱酸性为ph=4-6,优选ph=4.5-5.5,例如ph=5。
[0045]
在本发明的制备方法中,步骤(6)中所采用的弱碱性为ph=9-11,优选ph=9.5-10.5,例如ph=10。
[0046]
例如,作为本发明制备方法的一种具体实施方式,可采用新鲜苦参根10kg,粉碎,用乙醇渗漏提取24小时,合并减压浓缩提取液,得浸膏。用水溶解浸膏得混悬液,用hcl调ph到5,并加入氯仿使分层。水层用nh3·
h2o调ph到10,再用氯仿萃取得苦参碱提取物。进一步地,苦参提取物经色谱法分离及hplc制备及活性评价化合物活性,最终得到具有最佳保护活性的苦参生物碱化合物。提取时,苦参与酒精的质量比可为1:(10-100)。式1、式2、式3、式4、式5和式6所示的苦参生物碱化合物,分别命名为苦参生物碱-1、苦参生物碱-2、苦参生物碱-3、苦参生物碱-4、苦参生物碱-5、苦参生物碱-6,分别简称为ksa-1、ksa-2、ksa-3、ksa-4、ksa-5、ksa-6。
[0047]
在本发明制备方法中,苦参生物碱可以从苦参中基于活性追踪方法分离提取得到,也为苦参生物碱的制备提供了一个新的途径。
[0048]
再一方面,为了实现上述的发明目的,本发明还提供了一种用于抗炎、舒缓、止痒的苦参生物碱的组合物,该组合物包括上述的如式1或式2所示的化合物、或者包含式1-式6所示化合物的混合物。
[0049]
在本发明的抗炎、舒缓、止痒的苦参生物碱组合物中,式1、式2、式3、式4、式5、式6所示化合物的质量比可以为1:(1-100):(1-100):(1-100):(1-100):(1-100);优选地,在本发明的组合物中,式1、式2、式3、式4、式5、式6所示化合物的质量比为1:(1-10):(1-10):(1-10):(1-10):(1-10);更有选地,在本发明的组合物中,式1、式2、式3、式4、式5、式6所示化合
物的质量比大致为1:1:1:1:1:1,但此处并非是严格的比例。
[0050]
经过试验,本技术的发明人发现,相比于苦参提取物以及ksa-3、ksa-4、ksa-5、ksa-6,ksa-1和ksa-2具有更好的抗炎、舒缓、止痒的活性,而包括ksa-1到ksa-6的kst,则显示出比ksa-1和ksa-2更为出色的抗炎、舒缓、止痒的活性。
[0051]
又一方面,为了实现上述的发明目的,本发明还提供了上述苦参生物碱或其组合物在制备消炎、舒缓、止痒化妆品或药品中的应用。
[0052]
在本发明上述的应用中,该应用是通过提高hacat细胞、抑制hacat细胞炎性细胞因子分泌、抑制hacat细胞炎性细胞因子蛋白表达、抑制细胞ros含量、缓解相关抗氧化酶活性降低及表达抑制、和/或缓解hacat细胞抗氧化通路相关蛋白表达的抑制而实现的。
[0053]
在本发明上述的应用中,化妆品包括护肤品,此类化妆品和护肤品可以为乳、霜、水剂等形式。苦参生物碱或其组合物可以作为化妆品或护肤品的添加剂,加入至化妆品或护肤品中,作为舒缓、抗炎、止痒的有效成分。
[0054]
在本发明上述的应用中,所涉及的炎症可以是指皮炎、湿疹、皮肤瘙痒等皮肤病的炎症,特别是皮肤瘙痒症。
[0055]
相对于现有技术,本发明至少具有如下的有益效果:
[0056]
(1)采用本发明所提供的苦参生物碱组合物,细胞实验结果表明苦参生物碱组合物能抑制2,4-二硝基氯苯诱导的人永生化角质形成细胞(hacat细胞)相关炎性因子分泌,抑制相关炎症信号通路激活及相关蛋白表达,发挥抗炎、舒缓活性;
[0057]
(2)采用本发明所提供的苦参生物碱组合物,动物实验结果表明苦参生物碱组合物能明显延长皮肤瘙痒模型小鼠瘙痒潜伏搔抓时间,减轻皮肤瘙痒小鼠搔抓次数。苦参生物碱组合物治疗后,各用药组小鼠血清ige表达较皮肤瘙痒模型组降低,说明苦参生物碱组合物具有抗皮肤瘙痒作用;
[0058]
(3)本发明所提供的苦参生物碱组合物具有优异的抗炎、舒缓、抗皮肤瘙痒活性,因此,苦参生物碱组合物可以作为抗皮肤瘙痒活性物使用,在化妆品或药物中具有广泛的应用前景;
[0059]
(4)本发明的苦参生物碱或其组合物可以采用从苦参中提取、分离、组合得到,来源丰富;且苦参生物碱或其组合物制备工艺简单、操作方便,有利于其在药品和化妆品中的应用。。
[0060]
下面将结合具体实施方式和附图对本发明技术方案进行清楚、完整描述。本领域技术人员可以理解的是,此处所描述的具体实施方式仅仅是本发明一部分的实施方式,而不是全部的实施方式。基于本发明的精神,本领域的普通技术人员可以在不作出创造性劳动的前提下进行相应的替换、变换、改变或改进,但这些替换、变换、改变或改进,仍属于本发明的保护范围。
附图说明
[0061]
图1是苦参生物碱-1的esi-ms谱图;
[0062]
图2是苦参生物碱-1的1hnmr谱图;
[0063]
图3是苦参生物碱-1的
13
cnmr谱图;
[0064]
图4是苦参生物碱-1的dept谱图;
[0065]
图5是苦参生物碱-2的esi-ms谱图;
[0066]
图6是苦参生物碱-2的1hnmr谱图;
[0067]
图7是苦参生物碱-2的
13
cnmr谱图;
[0068]
图8是苦参生物碱-2的dept谱图;
[0069]
图9是苦参生物碱-3的esi-ms谱图;
[0070]
图10是苦参生物碱-3的1hnmr谱图;
[0071]
图11是苦参生物碱-3的
13
cnmr谱图;
[0072]
图12是图苦参生物碱-3的dept谱图;
[0073]
图13是苦参生物碱-4的esi-ms谱图;
[0074]
图14是苦参生物碱-4的1hnmr谱图;
[0075]
图15是苦参生物碱-4的
13
cnmr谱图;
[0076]
图16是苦参生物碱-4的dept谱图;
[0077]
图17是苦参生物碱-5的esi-ms谱图;
[0078]
图18是苦参生物碱-5的1hnmr谱图;
[0079]
图19是苦参生物碱-5的
13
cnmr谱图;
[0080]
图20是苦参生物碱-5的dept谱图;
[0081]
图21是苦参生物碱-6的esi-ms谱图;
[0082]
图22是苦参生物碱-6的1hnmr谱图;
[0083]
图23是苦参生物碱-6的
13
cnmr谱图;
[0084]
图24是苦参生物碱-6的dept谱图;
[0085]
图25显示了苦参生物碱、其组合物抑制2,4-二硝基氯苯诱导的hacat细胞活力下降,其中,苦参生物碱-1组标记为ksa-1,苦参生物碱-2组标记为ksa-2,苦参生物碱-3组标记为ksa-3,苦参生物碱-4组标记为ksa-4,苦参生物碱-5组标记为ksa-5,苦参生物碱-6组标记为ksa-6,空白组标记为con,2,4-二硝基氯苯组标记为dcnb,苦参生物碱组合物组标记为kst;
[0086]
图26显示了苦参生物碱、其组合物抑制2,4-二硝基氯苯诱导的hacat细胞炎性细胞因子分泌;
[0087]
图27显示了苦参生物碱、其组合物抑制2,4-二硝基氯苯诱导的hacat细胞炎性细胞因子蛋白表达;
[0088]
图28显示了苦参生物碱、其组合物抑制2,4-二硝基氯苯诱导的hacat细胞ros升高及抗氧化酶活力降低;
[0089]
图29显示了苦参生物碱、其组合物抑制2,4-二硝基氯苯诱导的hacat细胞抗氧化酶蛋白表达减少;
[0090]
图30显示了苦参生物碱、其组合物缓解2,4-二硝基氯苯诱导的hacat细胞抗氧化信号通路蛋白表达抑制;
[0091]
图31显示了苦参生物碱、其组合物减轻瘙痒模型小鼠相关炎性蛋白分泌。
具体实施方式
[0092]
本发明具体实施方式中所采用的主要试验仪器和主要材料来源为:化合物的核磁
检测用bruker av-500或bruker av-400mhz核磁共振仪测定核磁(nmr),并以tms为内标(德国bruker公司);用agilent 6210lc/msd tof型质谱仪测定高分辨质谱;用thermo finnigan lcq advantage max质谱仪(美国thermo公司)测定质谱(esi-ms);hplc采用dionex型高效液相色谱仪(美国dionex公司);phplc采用varian制备型高效液相色谱仪(美国varian公司)和agilent 1100lc/msd型高校色谱仪(美国agilent公司);cosmosil c-1(8250mm
×
4.6mm,5μm)色谱柱。sephadex lh-20层析填料购于pharmacia公司;ods柱色谱材料购于德国merck公司;柱色谱用硅胶购于青岛海洋化工厂;核磁用氘代试剂购自美国cil公司;所用试剂均为分析纯和色谱纯。
[0093]
实施例1苦参生物碱的分离、鉴定
[0094]
下面所进行的实施方式是一具体的实施例,但分离制备的方法并不限于该实施例。
[0095]
新鲜苦参根10kg,粉碎,用40%乙醇的渗漏提取,合并减压浓缩提取液,得浸膏311g。用水溶解浸膏得混悬液,用hcl调ph到5,并加入氯仿使分层。水层用nh3·
h2o调ph到10,再用氯仿萃取得71.8g浸膏,标记为苦参生物碱。
[0096]
苦参生物碱(30g)经硅胶(200~300目)柱色谱分离,用氯仿-甲醇(100∶10
→
10∶100)梯度洗脱获得4个馏分(fr.1-4)。
[0097]
构建的2,4-二硝基氯苯暴露人永生化角质形成细胞(hacat)损伤模型,评价fr.1-4保护活性。
[0098]
活性最佳组分fr.3经d101大孔树脂分离,用乙醇-水(100∶10
→
10∶100)梯度洗脱,得到10%部位、30%部位、50%部位、70%部位部位4个馏分。
[0099]
基于前期构建的2,4-二硝基氯苯暴露人永生化角质形成细胞(hacat)损伤模型,评价此4个馏分保护活性。
[0100]
活性最佳组分50%部位经反复硅胶色谱柱,氯仿-甲醇(100∶10
→
10∶100)梯度洗脱,再经ods柱色谱及hplc分离纯化,得苦参生物碱-1(393.4mg),苦参生物碱-2(445.8mg),苦参生物碱-3(353.1mg),苦参生物碱-4(558.5mg),苦参生物碱-5(559.4mg),苦参生物碱-6(690.1mg)。其中:
[0101]
苦参生物碱-1的结构鉴定(确定):
[0102]
请参阅图1-4。苦参生物碱-1为黄色油状,碘化铋钾显色呈阳性,正离子esi-ms显示m/z 265[m+h]
+
,249[m-o]
+
等碎片离子推测该该化合物分子量264。且结合1h nmr和
13
c nmr数据推断其分子式为c
15h24
n2o2,不饱和度为ω=5。
[0103]
13
c nmr(100mhz,cd3od)谱和dept 135谱总共显示有15个碳,包括9个亚甲基、5个次甲基和1个季碳。其中包括1个酰羰基碳信号(δc173.5),3个与杂原子相连的次甲基碳信号(δc69.4,64.9,55.2)和3个与杂原子相连的次甲基碳信号(δc58.3,58.3,42.9)。
[0104]1h nmr(400mhz,cd3od)谱在显示出23个氢质子信号,结合质谱,化合物有1个活泼氢质子,[δh4.26,3.81]处显示苦参碱型生物碱c-11、c-17位特征的氢信号。1h nmr和
13
c nmr数据汇总如下:1h nmr(400mhz,cd3od)δ:4.26(1h,dd,j=12.8,4.4hz,h-17),3.92(1h,m,h-14),3.81(1h,m,h-11),3.02~3.13(2h,m,h-17,10),2.88(1h,m,h-20),2.06~2.14
(2h,m),1.93~1.95(3h,m),1.63~1.92(6h,m),1.30~1.51(6h,m);
13
c nmr(100mhz,cd3od)δ:173.5(c-15),69.4(c-14),64.9(c-6),58.3(c-10),55.2(c-11),45.0(c-7),42.9(c-17),36.6(c-5),28.8(c-4),28.7(c-13),26.8(c-8),26.1(c-12),22.1(c-3),21.6(c-9)。最终,鉴定化合物如式1所示。
[0105]
苦参生物碱-2的结构鉴定:
[0106]
请参阅图5-8。苦参生物碱-2为黄色油状物,碘化铋钾显色呈阳性,正离子esi-ms显示m/z 247[m+h]
+
,推测该该化合物分子量为246。且结合1h nmr和
13
c nmr数据推断其分子式为c
15h22
n2o,不饱和度为ω=5。
[0107]
13
c nmr(75mhz,cd3od)谱和dept 135谱总共显示有15个碳,包括10个亚甲基、2个次甲基和3个季碳。其中包括1个酰羰基碳信号(δ
c 171.1),1个与杂原子相连的次甲基碳信号(δ
c 62.8),3个与杂原子相连的次甲基碳信号(δc58.2,56.2,42.1)和2个烯碳信号(δ
c 130.4,116.3)。
[0108]1h nmr(300mhz,cd3od)谱在显示出22个氢质子信号,[δ
h 4.22,3.26,2.95]处显示苦参碱型生物碱的c-11、c-17位的特征氢信号。1h nmr和
13
c nmr数据汇总如下:1h nmr(300mhz,cd3od)δ:4.22(lh,dd,j=8.14hz,h-17a),3.26(lh,m,h-17b),2.95(1h,d,j=8.7,h-11),2.63~2.70(3h,m),2.32~2.62(5h,m),2.18(1h,m),1.93(2h,m),1.67~1.77(8h,m);
13
c nmr(75mhz,cd3od)δ:171.1(c-15),130.4(c-11),116.3(c-7),62.8(c-6),58,2(c-10),56.2(c-2),42.1(c-17),33.7(c-14),33.4(c-5),30.0(c-12),27.8(c-4),27.6(c-8),25.6(c-9),22.6(c-3),20.7(c-13)。最终,鉴定化合物如式2所示。
[0109]
苦参生物碱-3的结构鉴定:
[0110]
请参阅图9-12。苦参生物碱-3为黄色油状物,碘化铋钾显色呈阳性,正离子esi-ms显示m/z 295[m+h]
+
、277[m-oh]
+
推测该该化合物分子量为294,且存在羟基。且结合1h nmr和
13
c nmr数据推断其分子式为c
15h22
n2o4,不饱和度为ω=6。
[0111]
13
c nmr(75mhz,cd3od)谱和dept 135谱总共显示有15个碳,包括10个亚甲基、1个次甲基和4个季碳。其中包括3个羰基碳信号(δ
c 210.2,174.0,172.9),1个与杂原子相连的次甲基碳信号(δc68.0),3个与杂原子相连的亚甲基碳信号(δc55.6,49.3,49.0)和1个与杂原子相连的季碳信号(δ
c 73.6)。
[0112]1h nmr(300mhz,cd3od)谱在显示出22个氢质子信号,包括一个羟基信号[δ
h 2.95(1h,m,-oh)]。
[0113]1h nmr和
13
c nmr数据汇总如下:1h nmr(300mhz,cd3od)δ:4.50(1h,d,j=13.2,h-2),4.39(1h,m,h-12),3.12(1h,d,j=13.2,h-2),2.95(1h,m,-oh),2.18~2.70(10h,m),1.80~1.96(8h,m);
13
c nmr(75mhz,cd3od)δ:210.2(c-11),174.0(c-17),172.9(c-16),73.6(c-3),68.0(c-12),55.6(c-2),49.3(c-6),37.8(c-10),31.5(c-15),31.5(c-4),26.3(c-9),24.9(c-14),19.2(c-5),17.4(c-13)。最终,鉴定化合物如式3所示。
[0114]
苦参生物碱-4的结构鉴定:
[0115]
请参阅图13-16。苦参生物碱-4为淡黄色油状物,碘化铋钾显色呈阳性,
正离子esi-ms显示m/z 265[m+h]
+
、247[m-oh]
+
,推测该该化合物分子量为264,且存在羟基。且结合1h nmr和
13
c nmr数据推断其分子式为c
15h24
n2o2,不饱和度为ω=5。
[0116]
13
c nmr(75mhz,cd3od)谱和dept 135谱总共显示有15个碳,包括10个亚甲基、3个次甲基和2个季碳。其中包括1个酰羰基碳信号(δ
c 174.2),2个与杂原子相连的次甲基碳信号(δ
c 70.1,54.7),3个与杂原子相连的亚甲基碳信号(δ
c 58.2,57.8,47.4)和1个与杂原子相连的季碳信号(δ
c 68.8)。
[0117]1h nmr(300mhz,cd3od)谱在显示出24个氢质子信号,包括苦参碱型生物碱的c-11、c-17位的特征氢信号[δh4.30(1h,m),3.80(1h,m),3.23(1h,d,j=13.5hz)]。
[0118]1h nmr和
13
c nmr数据汇总如下:1h nmr(300mhz,cd3od)δ:4.30(1h,m,h-17),3.80(1h,m,h-11),3.23(1h,d,j=13.5hz,h-17),2.80~2.91(3h,m,h-10,2),2.33(2h,m,h-14),1.80~2.06(8h,m),1.40~1.67(8h,m);
13
c nmr(75mhz,cd3od)δ:174.2(c-15),70.1(c-6),68.8(c-5),58.2(c-10),57.8(c-2),54.7(c-11),47.4(c-17),38.3(c-7),38.0(c-4),33.6(c-14),28.1(c-8),27.1(c-12),23.5(c-9),21.4(c-3),19.8(c-13)。最终,鉴定化合物如式4所示。
[0119]
苦参生物碱-5的结构鉴定:
[0120]
请参阅图17-20。苦参生物碱-5为黄色油状物,碘化铋钾显色呈阳性,正离子esi-ms显示m/z 249[m+h]
+
,提示该该化合物分子量为248。结合1h nmr和
13
c nmr数据推断其分子式为c
15h24
n2o,不饱和度为ω=5。
[0121]
13
c nmr(75mhz,cd3od)谱和dept 135谱总共显示有15个碳,包括10个亚甲基、4个次甲基和1个季碳。其中包括1个酰羰基碳信号(δc168.9),2个与杂原子相连的次甲基碳信号(δc65.9,58.8)和3个与杂原子相连的亚甲基碳信号(δc57.4,57.0,42.3)。
[0122]1h nmr(300mhz,cd3od)谱在显示24个氢信号,在[δh4.88(1h,d,j=13.5hz),2.92(1h,m)]处显示出无叶豆碱型生物碱c-10、c-17位的特征的氢信号。
[0123]1h nmr和
13
c nmr数据汇总如下:1h nmr(300mhz,cd3od)δ:4.88(1h,d,j=13.5,h-10),2.92(1h,d,h-17),2.05~2.60(7h,m),1.12~1.77(15h,m);
13
c nmr(75mhz,cd3od)δ:168.9(c-2),65.9(c-11),58.8(c-6),57.4(c-15),57.0(c-17),42.3(c-10),35.7(c-8),34.6(c-7),34.5(c-9),33.2(c-3),30.6(c-12),27.8(c-5),25.9(c-14),25.0(c-13),20.0(c-4)。最终,鉴定化合物如式5所示。
[0124]
苦参生物碱-6的结构鉴定:
[0125]
请参阅图21-24。苦参生物碱-6为黄色油状物,碘化铋钾显色呈阳性,正离子esi-ms显示m/z 249[m+h]
+
,提示该该化合物分子量为248,且给出了苦参碱的特征裂解碎片m/z 206、149。结合1h nmr和
13
c nmr数据推断化合物的分子式为c
15h24
n2o,不饱和度为ω=5。
[0126]
13
c nmr(100mhz,cd3od)谱和dept 135谱总共显示有15个碳,包括10个亚甲基、4个次甲基和1个季碳。其中包括1个酰羰基碳信号(δc171.9),2个与杂原子相连的次甲基碳信
号(δc71.7,61.5)和3个与杂原子相连的亚甲基碳信号(δc57.4,56.9,47.5)。
[0127]1h nmr(400mhz,cd3od)谱共显示出24个氢质子信号,且在[δ
h 4.60(1h,dd,j=13.2,3.0hz),3.15(1h,m,j=5.4hz)]显示出苦参碱型生物碱c-17、c-11位特征氢信号。
[0128]1h nmr和
13
c nmr数据汇总如下:1h nmr(400mhz,cd3od)δ:4.60(1h,dd,j=13.2,3.0hz,h-17),3.15(1h,m,5.4hz,h-11),2.77~2.90(2h,m,h-10,2),1.52~2.34(18h,m),1.02(2h,m);
13
c nmr(100mhz,cd3od)δ:171.9(c-15),71.7(c-6),61.5(c-11),57.4(c-10),56.9(c-2),47.5(c-17),47.2(c-7),40.3(c-5),33.5(c-14),29.2(c-12),28.2(c-4),27.6(c-8),25.5(c-3),25.4(c-9),20.0(c-13)。
[0129]
最终,鉴定化合物如式6所示。
[0130]
实验例2:本发明之苦参生物碱及其组合物的保护活性的细胞试验
[0131]
hacat细胞接种于96孔板,密度为5
×
104细胞/孔,培养24h。加入2,4-二硝基氯苯(5μm)处理细胞12h,然后,收集细胞,冷pbs清洗2遍,加入新的培养基并加入终浓度为10μg/ml的苦参生物碱-1或苦参生物碱-2或苦参生物碱组合物(苦参生物碱-1与苦参生物碱-2、苦参生物碱-3、苦参生物碱-4、苦参生物碱-5、苦参生物碱-6质量比为1:1:1:1:1:1)。室温条件下共培育24h后,分离细胞及上清液备用。本实验部分,苦参生物碱-1组标记为ksa-1,苦参生物碱-2组标记为ksa-2,苦参生物碱-3组标记为ksa-3,苦参生物碱-4组标记为ksa-4,苦参生物碱-5组标记为ksa-5,苦参生物碱-6组标记为ksa-6,空白组标记为con,2,4-二硝基氯苯组标记为dcnb,苦参生物碱组合物组标记为kst。
[0132]
图25所示的实验结果显示,相比于空白对照组(细胞活力设为100%),2,4-二硝基氯苯暴露使hacat细胞活力降低19.8%,而经苦参生物碱、苦参生物碱组合物处理后,细胞活力显著提高;相比于dcnb组,kst组细胞活力提高14.1%。进一步分析实验结果发现,ksa-1、ksa-2组细胞活力高于其它苦参生物碱组,相比于dcnb组,ksa-1组、ksa-2组细胞活力提高10.9%,10.5%。故后续实验,我们以ksa-1、ksa-2代表苦参碱进行活性实验。
[0133]
图26所示的elisa实验结果显示,2,4-二硝基氯苯暴露使细胞炎性细胞因子分泌显著增加,说明2,4-二硝基氯苯暴露诱导了hacat细胞炎性损伤,而经苦参生物碱-1、苦参生物碱-2、苦参生物碱组合物处理后,细胞炎性细胞因子过度分泌被抑制。进一步的分析实验结果发现,相比于ksa-1组、ksa-2组,kst组细胞炎性细胞因子过度分泌被抑制更为显著。类似地,图27所示的western blotting分析结果与elisa检测结果一致,2,4-二硝基氯苯暴露诱导hacat炎性因子过度分泌被抑制,其中,相比于ksa-1组、ksa-2组,kst组细胞炎性细胞因子过度分泌被抑制更为显著。
[0134]
进一步的实验结果显示,2,4-二硝基氯苯暴露使细胞ros含量显著增加,而相关抗氧化酶活性及表达被抑制,而苦参生物碱组合物处理后,细胞ros含量增加被抑制,相关抗氧化酶活性降低及表达抑制显著缓解(请参见图28、29)。进一步的分析实验结果发现,苦参生物碱组合物对2,4-二硝基氯苯暴露诱导的细胞ros含量增加的抑制活性、相关抗氧化酶活性降低及表达抑制的转录抑制能力高于苦参碱或苦参提取物单独使用。
[0135]
图30所示的分析实验结果显示,2,4-二硝基氯苯暴露使hacat细胞相关抗氧化信号通路蛋白表达被抑制,而苦参生物碱组合物处理缓解了hacat细胞相关抗氧化信号通路蛋白表达抑制,相关抗氧化蛋白表达增加。从这些分析实验结果可以发现,苦参生物碱组合物对2,4-二硝基氯苯暴露诱导的细胞相关抗氧化信号通路蛋白表达抑制缓解活性高于苦
参生物碱-1、苦参生物碱-2单独使用。
[0136]
实验例3本发明之苦参生物碱组合物的动物活性试验
[0137]
昆明种小鼠,spf级,雄性,体重(30
±
2)g,恒温环境饲养,温度(20
±
2)℃,湿度50%,饲养环境为光照节律12h:12h,自由进食进水,适应性喂养1周。将小鼠随机分为5组,每组8只,分别为正常组;皮肤瘙痒模型组;苦参生物碱-1组;苦参生物碱-2组;苦参生物碱组合物组。实验开始后,除正常组外,其余各组小鼠颈背部皮下注射d-半乳糖注射液125/mg
·
kg,连续3周(正常组予同等剂量生理盐水)。第4周开始,各用药组小鼠按0.5mg/cm2涂抹给药,于每日傍晚给药1次,连续7d(正常组、皮肤瘙痒模型组每日给予同等剂量蒸馏水)。实验过程中,小鼠颈背部剪刀剃毛,保持颈背部无毛。
[0138]
于第7天涂药1h后,静脉注射0.025%低分子右旋糖酐-40注射液,30min后,摄像机记录小鼠搔抓表现。摘眼球取血,3000r/min离心10min,取血清,酶联免疫吸附法检测血清il-1β,par-2含量。
[0139]
表1苦参生物碱组合物对小鼠瘙痒潜伏时间及瘙痒次数的影响
[0140][0141]
与皮肤瘙痒模型组比较
*
p<0.05,
**
p<0.01.
[0142]
表2苦参生物碱组合物对小鼠il-1β的影响
[0143][0144]
与正常组比较
#
p<0.05,
##
p<0.01;与皮肤瘙痒模型组比较
*
p<0.05,
**
p<0.01.
[0145]
表3苦参生物碱组合物对小鼠血清par-2的影响
[0146][0147]
与正常组比较
#
p<0.05,
##
p<0.01;与皮肤瘙痒模型组比较
*
p<0.05,
**
p<0.01.
[0148]
从表1数据中可以看出,与正常组比较,皮肤瘙痒模型组瘙痒潜伏时间缩短,瘙痒次数增多。而与皮肤瘙痒模型组比较,用药后各用药组瘙痒潜伏时间显著延长,瘙痒次数显著减少。
[0149]
从表2数据中可以看出,与正常组比较,皮肤瘙痒模型组il-1β显著性升高。而与皮肤瘙痒模型组比较,用药后各用药组il-1β显著性降低,说明苦参生物碱-1、苦参生物碱-2及苦参碱组合物均有减轻皮肤瘙痒的作用。
[0150]
从表3数据中可以看出,与正常组比较,皮肤瘙痒模型组par-2含量显著性升高。用药后,与皮肤瘙痒模型组比较,各用药组par-2含量显著降低。
[0151]
老年性皮肤瘙痒症的发生与免疫细胞和炎性因子有重要的关系。肥大细胞广泛存在于皮肤和组织血管周围,内含组胺,肝素,5-羟色胺等炎性因子,肥大细胞和上述炎性因子在诱导变态反应过程中发挥着重要的作用。我们进一步分析了苦参生物碱-1、苦参生物碱-2及苦参碱组合物对小鼠胸腺基质淋巴细胞生成素(tslp)、粒细胞巨噬细胞集落刺激因子(gm-csf)、粒细胞集落刺激因子(g-csf)的影响。
[0152]
图31的elisa实验结果显示,d-半乳糖暴露使小鼠胸腺基质淋巴细胞生成素(tslp)、粒细胞巨噬细胞集落刺激因子(gm-csf)、粒细胞集落刺激因子(g-csf)显著增加,说明d-半乳糖暴露诱导了小鼠炎性损伤,而苦参生物碱-1、苦参生物碱-2、苦参生物碱组合物处理后,胸腺基质淋巴细胞生成素(tslp)、粒细胞巨噬细胞集落刺激因子(gm-csf)、粒细胞集落刺激因子(g-csf)过度分泌被抑制。进一步的分析实验结果发现,相比于ksa-1组、ksa-2组,kst组胸腺基质淋巴细胞生成素(tslp)、粒细胞巨噬细胞集落刺激因子(gm-csf)、粒细胞集落刺激因子(g-csf)过度分泌被抑制更为显著。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1